生物转化L-脯氨酸生成反式-4-羟基-L-脯氨酸的定量分析方法
2016-11-08张红蕾徐志栋杨瑜涛韩孟楠王烁康
张红蕾,徐志栋,李 玮,2*,杨瑜涛,杜 洁,韩孟楠,王烁康
(1.河北大学 化学与环境科学学院,河北 保定 071002;2.河北博伦特药业有限公司,河北 石家庄 052263)
生物转化L-脯氨酸生成反式-4-羟基-L-脯氨酸的定量分析方法
张红蕾1,徐志栋1,李玮1,2*,杨瑜涛1,杜洁1,韩孟楠1,王烁康1
(1.河北大学化学与环境科学学院,河北保定071002;2.河北博伦特药业有限公司,河北石家庄052263)
以芴甲氧羰酰氯(FMOC-Cl)为柱前衍生剂,四硼酸钠为缓冲溶液,建立了一种柱前衍生反相高效液相色谱(RP-HPLC)测定微生物转化L-脯氨酸生成反式-4-羟基-L-脯氨酸的定量分析方法。优化了衍生反应条件,当衍生反应体系中水和乙腈的比例为66∶34,pH值为9.9时衍生效果最佳。采用Agilent Extend C-18柱进行分离,以0.1%三氟乙酸水溶液和乙腈作为流动相,梯度洗脱,检测波长263 nm。L-脯氨酸和反式-4-羟基-L-脯氨酸均在0.01~5.00 mg/mL范围内线性关系良好,相关系数均大于0.999,检出限为5.00~7.00 ng/L,不同浓度下的平均回收率分别为98.9%~102%和97.9%~100%。该方法重现性好,精密度高,为定量分析微生物发酵液中的L-脯氨酸和反式-4-羟基-L-脯氨酸提供了有效方法。
柱前衍生;反相高效液相色谱;反式-4-羟基-L-脯氨酸;L-脯氨酸;微生物转化
反式-4-羟基-L-脯氨酸(trans-4-Hydroxy-L-proline,trans-Hyp)为亚氨基酸,是L-脯氨酸 (L-Pro) 羟基化后的产物,易于衍生,药理活性多样[1-2],可用于新一代培南类抗生素[3]、抗肿瘤药[4]、抗高血压药[5]及新型胃药[6]等多种新创制药物的合成。由于具有抗氧化、抗辐射的作用,该物质在化妆品领域也有重要应用[7]。
目前,反式-4-羟基-L-脯氨酸的生产方法主要有生物提取法和生物酶催化转化法[8-11]。生物提取法主要以动物胶原蛋白为原料,通过强酸水解、亚硝酸氧化和离子交换树脂纯化等过程制备,此方法虽然技术成熟,但原料成本高,提取率低,“三废”排放量大、污染严重。生物酶催化法利用脯氨酸羟化酶的催化特性,以L-脯氨酸为原料通过发酵转化得到反式-4-羟基-L-脯氨酸。生物转化法与生物提取法相比反应条件温和,能耗低,污染小。本实验室曾筛选到一株可以生物转化L-脯氨酸产生反式-4-羟基-L-脯氨酸的重组大肠杆菌工程菌[12]。
在反式-4-羟基-L-脯氨酸的微生物转化及生产中,对其含量进行分析十分重要。目前,文献已报道的反式-4-羟基-L-脯氨酸的定量分析方法大部分采用氯胺T法[13],该方法简便易操作,但检测浓度范围较窄,且只能对羟脯氨酸定量,无法反映脯氨酸的变化情况。高效液相色谱可解决这一问题,本文借鉴衍生试剂柱前衍生氨基酸的高效液相色谱分析方法[14-16],利用芴甲氧羰酰氯(FMOC-Cl)与样品进行衍生反应,对衍生体系中水和乙腈的比例进行了优化,并对衍生化样品的稳定性进行了考察。结果显示,该方法前处理简单、检测范围宽、重复性好、衍生产物稳定,为应用高效液相色谱分离及定量分析微生物转化体系中L-脯氨酸和反式-4-羟基-L-脯氨酸提供了有效方法。
1 实验部分
1.1仪器与材料
Dionex Ultimate 3000型高效液相色谱仪(美国Thermo Fisher Scientific公司);Centrifuge 5424R离心机(德国Eppendorf公司);ZWYR-200D振荡培养箱(上海智城分析仪器制造有限公司);Vortex-5旋涡混合器(海门市其林贝尔仪器制造有限公司);BT125D天平(德国Sartorius公司)。
L-脯氨酸、反式-4-羟基-L-脯氨酸、FMOC-Cl、十水合四硼酸钠(上海阿拉丁生化科技股份有限公司);三氟乙酸(上海麦恪林生化科技有限公司);乙腈、甲醇(安徽时联特种试剂有限公司);LB培养基(生工生物工程股份有限公司)。实验用水均为去离子水。
1.2标准溶液的配制
精密称取L-脯氨酸和反式-4-羟基-L-脯氨酸适量,用水配制成浓度为50.00 mg/mL 的标准溶液,分别将上述两种标准溶液用水梯度稀释至0.01,0.05,0.10,0.20,0.40,0.80,1.00,2.00,3.00,4.00,5.00 mg/mL。于4 ℃保存,备用。
1.3衍生化方法
1.3.1标准品衍生化 分别吸取“1.2”中不同浓度标准品溶液50 μL于1.5 mL EP管中,向每支EP管内分别加入200 μL 0.125 mol/L四硼酸钠水溶液、410 μL水、320 μL乙腈、20 μL FMOC-Cl的乙腈溶液(0.38 mol/L),置于涡旋混匀器振荡5 s后静置10 min,过0.45 μm微孔滤膜后进行RP-HPLC检测。
1.3.2待测样品衍生化 重组大肠杆菌接种于含3.00 g/LL-脯氨酸的LB培养基中,于37 ℃恒温培养箱中培养48 h,将大肠杆菌发酵液以9 000 r/min离心2 min,取50 μL上清液加入1.5 mL离心管内,并加入0.125 mol/L四硼酸钠水溶液200 μL、水410 μL、乙腈320 μL、0.38 mol/L FMOC-Cl的乙腈溶液20 μL,置于涡旋混匀器振荡5 s后静置10 min,过0.45 μm微孔滤膜后进行RP-HPLC分析。
1.4RP-HPLC分析条件
色谱柱为Agilent Extend C-18(4.6 mm ×250 mm,5 μm,Agilent公司),流动相A为0.1% 三氟乙酸水溶液,B为0.1% 三氟乙酸乙腈溶液,检测波长263 nm,进样量5 μL,梯度洗脱条件∶0~5 min,30% B;5~8 min,30%~40% B;8~15 min,40% B;15~20 min,40%~50% B;20~25 min,50% B;25~30 min,50%~90% B;30~38 min,90% B;38~41 min,90%~30% B;41~45 min,30% B。
1.5衍生化样品的稳定性测定
分别配制浓度为0.20,1.00,5.00 mg/mL 的L-脯氨酸和反式-4-羟基-L-脯氨酸的标准品,进行衍生化处理后,再分别于4 ℃、室温(RT)和37 ℃放置20 h后取出进行液相色谱分析,以室温放置0 h的衍生化样品为对照。并采用RP-HPLC对4 ℃保存0,12,24,48,72 h的不同浓度衍生化样品的稳定性进行分析。
2 结果与讨论
2.1衍生条件优化
2.1.1衍生体系缓冲盐的选择 对衍生体系3种不同缓冲盐溶液进行考察。结果显示,以N-甲基吗啉盐酸盐(0.125 mol/L)作为缓冲盐时,L-脯氨酸和反式-4-羟基-L-脯氨酸的衍生产物不出峰;以三乙胺(0.125 mol/L)作为缓冲盐时有目标峰,但相邻有杂峰干扰;以四硼酸钠(0.125 mol/L)作为缓冲盐时,不仅有呈高斯对称的目标峰,无杂峰干扰,且峰面积最大。综上所述,选择最佳缓冲盐为四硼酸钠。
2.1.2衍生体系水与乙腈比例的选择 对衍生体系中水与乙腈的不同比例进行了研究。在不同水和乙腈比例条件下,5.00 mg/mLL-脯氨酸和反式-4-羟基-L-脯氨酸标准溶液的衍生结果如表1所示,当水和乙腈的比例为98∶2和82∶18时有FMOC-Cl结晶析出,衍生产物的峰高较低;当水和乙腈的比例为50∶50和34∶66时有四硼酸钠结晶析出,且衍生产物的峰严重拖尾;当水和乙腈的比例为66∶34时,衍生产物无色透明,峰形呈高斯对称,且半峰宽较窄,无明显拖尾,故选择该比例下0.38 mol/L衍生剂用量20 μL。在该比例下缓冲体系的pH值为9.9,满足上述两种氨基酸易于在碱性环境中衍生的条件。

表1 不同比例的水和乙腈对衍生效果的影响Table 1 Effect of different proportions for water and acetonitrile on derivatization
2.1.3衍生反应时间的选择将5.00 mg/mLL-脯氨酸和反式-4-羟基-L-脯氨酸的衍生反应体系分别静置0,1,5,10,15,20 min后,采用RP-HPLC检测,发现随反应时间的延长,两种氨基酸的峰面积相应增加,当反应时间为10 min时,峰面积达到最大,反应时间继续延长,峰面积反而下降。故选择最优反应时间为10 min。
2.2线性范围、检出限与回收率
在“2.1”优化条件下,对不同浓度(0.01,0.05,0.10,0.20,0.40,0.80,1.00,2.00,3.00,4.00,5.00 mg/mL)的L-脯氨酸和反式-4-羟基-L-脯氨酸标准溶液衍生后,采用高效液相色谱进行分析,每个浓度重复进样5次,以峰面积(y)为纵坐标,标准品浓度(x,mg/mL)为横坐标进行线性回归,L-脯氨酸和反式-4-羟基-L-脯氨酸的线性方程分别为y=33.79x+0.983 0和y=38.86x+0.939 7,相关系数(r2)分别为0.999 9和0.999 8,线性范围均为0.01~5.00 mg/mL。当信噪比为4时,L-脯氨酸和L-羟脯氨酸的检出限分别为7.00 ng/L 和5.00 ng/L。重复测定不同浓度的标准溶液5次,L-脯氨酸和反式-4-羟基-L-脯氨酸的平均回收率分别为98.9%~102%和97.9%~100%。
2.3精密度与重现性
将不同浓度(1.00,2.00,3.00,4.00,5.00 mg/mL)的L-脯氨酸和反式-4-羟基-L-脯氨酸标准溶液按“1.3”方法处理后,进行RP-HPLC分析,每种浓度做5个平行,不同批次做3次重复。两种待测物3批次5次平行间的相对标准偏差(RSD)均小于3%,表明该方法的重现性良好。
2.4储存条件对衍生化样品稳定性的影响
分别对5.00 mg/mLL-脯氨酸和反式-4-羟基-L-脯氨酸衍生后样品的储存温度进行检测。经衍生化处理后,2种氨基酸衍生化样品分别于室温、37 ℃和4 ℃下放置20 h后进行RP-HPLC检测。结果显示,以室温放置0 h的衍生化样品为对照(CK),发现衍生化样品于4 ℃储存时的稳定性最佳,与CK相比无显著差异。而室温放置20 h和37 ℃放置20 h的样品的稳定性较CK显著下降(P<0.05),说明低温储存有利于衍生化样品的稳定。
此外,对不同浓度衍生化样品于4 ℃的储存时间(0,12,24,48,72 h)进行了检测。结果显示,不同浓度的L-脯氨酸和反式-4-羟基-L-脯氨酸在不同保存时间下的峰面积无显著差异,说明衍生化处理的样品在4 ℃较为稳定,可以短时间(72 h)于4 ℃保存。
2.5微生物发酵体系中反式-4-羟基-L-脯氨酸的色谱分离及测定
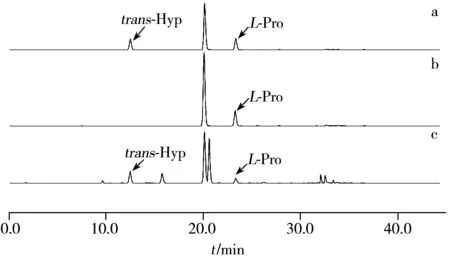
图1 氨基酸标准品及发酵液样品的色谱图Fig.1 Chromatograms of amino acids standard and fermented liquid samplesa:L-Pro and trans-Hyp standard;b:L-Pro in LB mediun without inoculation of bacterium;c:co-culture with L-Pro biotransforming bacteriumwhich can bioconvert L-Pro into trans-Hyp
应用上述优化的柱前衍生方法检测重组大肠杆菌转化体系中L-脯氨酸和反式-4-羟基-L-脯氨酸的含量。氨基酸标准品及发酵液样品的色谱图见图1,由图可见大肠杆菌发酵液中L-脯氨酸和反式-4-羟基-L-脯氨酸获得了良好的分离,根据线性回归方程计算出剩余L-脯氨酸的浓度为0.64 mg/mL,转化生成反式-4-羟基-L-脯氨酸的浓度为1.77 mg/mL,表明此时大肠杆菌转化L-脯氨酸为反式-4-羟基-L-脯氨酸的转化率为 59.0%。
3 结 论
采用本文建立的柱前衍生反相高效液相色谱法可以准确、快速、灵敏地分离并检测重组大肠杆菌转化体系中的L-脯氨酸和反式-4-羟基-L-脯氨酸含量,该方法适用于微生物转化体系中L-脯氨酸和反式-4-羟基-L-脯氨酸的分离及定量分析。
[1]Remuzon P.Tetrahedron,1996,52(44):13803-13835.
[2]Seki M,Matsumoto K.Biosci.Biotechnol.Biochem.,1995,59:1161-1162.
[3]Wichmann C F,Liesch J M,Schwartz R E.J.Antibiot.,1989,42:168-173.
[4]DeFronzo R A.Diabetes,1988,37:667-687.
[5]Baker D H.AminoAcids,2009,37:29-41.
[6]Wu G,Bazer F W,Burghardt R C,Johnson G A,Kim S W,Knabe D A,Li P,Li X L,McKnight J R,Satterfield M C,Spencer T E.AminoAcids,2011,40:1053-1063.
[7]Zhang Z Q,Zhao D X,Yang X L.AminoAcidsandBioticResources(张自强,赵东旭,杨新林.氨基酸和生物资源),2006,28:55-58.
[8]Kuttan R,Panikkar B,Binitha P P.Springerplus,2015,4:546.
[9]Yi Y,Sheng H,Li Z,Ye Q.BMCBiotechnol.,2014,14:44.
[10]Falcioni F,Blamk L M,Oliver F,Andreas K,Bruno B,Schmid A.Appl.Environ.Microbiol,2013,79:3091-3100.
[11]Falcioni F,Bühler B,Schmid A.Biotechnol.Bioeng.,2015,112:322-330.
[12]Hebei Brant Pharmaceutical Co.,Ltd.Hebei Normal University.China Patent (河北博伦特药业有限公司,河北师范大学.中国专利),103275998A.2013-09-04.
[13]Takeshi S,Hideo M,Akio O.Biosci.Biotechnol.Biochem.,2000,64:746-750.
[14]Polly Chan S W,Greaves J,Da Silva N A,Wang S W.BMCBiotechnol.,2012,12:51.
[15]Tu C Y,Zhao J,Ge J L,Wu Y Q,Tang M H,Yuan Y J,Wei P,Li S C.J.Instrum.Anal.(屠春燕,赵珺,葛佳璐,吴燕娇,唐美华,袁艳娟,韦萍,李寿椿.分析测试学报),2008,27(7):681-685.
[16]Wei X L,Ding M F,Dong Y C,Yang D Z.ChinaFeed(魏秀莲,丁美方,董颖超,杨定忠.中国饲料),2011,18:41-43.
Quantitative Analysis of trans-4-Hydroxy-L-proline by Microbial Conversion of L-Proline
ZHANG Hong-lei1,XU Zhi-dong1,LI Wei1,2*,YANG Yu-tao1,DU Jie1,HAN Meng-nan1,WANG Shuo-kang1
(1.College of Chemistry Environmental Science,Hebei University,Baoding071002,China;2.Heibei Brant Pharmaceutical Co.,Ltd.,Shijiazhuang052263,China)
trans-4-Hydroxy-L-proline is one of the valuable chiral building block in the production of many pharmaceuticals.A quantification method oftrans-4-hydroxy-L-proline andL-proline from microbial transformation by using reverse phase high performance liquid chromatography (RP-HPLC) was developed.9-Fluorenylmethyl chloroformate(FMOC-Cl) was used as pre-column derivation agent,and the derivatization was proceeded in sodium tetraborate buffer solution(pH 9.9) containing acetonitrile-water(66∶34).The solution then was separated on an Agilent Extend C-18 column by using 0.1% trifluoroacetic acid and acetonitrile as mobile phase,and detected with UV detector at 263 nm.The linear ranges of two amino acid were in the range of 0.01-5.00 mg/mL,with correlation coefficients greater than 0.999.The limits of detection(LOD) were in the range of 5.00-7.00 ng/L,and the average recoveries oftrans-4-hydroxy-L-proline andL-proline were 98.9%-102% and 97.9%-100%,respectively.This method provides an effective way to quantifyL-proline andtrans-4-hydroxy-L-proline in microorganism fermented liquid system with good reproducibility,and high precision.
pre-column derivation; RP-HPLC;trans-4-hydroxy-L-proline;L-proline; microbial conversion
2016-02-16;
2016-04-05
2014年河北省高等学校高层次人才科学研究项目(GCC 2014013 );国家国际科技合作专项项目(2013DFB30190)
李玮,博士,教授,研究方向:化学合成,Tel:0312-5929009,E-mail:13731461388@139.com
10.3969/j.issn.1004-4957.2016.09.020
O657.72;O629.71
A
1004-4957(2016)09-1181-04
