IL-15对CIK细胞增殖、活化及抗瘤作用的影响
2016-11-08叶萍萍王豪勋马军张中冕武海英董海侠
叶萍萍,王豪勋,马军,张中冕,武海英,董海侠
(1郑州大学第二附属医院,郑州 450014;2河南省人民医院;3山西煤炭中心医院)
IL-15对CIK细胞增殖、活化及抗瘤作用的影响
叶萍萍1,王豪勋1,马军1,张中冕1,武海英2,董海侠3
(1郑州大学第二附属医院,郑州 450014;2河南省人民医院;3山西煤炭中心医院)
目的观察IL-15对人细胞因子诱导的杀伤细胞(CIK)细胞增殖、活化及抗瘤作用的影响。方法对照组常规培养CIK细胞,IL-15组在CIK常规制备的基础上添加IL-15,诱导培养10 d,比较两组CIK细胞增殖能力、细胞表型、细胞上清液中的细胞因子,观察两组CIK细胞对食管鳞癌细胞系EC9706细胞凋亡的影响。结果IL-15组、对照组细胞计数分别为(26.00±9.86)×105/mL、(7.83±1.18)×105/mL,两组比较,P<0.05。IL-15组、对照组CD3+细胞分别占99.40%±0.46%、95.02%±1.18%,CD3+CD4+细胞分别占41.59%±0.71%、33.36%±1.91%,两组比较,P均<0.05。IL-15组、对照组细胞上清液中IFN-γ分别为(15.00±5.77)×103、(7.00±2.74)×103pg/mL,TNF-α分别为(25.0±1.5)×103、(12.5±2.3)×103pg/mL,两组比较,P均<0.05。IL-15组、对照组食管癌细胞株EC9706凋亡率分别为15.71%±1.31%、13.25%±1.17%,两组比较,P<0.05。结论IL-15能增加CIK细胞增殖能力及细胞表型CD3+、CD3+CD4+阳性细胞表达,促进细胞分泌细胞因子IFN-γ、TNF-α及诱导食管癌细胞株EC9706细胞凋亡。
白细胞介素15;细胞因子诱导的杀伤细胞;细胞表型;细胞增殖;细胞凋亡
目前,在过继免疫治疗中用于治疗肿瘤的细胞主要有淋巴因子激活的杀伤细胞(LAK)、肿瘤浸润淋巴细胞、细胞毒性功能的T淋巴细胞、γδT细胞、树突状细胞(DC)、细胞因子诱导的杀伤细胞(CIK)、自然杀伤细胞(NK)等。CIK细胞是1991年首次报道的一类由多种细胞因子诱导的杀伤免疫活性细胞,其主要效应细胞为CD3+CD56+细胞。CIK细胞具有体外增殖快、杀瘤活性强、杀瘤谱广和非MHC限制的溶细胞活性等特点,还可以分泌IFN-γ、IL-12、TNF-α直接或间接杀伤肿瘤细胞,能通过颗粒酶、穿孔素途径杀伤肿瘤细胞,并且与其他杀瘤方式具有协同作用,是至今发现最有效的抗肿瘤免疫细胞。但CIK细胞在血液中含量都较低,正常人体外周血中CIK细胞占外周血淋巴细胞的1%~5%[1]。研究[2~4]发现,多种细胞因子联合进行体外培养,可促进CIK细胞增殖、活化及杀瘤毒性。IL-15是由多种细胞产生的细胞因子,具有一定的抗肿瘤作用。本研究在原有传统培养基中添加IL-15,观察IL-15对CIK细胞增殖、活化及抗瘤作用的影响。
1 材料与方法
1.1细胞、试剂、仪器食管癌细胞株EC9706(本实验室自存)在含有胎牛血清、抗生素的RPMI1640培养基中,于5%CO2、37 ℃恒温培养箱中在本实验室常规培养、传代。CO2培养箱(美国Thermo Scientific公司),多功能酶标仪(TECAN公司),流式细胞仪(BD公司),光学显微镜(Olympus公司),离心机(BD公司)。PerCP-CD3/FITC-CD4/PE-CD8三色直标荧光抗体、APC-CD56直标荧光抗体(美国BD公司),IL-15(美国PEPROTCH公司),ELISA试剂盒(DAKEWE公司),Annexin V-FITC/PI凋亡检测试剂盒(北京四正柏生物科技有限公司),淋巴细胞分离液(上海华精生物高科技有限公司)。
1.2IL-15处理CIK细胞方法及分组本实验分为对照组和IL-15组,对照组按常规方法制备CIK,IL-15组在CIK常规制备的基础上添加IL-15,具体步骤如下。①分离单个细胞:用Ficoll-Hypaque密度梯度离心法从健康志愿者外周血分离出PBMC,加4 mL PBS稀释4 mL全血(比例为1∶1),取出稀释血缓慢加入装有4 mL Ficoll-Hypaque离心管中,注意不要打乱液面界面,2 000 r/min离心20 min,轻轻吸取单个核细胞至另一支离心管中。加入生理盐水5 mL,轻轻吹匀细胞,离心洗涤2次。②CIK制备:在生理盐水悬浮的PBMC中加CIK初始培养液,调整细胞浓度为5×105/mL,种植于24孔板中,每孔200 μL,首先加入含1 000 U/mL IFN-γ的培养液,置于5%CO2、37 ℃恒温培养箱中培养;24 h后加100 ng/mL抗CD3,500 U/mL IL-2;培养4 d后调整细胞浓度为1×106/mL,每隔2 d对照组补加500 U/mL IL-2,IL-15组同时加100 ng/mL IL-15。照此法扩增至第10天收获CIK细胞。
1.3CIK细胞增殖能力观察采用台盼蓝血球计数板细胞计数法。用75%乙醇清洗计数板和盖玻片,用吸水纸擦干;在每次细胞补液前将10 μL细胞悬液和10 μL 0.4%台盼蓝充分混合,再加入80 μL的PBS缓冲液稀释细胞悬液;吸取10 μL细胞悬液,加入在计数板上的盖玻片内,一定注意不要溢出至计数板上的小槽内,也不要过少或带气泡,倒置显微镜下在血球计数板上计数4个大方格内的细胞总数及活力。细胞悬液密度(细胞个数/mL)=4个大格细胞总数/4×104×10(稀释倍数)。
1.4CIK细胞表型检测采用流式细胞仪检测。CIK细胞培养第10天时,将24孔板每孔细胞用枪头吹打均匀,分别收集至15 mL离心管中,混匀,分为对照组和IL-15组。分别取50 μL至流式管中,在管底部分别加入10 μL PerCP-CD3/FITC-CD4/PE-CD8三色直标荧光抗体、2.5 μL APC-CD56直标荧光抗体及PBS缓冲液使反应体系为100 μL。常温避光孵育20 min。1 mL过滤后的PBS缓冲液或鞘液洗2次,1500 g离心5 min,每次离心后小心吸取上清。加500 μL PBS,混匀后立即上机检测细胞表型。
1.5细胞上清液中IFN-γ、TNF-α检测用15 mL无菌离心管分别收集对照组和IL-15组培养液,2 000 r/min离心20 min,仔细收集细胞上清液。用ELISA试剂盒分别检测对照组和IL-15组细胞上清液中的IFN-γ和TNF-α,实验步骤参照ELISA使用说明书。
1.6IL-15对CIK细胞对食管鳞癌细胞系EC9706细胞凋亡的影响观察采用Annexin V-FITC/PI凋亡检测试剂盒检测细胞凋亡。收集接种于24孔培养板上的CIK培养细胞,1 500 r/min离心5 min,对照组和IL-15组效靶比均为50∶1,其中处于对数生长期靶细胞食管癌细胞株EC9706浓度为5×104个/mL,效应细胞和靶细胞等体积种植于96孔板内,最终体积为200 μL(食管癌细胞株EC9706培养基),每组3个复孔,5% CO2、37 ℃培养箱中培养24 h。共培养24 h,吸去细胞培养液,每孔用无菌PBS缓冲液或无血清培养液洗涤细胞2次,0.25%胰酶100 μL消化24孔板中细胞,收集至1.5 mL Ep管中,收集各组细胞。用4 ℃预冷的PBS缓冲液洗对照组和IL-15组细胞2次,用结合缓冲液重新悬浮细胞,调整细胞密度为1×106/mL。取100 μL结合缓冲液悬浮细胞于5 mL流式管中,加入5 μL AnnexinV-FITC混匀,室温避光反应15 min,后加入10 μL的PI,混匀后室温避光反应5 min,在反应管中加400 μL过滤后的PBS缓冲液或流式鞘液,上机流式检测。
2 结果
在CIK细胞培养的第1~2天,细胞增殖活化尚不明显,且细胞浓度有所下降。加入IL-2及IL-15后细胞开始明显活化增殖,镜下可见细胞成簇、成团增长。在细胞培养的第10天时,IL-15组、对照组细胞计数分别为(26.00±9.86)×105/mL、(7.83±1.18)×105/mL,两组比较,P<0.05。两组CIK细胞表型表达比较见表1。IL-15组、对照组细胞上清液中IFN-γ分别为(15±5.77)×103、(7±2.74)×103pg/mL,TNF-α分别为(25±1.5)×103、(12.5±2.3)×103pg/mL,两组比较,P均<0.05。IL-15组、对照组食管癌细胞株EC9706凋亡率分别为15.71%±1.31%、13.25%±1.17%,两组比较,P<0.05。
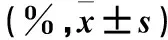
表1 两组CIK细胞表型情况
注:与对照组相比,*P<0.05。
3 讨论
目前,尽管肿瘤的治疗策略有了很大改进,但患者总体疗效和生存率仍不能令人满意。肿瘤的免疫治疗是近几年的研究热点,单抗的靶向治疗和细胞免疫治疗取得了重大突破。CIK细胞是过继免疫治疗的一种,其抗肿瘤机制是通过多种途径完成的[5,6]。CIK的传统培养方法是提取外周血单个核细胞,体外用不同的细胞因子刺激,大量扩增具有肿瘤杀伤作用的免疫效应细胞,然后回输到体内进而发挥其抗肿瘤免疫效应。这一治疗已经在肾癌、黑色素瘤等肿瘤治疗中取得了一定的疗效[7]。CIK的数量、存活率与其抗瘤作用呈正相关,但其体外培养方案及技术还有待改善。因此,我们拟通过改进体外诱导方案,增强细胞杀伤肿瘤的途径以提高其抗肿瘤活性。
IL-15生物学作用与IL-2相似[8],能诱导T、B和NK细胞的分化和增殖,增强CD8+T细胞的细胞溶解活性,诱导产生持久的抗原刺激CD8+CD44hi记忆性T细胞,刺激B细胞的分化和免疫球蛋白的合成,诱导DC的成熟但无刺激免疫调节性T细胞活性[9]。因此,提高IL-15的活性能增强机体抗肿瘤的非特异性和特异性免疫。有实验研究表明,在CIK细胞的常规培养过程中加入IL-15可促进CIK细胞增殖和NKG2D表型的表达,并提高CIK细胞体外杀瘤活性能力。另有研究[10]发现,IL-15还可以上调NK细胞表面受体的表达,同时促进CD56+细胞的扩增。本实验研究表明,IL-15体外诱导CIK细胞能增加细胞增殖数量。CIK细胞中的主要效应细胞是CD3+CD56+细胞,在体外多种细胞因子的作用下,扩增出的效应细胞多是来源于CD3+CD56-T细胞,而不是CD3-CD56+NK细胞,CD4+CD8+、CD4+CD8-、CD4-CD8+均可在细胞因子诱导培养下表达CD56+分子。CD4+CD8-细胞和CD4+CD8+细胞在正常人外周血中的含量极低,这就间接提示了外周血中CD3+CD56+细胞大多数来源于CD4-CD8+T细胞。外周血中CD4-CD8+T细胞及CD4+CD8-T细胞含量增多时,机体的抗肿瘤作用也会增强。本研究结果表明,IL-15可增强CIK细胞表面CD3+、CD3+CD4+阳性分子的表达,在IL-15诱导作用下可明显增加CIK中免疫活性细胞比例。CIK细胞通过分泌IL-12、IL-6、TNF-α及IFN-γ等细胞因子途径杀伤肿瘤,此途径也是CIK细胞抗肿瘤的主要部分。本研究结果表明,IL-15可促进CIK细胞分泌TNF-α及IFN-γ,进而增强CIK细胞抗肿瘤的作用。CIK细胞可诱导肿瘤细胞凋亡而发挥其抗肿瘤作用,本研究中添加IL-15诱导的CIK增加了食管癌细胞株EC9706的凋亡率。
可见,IL-15能增加CIK细胞增殖能力及细胞表型CD3+、CD3+CD4+阳性表达,促进细胞分泌细胞因子IFN-γ、TNF-α及诱导食管癌细胞株EC9706细胞凋亡。
[1] Zamai L, Ponti C, Mirandola P, et al. NK cells and cancer[J]. J Immunol, 2007,178(7):4011-4016.
[2] Brady J, Carotta S, Thong RP, et al. The interactions of multiple cytokines control NK cell maturation[J]. J Immunol, 2010,185(11):6679-6688.
[3] Liu J, Li H, Cao S, et al. Maintenance therapy with autologous cytokine-induced killer cells in patients with advanced epithelial ovarian cancer after first-line treatment[J]. J Immunother, 2014,37(2):115-122.
[4] Lapteva N, Durett AG, Sun J, et al. Large-scale ex vivo expansion and characterization of natural killer cells for clinical applications[J]. Cytotherapy, 2012,14(9):1131-1143.
[5] Schmidt-Wolf IG, Lefterova P,Johnston V,et al. Propagation of large numbers of T cells with natural killer cell markers[J]. Br J Haematol, 1994, 87(3):453-458.
[6] Jiang J, Wu C, Lu B. Cytokine-induced killer cells promote antitumor immunity[J]. J Transl Med, 2013,11(7):230-235.
[7] 郭晓玲,朱平.恶性肿瘤细胞过继免疫治疗研究进展[J].国外医学:肿瘤学分册,2004,31(6):418-421.
[8] Waldmann TA. The biology of interleukin-2 and interleukin-15: implications for cancer therapy and vaccine design[J]. Nat Rev Immunol, 2006,6(8):595-601.
[9] Steel JC, Waldmann TA, Morris JC. Interleukin-15 biology and its therapeutic implications in cancer[J]. Trends Pharmacol Sci, 2012,33(1):35-41.
[10] Boyiadzis M, Memon S, Carson J, et al. Up-regulation of NK cell activating receptors following allogeneic hematopoietic stem cell transplantation under a lymphodepleting reduced intensity regimen is associated with elevated IL-15 levels[J]. Biol Blood Marrow Transplant, 2008,14(3):290-300.
河南省医学科技攻关计划资助项目(201404008);河南省科技厅科技攻关项目(142300410270)。
马军(E-mail: 843093451@qq.com)
10.3969/j.issn.1002-266X.2016.23.013
R392
A
1002-266X(2016)23-0041-03
2016-01-11)
