同一层面裸鼠移植瘤PET/CT图像18F-FLT摄取量与Ki-67表达的关系
2016-11-08李澄明张晓丽张建波孙新东于金明孟雪
李澄明,张晓丽,张建波,孙新东,于金明,孟雪
(1济南大学·山东省医学科学院医学与生命科学学院,济南 250012;2山东省肿瘤医院;3武汉大学人民医院)
同一层面裸鼠移植瘤PET/CT图像18F-FLT摄取量与Ki-67表达的关系
李澄明1,2,张晓丽2,3,张建波2,孙新东2,于金明2,孟雪2
(1济南大学·山东省医学科学院医学与生命科学学院,济南 250012;2山东省肿瘤医院;3武汉大学人民医院)
目的观察同一层面裸鼠移植瘤PET/CT图像18F-FLT摄取量与Ki-67表达的关系。方法10只雌性BALB/c型裸鼠,建立裸鼠移植瘤模型,裸鼠在体瘤及离体瘤接受18F-FLT PET/CT扫描,在PET图像上勾画感兴趣区计算18F-FLT标准摄取值(SUV)的最大值(SUVmax)、平均值(SUVmean),并在病理切片上检测对应位置的Ki-67,采用斯皮尔曼秩和检验观察SUV与Ki-67指数的关系。结果离体瘤与在体瘤的SUVmax、SUVmean比较差异无统计学意义。离体瘤SUVmax与Ki-67指数呈正相关(r=0.763,P<0.001),SUVmean与Ki-67指数亦呈正相关(r=0.575,P=0.013)。结论同一层面裸鼠移植瘤PET/CT图像18F-FLT摄取量与Ki-67表达具有一致性。
非小细胞肺癌;18F-FLT PET/CT摄取量;细胞增殖;Ki-67指数;放射治疗
非小细胞肺癌(NSCLC)患者局部复发率高、预后差,增加病灶的放疗剂量可降低复发率并提高总生存,但放疗引起的不良反应会限制剂量增加[1]。靶区的大小是影响剂量增加的重要因素,PET图像可定义肿瘤的生物靶区。因此,为避免高剂量引起的组织损伤,可参考PET扫描来勾画靶区[2]。肿瘤细胞增殖与NSCLC等多种肿瘤的预后有关[3]。Ki-67指数是评价细胞增殖的金标准[4],但Ki-67指数只能通过活检标本或者切除的肿瘤组织计数,因此需要一种无创可重复的方法评价细胞增殖。18F-FLT被认为是可在体反映细胞增殖的示踪剂[5,6],已被应用到多种细胞系的体外实验中[7]。应用肿瘤模型及肿瘤患者进行的在体研究[8,9]表明,肿瘤总体的18F-FLT摄取与特异性肿瘤增殖指标(Ki-67指数)有相关关系。但这些研究没有进行示踪剂摄取分布与病理细胞增殖区域的空间位置对比。有文献[10]认为18F-FLT摄取的量级尚无充分理由作为评价细胞增殖高低的指标。18F-FLT示踪剂浓聚多的区域给予高剂量的放疗是否能真正提高肿瘤的控制率有待验证。本研究通过18F-FLT PET图像与病理切片层对层之间的对比,观察同一层面裸鼠移植瘤PET/CT图像18F-FLT摄取量与Ki-67表达的关系,明确18F-FLT摄取量与肿瘤细胞增殖的关系,从而指导临床放疗的剂量雕刻。
1 材料与方法
1.1细胞培养 A549细胞系购自中科院上海细胞所。细胞培养应用RPMI1640培养基(Gibco,美国),加入10%的胎牛血清(FBS,Gibco,美国)、链霉素100 μg/mL、青霉素100 U/mL(Gibco,美国),置于37 ℃、5%CO2饱和湿度的孵育箱中常规传代培养。
1.2裸鼠移植瘤模型的建立 5~6周龄的雌性BALB/c型裸鼠10只,购自北京华阜康生物科技公司,动物生产许可证号:SCXK[京]2009-0008。于山东省肿瘤医院基础实验中心动物房无特定病原体(SPF级)条件下饲养,标准颗粒饲料、饮用水、垫料等所有物品均经灭菌处理。动物房保持26 ℃的恒温及50%~60%的相对湿度。取指数生长期的A549细胞,经消化后,用平衡盐溶液调整细胞浓度为2×107/mL,在无菌条件下,每只BALB/c型裸鼠右后肢皮下注射A549细胞悬液100 μL(含有2×106个细胞)。用游标卡尺测量肿瘤直径。当肿瘤的平均直径达到8 mm时即进行PET显像。
1.318F-FLT PET/CT显像及18F-FLT摄取量计算使用PET-MF-2V-IT-I型氟多功能合成模块制备18F-FLT,合成方法如文献[11]所述。用Inveon DPET(美国西门子公司)进行小动物PET扫描。通过尾静脉对裸鼠进行18F-FLT注射,剂量为(4.46 ± 2.47)MBq。在进行18F-FLT PET扫描的前夜起至扫描结束,裸鼠禁饮水。PET扫描在注射18F-FLT 60 min后开始,扫描前及扫描过程中裸鼠用纯氧中含1.5%的异氟烷气体麻醉,流量是2.0 L/min。将裸鼠仰卧位放于小动物PET扫描床上,四肢用胶带固定。扫描10 min获得静态单帧图像,并将图像用OSEM-3D IAW(美国西门子公司)软件重建。每只裸鼠PET扫描结束后即用MicroCAT®Ⅱ系统(美国西门子公司)进行小动物CT扫描,进行CT扫描所用到的扫描床即PET扫描时所用的扫描床,目的是对肿瘤进行定位,用于后期PET与CT图像融合时确保肿瘤的位置不发生变化。小动物PET与小动物CT图像用Inveon软件(西门子公司)融合。接着在异氟烷麻醉状态下颈椎脱臼处死裸鼠并取出肿瘤,离体肿瘤去除肌肉和骨等组织。对裸鼠所有的处理均经过了伦理委员会的同意。离体瘤按照上述扫描过程再次扫描。为了保证扫描图像与相同层面的病理图像进行比较,我们利用3D打印技术设计了离体瘤固定器。该固定器能够在离体瘤内部做出明显标记。固定器上有4个针孔以确定4根针线穿过肿瘤内部时能定位出2个平行的平面。根据CT图像上细线穿过肿瘤的低密度影选取出相应的层面。PET图像由两位经验丰富的核医学医师独立分析并计算18F-FLT标准摄取值(SUV)。SUV通过公式(CT×W)/Dinj计算,CT是组织放射性浓度,W是裸鼠体质量,Dinj是18F-FLT的注射剂量。我们在PET扫描横断位图像上勾画感兴趣区(ROI)。在每个标本选取要分析的层面。在所选取的每个层面勾画出5个ROI计算SUV值,包括该层的4个ROI(图1标号为1~4),另一个ROI是横断位整个层面(图1标号为5),标号6以整个肿瘤作为一个ROI。通过上述公式计算出每个ROI的SUVmax和SUVmean。
1.4肿瘤组织Ki-67检测图像扫描完成后,将离体瘤置于4%甲醛溶液中固定24 h,后用石蜡包埋,随后剔除所有穿过瘤体的细线。沿着两条十字交叉细线所在处将离体瘤切割成节段。在离断平面处切取4 μm厚的切片进行免疫组化染色,根据CT图像同样选取切片上有细线穿过形成十字空隙的片子进行分析。切片用Ki-67 MIB-1鼠单克隆抗体(按1∶200稀释,Dianova,Hamburg,德国)孵育。切片染色后在显微镜下放大40倍计数Ki-67阳性细胞与肿瘤细胞,计算Ki-67指数(Ki-67阳性细胞与所有肿瘤细胞的比值)。细胞核染色清晰或为均匀颗粒状定义为Ki-67阳性细胞,细胞质被染色的细胞不认为是阳性细胞[12]。为避免偏差,计数肿瘤组织切片Ki-67阳性细胞与分析PET图像分别进行。分别在离体瘤病理图像上计数与相应PET图像层画出的ROI的对应处的Ki-67(图1)。
2 结果
10只裸鼠移植瘤模型均建立成功,其移植瘤分别于在体、离体状态下接受PET和CT扫描,但其中1只裸鼠的肿瘤包绕后肢生长未纳入分析。9只裸鼠整个在体移植瘤的SUVmax与SUVmean分别为1.87±0.05、1.19±0.12,整个离体移植瘤分别为1.65 ±0.64、1.05±0.37,两者SUVmax、SUVmean比较,P均>0.05。勾画标号1~5的ROI层面中,在体移植瘤的SUVmax与SUVmean分别为1.24 ±0.19、1.14 ±0.16,离体移植瘤相对应层面分别为1.28 ±0.51、1.12 ±0.36,两者SUVmax、SUVmean比较,P均>0.05。
9只裸鼠离体移植瘤组织切片HE染色良好。大部分切片同时含有肿瘤细胞、纤维化组织、炎症细胞,有或没有坏死组织,肿瘤直径控制良好,其内坏死组织相对较少,所有的标本中均有有活性的肿瘤细胞。用于实验分析的9个标本中,所有标号1~4的ROI的SUVmax是1.28±0.51、SUVmean是1.12±0.36,Ki-67指数是79.6%±15.8%,SUVmax与Ki-67指数呈正相关(r=0.763,P<0.001),SUVmean与Ki-67指数亦呈正相关(r=0.575,P=0.013)。图1标号1处SUVmax=2.340,SUVmean=1.718,Ki-67指数=98%;标号2处SUVmax=2.069,SUVmean=1.869,Ki-67指数=95%;标号3处SUVmax=1.229,SUVmean=1.226,Ki-67指数=85%;标号4处SUVmax=1.770,SUVmean=1.616,Ki-67指数=90%。
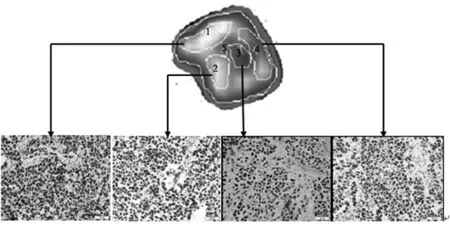
图1 同一层面的ROI及Ki-67染色
3 讨论
本研究的目的是利用移植瘤模型验证肿瘤内部18F-FLT的摄取区与肿瘤增殖指标空间位置一致性。为了避免肿瘤切除前后引起的误差,我们用离体瘤图像分析18F-FLT摄取与离体肿瘤组织Ki-67指数的关系。在我们的研究中,在体瘤与离体瘤的SUV值没有差异,可以认为离体瘤的SUV值与Ki-67的关系可以代表在体瘤的SUV值与Ki-67指数的关系。且本研究中18F-FLT摄取的空间分布与Ki-67阳性细胞数有良好的相关关系。根据上述结果可得出:18F-FLT高摄取区的空间位置与Ki-67阳性细胞数高表达空间位置有良好的相关关系。也就是说,可初步认为PET/CT上18F-FLT的摄取可以指导放疗生物亚靶区的勾画。
许多肿瘤模型及临床试验已经证实,当把肿瘤作为一个整体分析时,18F-FLT的摄取与Ki-67指数有相关关系[13~16]。然而,当考虑到肿瘤内部的微环境异质性时,上述结论的得出难免有些草率。功能分子影像能够将有活性的肿瘤组织与坏死组织区分开。在NSCLC的临床放射治疗中,我们可以应用肿瘤内微环境异质性定义亚靶区。Marian等[17]研究认为,只要成像设备能够区分出肿瘤微环境异质性的特征,那么在勾画靶区时引入亚靶区的概念就是可行的。意识到在直接评估肿瘤异质性存在的内在局限后,本研究应用人肺腺癌裸鼠移植瘤模型层与层比较瘤内18F-FLT摄取与细胞增殖标志物分布的关系,旨在探究18F-FLT PET在评价肿瘤增殖中的潜在作用。本研究的结果补充了先前研究中的不足,先前的有关研究没有进行空间位置的比较[18~20]。Chalkidou等[21]发表了1篇关于FLT和Ki-67指数关系的Meta分析,该分析将先前诸多文献中FLT和Ki-67相关关系的差异归因于研究方法的不同,并指出应该进行更大样本的改良前瞻性研究设计以解释在不同的肿瘤中得出的矛盾结果。
对应的层与层比较PET图像与病理图像使得实验能够确定肿瘤内部PET示踪剂的空间分布与相应区域生物学特性的相关性。本研究认为,18F-FLT PET可以作为一种无创的方法定量地评估NSCLC的细胞增殖情况,为临床医生进一步地提供评价肿瘤恶性程度的预测指标并可能更精确地勾画肿瘤放疗靶区。但存在以下几点不足:作为可行性研究,本实验样本数太少,应该扩大研究样本并在临床中展开实验;在病理切片制作过程中,标本的形变是无法避免的,所以说层与层的比较只能是粗略配准;本研究应用的A549细胞系的Ki-67指数比预期的要高很多,我们没有找到有关定义Ki-67指数高表达的文献,本研究计数的阳性细胞指数只是一个主观指标。
[1] Moller DS, Khalil AA, Knap MM, et al. A planning study of radiotherapy dose escalationof PET-activetumour volumes in non-small cell lung cancer patients[J]. Acta Oncol, 2011,50(6):883-888.
[2] 于金明.21世纪的放射肿瘤学[J].中华肿瘤杂志,2002,24(6):521-525.
[3] Costa A, Silvestrini R, Mochen C, et al. P53 expression, DNA ploidy and S-phase cell fraction in operable locally advanced non-small-cell lung cancer[J]. Br J Cancer, 1996,73(7):914-919.
[4] Thureau S, Chaumet-Riffaud P, Modzelewski R, et al. Interobserver agreement of qualitative analysis and tumor delineation of18F-fluoromisonidazole and 3′-deoxy-3′-18F-fluorothymidine PET images in lung cancer[J]. J Nucl Med, 2013,54(9):1543-1550.
[5] Soloviev D, Lewis D, Honess D, et al. [(18)F]FLT: an imaging biomarker of tumour proliferation for assessment of tumour response to treatment[J]. Eur J Cancer, 2012,48(4):416-424.
[6] Sanghera B, Wong WL, Sonoda LI, et al. FLT PET-CT in evaluation of treatment response[J]. Indian J Nucl Med, 2014,29(2):65-73.
[7] Grierson J, Schwartz J, Muzi M, et al. Metabolism of 3′-deoxy-3′- [F-18]fluorothymidine in proliferating A549 cells: validations for positron emission tomography[J]. Nucl Med Biol, 2004,31(7):829-837.
[8] Kenny LM, Vigushin DM, Al-Nahhas A, et al. Quantification of cellular proliferation in tumor and normal tissues of patients with breast cancer by [18F]fluorothymidine-positron emission tomography imaging: evaluation of analytical methods[J]. Cancer Res, 2005,65(21):10104-10112.
[9] Woolf DK, Beresford M, Li SP, et al. Evaluation of FLT-PET-CT as an imaging biomarker of proliferation in primary breast cancer[J]. Br J Cancer, 2014,110(12):2847-2854.
[10] McKinley ET, Ayers GD, Smith RA, et al. Limits of [18F]-FLT PET as a Biomarker of Proliferation in Oncology[J]. PLoS One, 2013,8(3):e58938.
[11] 郭先伟,黄丽蓉,虞善友,等.PET显像剂18F-FLT的合成条件优化[J].同位素,2011,24(B12):76-79.
[12] Spyratos F, Ferrero-Poüs M, Trassard M, et al. Correlation between MIB-1 and other proliferation markers: clinical implications of the MIB-1 cut-off value[J]. Cancer, 2002,94(8):2151-2159.
[13] Yamamoto Y, Nishiyama Y, Ishikawa S, et al. Correlation of 18F-FLT and18F-FDG uptake on PET with Ki-67 immunohistochemistry in non-small cell lung cancer[J]. Eur J Nucl Med Mol Imaging, 2007,34(10):1610-1616.
[14] Hatakeyama T, Kawai N, Nishiyama Y, et al. 11C-methionine(MET) and18F-fluorothymidine (FLT) PET in patients with newly diagnosed glioma[J]. Eur J Nucl Med Mol Imaging, 2008,35(11):2009-2017.
[15] Brockenbrough JS, Souquet T, Morihara JK, et al. Tumor 3′-deoxy-3′-18F-fluorothymidine (18F-FLT) uptake by PET correlates with thymidine kinase 1 expression: static and kinetic analysis of18F-FLT PET studies in lung tumors[J]. J Nucl Med, 2011,52(8):1181-1188.
[16] Yue JB, Yang J, Liu J, et al. Histopathologic validation of 3′-deoxy-3′-18F-fluorothymidine PET for detecting tumor repopulation during fractionated radiotherapy of human FaDu squamous cell carcinoma in nude mice[J]. Radiother Oncol, 2014,111(3):475-481.
[17] Axente M, He J, Bass CP, et al. Tumour microenvironment heterogeneity affects the perceived spatial concordance between the intratumoural patterns of cell proliferation and18F-fluorothymidine uptake[J]. Radiother Oncol, 2012,105(1):49-56.
[18] Troost EG, Bussink J, Slootweg PJ, et al. Histopathologic validation of 3′-deoxy-3′-18F-fluorothymidine PET in squamous cell carcinoma of the oral cavity[J]. J Nucl Med, 2010,51(5):713-719.
[19] Sanghera B, Wong WL, Sonoda LI, et al. FLT PET-CT in evaluation of treatment response[J]. Indian J Nucl Med, 2014,29(2):65-73.
[20] Nakajo M, Nakajo M, Kajiya Y, et al. Correlations of (18)F-fluorothymidine uptake with pathological tumour size,Ki-67and thymidine kinase 1 expressions in primary and metastatic lymph node colorectal cancer foci[J]. Eur Radiol, 2014,24(12):3199-3209.
[21] Chalkidou A, Landau DB, Odell EW, et al. Correlation between Ki-67 immunohistochemistry and18F-fluorothymidine uptake in patients with cancer: a systematic review and meta-analysis[J]. Eur J Cancer, 2012,48(18):3499-3513.
Correlation between uptake of 18 F-FLT on PET/CT imaging and Ki-67 expression at the same layer based on nude mice with tumor xenografts
LIChengming1,ZHANGXiaoli,ZHANGJianbo,SUNXindong,YUJinming,MENGXue
(1UniversityofJinan,ShandongAcademyofMedicalSciences,Jinan250012,China)
Objective To observe the correlation between the uptake of18F-FLT on PET/CT imaging and the expression of Ki-67 at the same layer based on nude mice with tumor xenografts. MethodsTen BALB/c female nude mice with A549 cell xenografts in vivo and in vitro underwent18F-FLT PET/CT scan. In the interested region, we calculated the maximum (SUVmax) of18F-FLT standard uptake value (SUV) and mean uptake value (SUVmean).On the pathological section, the expression of Ki-67 was detected at the same corresponding position. Correlations among the SUV definition of FLT uptake and proliferation makers (Ki-67 LI) were analyzed using the nonparametric Spearman rank test. ResultsThere was no statistically significant difference in the SUVmaxand SUVmeanbetween tumor in vitro and in vivo. For tumors in vitro,18F-FLT SUVmaxwas positively correlated with Ki-67 (r=0.763,P<0.001), and18F-FLT SUVmeanwas also positively correlated with Ki-67 (r=0.575,P=0.013).ConclusionAt the same layer, the uptake of18F-FLT on PET/CT imaging of nude mice with tumor xenografts was in good agreement with Ki-67 expression.
non-small-cell lung cancer; uptake of18F-FLT PET/CT; cell proliferation; Ki-67 index; radiotherapy
公益性行业科研专项资助项目(201402011);国家自然科学基金资助项目(81472810);山东省科技发展计划项目(2014GSF118138)。
李澄明(1988-),女,硕士研究生,主要从事肿瘤放射治疗学研究。E-mail: mzsdry@126.com
简介:孟雪(1981-),女,博士,副主任医师,主要从事肿瘤放射治疗学研究。E-mail: mengxue5409@126.com
10.3969/j.issn.1002-266X.2016.23.002
R730.4
A
1002-266X(2016)23-0005-04
2016-01-27)
