普萘洛尔及异丙肾上腺素对体外培养婴儿血管瘤内皮细胞增殖和血管内皮生长因子、碱性成纤维细胞生长因子表达的影响
2016-11-06朱雅琳侯巍帕丽达阿布利孜
朱雅琳 侯巍 帕丽达·阿布利孜
830054乌鲁木齐,新疆医科大学第一附属医院皮肤科
·论著·
普萘洛尔及异丙肾上腺素对体外培养婴儿血管瘤内皮细胞增殖和血管内皮生长因子、碱性成纤维细胞生长因子表达的影响
朱雅琳 侯巍 帕丽达·阿布利孜
830054乌鲁木齐,新疆医科大学第一附属医院皮肤科
目的 探讨普萘洛尔及异丙肾上腺素在体外对婴儿血管瘤内皮细胞增殖及血管内皮细胞生长因子(VEGF、VEGF-2)、人碱性成纤维细胞生长因子(bFGF)表达的影响。方法 将体外培养的2~3代增殖期婴儿血管瘤内皮细胞分为普萘洛尔组和异丙肾上腺素组,其中普萘洛尔组分别换浓度为10、15、20 mg/L普萘洛尔工作液(10、15、20 mg/L普萘洛尔组)、空白EGM-2培养基(空白组)和含0.16%DMSO EGM-2培养基(DMSO组)培养,而异丙肾上腺素组分别换5、10、20 mg/L异丙肾上腺素工作液(5、10、20 mg/L异丙肾上腺素组)和空白EGM-2培养基(空白组)培养。采用MTT法测定24、48、72、96 h时各组血管瘤内皮细胞的增殖情况,ELISA法测定培养24、48 h时各组细胞培养上清液中VEGF、VEGF-2、bFGF的浓度。 结果 培养24、48 h时,10、15、20 mg/L普萘洛尔组血管瘤内皮细胞增殖差异无统计学意义(H值分别为1.152、2.643,均P>0.05);72、96 h时,20 mg/L普萘洛尔组血管瘤内皮细胞的增殖明显低于空白组(P<0.05),而空白组、DMSO组及10、15 mg/L普萘洛尔组间差异均无统计学意义。各浓度普萘洛尔、异丙肾上腺素作用24 h时均对VEGF、VEGF-2、bFGF水平有一定影响。48 h时,15、20 mg/L普萘洛尔组VEGF水平均较空白组显著下降,同时10、15、20 mg/L普萘洛尔组VEGF-2、bFGF水平也均较空白组显著下降(P<0.05);而5、10、20 mg/L异丙肾上腺素组VEGF水平均较空白组显著升高(P<0.05),20 mg/L异丙肾上腺素组VEGF-2、bFGF水平均显著高于空白组及5、10 mg/L异丙肾上腺素组(P<0.05)。结论 一定浓度普萘洛尔作用于增殖期婴儿血管瘤内皮细胞一定时间后能够抑制细胞生长,而异丙肾上腺素反之,两者对细胞因子表达的影响作用也相反,因此推断普萘洛尔治疗婴儿血管瘤的机制可能与β肾上腺素能受体及其下游信号转导影响相关细胞因子表达相关。
血管瘤;内皮细胞;普萘洛尔;异丙肾上腺素;成纤维细胞生长因子2;内皮生长因子
目前血管瘤的发病机制尚不清楚,主要有遗传和基因突变学说、胎盘绒毛膜细胞异位学说、内皮祖细胞或干细胞学说、血管发生失衡理论等[1-7]。自2008年始,大量研究和临床资料显示,普萘洛尔对血管瘤有明显疗效[8-11]。近期有报道认为,异丙肾上腺素在体外能促进血管生成[12],但机制不清。普萘洛尔和异丙肾上腺素均作用于β肾上腺素受体,前者为受体阻断剂,后者为受体激动剂。β肾上腺素受体在婴儿血管瘤发生发展中的作用越来越受到人们重视。此外,内皮细胞增殖失控已成为血管瘤发病机制研究的一个重要方面,其中,血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等促血管生成因子在患儿体内及组织中高表达,是增生期血管瘤的主要发病机制[13-15],而VEGF是作用最强的一种[16-18]。本研究使用一定浓度的普萘洛尔及异丙肾上腺素作用于体外培养的血管瘤内皮细胞,比较二者对体外培养环境下的血管瘤内皮细胞增殖的影响,同时用ELISA分别测定两种药物作用前后VEGF、VEGF-2、bFGF的变化,研究普萘洛尔治疗婴儿血管瘤的机制以及β受体在婴儿血管瘤发生发展过程中的作用。
材料和方法
1.样本来源:血管瘤标本来自临床手术切除的额部增殖期血管瘤,患儿女,9个月。患儿父母均知情同意。
2.主要试剂与仪器:EBM-2培养基、EGMTM-2MV BulletKitTM(瑞士Lonza公司),0.25%胰蛋白酶、磷酸盐缓冲液(PBS)、含双抗 PBS(美国 HyClone公司),20%胎牛血清(美国Gibco公司),兔抗人血浆血管性血友病因子(vwf)多克隆抗体、聚合HRP标记抗兔IgG、兔抗人VEGFR-2抗体(武汉博士德生物工程有限公司),抗人CD31 FITC、鼠IgG1 K同型对照FITC(美国 eBioscience公司),MTT、DMSO(美国Sigma公司),AnnexinV-FITC/PI细胞凋亡检测试剂盒(上海贝博生物)。酶标仪、CO2细胞培养箱(美国Thermo公司),荧光倒置显微镜(日本Olympus公司),MACSQuant流式细胞仪(德国MiltenyiBiotec公司)。VEGF、VEGF-2、bFGF的ELISA 试剂盒(武汉华美生物工程有限公司)。
3.普萘洛尔对细胞生长曲线的影响:首先配制含普萘洛尔的培养基,用DMSO溶解普萘洛尔,用EGM-2培养基稀释成 10、15、20 mg/L工作液,DMSO终浓度为0.16%,0.22 μm滤器过滤分装。血管瘤内皮细胞的原代培养及鉴定见文献[19]。取2代细胞消化离心并计数,均匀铺入96孔板,每孔2×104个,加入 EGM-2 培养基 200 μl,孵育 24 h,待细胞贴壁后换液。将细胞随机分为5组,分别换浓度为10、15、20 mg/L普萘洛尔工作液,空白EGM-2培养基(空白组)和含0.16%DMSO EGM-2培养基(DMSO组),每组均设4个复孔。放入CO2培养箱继续培养,分别于 24、48、72、96 h 用 MTT 法[19]测定其吸光度(A值),观察细胞形态学改变。以时间做横坐标,平均A值为纵坐标,分别做每个浓度的细胞平均A值折线图。
4.普萘洛尔及异丙肾上腺素对体外培养血管瘤内皮细胞VEGF、VEGF-2、bFGF的影响:取2~3代增殖期血管瘤内皮细胞,在6孔板中调整细胞密度为3×105/ml,每孔2 ml。随后将6孔板放置37℃、5%CO2培养箱中培养24 h,待细胞贴壁后换液。将细胞分为普萘洛尔组和异丙肾上腺素组,其中普萘洛尔组又分为5组,分别换浓度为10、15、20 mg/L普萘洛尔工作液、空白EGM-2培养基(空白组)和含0.16%DMSOEGM-2培养基(DMSO组),每组8个复孔。异丙肾上腺素组分为4组,分别换EGM-2培养基稀释而成的5、10、20 mg/L异丙肾上腺素工作液和空白EGM-2培养基(空白组),每组8个复孔。各组在作用24、48 h时,取细胞培养上清液,采用 ELISA法分别检测各组 VEGF、VEGF-2、bFGF的水平。
5.统计方法:采用SPSS17.0软件,由于A值数据非正态,多组A值的比较采用多组独立样本的Kruskal-WallisH检验。细胞因子浓度计量资料采用±s表示,计量资料均进行正态性检验和方差齐性检验,方差齐使用单因素方差分析,两两比较为SNK法,方差不齐则使用Dunnett方法。P<0.05为差异有统计学意义。
结 果
1.普萘洛尔对血管瘤内皮细胞的影响:普萘洛尔作用前,各孔细胞贴壁生长良好,20 mg/L普萘洛尔作用96 h后,细胞形态呈圆形及类圆形,细胞间距增大,细胞变稀疏(图1)。10、15、20mg/L普萘洛尔分别作用24~96h(图2),24~48h时,空白组、DMSO 组及 10、15、20 mg/L普萘洛尔组间血管瘤内皮细胞增殖情况差异无统计学意义(H值分别为1.152、2.643,均 P > 0.05);72、96 h 时,各组血管瘤内皮细胞增殖情况不全相同(H值分别为13.521、11.329,均P<0.05)。进一步两两比较,72 h时空白组与DMSO组细胞增殖差异无统计学意义,其余各浓度普萘洛尔组细胞增殖活性随普萘洛尔浓度的升高而下降,差异均有统计学意义(P<0.05);96 h时空白组与DMSO组细胞增殖差异无统计学意义(P>0.05),10、15 mg/L普萘洛尔组较空白组差异无统计学意义(P>0.05),而20 mg/L组细胞增殖活性明显低于空白组(P<0.05)。
2.不同浓度普萘洛尔对体外培养血管瘤内皮细胞 VEGF、VEGF-2、bFGF 水平的影响(表 1):空白组和DMSO组VEGF、VEGF-2、bFGF水平在24、48 h时差异均无统计学意义(P>0.05);10、15、20 mg/L 普萘洛尔作用24 h时,各组VEGF含量差异无统计学意义(P>0.05);15、20 mg/L普萘洛尔组均较空白组和10 mg/L普萘洛尔组VEGF-2水平下降,差异有统计学意义(P<0.05),而 15、20 mg/L普萘洛尔组间差异无统计学意义(P>0.05);10、15、20 mg/L 普萘洛尔组bFGF水平均明显低于空白组,差异有统计学意义(P<0.05),而这3组差异无统计学意义(P>0.05)。
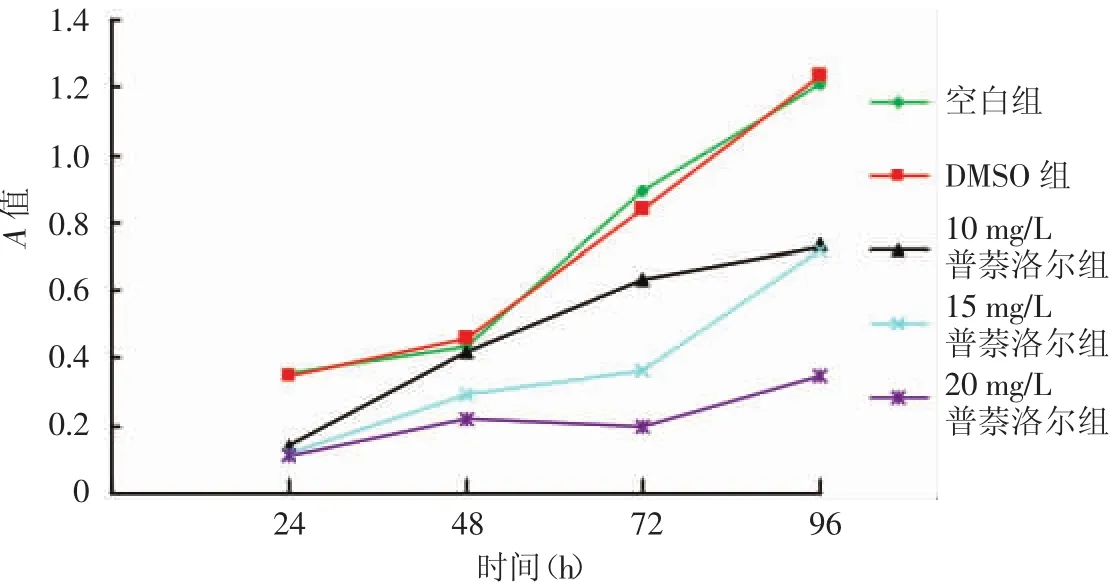
图2 10、15、20 mg/L普萘洛尔作用24~96 h对血管瘤内皮细胞增殖的影响24、48 h时,空白组、二甲基亚砜(DMSO)组与 10、15、20 mg/L 普萘洛尔组血管瘤内皮细胞的增殖无明显差别,但在72、96 h时各组A值不全相同
表1 普萘洛尔作用血管瘤内皮细胞24、48 h后细胞培养上清液血管内皮细胞生长因子(VEGF、VEGF-2)、碱性成纤维细胞生长因子(bFGF)含量(±s,ng/L)

表1 普萘洛尔作用血管瘤内皮细胞24、48 h后细胞培养上清液血管内皮细胞生长因子(VEGF、VEGF-2)、碱性成纤维细胞生长因子(bFGF)含量(±s,ng/L)
注:n=8。a:与空白组比较,P < 0.05;b:与 10 mg/L 普萘洛尔组比较,P < 0.05
组别24 h 48 h VEGF VEGF-2 bFGF VEGF VEGF-2 bFGF空白组 251.00±44.34 83.82±1.21 10.27±0.34 702.40±91.79 110.50±3.88 14.46±0.30二甲基亚砜组 228.70±12.75 85.14±2.55 11.59±0.49 659.60±95.88 100.60±3.59 14.58±0.32 10 mg/L普萘洛尔组 212.00±38.81 81.90±1.96 5.43±0.63a 621.20±32.08 81.83±3.16a 8.01±0.59a 15 mg/L普萘洛尔组 262.50±134.90 73.65±0.60ab 5.70±0.34a 484.30±53.17a 71.21±0.83ab 7.97±0.61a 20 mg/L普萘洛尔组 211.70±23.79 71.21±2.32ab 5.07±0.22a 535.90±5.36a 69.42±1.37ab 8.02±0.33a F值 1 236.23 872.23 182.11 8 922.34 2 251.22 159.21 P值 >0.05 <0.05 <0.05 <0.05 <0.05 <0.05
作用48 h时,15、20 mg/L普萘洛尔组VEGF水平均较空白组显著下降(P<0.05),而10 mg/L普萘洛尔组VEGF水平与空白组差异无统计学意义(P>0.05);10、15、20 mg/L 普萘洛尔组 VEGF-2、bFGF水平均较空白组下降,差异有统计学意义(P<0.05),其中15、20 mg/L普萘洛尔组较10 mg/L组VEGF-2水平低,差异有统计学意义(P<0.05)。
3.不同浓度异丙肾上腺素对体外培养血管瘤内皮细胞 VEGF、VEGF-2、bFGF 水平的影响(表 2):5、10、20 mg/L异丙肾上腺素作用于体外培养的血管瘤内皮细胞24 h时,20 mg/L异丙肾上腺素组较空白组、5 mg/L异丙肾上腺素组VEGF水平升高,差异有统计学意义(P<0.05),而与10 mg/L异丙肾上腺素组差异无统计学意义(P>0.05),空白组与5 mg/L组差异亦无统计学意义(P>0.05);5、10、20 mg/L 异丙肾上腺素组VEGF-2水平均较空白组显著升高(P<0.05),且VEGF-2水平随异丙肾上腺素浓度的增加而显著增加(P<0.05);20 mg/L异丙肾上腺素组bFGF水平较空白组、5、10 mg/L异丙肾上腺素组显著升高(P<0.05),而后3组间差异无统计学意义(P>0.05)。
作用 48 h 时,5、10、20 mg/L 异丙肾上腺素组VEGF水平均较空白组显著升高(P<0.05),而前3组间差异无统计学意义(P>0.05);20 mg/L异丙肾上腺素组VEGF-2、bFGF水平均显著高于空白组、5、10 mg/L异丙肾上腺素组(P<0.05),而后3组间差异无统计学意义(P>0.05)。
讨 论
普萘洛尔是一种β肾上腺素受体阻断剂,能够特异性地阻断β1和β2肾上腺素受体。临床上,普萘洛尔常被用于儿童偏头痛、心律失常、甲状腺功能亢进以及法洛四联症等疾病的治疗。2008年,Léauté-Labrèze发现普萘洛尔可以治疗婴幼儿血管瘤[8],但其机制不清。血管瘤中血管内皮细胞的异常增殖及消退期凋亡主要认为与局部微环境的变化(血管形成因子与血管形成抑制因子失衡等)及内皮细胞自身的转化有关,其中内皮细胞增殖失控的机制成为血管瘤发病机制研究的一个重要方面,表现为增殖期促进内皮细胞增殖、血管形成的因子过度表达,血管形成抑制因子低表达,而后者在消退期高表达。
本研究采用普萘洛尔处理体外培养血管瘤内皮细胞,24~48 h各浓度普萘洛尔对血管瘤内皮细胞无明显影响,72~96 h低浓度(10、15 mg/L)普萘洛尔对血管瘤内皮细胞仍无明显影响,而高浓度(20 mg/L)普萘洛尔明显抑制血管瘤内皮细胞的增殖。细胞形态学观察也显示,20 mg/L普萘洛尔可抑制血管瘤内皮细胞的生长。我们前期的研究[19]显示,β肾上腺素受体激动剂异丙肾上腺素作用血管瘤内皮细胞24~72 h内,对细胞增殖的影响不大,但在96 h后随异丙肾上腺素浓度的增高,细胞增殖活性增强,提示异丙肾上腺素对血管瘤内皮细胞的生长有促进作用,与普萘洛尔的作用恰恰相反,因此推断β肾上腺素受体在婴儿血管瘤发生发展中起着重要的作用。
表2 异丙肾上腺素作用血管瘤内皮细胞24、48 h后细胞培养上清液血管内皮细胞生长因子(VEGF、VEGF-2)、碱性成纤维细胞生长因子(bFGF)含量(±s,ng/L)
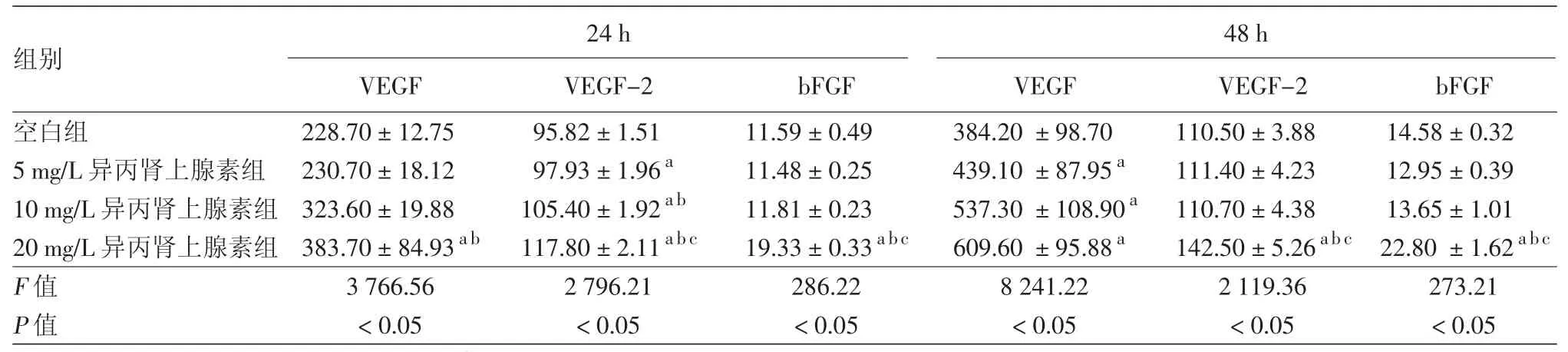
表2 异丙肾上腺素作用血管瘤内皮细胞24、48 h后细胞培养上清液血管内皮细胞生长因子(VEGF、VEGF-2)、碱性成纤维细胞生长因子(bFGF)含量(±s,ng/L)
注:n=8。a:与空白组比较,P < 0.05;b:与 5 mg/L 异丙肾上腺素组比较,P < 0.05;c:与 10 mg/L 异丙肾上腺素组比较,P < 0.05
48 h VEGF VEGF-2 bFGF VEGF VEGF-2 bFGF空白组 228.70±12.75 95.82±1.51 11.59±0.49 384.20±98.70 110.50±3.88 14.58±0.32 5 mg/L异丙肾上腺素组 230.70±18.12 97.93±1.96a 11.48±0.25 439.10±87.95a 111.40±4.23 12.95±0.39 10 mg/L异丙肾上腺素组 323.60±19.88 105.40±1.92ab 11.81±0.23 537.30±108.90a 110.70±4.38 13.65±1.01 20 mg/L异丙肾上腺素组 383.70±84.93ab 117.80±2.11abc 19.33±0.33abc 609.60±95.88a 142.50±5.26abc 22.80±1.62abc F值 3 766.56 2 796.21 286.22 8 241.22 2 119.36 273.21 P值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 24 h组别
目前发现的一系列促血管生成因子中,VEGF是作用最强的一种。VEGF是一种能促进内皮细胞分裂增殖、增加血管通透性的糖蛋白,可与特定的受体即内皮细胞生长因子受体(VEGFR)结合发挥作用。VEGFR-2与血管瘤的发生和发展有非常密切的关系[13],主要分布于血管内皮细胞、淋巴管内皮细胞、巨核细胞、造血干细胞等。VEGFR-2与VEGF结合可促进内皮细胞增殖、迁移,抑制其凋亡,增加血管通透性。bFGF分布广泛,是强烈的内皮细胞和管壁结缔组织的促生长因子,可能是参与血管瘤生长的主要因子,被认为是血管瘤生长的重要标志之一。血管内皮细胞和肥大细胞是血管瘤组织中bFGF合成的主要细胞[14]。本研究中普萘洛尔和异丙肾上腺素对于VEGF、VEGF-2、bFGF这3种细胞因子的影响作用相反,即普萘洛尔抑制3种细胞因子的分泌,而异丙肾上腺素则相反,刺激3种细胞因子的分泌,进一步证明了β肾上腺素受体在婴儿血管瘤发生发展中的作用。
综上,两种药物是通过阻断或激动β肾上腺素受体,进而影响下游的转导信号,引起级联反应,影响血管瘤内皮细胞分泌 VEGF、VEGF-2、bFGF,导致细胞增殖、分化,血管形成过程受到影响,呈现两种药物对细胞增殖的抑制或促进效应,但是否还存在其他的作用途径,例如是否对β肾上腺素受体的表达存在影响等,还有待进一步研究。
[1]North PE,Waner M,Brodsky MC.Are infantile hemangiomas of placental origin[J].Ophthalmology,2002,109(4):633-634.DOI:10.1016/S0161-6420(02)01071-0.
[2]Régnier S,Dupin N,Le Danff C,et al.Endothelial cells in infantile haemangiomas originate from the child and not from the mother(a fluorescence in situ hybridization-based study)[J].Br J Dermatol,2007,157(1):158-160.DOI:10.1111/j.1365-2133.2007.07922.x.
[3]Zhang GY,Yi CG,Li X,et al.Proliferation hemangiomas formation through dual mechanism of vascular endothelial growth factor mediated endothelial progenitor cells proliferation and mobilization through matrix metalloproteinases 9[J].Med Hypotheses,2008,70(4):815-818.DOI:10.1016/j.mehy.2007.06.042.
[4]Takahashi K,Mulliken JB,Kozakewich HP,et al.Cellular markers that distinguish the phases of hemangioma during infancy and childhood [J].J Clin Invest,1994,93 (6):2357-2364.DOI:10.1172/JCI117241.
[5]Gordillo GM,Onat D,Stockinger M,et al.A key angiogenic role of monocyte chemoattractant protein-1 inhemangioendothelioma proliferation[J].Am J Physiol Cell Physiol,2004,287(4):C866-C873.DOI:10.1152/ajpcell.00238.2003.
[6]Eum SY,Maghni K,Hamid Q,et al.Inhibition of allergic airways inflammation and airway hyperresponsiveness in mice by dexamethasone:role of eosinophils,IL-5,eotaxin,and IL-13[J].J Allergy Clin Immunol,2003,111(5):1049-1061.
[7]Bauland CG,Smit JM,Bartelink LR,et al.Hemangioma in the newborn:increased incidence after chorionic villus sampling[J].Prenat Diagn,2010,30(10):913-917.DOI:10.1002/pd.2562.
[8]Léauté-Labrèze C,Dumas de la Roque E,Hubiche T,et al.Propranolol for severe hemangiomas of infancy[J].N Engl J Med,2008,358(24):2649-2651.DOI:10.1056/NEJMc0708819.
[9]Buckmiller LM,Munson PD,Dyamenahalli U,et al.Propranolol for infantile hemangiomas:early experience at a tertiary vascular anomalies center[J].Laryngoscope,2010,120(4):676-681.DOI:10.1002/lary.20807.
[10]Sans V,de la Roque ED,Berge J,et al.Propranolol for severe infantile hemangiomas:follow-up report[J].Pediatrics,2009,124(3):e423-e431.DOI:10.1542/peds.2008-3458.
[11]Denoyelle F,Leboulanger N,Enjolras O,et al.Role of Propranolol in the therapeutic strategy of infantile laryngotracheal hemangioma[J].Int J Pediatr Otorhinolaryngol,2009,73(8):1168-1172.DOI:10.1016/j.ijporl.2009.04.025.
[12] Ji Y,Chen S,Li K,et al.The role of β-adrenergic receptor signaling in the proliferation of hemangioma-derived endothelial cells[J].Cell Div,2013,8(1):1.DOI:10.1186/1747-1028-8-1.
[13]Przewratil P,Sitkiewicz A,Andrzejewska E.Serum levels of basic fibroblastic growth factor (bFGF) in children with vascular anomalies:Another insight into endothelial growth [J].Clin Biochem,2010,43(10-11):863-867.DOI:10.1016/j.clinbiochem.2010.03.010.
[14]Przewratil P,Sitkiewicz A,Andrzejewska E.Local serum levels of vascular endothelialgrowth factorin infantilehemangioma:intriguing mechanism of endothelial growth[J].Cytokine,2010,49(2):141-147.DOI:10.1016/j.cyto.2009.11.012.
[15]Jia J,Zhao YF.Biomarkers:important clues to the pathogenesis of infantile haemangioma and their clinical significance[J].Chin J Dent Res,2010,13(2):105-108.
[16]陈晓东,林晓曦.婴幼儿血管瘤发病机制的研究进展[J].组织工程与重建外科杂志,2010,6(3):175-177.DOI:lO.39696.issn.1673-0364.2010.03.016.Chen XD,Lin XX.Advances in the pathogenesis of infantile hemangioma[J].J Tissue Eng Reconstr Surg,2010,6(3):175-177.DOI:lO.39696.issn.1673-0364.2010.03.016.
[17]许振起,刘宇,王依祥,等.Avastin治疗小鼠血管内皮瘤的实验研究[J].北京大学学报(医学版),2009,41(1):105-108.Xu ZQ,Liu Y,Wang YX,et al.Therapeutic effects of avastin on the murine hemangioendothelioma[J].J Peking Univ (Health Sci),2009,41(1):105-108.
[18]Sagong M,Lee J,Chang W.Application of intravitreal bevacizumab for circumscribed choroidal hemangioma[J].Korean J Ophthalmol,2009,23(2):127-131.DOI:10.3341/kjo.2009.23.2.127.
[19]聂晶,帕提古丽·买买托合提,朱雅琳.异丙肾上腺素对婴儿血管瘤内皮细胞影响的体外研究[J].新疆医科大学学报,2015(7):839-842.DOI:10.3969/j.issn.1009-5551.2015.07.010.Nie J,Maimaituoheti P,Zhu YL.The effect of isoproterenol on hemangioma endothelial cellsin vitro [J].J Xinjiang Med Univ,2015,38(7):839-842.DOI:10.3969/j.issn.1009-5551.2015.07.010.
In vitroeffects of propranolol and isoproterenol on proliferation of cultured infantile hemangioma endothelial cells and expressions of vascular endothelial growth factors and basic fibroblast growth factor
Zhu Yalin,Hou Wei,Paride Abliz
Department of Dermatology,First Affiliated Hospital of Xinjiang Medical University,Urumqi 830054,China
Objective To evaluatein vitroeffects of propranolol and isoproterenol on proliferation of infantile hemangioma endothelial cells(IHECs)as well as expressions of vascular endothelial growth factors(VEGF and VEGF-2)and human basic fibroblast growth factor(bFGF).Methods The second-third passage endothelial cells derived from the proliferative phase of infantile hemangioma were divided into propranolol and isoproterenol groups.The propranolol group was further classified into 5 groups to be treated with propranolol solutions at concentrations of 10,15,20 mg/L,EGM-2 medium (blank control group 1),or EGM-2 medium containing 0.16%DMSO (DMSO group),while the isoproterenol group was classified into 4 groups to be treated with isoproterenol solutions at concentrations of 5,10,20 mg/L or EGM-2 medium(blank control group 2).Methyl thiazolyl tetrazolium(MTT)assay was performed to evaluate cellular proliferative activity in these propranolol groups at 24,48,72 and 96 hours separately,enzyme-linked immunosorbent assay (ELISA)to measure VEGF,VEGF-2 and bFGF levels in culture supernatants of IHECs at 24 and 48 hours separately.Results The proliferative activity of IHECs showed no significant differences between 10-,15-and 20-mg/L propranolol groups at either 24 or 48 hours(H=1.152,2.643,respectively,bothP>0.05),or between the blank control group 1,DMSO group,and 10-and 15-mg/L propranolol groups at either 72 or 96 hours,but significantly decreased in the 20-mg/L propranolol group compared with the blank control group 1 at 72 and 96 hours(bothP<0.05).The 24-hour treatments with propranolol or isoproterenol at the above concentrations all affected the expressions of VEGF,VEGF-2 and bFGF to different degrees.At 48 hours,there was a significant decrease in VEGF levels in 15-and 20-mg/L propranolol groups,as well as in VEGF-2 and bFGF levels in 10-,15-and 20-mg/L propranolol groups compared with the blank control group 1 (allP<0.05),but a significant increase in VEGF levels in 5-,10-and 20-mg/L isoproterenol groups compared with the blank control group 2 (allP < 0.05),as well as in VEGF-2 and bFGF levels in the 20-mg/L isoproterenol group compared with the blank control group 2,5-and 10-mg/L isoproterenol groups (allP < 0.05).Conclusions The treatment with propranolol at certain concentrations for certain durations can suppress the growth of,as well as expressions of VEGF,VEGF-2 and bFGF in,endothelial cells derived from the proliferative phase of infantile hemangioma,whereas that with isoproterenol has opposite effects.The therapeutic mechanism of propranolol in infantile hemangioma may be associated with expressions of β-adrenergic receptors and their downstream signal transductionrelated cytokines.
Hemangioma;Endothelial cells;Propranolol;Isoproterenol;Fibroblast growth factor 2;Endothelial growth factors
Paride Abliz,Email:palidae@aliyun.com
帕丽达·阿布利孜,Email:palidae@aliyun.com
10.3760/cma.j.issn.0412-4030.2016.03.002
2015-05-25)
(本文编辑:周良佳 颜艳)
