Syndecan-1蛋白在皮肤鳞状细胞癌的表达及意义
2016-11-06孙怡王振华王荣荣张云香
孙怡 王振华 王荣荣 张云香
261041山东,潍坊市人民医院皮肤科(孙怡、王振华),检验科(王荣荣),病理科(张云香)
Syndecan-1蛋白在皮肤鳞状细胞癌的表达及意义
孙怡 王振华 王荣荣 张云香
261041山东,潍坊市人民医院皮肤科(孙怡、王振华),检验科(王荣荣),病理科(张云香)
目的 检测皮肤鳞状细胞癌(鳞癌)患者血清可溶性多配体蛋白聚糖1(SDC1)水平和SDC1蛋白在组织中的表达及两者的相关性。方法 免疫组化方法检测93例鳞癌及30例健康对照者表皮SDC1的表达,酶联免疫吸附测定(ELISA)检测81例鳞癌患者和30例健康对照者血清中可溶性SDC1的表达水平。结果鳞癌组织中,SDC1表达明显低于健康对照组(Z=3.85,P<0.01)。在不同肿瘤厚度和分化程度的鳞癌中,SDC1表达强度随肿瘤厚度的增加和分化程度地降低而有下降趋势(χ2分别为11.66和12.51,均P<0.01)。鳞癌患者中伴淋巴结转移组SDC1表达强度显著低于无淋巴结转移组(Z=2.20,P<0.05)。鳞癌患者血清可溶性SDC1表达水平显著高于健康对照组(Z=4.12,P<0.01),且随着肿瘤厚度的增加和临床分期的变晚血清可溶性SDC1水平逐渐升高。侵袭性鳞癌的SDC1水平高于原位鳞癌的患者(Z=3.02,P<0.01),但不同分化程度的侵袭性鳞癌血清SDC1水平比较,差异无统计学意义(均P>0.05)。有淋巴结转移的鳞癌患者血清SDC1水平明显高于无淋巴结转移组(Z=5.30,P<0.01)。鳞癌患者血清中可溶性SDC1的水平与组织中SDC1表达强度呈负相关(rs=-0.625,P<0.01)。用受试者工作曲线法判断血清可溶性SDC1水平对诊断有无淋巴结转移的最佳临界点为65.5 μg/L,其敏感度为73.7%,特异度为87.1%,曲线下面积值为0.904(0.840~0.968)。结论 鳞癌组织中,SDC1表达减弱和血清中可溶性SDC1水平升高与鳞癌的侵袭性相关,血清SDC1水平升高对鳞癌患者淋巴结转移的诊断具有一定的价值。
癌,鳞状细胞;皮肤;血清;病理学;多配体蛋白聚糖1
皮肤鳞状细胞癌(鳞癌)是起源于表皮角质形成细胞的一种恶性肿瘤,近年来其发病率有增长趋势[1]。多配体蛋白聚糖 1(syndecan-1,SDC1)属于黏附分子,其表达减少或者缺如可致细胞-细胞和细胞-基质间的黏附功能降低,从而促进肿瘤生长、侵袭和转移[2]。研究[3-7]发现,一些肿瘤患者血清可溶性SDC1的水平升高,且其水平越高,肿瘤预后越差。我们用酶联免疫吸附测定(ELISA)检测鳞癌患者血清可溶性SDC1的水平,并用免疫组化法观察组织中SDC1的表达,探讨两者相关性及其与鳞癌临床病理特征的关系。
对象与方法
一、对象
1.标本来源:2009年9月至2014年3月在潍坊市人民医院皮肤科就诊,经病理检查证实为鳞癌患者93例行免疫组化检测。其中男51例,女42例,年龄38~83(59.36±16.57)岁。入选病例均排除合并糖尿病、炎症性肠病及结缔组织病的患者和合并其他肿瘤的患者,最终符合条件的鳞癌患者81例行ELISA检测。其中男44例、女37例,年龄38~80(59.74±15.69)岁。所有入选的病例按发病部位分为曝光部位(头面部+四肢)和生殖器部位,按组织学分级分为原位鳞癌、高分化鳞癌、中分化鳞癌和低分化鳞癌,见表1。另外,收集接受美容整形外科手术的健康皮肤标本和健康体检者的静脉血各30份,分别作为健康对照组。健康对照组性别、年龄与鳞癌组相比,差异无统计学意义,均与病例组相匹配。本研究通过医院伦理委员会批准,患者与健康对照者均签署知情同意书。
2.临床分期:根据美国癌症协会非黑素瘤皮肤肿瘤TNM分期系统,将鳞癌分为5期:0期为原位癌;Ⅰ期为肿瘤直径<2 cm,无局部淋巴结转移及远处转移;Ⅱ期为肿瘤直径>2 cm,但<5 cm,或肿瘤直径>5 cm,无局部淋巴结转移及远处转移;Ⅲ期为肿瘤侵犯其他组织(如,软骨、骨骼肌或骨),无局部淋巴结转移及远处转移;或无论肿瘤大小,有局部淋巴结转移,但无远处转移;Ⅳ期为无论肿瘤大小,无论有无局部淋巴结转移,有远处转移。根据临床分期标准,分别对鳞癌患者的组织标本和血液样本进行分组,见表1。Ⅲ期患者中有淋巴结转移的其原发部位肿瘤直径均>2 cm,仅有1例肿瘤直径>5 cm且侵及骨骼肌,但未发生淋巴结转移。
二、方法
1.主要试剂及仪器:鼠抗人Syndecan-1单克隆抗体和通用型免疫组化PV-9000通用型试剂盒均为北京中杉金桥生物技术有限公司产品,Syndecan-1 ELISA试剂盒为法国Diaclone公司产品,酶标仪为美国BioTek公司产品。
2.ELISA检测鳞癌患者血清SDC1表达:取鳞癌患者及健康对照组外周EDTA抗凝血2ml,400×g离心10 min,提取血清,分装入冻存管中,置于-70℃冻存备用。应用ELISA同批试剂盒检测血清SDC1水平,操作步骤按试剂盒说明书进行。用酶标仪在450nm波长测定吸光度,并根据标准品的吸光度所对应的浓度绘制标准曲线,根据标准曲线计算样品浓度。
3.免疫组化染色及结果判定:标本经4%甲醛固定,常规制成蜡块,3 μm厚连续石蜡切片,切片脱蜡至水。按免疫组化二步法常规操作,Tris-EDTA(pH=8.0)溶液进行微波抗原修复,滴加一抗(SDC1一抗浓度为1∶150),PBS彻底冲洗后滴加二抗,操作步骤按PV-9000试剂盒说明书进行,DAB显色,苏木素复染,脱水透明后中性树胶封片。阴性对照以PBS代替一抗。SDC1染色阳性信号主要位于细胞的胞膜,在显微镜下观察并计数,每张切片观察10个高倍视野(×200),取其均数。根据膜着色反应强度及比例进行评分:①无着色为0,淡黄色为1,棕黄色为2,棕褐色为3;②阳性范围<5%为0,5% ~25%为 1,26% ~50%为 2,51% ~75%为 3,>75%为4。两项评分结果相乘,<3为阴性(-),3~4为弱阳性(+),5~8为中度阳性(++),9~12为强阳性(+++)。所有组织切片与免疫组化结果由两位病理科医师进行盲法评估。
4.统计学处理:用SPSS17.0统计软件进行统计学分析,非正态分布的计量资料用中位数(P25~P75)表示,两组间比较采用Mann-Whitney检验,多组间比较采用Kruskal-WallisH检验,多重比较时,将数据进行秩变换后用LSD进行比较。四格表资料采用χ2检验,单向有序资料采用秩和检验,双向有序等级资料采用有序分组资料的线性趋势χ2检验。相关性分析采用Spearman相关分析。用受试者工作曲线(ROC)法评价血清中SDC1的水平对判断有无淋巴结转移的诊断价值。P<0.05为差异有统计学意义。
结 果
一、鳞癌组织中SDC1的表达及其与临床病理特征的关系
免疫组化染色(图1~3)显示,SDC1在30例健康对照组中呈阳性或强阳性表达,强阳性表达21例,中度阳性表达7例,弱阳性表达1例,阴性1例,阳性率为 96.67%(29/30),强阳性率为 70.00%(21/30)。SDC1在鳞癌组中表达阳性率较低,染色强度明显减弱,强阳性表达29例,中度阳性表达31例,弱阳性表达25例,阴性8例,阳性率为91.40%(85/93),强阳性率为31.18%(29/93)。经秩和检验,两组SDC1不同表达阳性程度差异有统计学意义(Z=3.85,P<0.01;χ2=13.17,P<0.01)。

图1 健康皮肤Syndecan-1呈强阳性表达(免疫组化×100)SDC1染色阳性信号主要位于胞膜,染色呈棕褐色

图2 低分化鳞状细胞癌Syndecan-1呈阴性表达(免疫组化×400)
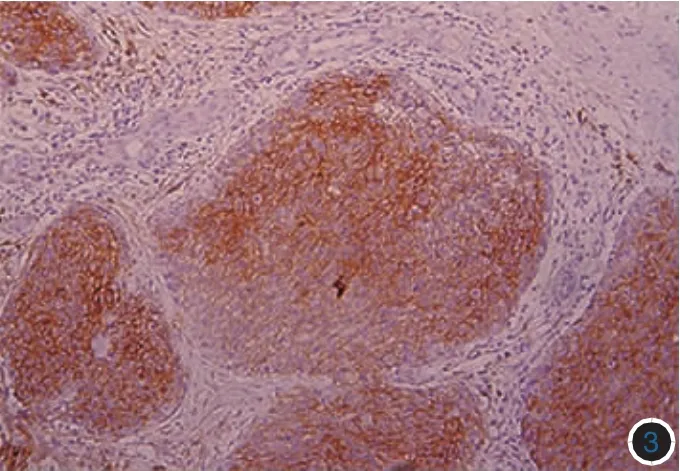
图3 中分化鳞状细胞癌Syndecan-1阳性表达,在肿瘤边缘表达减弱(免疫组化×100)
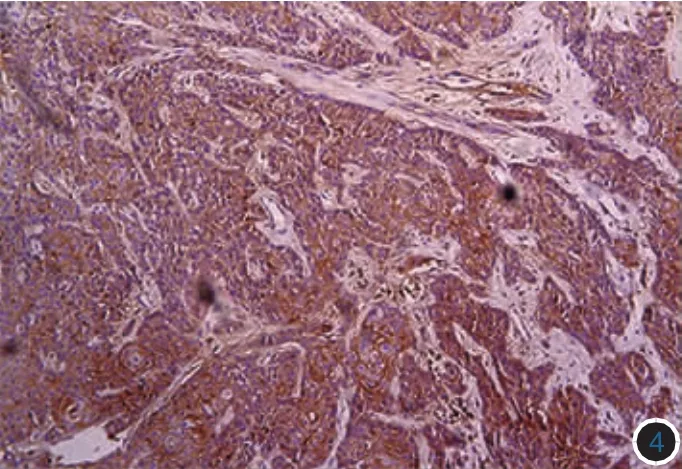
图4 高分化鳞状细胞癌Syndecan-1呈阳性表达,着色强度高于中分化鳞癌(免疫组化×100)
不同年龄、性别、病程及肿瘤发病部位的患者间,鳞癌组织中SDC1的表达差异无统计学意义(均P>0.05)。在不同肿瘤厚度的鳞癌中,SDC1表达强度随着厚度的递增有下降趋势(P<0.01)。在不同分化程度的鳞癌中,SDC1表达强度随分化程度地降低有下降趋势,低分化鳞癌中SDC1表达强度明显减弱(P<0.01)。在不同临床分期的鳞癌中,SDC1表达强度随着临床分期的变晚亦有下降趋势(P<0.05)。伴有局部淋巴转移的鳞癌组织中SDC1阳性表达强度明显低于无局部淋巴结转移的鳞癌组织,差异有统计学意义(P<0.05)。见表1。
二、鳞癌患者血清中可溶性SDC1水平及其与临床病理特征的关系
ELISA检测显示,鳞癌组血清中可溶性SDC1水平[45(31.5~67.5)μg/L]高于健康对照组[28(22~39)μg/L],差异有统计学意义(Z=4.12,P<0.01)。不同年龄、性别、病程及肿瘤发病部位的患者间,血清中可溶性SDC1水平的差异无统计学意义(均P>0.05)。原位鳞癌患者的血清SDC1水平[33(27~ 43)μg/L]低于侵袭性鳞癌患者[51.5(34.5~72.5)μg/L],差异有统计学意义 (Z=3.02,P<0.01),而不同分化程度的侵袭性鳞癌中血清SDC1水平差异无统计学意义(P>0.05)。在不同肿瘤厚度的鳞癌中,血清SDC1水平随着肿瘤厚度的增加有递增的趋势,肿瘤厚度2~5 mm鳞癌组高于<2 mm组(LSD-t=2.01,P<0.05),肿瘤厚度 >5 cm 组明显高于2~5 mm和>5 cm鳞癌组(LSD-t分别为6.55和4.14,均P<0.01)。除肿瘤厚度<2 mm的鳞癌组织,2~5 mm和>5 cm鳞癌组血清SDC1水平均明显高于健康对照组,差异有统计学意义(Z分别为2.30和5.67,P<0.05和P<0.01)。在不同临床分期的鳞癌中,血清SDC1水平随分期的递增有升高的趋势,Ⅱ期鳞癌组高于0+Ⅰ期鳞癌组(LSD-t=3.10,P<0.05),Ⅲ期鳞癌组明显高于0+Ⅰ期和Ⅱ期鳞癌组,(LSD-t分别为7.60和4.18,均P<0.01)。除 0+Ⅰ期鳞癌,Ⅱ期和Ⅲ期鳞癌的血清可溶性SDC1水平均高于健康对照组(均P<0.01)。伴有局部淋巴结转移的鳞癌组织的血清SDC1水平明显高于无淋巴结转移组,差异有统计学意义(P<0.01)。见表1。
三、鳞癌患者血清和组织中SDC1表达的相关性
鳞癌患者血清中可溶性SDC1的水平与组织中SDC1表达强度呈负相关,Spearman相关系数rs=-0.625,P<0.01。

表1 皮肤鳞状细胞癌(鳞癌)患者血清和组织中多配体蛋白聚糖1(SDC1)的表达及其与相关临床病理特征的关系
四、ROC曲线法判断血清可溶性SDC1水平对淋巴结转移的诊断价值
用ROC法建立血清中SDC1的水平对鳞癌患者有无淋巴结转移的诊断曲线,其AUC值为0.904,95%的可信区间为0.840~0.968,诊断有无淋巴结转移的最佳临界点为65.5 μg/L,其敏感度为73.7%,特异度为87.1%。
讨 论
Syndecan家族是一类细胞表面跨膜蛋白多糖,SDC1属于Ⅰ型跨膜蛋白,其存在于大多数上皮细胞的表面,尤其在成熟复层鳞状上皮表达最为丰富,主要由3部分构成:①胞外区:含硫酸乙酰肝素侧链的糖氨聚糖链;②短跨膜区;③高度保守胞内区。SDC1的各种功能如,细胞间黏附、细胞迁移及信号传导等,主要通过其胞外区来完成,因为其硫酸乙酰肝素侧链可与多种配体(细胞因子、生长因子和细胞外基质分子等)相结合。作为承载SDC1主要功能的胞外区可发生水解脱落,释放的胞外区为可溶性,在健康人和癌症患者的血清中均可以检测到[8]。
黏附分子SDC1在多种肿瘤细胞发生、发展、转移过程中起重要作用,随着肿瘤恶性程度的增高,其膜表达有逐渐减弱的趋势[9-10]。本研究免疫组化结果显示,鳞癌组织中SDC1的阳性率(91.40%)低于健康对照组(96.67%)。原位鳞癌中SDC1的阳性率(95.24%)与健康对照组相比差别不大,但其强阳性率明显低于健康对照组(52.38%比70%),且随着分化程度降低,SDC1表达呈下降的趋势(高、中、低分化鳞癌中SDC1阳性率分别为96.30%、93.33%、73.33%)。提示SDC1的表达强度与组织学分型相关,这与 Kurokawa 等[11]和Ro 等[12]在口腔鳞癌和舌鳞癌中的研究结果相同。另外,在不同肿瘤厚度及不同临床分期的鳞癌中,SDC1表达强度分别随着肿瘤厚度及临床分期的的递增有下降的趋势。SDC1在伴有淋巴结转移的鳞癌中阳性表达率也明显低于无转移者。鳞癌分化越差、临床分期越晚、侵袭性愈强,SDC1的表达愈弱,提示SDC1的表达减弱或缺失与鳞癌的侵袭和转移有关。此外,在发生部位不同的鳞癌中,SDC1的表达强度无明显差异,而鳞癌组与健康对照组的部位没有匹配性是本研究的局限之处。
多种肿瘤患者SDC1从细胞膜脱落增加,血清中的可溶性 SDC1 明显高于健康人。有研究[3,7]发现,SDC1表达水平在不同临床分期的肿瘤患者中有差异,随着肿瘤的进展,SDC1可进一步升高,提示SDC1可以作为评价多种肿瘤预后的生物学指标。此外,SDC1在一些慢性炎症性疾病如,糖尿病、炎症性肠病、系统性红斑狼疮等也会出现轻微升高[13-15]。因此,我们在筛选鳞癌病例时,排除了合并肿瘤和以上慢性疾病的患者,以免对检测结果造成影响。本研究显示,鳞癌组血清中可溶性SDC1水平要显著高于健康对照组。虽然,原位鳞癌和Ⅰ期的鳞癌患者血清中可溶性SDC1水平与健康对照组相比,差异无统计学意义,但侵袭性鳞癌患者和Ⅱ期和Ⅲ期鳞癌患者血清SDC1水平均明显高于健康对照组,提示鳞癌要发展到一定程度,其血清可溶性SDC1水平才会明显升高。然而,不同分化程度的侵袭性鳞癌中血清SDC1水平差异无统计学意义。随着肿瘤厚度的增加和临床分期变晚,血清SDC1水平均逐渐升高,差异有统计学意义,可见血清SDC1水平与鳞癌的厚度及临床分期呈正相关。
对鳞癌组织的细胞膜和血清中SDC1表达情况进行相关性分析发现,两者表达呈负相关。根据以上数据推测,在鳞癌侵袭演进过程中,SDC1胞外区脱落是肿瘤细胞膜SDC1表达逐渐减弱的重要机制,随着鳞癌体积增大和侵袭性增强,血清可溶性SDC1水平逐渐升高,因此血清SDC1水平可能是反映鳞癌发展程度的间接指标。通过对有无淋巴结转移进一步行ROC曲线分析显示,AUC可达0.904,SDC1最佳临界点为65.5 μg/L,其敏感度为73.7%,特异度为87.1%,提示SDC1水平对鳞癌患者淋巴结转移的诊断具有一定的价值,且血清SDC1水平高于65.5 μg/L时,鳞癌患者可能发生淋巴结转移。因此,高血清SDC1水平的患者有较高发生淋巴结转移的风险,我们建议尽早做淋巴结活检。
[1]Kozma B,Eide MJ.Photocarcinogenesis:an epidemiologic perspective on ultraviolet light and skin cancer[J].Dermatol Clin,2014,32(3):301-313.DOI:10.1016/j.det.2014.03.004.
[2]Teng YH,Aquino RS,Park PW.Molecular functions of syndecan-1 in disease[J].Matrix Biol,2012,31 (1):3-16.DOI:10.1016/j.matbio.2011.10.001.
[3]Joensuu H,Anttonen A,Eriksson M,et al.Soluble syndecan-1 and serum basic fibroblast growth factor are new prognostic factors in lung cancer[J].Cancer Res,2002,62(18):5210-5217.
[4]Nault JC,Guyot E,Laguillier C,et al.Serum proteoglycans as prognostic biomarkers of hepatocellular carcinoma in patients with alcoholic cirrhosis[J].Cancer Epidemiol Biomarkers Prev,2013,22(8):1343-1352.DOI:10.1158/1055-9965.EPI-13-0179.
[5]Mundt F,Heidari-Hamedani G,Nilsonne G,et al.Diagnostic and prognostic value of soluble syndecan-1 in pleural malignancies[J].Biomed Res Int,2014,2014:419853.DOI:10.1155/2014/419853.
[6]Wang X,Zuo D,Chen Y,et al.Shed Syndecan-1 is involved in chemotherapy resistance via the EGFR pathway in colorectal cancer[J].Br J Cancer,2014,111(10):1965-1976.DOI:10.1038/bjc.2014.493.
[7]Szarvas T,Reis H,Kramer G,et al.Enhanced stromal syndecan-1 expression is an independent risk factor for poor survival in bladder cancer[J].Hum Pathol,2014,45 (4):674-682.DOI:10.1016/j.humpath.2013.10.036.
[8]Ramani VC,Purushothaman A,Stewart MD,et al.The heparanase/syndecan-1 axis in cancer:mechanisms and therapies[J].FEBS J,2013,280(10):2294-2306.DOI:10.1111/febs.12168.
[9]席银雪,宋鑫,陈洁,等.syndecan-1在胃黏膜癌变不同阶段组织中的表达及意义[J].中华肿瘤杂志,2007,29(3):193-196.DOI:10.3760/j.issn:0253-3766.2007.03.008.Xi YX,Song X,Chen J,et al.Expression of syndecan-1 at different stages in the course of gastric carcinoma and its significance[J].Chin J Oncol,2007 (3):193-196.DOI:10.3760/j.issn:0253-3766.2007.03.008.
[10]Roh YH,Kim YH,Choi HJ,et al.Fascin overexpression correlates with positive thrombospondin-1 and syndecan-1 expressions and a more aggressive clinical course in patients with gallbladder cancer[J].J Hepatobiliary Pancreat Surg,2009,16 (3):315-321.DOI:10.1007/s00534-009-0046-1.
[11]Kurokawa H,Zhang M,Matsumoto S,et al.Reduced syndecan-1 expression is correlated with the histological grade of malignancy at the deep invasive front in oral squamous cell carcinoma[J].J Oral Pathol Med,2006,35(5):301-306.
[12]Ro Y,Muramatsu T,Shima K,et al.Correlation between reduction of syndecan-1 expression and clinico-pathological parameters in squamous cell carcinoma of tongue[J].Int J Oral Maxillofac Surg,2006,35(3):252-257.
[13]Wang JB,Guan J,Shen J,et al.Insulin increases shedding of syndecan-1 in the serum of patients with type 2 diabetes mellitus[J].Diabetes Res Clin Pract,2009,86(2):83-88.DOI:10.1016/j.diabres.2009.08.002.
[14]Yablecovitch D,Stein A,Shabat-Simon M,et al.Soluble syndecan-1 levels are elevated in patients with inflammatory bowel disease[J].Dig Dis Sci,2015,60(8):2419-2426.DOI:10.1007/s10620-015-3589-9.
[15]Kim KJ,Kim JY,Baek IW,et al.Elevated serum levels of syndecan-1 are associated with renal involvement in patients with systemic lupus erythematosus[J].J Rheumatol,2015,42(2):202-209.DOI:10.3899/jrheum.140568.
Syndecan-1 expression in cutaneous squamous cell carcinoma and its significance
Sun Yi,Wang Zhenhua,Wang Rongrong,Zhang Yunxiang
Department of Dermatology,Weifang People′s Hospital,Weifang 261041,Shandong,China(Sun Y,Wang ZH);Clinical Laboratory,Weifang People′s Hospital,Weifang 261041,Shandong,China(Wang RR);Department of Pathology,Weifang People′s Hospital,Weifang 261041,Shandong,China(Zhang YX)
ObjectiveTo measure serum and tissue levels of soluble syndecan-1 (SDC1)in patients with cutaneous squamous cell carcinoma (CSCC),and to explore the relationship between the expression of SDC1 and clinicopathologic features of CSCC as well as between the serum and tissue levels of SDC1.MethodsAn immunohistochemical study was performed to measure SDC1 expression in the epidermis of lesional specimens from 93 patients with CSCC and normal skin specimens from 30 healthy human controls,and enzyme-linked immunosorbent assay(ELISA)to detect serum levels of soluble SDC1 in 81 patients with CSCC and 30 healthy human controls.ResultsThe expression of SDC1 was significantly lower in CSCC tissues than in normal skin tissues(Z=3.85,P<0.01).The expression intensity of SDC1 decreased with the increase in tumor thickness but with the decrease in degree of differentiation of CSCC(χ2=11.66,12.51 respectively,bothP<0.01).Furthermore,the expression of SDC1 was significantly lower in lesional tissues of CSCC with lymph node metastasis than in those without(Z=2.20,P<0.05).As ELISA showed,serum levels of soluble SDC1 were significantly higher in patients with CSCC than in healthy controls(Z=4.12,P<0.01),and gradually increased with the increase in tumor thickness and with advancing clinical stages of CSCC.In addition,serum levels of SDC1 were significantly up-regulated in patients with invasive CSCC compared with those with CSCCin situ(Z=3.02,P<0.01),but were not significantly different among patients with invasive CSCC at different degrees of differentiation (P>0.05).CSCC patients with lymphatic metastasis showed significantly higher serum levels of SDC1 compared with those without(Z=5.30,P<0.01).The serum levels of soluble SDC1 were significantly negatively correlated with its tissue levels in CSCC patients(rs= -0.625,P<0.01).Receiver operating characteristic(ROC)curve analysis showed that the best cutoff point of serum SDC1 levels was 65.5 μg/L for the diagnosis of lymphatic metastasis,with the sensitivity,specificity and area under the curve(AUC)being 73.7%,87.1%and 0.904(0.840-0.968)respectively.Conclusion The downregulated tissue expression but up-regulated serum levels of SDC1 may be associated with the invasiveness of CSCC,and elevated serum SDC1 levels are somewhat valuable to the diagnosis of lymphatic metastasis.
Carcinoma,squamous cell;Skin;Serum;Pathology;Syndecan-1
Wang Zhenhua,Email:wfzcwzh@126.com
2015-06-01)
(本文编辑:吴晓初)
王振华,Email:wfzcwzh@126.com
10.3760/cma.j.issn.0412-4030.2016.02.005
潍坊市科技发展计划项目(201302005)
Fund program:Weifang Science and Technology Development Program(201302005)
