CREB丝氨酸129位点磷酸化提高miR-132的水平
2016-11-05王翔胡家劭
王翔,胡家劭
(江汉大学医学院,湖北武汉430056)
CREB丝氨酸129位点磷酸化提高miR-132的水平
王翔,胡家劭
(江汉大学医学院,湖北武汉430056)
目的通过磷酸化的环磷酸腺苷效应元件结合蛋白(CREB)的激活,使表达记忆的相关蛋白获得长时记忆,探讨CREB丝氨酸(Ser)129位点的磷酸化对微小RNA-132(miR-132)的影响。方法采用长时程增强作用(LTP)电刺激,尾静脉注射方法给予糖原合成酶激酶3β抑制剂SB216763,应用蛋白质印迹法检测大鼠脑内海马区CREB的磷酸化水平,逆转录-聚合酶链反应检测miR-132的表达情况。结果高频刺激CA3-CA1神经环路可成功诱导LTP,使大鼠海马的CREB Ser129位点的磷酸化水平和miR-132的表达明显升高;SB216763可抑制糖原合成酶激酶3β的活性,从而抑制CREB Ser129的磷酸化,使LTP的斜率增幅明显降低,CREB Ser129的磷酸化水平及miR-132的表达明显降低。结论
CREB Ser129位点的磷酸化通过调节miR-132的表达促进LTP形成,LTP形成过程中CREB Ser129位点的磷酸化可调节miR-132的表达,从而影响长期记忆形成。
cAMP反应元件结合蛋白质;微RNAs;蛋白质丝氨酸苏氨酸激酶;磷酸转移酶类;糖原合成酶激酶3;长时程增强;电位测定法;记忆
学习记忆的机制研究一直是热点问题,环磷酸腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)是一种选择性结合CREs的核蛋白。CREB的磷酸化位点包括丝氨酸(Ser)133位点和Ser129位点,一般认为,通过蛋白激酶A(protein kinase A,PKA)使Ser133位点磷酸化后可使CREB的磷酸化活性增强[1],而通过糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)使Ser129位点磷酸化则可使CREB活性下降[2]。经PKA磷酸化后,CREB的转录活性可增加10~20倍,CREB的激活可导致记忆相关蛋白表达增加,产生长期记忆[3]。
微小RNA是内源性的非编码RNA,主要作用于转录后的mRNA,抑制蛋白质合成。微小RNA-132(microRNA-132,miR-132)能够通过促进突触后α-氨基-3羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methl-4-isoxazole-propionic acid,AMPA)受体的合成,调节学习记忆[4]。近年来已有文献报道,CREB Ser133位点的磷酸化可以调节miR-132的水平[5-6],但是有关CREB Ser129位点的磷酸化对miR-132的影响研究尚鲜见相关报道。本研究拟通过长时程增强作用(long-term potentiation,LTP)造模,大鼠尾静脉注射GSK-3β抑制剂,探讨CREB Ser129位点的磷酸化能否调节miR-132的表达,从而分析其对学习记忆的影响。
1 材料与方法
1.1材料
1.1.1实验动物及分组20只雄性SD大鼠购于华中科技大学同济医学院动物实验中心,周龄(7.0±1.0)周,体质量(250.0±20.0)g。所有实验动物饲养于有良好光线和充足饮用水及食物的25℃房间,均按照神经科学研究动物使用规定进行动物实验。将20只大鼠分为对照组(Con组)和实验组(LTP组),每组10只。
1.1.2仪器与试剂CREB及其phosphoS129(武汉艾美捷科技有限公司,批号:ab32515、ab47373),TRIZOL(美国英杰生命技术有限公司,批号:15596-026),TAKARA逆转录试剂盒[宝生物工程(大连)有限公司,批号:D6110A],引物(美国英杰生命技术有限公司),TAKARA聚合酶链反应(PCR)试剂盒[宝生物工程(大连)有限公司,批号:DRR096A],GSK-3β抑制剂SB216763(上海拓旸生物科技有限公司,批号:L001075)。
1.2方法
1.2.1电刺激方法Con组大鼠给予脑内海马区一般性刺激;LTP组大鼠给予高频刺激(high frequency stimulates,HFS),具体方法如下:大鼠腹腔给予乌拉坦(氨基甲酸乙酯,6 mL/kg)麻醉,采用电刺激方法激活CA3~CA1环路,根据所查文献确定并记录CA3~CA1通路的LTP情况。通过大鼠脑立体定位图谱确定其脑内海马区CA3坐标(前囟后3.5 mm,旁开4.0 mm,深3.8 mm)和CA1坐标(前囟后4.1 mm,旁开2.4 mm,深2.8 mm)。将记录电极放在CA1区,刺激电极放在CA3区,记录到稳定的波形后,以5~30 mV给予不同大小的刺激幅度,诱导出最大兴奋性突触后电位,选择最大值的30%作为基础刺激强度。在静息状态下给予60次刺激,每次间隔30s;然后给予10次强直刺激,每次刺激50次,间隔2 s;再以静息状态下的刺激强度刺激,每次间隔30 s,240次,记录2 h。根据所得波形,按照该模式统计LTP的增幅和斜率变化,比较静息状态和强直刺激后比值评估LTP强度。
1.2.2miR-132检测
1.2.2.1总RNA提取取两组大鼠海马组织,用液氮冷冻再研磨至细粉或用匀浆器匀浆,最后加入1mLTrizol,反复震荡5 min;室温下静置10 min。每毫升Trizol中加入氯仿200 μL,盖上盖子,剧烈震荡约1 min;室温静置2~5 min,然后10 000 r/min冷冻离心1 min,最上层即为含有RNA的样品,通过电泳检测RNA质量。
1.2.2.2RNA逆转录采用TAKARA逆转录试剂盒,取1 μg总RNA,按照试剂盒相应步骤及试剂,37℃、15min,85℃、5 s,最后室温冷却检测RNA浓度,-20℃保存。1.2.2.3miR-132检测使用TAKARA PCR试剂盒检测miR-132水平,每个样品设置3个重复。引物:正义引物为5′-CTAGCCCCGCAGACACTAGC,反义引物为5′-CCCCGCCTCCTCTTGCTCTGTA。通过比较正反义引物的△△Ct计算miR-132丰度,由于U6 snRNA能在真核生物稳定表达,故使用U6 snRNA作为对照。
1.2.3蛋白质印迹检测大鼠LTP后直接处死,分离海马,使用组织匀浆液匀浆(氯化钠50 mmol/L、三羟甲基氨基甲烷10 mmol/L、二水乙二胺四乙酸二钠1 mmol/L、十二水钒酸钠0.5 mmol/L、氟化钠50 mmol/L、二苯甲烷1 mmol/L、苯基-甲基磺酰氟1 mmol/L),匀浆好的样品再加入4×缓冲液(含8%十二烷基硫酸钠、三羟甲基氨基甲烷200 mmol/L、40%甘油),然后沸水中煮10 min,10 000 r/min、4℃离心10 min,去上清液,用二喹啉甲酸(bicinchoninic acid,BCA)法检测待测样品蛋白浓度,取相同上样量在10%浓缩胶和4%分离胶中电泳,并转移到硝酸纤维素膜上,在6%牛血清清蛋白(bovine serum albumin,BSA)溶液中封闭30 min后按照适当的抗体稀释比例孵育,加入二抗并进行显色。
1.2.4尾静脉注射将SD大鼠固定在自制矿泉水瓶中,尾巴从瓶子后方的小孔暴露出来,使用75%乙醇消毒处理后,用头皮针将SB216763(0.2 mg/kg)经尾静脉注射入大鼠血液中,从而抑制大鼠脑内GSK-3β的活性。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计量资料以±s表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1CREB Ser129磷酸化及miR-132参与LTP形成HFS诱导LTP后大鼠海马CDEB Ser129位点的磷酸化和miR-132的表达见图1。
2.1.1HFS后两组大鼠动作电位增幅和相对总量表达强直刺激激活CA3~CA1环路后,LTP组大鼠海马动作电位无论是斜率和增幅均较强直刺激前明显增加,而且均高于Con组(图1A、C);与对照组比较,LTP组动作电位增加(1.70±0.13)倍(图1B),差异均有统计学意义(P<0.01),表明LTP诱导成功。
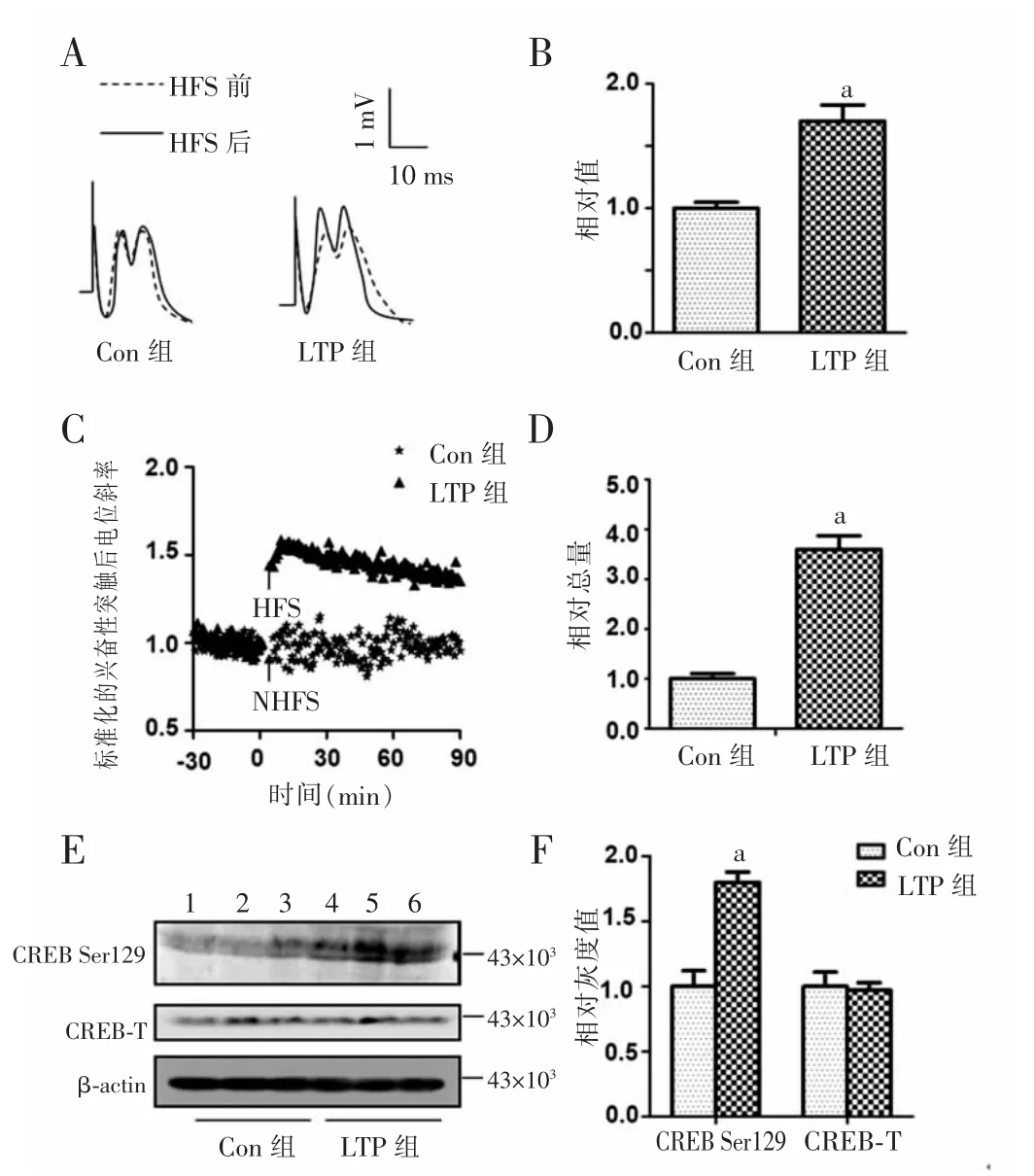
图1 HFS诱导LTP后大鼠海马CREB Ser129位点的磷酸化和miR-132的表达
2.1.2蛋白质印迹法和RT-PCR检测CREB Ser129位点的磷酸化及miR-132的表达HFS后,LTP组大鼠CREB在Ser129位点的磷酸化及海马miR-132的表达水平均明显增加,分别较Con组增加(1.80±0.08)倍和(3.60±0.27)倍,差异均有统计学意义(P<0.01)。见图1D、E、F。
2.2尾静脉注射SB216763抑制miR-132表达LTP电刺激前给予大鼠尾静脉注射SB216763后,通过HFS发现LTP受抑制,与Con组比较,LTP组动作电位显著降低,海马miR-132的表达和CREB Ser129位点的磷酸化水平明显降低,分别是Con组的(0.54±0.04)倍和(0.10±0.02)倍,差异均有统计学意义(P<0.01)。见图2。

图2 应用SB216763后大鼠海马CREB Ser129位点的磷酸化和miR-132的表达
3 讨论
miRNA与学习记忆的关系已有大量文献报道。miRNA可调节LTP相关蛋白合成,包括N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)和AMPA[7]。同样,在体外介导LTP也可以调节miRNA的表达[8-9]。研究表明,使用麻醉大鼠在海马齿状回区(dentate gyrus,DG)诱导LTP可以导致miR-132、miR-212表达上调和miR-219a表达下调,而NMDA的活性可以抑制这些miRNA的表达,AMPA的活性可以上调这些miRNA的表达[10]。但有研究发现,在清醒大鼠体内诱导LTP可以下调miRNA的表达,包括miR-132[9]。也有报道指出,在清醒大鼠体内没有发现相关的miRNA有很大改变,包括miR-132[11]。
本研究结果显示,给予麻醉大鼠LTP电刺激后,海马CA1区的miR-132水平明显升高,而使用GSK-3β抑制剂SB216763后,CA1区的miR-132显著降低。表明海马CA1区miR-132的升高可以通过CREB Ser129的磷酸化来调节。
综上所述,CREB Ser129的磷酸化是由GSK-3β介导的,而GSK-3β对学习记忆的巩固和提高有非常重要的作用[12],表明CREB Ser129位点的磷酸化对于记忆的巩固和提取有重要作用。然而有报道指出,CREB Ser129位点的磷酸化可以降低CREB的活性,该位点的磷酸化所导致CREB活性降低在学习记忆中的作用还不清楚[13]。因此,CREB Ser129位点对于学习记忆的作用还有待进一步探讨。
[1]Suzuki A,Fukushima H,Mukawa T,et al.Upregulation of CREB-mediated transcription enhances both short-and long-term memory[J].J Neurosci,2011,31(24):8786-8802.
[2]Horike N,Sakoda H,Kushiyama A,et al.AMP-activated protein kinase activation increases phosphorylation of glycogen synthase kinase 3beta and thereby reduces cAMP-responsive element transcriptional activity and phosphoenolpyruvate carboxykinase C gene expression in the liver[J]. J Biol Chem,2008,283(49):33902-33910.
[3]Tully T,Bourtchouladze R,Scott R,et al.Targeting the CREB pathway for memory enhancers[J].Nat Rev Drug Discov,2003,2(4):267-277.
[4]Phillpotts RJ,Tyrrell DA.Rhinovirus colds[J].Br Med Bull,1985,41(4):386-390.
[5]GuoJ,WangH,WangQ,etal.Expressionofp-CREBandactivity-dependent miR-132in temporallobeepilepsy[J].IntJ Clin Exp Med,2014,7(5):1297-1306.
[6]Nudelman AS,Dirocco DP,Lambert TJ,et al.Neuronal activity rapidly induces transcription of the CREB-Regulated MicroRNA-132,in vivo[J]. Hippocampus,2010,20(4):492-498.
[7]OldeLoohuis NF,Ba W,Stoerchel PH,et al.MicroRNA-137 controls AMPA-receptor-mediated transmission and mGluR-dependent LTD[J]. Cell Rep,2015,11(12):1876-1884.
[8]Park CS,Tang SJ.Regulation of microRNA expression by induction of bidirectional synaptic plasticity[J].J Mol Neurosci,2009,38(1):50-56.
[9]JoilinG,GuévremontD,RyanB,etal.RapidregulationofmicroRNAfollowing induction of long-term potentiation in vivo[J].Front Mol Neurosci,2014,7:98.
[10]Wibrand K,Panja D,Tiron A,et al.Differential regulation of mature and precursor microRNA expression by NMDA and metabotropic glutamate receptor activation during LTP in the adult dentate gyrus in vivo[J].Eur J Neurosci,2010,31(4):636-645.
[11]Pai B,Siripornmongcolchai T,Berentsen B,et al.NMDA receptordependent regulation of miRNA expression andassociationwith Argonaute during LTP in vivo[J].Front Cell Neurosci,2014,7:285.
[12]Hong JG,Kim DH,Lee CH,et al.GSK-3β activity in the hippocampus is required for memory retrieval[J].Neurobiol Learn Mem,2012,98(2):122-129.
Phosphorylation at serine 129 site of CREB for increasing miR-132 level
Wang Xiang,Hu Jiashao
(Medical School,Jianghan University,Wuhan,Hubei 430056,China)
ObjectiveTo investigate the influence of phosphorylation at serine(Ser)129 site of cAMP-response element binging(CREB)protein on micro RNA-132(miR-132)by activating phosphorylated CREB for the related protein expressing memory obtaining the long term memory.MethodsThe long-term potentiation(LTP)electric stimulation and tail vein injection were adopted to give glycogen synthase kinase-3β(GSK-3β)inhibitor SB216763,the level of CREB phosphorylation in rat hippocampus area was detected by using the Western blot and the miR-132 expression was detected by using RT-PCR.Results
High frequency stimulation at CA3-CA1 neurocircuit could successfully induce LTP,which significantly increased the expression level of phosphorylated CREB Ser 129 in rat hippocampus and miR-132 level;SB216763 could inhibit the GSK-3β activity,thereby inhibited serine 129 phosphorylation of CREB and significantly decreased the LTP slope amplification and reduced the CREB Ser phosphorylation level and miR-132 expression.ConclusionThe phosphorylation of CREB at the serine 129 site could promote the LTP formation by regulating miR-132 expression,the phosphorylation of CREB Ser 129 site regulates the miR-132 expression during the LTP formation process,thus influences the long term memory formation.
Cyclic AMP response element-binding protein;MicroRNAs;Protein-serine-threonine kinases;Phosphotransferases;Glycogen synthase kinase 3;Long-term potentiation;Potentiometry;Memory
10.3969/j.issn.1009-5519.2016.20.010
A
1009-5519(2016)20-3125-03
王翔(1984-),博士研究生,主要从事神经生物学、阿尔茨海默病的研究。
(2016-07-17)
