Mg2Ni1-xCox合金相的固溶烧结法制备及结构和储氢性能
2016-11-02李祥志李永涛柳东明张庆安斯庭智
马 勇, 李祥志, 李永涛, 柳东明, 张庆安, 斯庭智
(安徽工业大学材料科学与工程学院, 马鞍山 243002)
Mg2Ni1-xCox合金相的固溶烧结法制备及结构和储氢性能
马勇, 李祥志, 李永涛, 柳东明, 张庆安, 斯庭智
(安徽工业大学材料科学与工程学院, 马鞍山 243002)
采用固溶烧结法制备了Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金, 利用X射线衍射仪和压力-组成-温度测试仪等研究了Co含量对合金相结构和储氢性能的影响. 结果表明, 合金由Mg2Ni型Mg2(Ni, Co)主相及少量Mg和MgNi3Co新相组成. Mg2(Ni, Co)具有良好的可逆储氢性能, 吸氢形成Mg2Ni0.9Co0.1H4型四元氢化物, 其具有与父系氢化物HT-Mg2NiH4相近的放氢焓变(ΔHd=63.9 kJ/mol H2). Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金具有良好的放氢动力学性能, 二维相界面迁移为放氢过程的控制步骤. 随着Co含量的增加, 合金的放氢活化能(Ea)降低, 其中, Mg2Ni0.8Co0.2的Ea降低到54.0 kJ/mol.
Mg2Ni型合金; Co合金化; 固溶烧结; Mg2Ni0.9Co0.1H4; 储氢性能
Mg具有密度小、 资源丰富、 价格低廉及储氢量高[MgH2储氢量(质量分数)达7.6%]等优点, 被认为是最有发展潜力的轻质储氢材料之一[1]. 然而, 纯Mg作为储氢材料吸放氢动力学性能差, 其氢化物较稳定(放氢温度约为350 ℃), 严重限制了它的实际应用[2,3]. 为了克服上述缺点, 国内外学者开展了大量的研究工作[4~7], 并取得了一定的进展.
将Mg与过渡元素进行合金化是改善Mg基材料储氢性能的一种有效方法. 其中, 最具代表性的是Mg2Ni合金[8], 其氢化物Mg2NiH4的放氢焓变(ΔHd)由MgH2的75 kJ/mol H2降低到65 kJ/mol H2, 热力学性能改善明显. Co与Ni原子的属性相似, 但Mg和Co的金属间化合物不能储氢. 尽管如此, 人们在高压H2(~GPa)的作用下, 通过高能球磨Mg和Co的粉末制备了Mg2CoH5和Mg6Co2H11等新型三元氢化物. Mg2CoH5具有比Mg2NiH4更高的储氢容量(4.5%)和体积密度, 因此获得了广泛关注, 但它具有比MgH2更高的稳定性, ΔHd高达82.3 kJ/mol H2[9], 这严重制约了Mg-Co体系在储氢领域的应用.
研究发现, 通过Cu, Fe, V, Cr和Co等元素替代Mg2Ni中的Ni有利于放氢反应的进行, 并显著改善Mg2Ni的储氢动力学[10~13]. 在Mg-Ni-Co体系中通过高能球磨的方法可制备Mg2Ni0.9Co0.1H4和Mg2Ni0.5Co0.5H4.4四元氢化物, 预示着这些氢化物具有可调节的储氢性能. 由于Mg具有较高的蒸气压, 通过常规的熔炼法制备Mg-Ni-Co合金十分困难[14]; 而高压H2作用下高能球磨制备的安全性和产率低等问题也严重限制了新型Mg-Ni-Co-H体系的进一步发展. 本文采用固溶烧结法制备了主相为Mg2(Ni, Co)的Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金, 并研究了Co含量对其相结构和储氢性能的影响及四元氢化物Mg2Ni0.9Co0.1H4的储氢特性.
1 实验部分
1.1试剂与仪器
Ni粉和Co粉(纯度99.8%), 美国Alfa Aesar公司; Mg粉(纯度99.8%), 美国International Laboratory; 无水乙醇(分析纯), 国药集团化学试剂有限公司.
米开罗那(中国)有限公司Super 1220/750/900型手套箱; 南京大学仪器厂QM-3SP2 型行星式球磨机; 日本理学公司Rigaku D/Max-2500C型X射线粉末衍射仪; 日本铃木商社全自动压力-组成-温度(P-C-T)测试仪.
1.2实验过程
采用固溶烧结法制备Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金主要分为两步: Ni1-xCox(x=0.10, 0.15, 0.20)固溶体的制备和Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金的烧结. 首先通过湿法球磨制备Ni(Co)固溶体粉末: 按Ni1-xCox(x=0.10, 0.15, 0.20)的摩尔比称取Ni粉和Co粉倒入不锈钢球磨罐中, 并加入一定量的无水乙醇作为过程控制剂, 于球磨机上湿磨80 h; 其中, 球料比为20∶1, 转速为400 r/min, 每30 min正反转各一次. 湿磨样品在烘箱中烘干除去无水乙醇. 然后将Mg粉与Ni1-xCox固溶体粉末按照2∶1的摩尔比配料并进行球磨混合, 球料比为20∶1, 转速为300 r/min, 混合时间为1 h. 混合后的合金粉末压制成厚度为3 mm、 直径为13 mm的薄片, 在Ar气保护下于真空烧结炉中600 ℃烧结20 h后随炉冷却至室温. 将烧结后的样品去除表面氧化层, 在手套箱中研磨成300目粉末.
1.3表征
用X射线粉末衍射仪对样品的相组成及结构进行分析, 采用CuKα辐射, 功率为50 kV×150 mA, 以步进式扫描方式采集实验数据, 步长为0.02°, 积分时间为1 s; 并用RIETAN-2000程序[15]对XRD谱图进行Rietveld全谱拟合分析, 获得晶胞参数和相丰度. 储氢性能测试前, 烧结样品在350 ℃, 4.0 MPa/0.001 MPa氢气压力下经过3次吸/放氢循环活化, 吸/放氢时间均为2 h. 用PCT测试仪测定活化样品的P-C-T曲线和恒温放氢曲线.
2 结果与讨论
2.1合金的相结构
图1比较了球磨80 h的Ni1-xCox(x=0.10, 0.15, 0.20)和未球磨的Ni0.9Co0.1的XRD谱图. 可以看出, 球磨80 h后, 面心立方(fcc)结构Ni的衍射峰明显宽化, 强度降低并向小角度偏移, 而体心立方(bcc)结构Co的衍射峰消失. 这表明球磨粉末已经形成以Ni为溶剂、 Co为溶质的Ni(Co)固溶体. 宽化的衍射峰也表明球磨使粉末的晶粒得到了细化并产生了一定量的晶体缺陷, 它们将有利于后续烧结过程中合金的形成.

Fig.1 XRD patterns of Ni1-xCox (x=0.10, 0.15, 0.20) solid solutions(a—c) and Ni0.9Co0.1 mixture without milling(d)a.x =0.10; b. x =0.15; c. x =0.20.
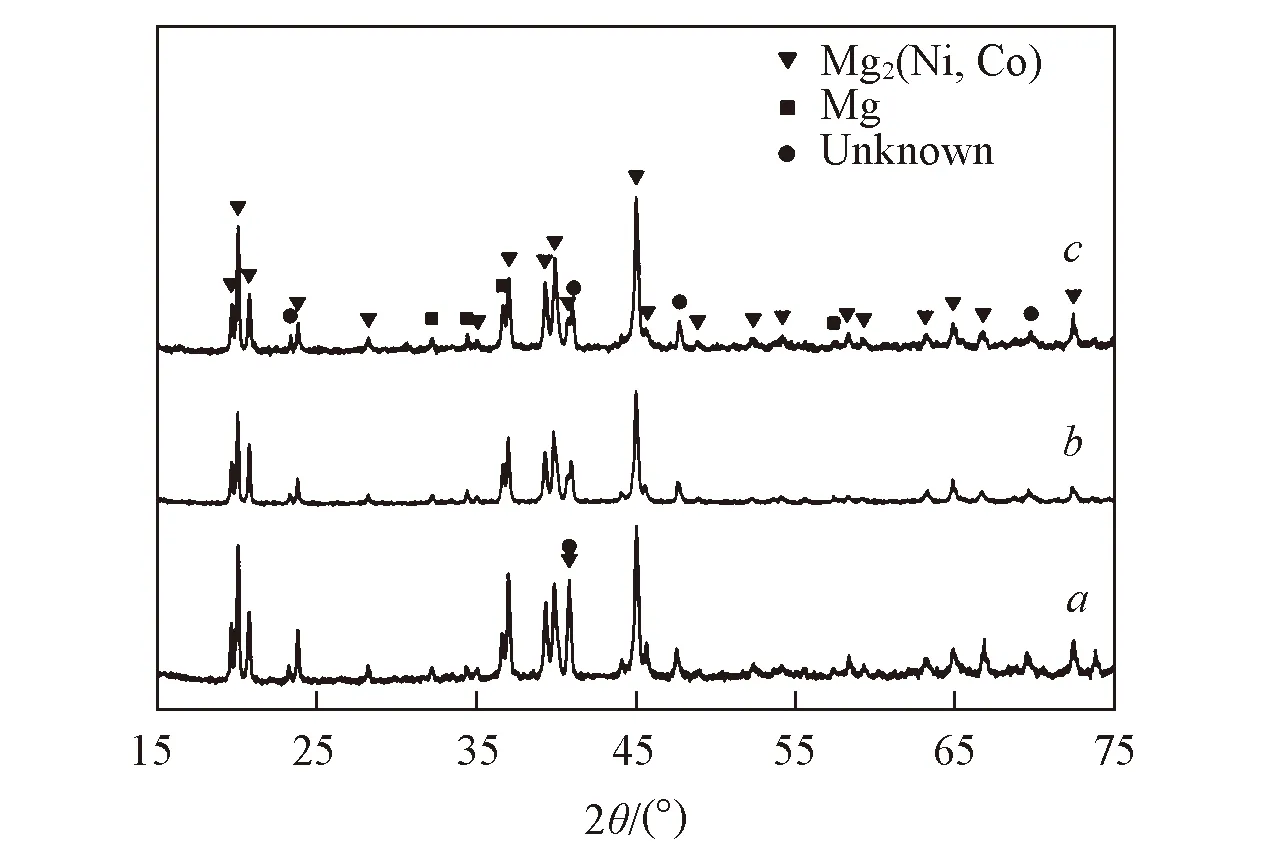
Fig.2 XRD patterns of the sintered Mg2Ni1-xCox alloys a. x=0.10; b. x =0.15; c. x =0.20.
图2为烧结Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金的XRD谱图. 可以看出, 合金均由Mg2Ni型Mg2(Ni, Co)主相、 少量的Mg和1个未知相组成. 由于Mg的蒸气压较高且Mg与Ni, Co的熔点相差较大, 通过熔炼制备Mg2Ni型Mg2(Ni, Co)化合物十分困难[13,16]. 在熔炼的Mg-Ni-Co三元合金中, Co和Mg结合并以MgCo2的形式存在, 这不但在随后的氢化过程中不能形成Mg-Ni-Co-H四元氢化物, 而且还会造成合金体系的储氢容量损失(MgCo2不吸氢). 由图2可知, 固溶烧结法是制备Mg2(Ni, Co)化合物的一种有效方法.


Table 1 Atomic coordinates, occupation factors(g) and isotropic thermal parameters(B) of MgNi3Co refined from X-ray powder diffraction data
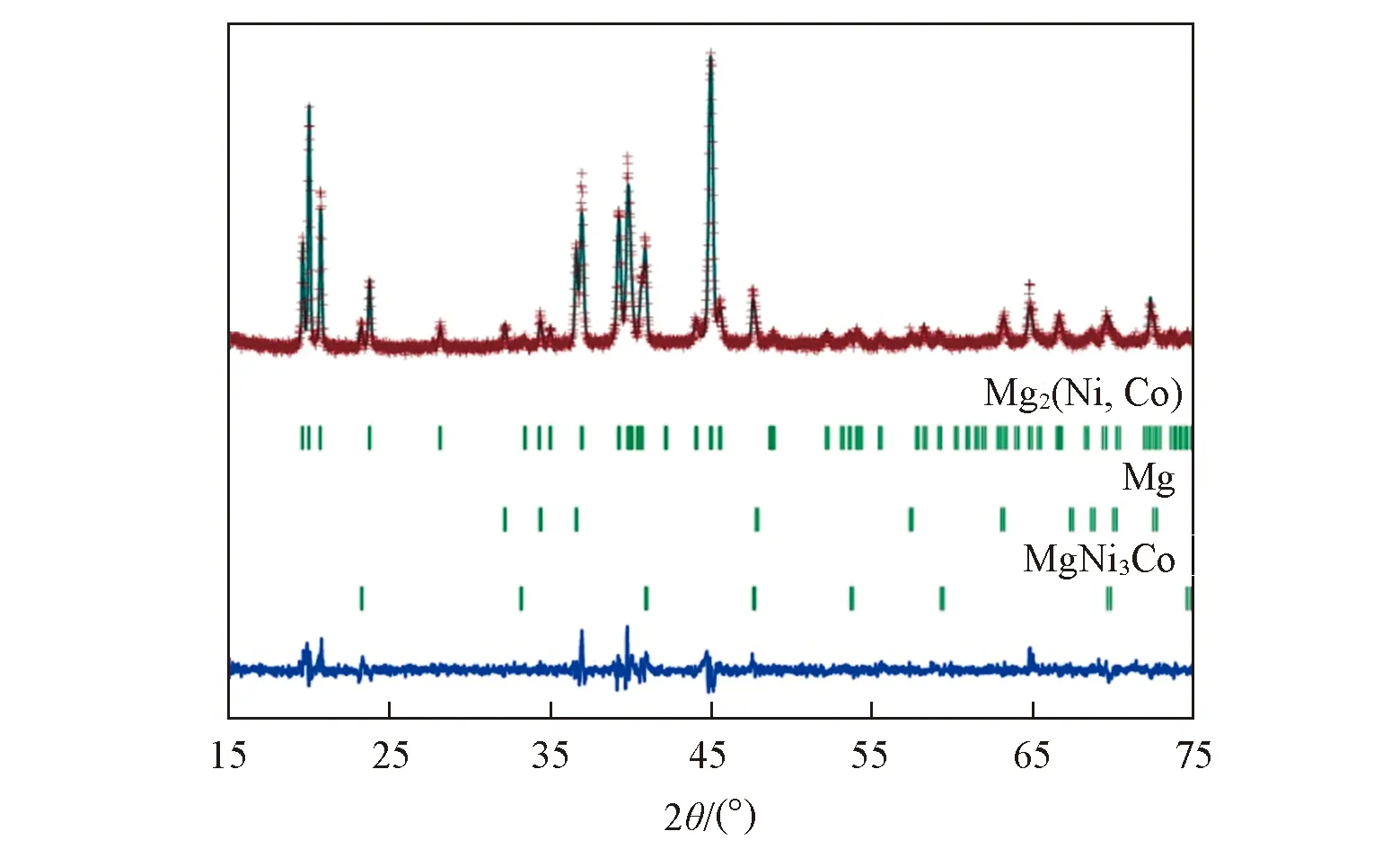
Fig.3 Rietveld refinement of the observed XRD pattern for the sintered Mg2Ni0.85Co0.15 alloyThe calculated(line) and observed(+) X-ray diffraction patterns for sintered Mg2Ni0.85Co0.15 alloy are displayed above the vertical bars, below which shows the difference between the observed and calculated patters.
采用Mg2(Ni, Co)、 Mg及解析的MgNi3Co新相的晶体结构参数对Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金的XRD谱图进行了Rietveld全谱拟合. 图3给出了烧结Mg2Ni0.85Co0.15合金XRD的Rietveld精修谱图, 可见, 测量峰和拟合峰十分吻合. 表2给出了拟合的Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金的相结构参数和相含量. 由表2可以看出, 随着合金中Co含量的增加, 大原子半径的Co取代Ni量增大, 使Mg2(Ni, Co)的晶格常数增大, 结构的调整预示着Mg2(Ni, Co)可能具有不同于Mg2Ni的储氢特性. 此外, Rietveld拟合结果也再次证实了EXPO软件解析MgNi3Co化合物结构的正确性.
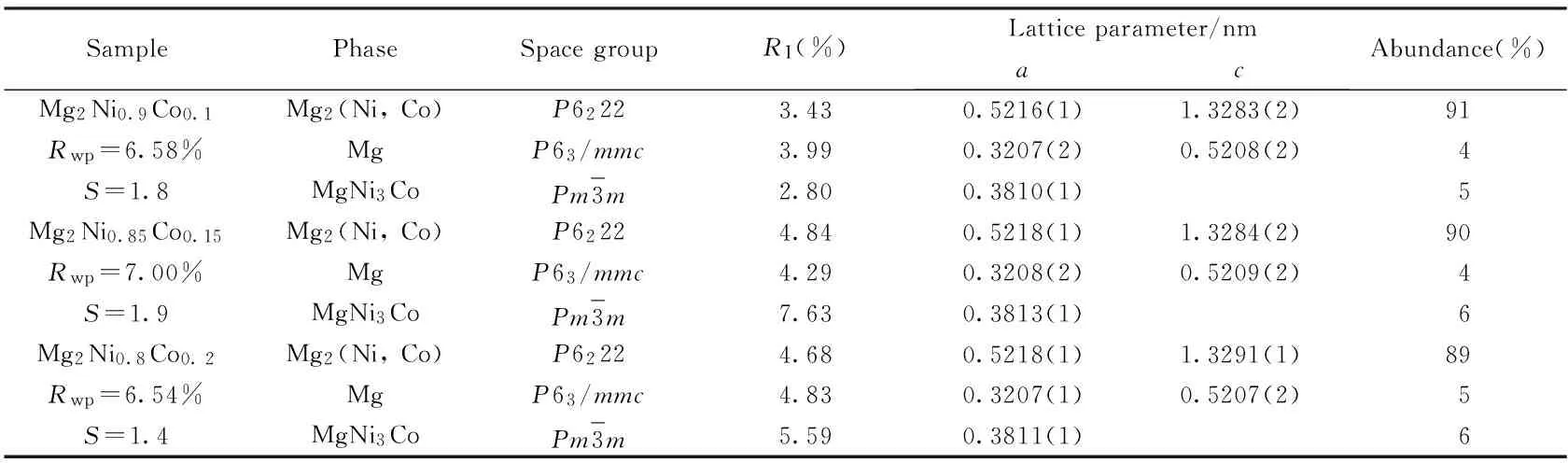
Table 2 Structural parameters and phase abundance of the sintered Mg2Ni1-xCox (x=0.10, 0.15, 0.20) alloys
*RIis theR-Bragg factor;Rwpis theR-weighted pattern;Sis the goodness of fitting.
Mg2Ni为六方结构(空间群为P6222), 每个晶胞中含有12个Mg和6个Ni原子, 其中Ni原子占据3d和3b位置. 研究发现, Co原子占据Ni(3d)位置时, 结合能最低, 六方结构最稳定[18]. 表3给出了经Rietveld拟合, Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金Mg2(Ni, Co)相中Co原子在Ni(3d)位置的占位因子. 由表3中的计算结果可知, 当x分别为0.10, 0.15, 0.20时, Mg2(Ni, Co)主相中Co替代单位Ni原子的量分别为0.08, 0.14和0.18. 这表明主相中的Co含量随合金中Co含量的增加而增加, 但略小于合金中的添加量.

Table 3 Occupation factor(g) of Co atoms in Ni(3d) sites of the Mg2(Ni, Co) phases
2.2吸/放氢反应机理

(1)
(2)
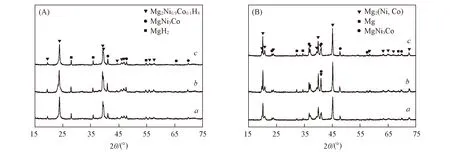
Fig.4 XRD patterns of the hydrogenated(A) and dehydrogenated(B) Mg2Ni1-xCox(x =0.10, 0.15, 0.20) alloys a. x=0.10; b. x =0.15; c. x =0.20.
2.3放氢热力学特性

Fig.5 P-C isotherms of hydrogen absorption/desorption for the Mg2Ni1-xCox (x =0.10, 0.15, 0.20) alloys(A)—(C) and van’t Hoff plots in dehydriding process(D)(A) x =0.10; (B) x =0.15; (C) x =0.20. a. Mg2Ni0.9Co0.1-H2; b. Mg2Ni0.85Co0.15-H2; c. Mg2Ni0.8Co0.2-H2.
图5(A)~(C)比较了Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金在320, 300和280 ℃下的吸放氢P-C-T曲线, 图中均只观察到1个单一的吸放氢平台. 由于Mg2Ni1-xCox合金中Mg含量(质量分数)低于5%, 根据2.2节合金的吸放氢机制可以判断该单一的平台为Mg2(Ni, Co)化合物的吸放氢平台; 该平台具有平坦、 吸放氢滞后较小的特征, 表明Mg2(Ni, Co)具有良好的吸放氢可逆性能.

2.4放氢动力学特性
图6为Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系在不同温度下的恒温放氢动力学曲线. 可见, 合金在300 ℃, 10 min左右即可放氢完全, 且随着Co含量的增大, 放氢量略有降低, 分别为3.24%, 3.15%和3.04%. 合金化往往会造成材料储氢容量的损伤, 本文合金中MgNi3Co杂相的产生导致储氢量小于Mg2Ni的理论储氢量(3.6%); 但由于其含量低于6%, 因此, 合金保持了较高的储氢容量. 在300 ℃下, 真空感应熔炼的Mg2Ni合金在10 min内放氢量只达到饱和吸氢量的45%左右[16], 即使球磨制备的纳米晶Mg2Ni合金也需要20 min左右才能放氢完全[28]. 与上述结果相比, Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系具有明显改善的放氢动力学性能.
为了进一步揭示Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系的放氢动力学机制, 采用下式的动力学模型对图6中的恒温放氢曲线进行分析[29]:

(3)
式中,α表示t时刻的反应分数,k是速率常数,g(α)和f(α)为代表不同反应机理的功能函数(如化学反应、 扩散和形核长大等[30]). 采用不同的功能函数[5,31]对图6中的实验数据进行拟合, 发现函数1-(1-α)1/2在较宽的α范围内对t具有最好的拟合度, 即Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系的放氢反应可用二维相界面迁移动力学方程来描述, 产物和反应物之间的相界面迁移为放氢反应的速度控制步骤.
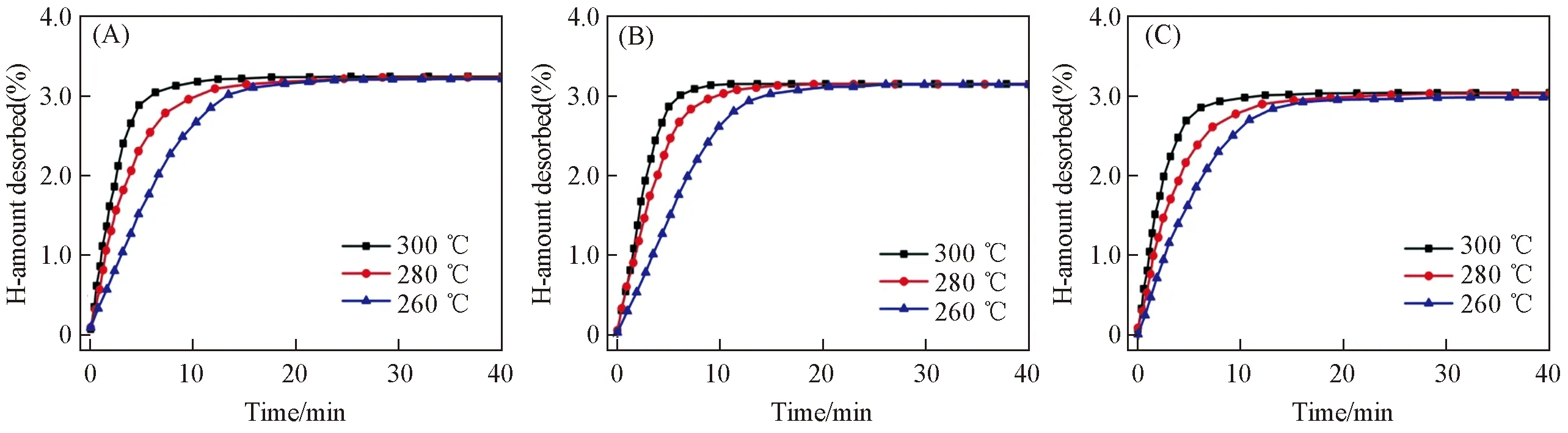
Fig.6 Isothermal hydrogen desorption curves of the Mg2Ni1-xCox (x =0.10, 0.15, 0.20) alloys (A) x=0.10; (B) x=0.15; (C) x=0.20.
图7给出了函数1-(1-α)1/2与时间t的线性关系. 根据图7中拟合直线的斜率可以得到不同温度下的速率常数k, 再利用Arrhenius方程即可获得样品放氢过程的表观活化能(Ea):
(4)
式中,k0为指前因子;R为气体常数;T为绝对温度.

Fig.7 Plots of 1-(1-α)1/2 vs. t for the Mg2Ni1-xCox (x =0.10, 0.15, 0.20)-H2 systems at various temperatures (A) x=0.10; (B) x=0.15; (C) x=0.20.

Fig.8 Arrhenius plots for hydrogen desorption of the Mg2Ni1-xCox (x =0.10, 0.15, 0.20) alloys a. x=0.10; b. x =0.15; c. x =0.20.
图8给出了不同样品放氢过程的Arrhenius曲线. 可以看出, lnk和1/T之间具有良好的线性关系. 由直线的斜率(-Ea/R)计算出Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系的表观活化能(Ea)分别为59.0, 54.7和54.0 kJ/mol. 铸态Mg2Ni的放氢表观活化能为80.0 kJ/mol[32], 机械合金化制备的纳米晶Mg2Ni的放氢表观活化能为69.0 kJ/mol[33], 通过对比可以发现, Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系的Ea明显下降, 这表明Mg2Ni0.9Co0.1H4型主相的放氢动力学性能有较大改善, 并且随氢化物中Co含量的增加Ea进一步下降. 放氢动力学性能的改善可以归结于: (1) 过渡元素的d层电子能够与H相互作用, 并弱化Mg—H键[34,35], 因此, 过渡元素合金化被证实能够改善Mg2Ni的吸放氢动力学性能; (2) HT-Mg2NiH4结构的变体Mg2Ni0.9Co0.1H4是一种亚稳相, 当热力学条件满足时, 将促进亚稳相在更短的时间内放氢[24,36]; (3) 合金的晶胞体积随着Co含量的增加而增大, 晶胞体积增大会导致氢化物不稳定, 有利于氢在体相内扩散[4], 因此随着合金中Co含量的增加, Mg2Ni1-xCox(x=0.10, 0.15, 0.20)-H2体系的Ea呈下降趋势.
3 结 论
研究了采用固溶烧结法制备的Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金的相结构和储氢性能. 结果表明, 该合金由Mg2Ni型Mg2(Ni, Co)主相、 少量的Mg和MgNi3Co新相组成. 主相中的Co含量随合金中Co含量的增加而增加, 但略小于合金中的添加量. Mg2(Ni, Co)氢化后形成Mg2Ni0.9Co0.1H4型相, 其具有Mg2M1-xM’xHy四元氢化物的基本特征. 随着Co含量的增加, 合金的放氢焓变略微增大, 由63.9 kJ/mol H2增大到66.7 kJ/mol H2, 与Mg2NiH4的十分相近. Mg2Ni1-xCox(x=0.10, 0.15, 0.20)合金具有良好的可逆储氢性能, 在300 ℃, 10 min内放氢完全, 放氢量分别为3.24%, 3.15%和3.04%. Co合金化能明显改善体系的放氢动力学性能, 当x=0.20时, 合金的放氢活化能达到最低值54.0 kJ/mol.
[ 1 ]Ma J. L., Wang Y., Tao Z. L., Chen J.,Chem.J.ChineseUniversities, 2012, 33(3), 536—540(马建丽, 王艳, 陶占良, 陈军. 高等学校化学学报, 2012, 33(3), 536—540)
[ 2 ]Zhu M., Lu Y., Ouyang L., Wang H.,Materials, 2013, 6(10), 4654—4674
[ 3 ]Jain I., Lal C., Jain A.,Int.J.HydrogenEnergy, 2010, 35(10), 5133—5144
[ 4 ]Huo L., Shi H. C., Xu B. E., Li X. Y., Meng L. P.,Chem.J.ChineseUniversities, 2011, 32(8), 1799—1806(霍亮, 史洪存, 许保恩, 李晓艳, 孟令鹏. 高等学校化学学报, 2011, 32(8), 1799—1806)
[ 5 ]Liang G., Huot J., Boily S., Schulz R.,J.AlloysCompd., 2000, 305(1), 239—245
[ 6 ]Jeon K. J., Moon H. R., Ruminski A. M., Jiang B., Kisielowski C., Bardhan R., Urban J. J.,Nat.Mater., 2011, 10(4), 286—290
[ 7 ]Jung H., Yuh J., Cho S., Lee W.,J.AlloysCompd., 2014, 601, 63—66
[ 8 ]Reilly Jr. J. J., Wiswall Jr. R. H.,Inorg.Chem., 1968, 7(11), 2254—2256
[ 9 ]Shao H., Xu H., Wang Y., Li X.,J.SolidStateChem., 2004, 177(10), 3626—3632
[10]Yang H., Yuan H., Ji J., Sun H., Zhou Z., Zhang Y.,J.AlloysCompd., 2002, 330, 640—644
[11]Palade P., Sartori S., Maddalena A., Principi G., Russo S. L., Lazarescu M., Schinteie G., Kuncser V., Filoti G.,J.AlloysCompd., 2006, 415(1), 170—176
[12]Wang X. L., Tu J. P., Zhang X. B., Gao R. G., Chen C. P.,Chin.J.NonferrousMet., 2002, 12(5), 907—911(王秀丽, 涂江平, 张孝彬, 高嵘岗, 陈长聘. 中国有色金属学报, 2002, 12(5), 907—911)
[13]Zhang Y. H., Li B. W., Ren H. P., Ding X. X., Liu X. G.,J.AlloysCompd., 2011, 509(6), 2808—2814
[14]Xie L., Shao H., Wang Y., Li Y., Li X.,J.HydrogenEnergy, 2007, 32(12), 1949—1953
[15]Izumi F., Ikeda T.,Mater.Sci.Forum, 2000, 321, 198—205
[17]Altomare A., Burla M., Cascarano G., Giacovazzo C., Guagliardi A., Moliterni A., Polidori G.,J.Appl.Crystallogr., 1995, 28(6), 842—846
[18]Chen J. S., Zeng H., Wang L., Lan Z. Q., Guo J.,Trans.NonferrousMet.Soc.China, 2012, 22(1), 216—223(陈捷狮, 曾含, 王路, 蓝志强, 郭进. 中国有色金属学报, 2012, 22(1), 216—223)
[19]Deledda S., Hauback B.,Nanotechnology, 2009, 20(20), 259—265
[20]Mendoza-Zélis L., Meyer M., Baum L.,J.HydrogenEnergy, 2011, 36(1), 600—605
[21]Parker S. F., Deledda S.,J.Phys.Chem.C, 2012, 116(48), 25206—25212
[22]Shelyapina M., Pinyugzhanin V., Skryabina N., Hauback B.,Phys.SolidState, 2013, 55(1), 12—20
[23]Verbovytskyy Y., Zhang J., Cuevas F., Paul-Boncour V., Zavaliy I.,J.AlloysCompd., 2015, 645, S408—S411
[24]Hayakawa H., Ishido Y., Nomura K., Uruno H., Ono S.,J.Less-CommonMet., 1984, 103(2), 277—283
[25]Darnaudery J., Darriet B., Pezat M.,Int.J.HydrogenEnergy, 1983, 8(9), 705—708
[26]Van Setten M. J., de Wijs G. A., Brocks G.,Phys.Rev.B, 2007, 76(7), 075125
[27]Takahashi Y., Yukawa H., Morinaga M.,J.AlloysCompd., 1996, 242(1), 98—107
[28]Xie D. H., Li P., Zeng C. X., Sun J. W., Qu X. H.,J.AlloysCompd., 2009, 478(1/2), 96—102
[29]Gu R., Zhang M., Wang C. Y., Huang W. J., Liu D. M.,Chem.J.ChineseUniversities, 2016, 37(4), 688—692(顾润, 张明, 王春阳, 黄维军, 柳东明. 高等学校化学学报, 2016, 37(4), 688—692)
[30]Li Q., Lin Q., Chou K. C., Jiang L.,J.Mater.Sci., 2004, 39(1), 61—65
[31]Barkhordarian G., Klassen T., Bormann R.,J.AlloysCompd., 2006, 407(1), 249—255
[32]Ouyang L., Cao Z., Wang H., Liu J., Sun D., Zhang Q., Zhu M.,Int.J.HydrogenEnergy, 2013, 38(21), 8881—8887
[33]Liang G., Huot J., Boily S., van Neste A., Schulz R.,J.AlloysCompd., 1999, 282(1), 286—290
[34]Jia Y., Sun C., Cheng L., Wahab M. A., Cui J., Zou J., Zhu M., Yao X.,Phys.Chem.Chem.Phys., 2013, 15(16), 5814—5820
[35]Jia Y., Sun C., Shen S., Zou J., Mao S. S., Yao X.,RenewableSustainableEnergyRev., 2015, 44, 289—303
[36]Lv P., Wang Z., Zhou H., Deng J., Yao Q., Zhang H.,Mater.Sci.Technol., 2014, 30(2), 176—182
(Ed.: S, Z, M)
† Supported by the National Natural Science Foundation of China(No.U1503192).
Phase Structures and Hydrogen Storage Properties of Mg2Ni1-xCoxAlloys Prepared by Solid Solution Sintering†
MA Yong, LI Xiangzhi, LI Yongtao, LIU Dongming, ZHANG Qing’an, SI Tingzhi*
(SchoolofMaterialsScienceandEngineering,AnhuiUniversityofTechnology,Ma’anshan243002,China)
Mg2Ni1-xCox(x=0.10, 0.15, 0.20) alloys were prepared by a novel method combining solid solution with sintering process. The effect of Co content on the phase structures and hydrogen storage properties were investigated by XRD and pressure-composition-temperature analyser. It was found that the alloys consisted of a Mg2Ni-type major phase Mg2(Ni, Co), minor Mg and a new phase MgNi3Co. The Mg2(Ni, Co) compounds displayed a reversible hydrogen storage process. After hydrogenation, the quaternary Mg2Ni0.9Co0.1H4-type hydride was formed with an enthalpy change of the hydrogen desorption(ΔHd=63.9 kJ/mol H2) approximate to the parent hydride HT-Mg2NiH4. The Mg2Ni1-xCox(x=0.10, 0.15, 0.20) alloys showed a superior desorption kinetics and the desorption process was mainly controlled by two-dimensional phase-boundary migration. For the Mg2Ni1-xCox(x=0.10, 0.15, 0.20) alloys, the activation energy of hydrogen desorption (Ea) decreased with the increase of Co content. As a result, theEavalue of the Mg2Ni0.8Co0.2alloy was significantly lowered to 54.0 kJ/mol.
Mg2Ni-type alloy; Co-alloying; Solid solution sintering; Mg2Ni0.9Co0.1H4; Hydrogen storage property
10.7503/cjcu20160284
2016-04-25. 网络出版日期: 2016-09-23.
国家自然科学基金(批准号: U1503192)资助.
O614
A
联系人简介: 斯庭智, 男, 博士, 教授, 主要从事储氢材料研究. E-mail: tzsiahut@163.com
