干肉制品中霉菌PCR鉴定方法的建立
2016-11-01敖特根巴雅尔乌兰其其格陆继爽特尼格尔
敖特根巴雅尔,乌兰其其格,陆继爽,特尼格尔
(1.内蒙古鄂托克旗农牧业局动物疫病预防控制中心,内蒙古 鄂托克旗 016100;2.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
干肉制品中霉菌PCR鉴定方法的建立
敖特根巴雅尔1,乌兰其其格1,陆继爽2,特尼格尔2
(1.内蒙古鄂托克旗农牧业局动物疫病预防控制中心,内蒙古 鄂托克旗 016100;2.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
为了早期预防传统牛肉干发生霉变,建立了牛肉干中真菌PCR的鉴定方法,在特异性和敏感性方面对所建立的PCR方法进行了验证。其中特异性试验以霉变的鲜牛肉、酵母菌、乳酸球菌、乳酸杆菌、大肠杆菌为材料进行验证;敏感性试验以霉变的鲜牛肉为材料,提取其DNA并将其稀释成不同的浓度进行PCR验证。结果显示:特异性试验中仅霉菌样品在约300 bp处出现特异性条带,而其他样品在该处无特异性条带出现,表明具有良好的特异性;敏感性试验中,霉菌DNA原液、10倍稀释、100倍稀释、1 000倍稀释时均出现了约300 bp的特异性条带,即霉菌DNA模板稀释度为1 000倍(2 ng/μL)时仍对引物有敏感性。该试验为市场传统牛肉干真菌PCR检测工作提供了依据。
传统牛肉干;真菌;PCR鉴定方法;特异性;敏感性
霉菌在自然界中广泛存在,且其可以产生多种微小的孢子,因而很容易对食品造成污染[1]。食品被霉菌污染后不仅会腐败变质,正常营养成分被改变,而且部分霉菌还会产生毒素,人畜误食后可能会发生中毒[2]。自从发现有强致癌作用的黄曲霉毒素以来[3],人们对霉菌污染食品日益重视。因此,食品中霉菌的检测就变得尤为重要。
目前,检测食品中霉菌的常用方法是平板培养法、镜检计数法、快速测试片法以及PCR检测法等[4]。平板培养法是使用灭菌的蒸馏水对样品稀释,选用合适的接种方法、培养基、温度以及培养时间对样品进行培养计数[5]。该检测方法虽然准确度和灵敏度都比较高,但其过程相当繁琐,需要花费大量的时间及人力物力,这对于食品厂家,尤其是保存期较短的食品来讲用途不大,由于其用时长而极易使被检测的保存期较短的食品产生食品安全问题。镜检计数法检测霉菌所用的是郝氏计数法,需要用到带有标准计测室的郝氏计测玻片,检测时要将已稀释样品涂抹到上面,用90~125倍的放大倍数检查每个视野,对其菌丝进行计数[5]。由于检测样品量小,检测结果往往偏差较大,但可大概确定霉菌数量级。快速测试片法是生化检测技术中的一种,它是以纸片、胶片和纸膜等作为培养基的载体,将特定培养基和显色物质附着在上面,凭借微生物在上面的生长特征和显色反应来判定食品中是否有霉菌的方法。因其反应具有特异性,所以该检测方法可以直观并且准确地反映出霉菌的种类和数量[6]。该方法操作简单,非常适合现场的取样和检测,而且成本较低,具有很广的应用范围。但其也有一定的局限性,因存在一些技术上的问题使得检测结果不准确。PCR检测技术是食品中霉菌检测技术领域的热点,具有敏感性高、准确度高、快速和方便的特点。它是一种体外DNA扩增技术,在一定温度下,由耐热的DNA聚合酶作用,重复变性—退火—复性3个基本反应步骤,是极微量的DNA片段成几何倍数的扩增,然后通过琼脂糖凝胶电泳检测扩增得到DNA条带,以确定霉菌的特定种类。随着分子生物技术的发展,很多新的技术如逆转录PCR、巢式PCR、多重PCR和实时定量PCR,使得霉菌的检测更为准确。该试验采用普通PCR方法,通过扩增霉菌的18S rDNA的保守区域,实现对已霉变的干肉制品的快速特异性检测。
1 材料与方法
1.1 试验材料 大肠杆菌、乳酸球菌、乳酸杆菌、霉菌、酵母菌,均由内蒙古农业大学兽医学院分子实验平台提供。
1.2 主要仪器及试剂
1.2.1 主要仪器:电子天平(赛多利斯科学仪器有限公司)、HZC-250型恒温振荡培养箱(太仓市实验设备厂)、核酸电泳仪(Bio-rad Power Pace Basic,美国伯乐公司)、凝胶成像系统(Vilber公司)、离心机(Thermo公司)、多功能酶标仪(BioTek公司)。
1.2.2 主要试剂:十六烷基三甲基溴化铵(CTAB,天津市兴复精细化工厂研究所);LB培养基、M17培养基、MRS培养基、麦芽汁培养基(北京陆桥技术有限责任公司);rTaq 酶、DL2000 DNA Marker(宝生物有限责任公司)。
1.3 试验方法
1.3.1 菌种培养:大肠杆菌、乳酸球菌、乳酸杆菌和酵母菌分别接种于LB培养基、M17培养基、MRS培养基和麦芽汁培养基中培养,霉菌则取自已经发霉的牛肉干中,这些菌均待提取DNA。
1.3.2 模板DNA制备:霉菌DNA提取:①从已经发霉的牛肉干上用已消毒刀片刮取少量霉菌菌体于研钵中;②向研钵中倒入液氮,充分研磨至粉末状。提前称量1.5 mL离心管重,将样品粉末小心倒入1.5 mL离心管中,室温放置1~2 min;再称量1.5 mL离心管重,计算样品质量;③按照1 g样品加入5 mL 2%CTAB的比例加入65℃预热的2%CTAB提取液,充分混匀后,置65℃水浴1 h,期间可适当摇匀(每隔 5~10 min混匀 1次),取出后,放至室温;④加入等体积的酚/氯仿/异戊醇(25∶24∶1),充分颠倒混合,将提取液中含有的蛋白质变性,分装至2.0 mL离心管内,室温下12 000 r/min离心10 min;⑤将上清转移到新的2.0 mL离心管中,注意不要吸到中间的蛋白质层,加入等体积氯仿/异戊醇(为吸取充分,可将吸到的蛋白质层再离心),充分颠倒混合,抽提提取液中含有的蛋白质,并萃取出其中的酚;室温下12 000 r/min离心10 min;⑥将上清转移到新1.5 mL离心管中,向上清中加入1倍体积异丙醇,充分颠倒混匀,使DNA从溶液中析出,形成絮状沉淀(-20℃放置1~2 h促进DNA沉淀);4℃离心,12 000 r/min离心20 min;⑦弃上清,加入500 μL 70%乙醇,颠倒混匀,至沉淀悬起;⑧4℃12 000 r/min离心5 min,再用500 μL70%乙醇洗涤1次;⑨4℃12 000 r/min离心5 min,弃酒精,将剩余的液体尽量吸净并干燥,加入适量TE缓冲液或灭菌三蒸水溶解DNA;如果DNA溶解困难,可以37℃温育30 min;⑩DNA溶解后,可按样品体积加入1/10体积的浓度为10 mg/mL的RNase A并在37℃处理 10 min,除去 RNA;取 1 μL用酶标仪检测其浓度,另取5 μL于1%琼脂糖凝胶电泳检测。
酵母菌DNA也使用上述方法提取。乳酸球菌和乳酸杆菌则用溶菌酶在37℃温浴30 min,再跟大肠杆菌一起用蛋白酶K在55℃处理30 min,然后再从上述步骤中的第4步开始进行DNA的提取。
1.3.3 引物设计:根据GenBank中公布的霉菌18S rDNA序列设计引物,上游引物序列为5′-AACTTAAAGGAATTGACGGAAG-3′,下游引物序列为 5′-GCATCACAGACCTGTTATTGCCT-3′,该引物为上海桑尼公司合成。
1.3.4 PCR体系的优化:通过梯度PCR来筛选出合适的退火温度。PCR反应条件:95℃(5 min),95℃(30 s),梯度退火温度(45 s),72 ℃(30 s),35 个循环,72 ℃(7 min);退火温度的梯度选择:52.2、53.4、54.2、55.1、55.9、56.7、57.6 ℃;4 ℃保存。

表1 PCR反应体系 μL
1.3.5 特异性试验:分别提取霉菌、酵母菌、乳酸杆菌、乳酸球菌、大肠杆菌基因组进行PCR检测,验证该检测方法的特异性。
1.3.6 敏感性试验:将霉菌DNA提取液进行10倍梯度稀释,稀释梯度分别为原液、10倍稀释、100倍稀释、1 000倍稀释以及10 000倍稀释,DNA模板用量为1 μL,应用以上DNA进行PCR检测,电泳观察结果。
1.3.7 PCR产物电泳:取5 μL PCR产物,用琼脂糖凝胶电泳检测,电泳条件为1×TAE、2%琼脂糖凝胶、120 V电压条件下电泳25 min,最后用凝胶成像系统观察结果并拍照留存。
2 结果与分析
2.1 引物退火温度的优化 应用梯度PCR方法对霉菌DNA进行扩增,退火温度设为52.2、53.4、54.2、55.1、55.9、56.7、57.6 ℃,在 300 bp 处均有目的条带出现,55.9℃时呈现最强荧光,而在这些退火温度均无非特异性扩增出现,说明该引物适合霉菌的DNA扩增。所以选择56℃作为以后PCR扩增的退火温度。结果如图1所示。
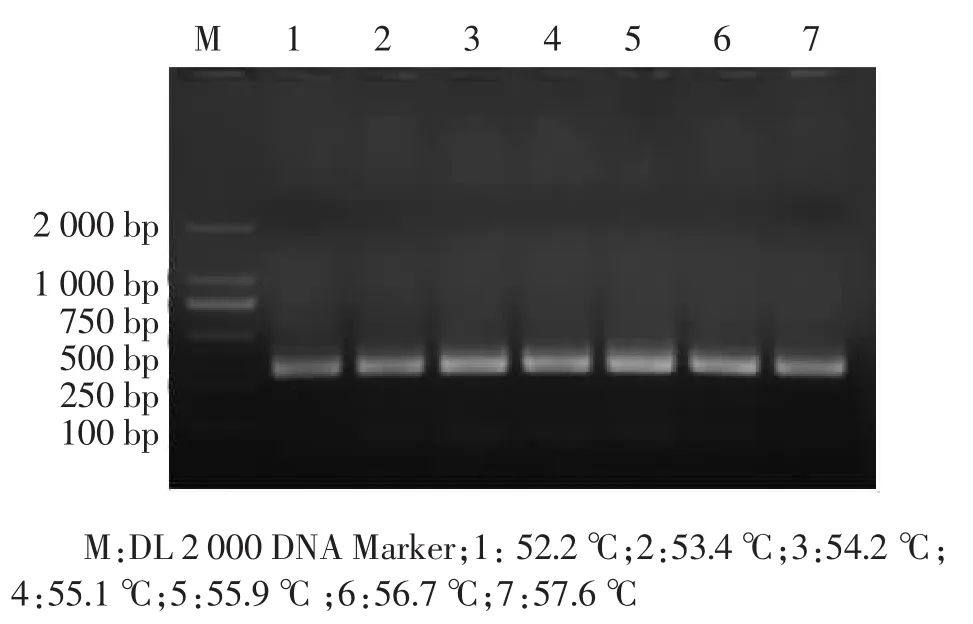
图1 不同退火温度下霉菌DNA PCR结果
2.2 特异性试验 霉菌DNA呈阳性扩增,而其他几种菌均无特异性条带出现,表明该引物只与霉菌样品有特性性反应,不与其他几种菌发生交叉反应,证明设计引物特异性很强,与预期相符合(见图2)。

图2 特异性试验结果
2.3 敏感性试验 分别以不同浓度的霉菌DNA做模板,检测该PCR方法对不同浓度模板的敏感性。由图3可知,随着模板DNA浓度的降低,PCR反应的条带亮度呈梯度下降。当霉菌DNA浓度降为2 ng/μL时,仍可见到有微弱的目的条带,因此该PCR检测方法的检测敏感度是DNA浓度约为2 ng/μL的反应体系。
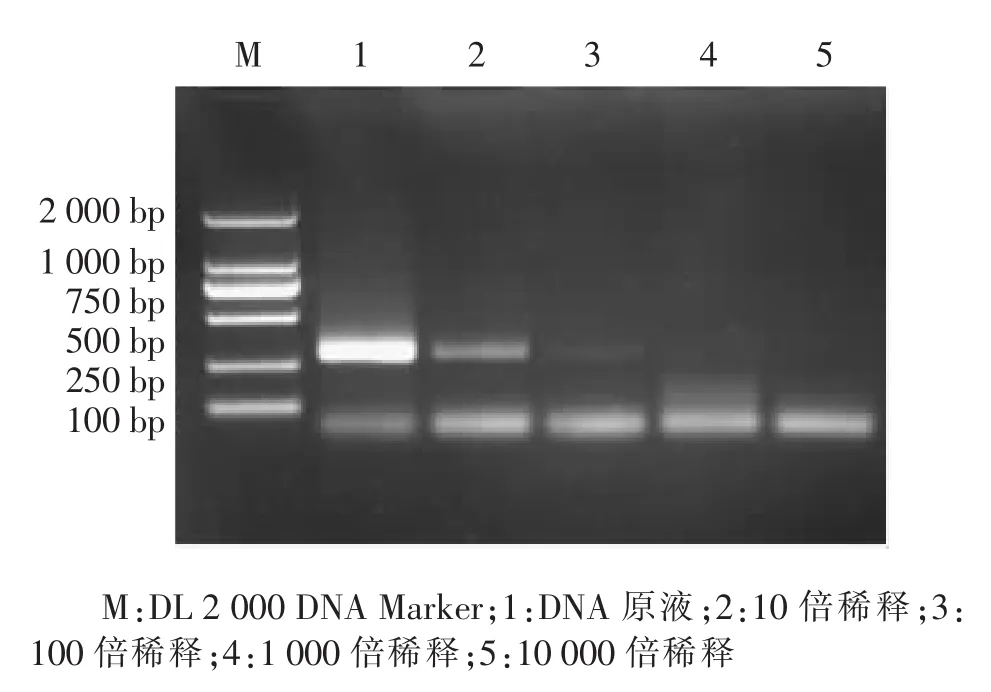
图3 敏感性试验结果
3 讨论
霉菌在生活中无处不在,它比较喜欢温暖潮湿的环境,一有合适的环境就会大量的繁殖,尤其是会对食品产生极大威胁。所以必须采取有效措施来阻止霉菌的繁殖或切断其传播途径,才可以摆脱霉菌的感染。食品受到霉菌污染后,其正常营养成分会被改变,并且会形成累积毒性,甚至生成有致癌作用的霉菌毒素,这会危害人与动物的生命安全[7]。最近几年,由霉菌引起的食物中毒越来越多,而且曾报道的由霉菌引发的食物中毒,多是和人们生活息息相关的食品,人们对食品的安全性的要求越来越高。如今国家对于食品安全等越来越重视,并出台了食品中的霉菌的检测标准。
目前霉菌的检测方法较多,该试验采用的是PCR方法。PCR早已广泛应用于各类病原菌的分类、鉴定以及检测。通常通过设计特异性很强的引物对病原菌rDNA进行PCR检测,而真菌PCR检测的是 18S rDNA 和 rDNA 中的 ITS、IGS 区[8-10]。PCR具有特异、敏感、高效、快速、简便、重复性好等优点,它可以分析少量真菌细胞,甚至单个真菌孢子。这对于试验的准确性、实用性以及试验周期更为实用。样品小样并不充足的前提下依然可以得出稳定的测试结果,对试验结果的准确性是至关重要的。
在该研究中,霉菌检测的特异性反应仅霉菌样品出现特异性条带,而其他样品在该处无特异性条带出现,表明该引物具有良好的特异性;在敏感性反应上,霉菌DNA原液、10倍、100倍、1 000倍时均出现了特异性条带,即霉菌DNA原液稀释1 000倍(2 ng)时,仍对引物有敏感性。由此证明该方法是非常有效的。市场上某些不法商贩为了盈利,将过期的牛肉干经过处理后仍然销售。经处理后的发霉牛肉干外表无眼观变化,通过气味也无法分辨,但其中霉菌的含量很高。该研究方法的建立为变质发霉牛肉干的快速检测奠定了实验室基础,为有关霉菌的检测工作提供参考,为实验室生产和生活安全提供保障。
[1]施震地.食品中霉菌检测方法探究[J].沿海企业与科技,2012(12):6-8.
[2]曹雁平,刘玉德.食品调色技术[M].北京:化学工业出版社,2003:195-201.
[3]罗自生,秦雨,徐艳群.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学,2015,36(3):250-257.
[4]林晓娜.基于智舌的食品中霉菌快速检测体系构建[D].杭州:浙江工商大学,2010.
[5]中华人民共和国卫生部.GB 4789.15-2010,食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2010.
[6]中华人民共和国国家质量监督检验检疫总局.SN/T 2566-2010,食品中霉菌和酵母菌的计数Petrifilm测试片法[S].北京:中国标准出版社,2010.
[7]杨福馨,吴龙奇.食品包装实用新材料新技术[M].北京:化学工业出版社,2009.
[8]WHITE T J, BRUNS T, LEE S, et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]//INNIS M A, GELFAND D H,SNINSKY J J,et al.PCR Protocols:A Guide to Methods and Applications.San Diego: Academic Press, 1990:315-322.
[9]IOOS R,FREY P.Genomic variation within Monilinia laxa,M.fructigena and M.fructicola,and application to species identification by PCR [J].European Journal of Plant Pathology,2000,106(4):373-378.
[10]HUNT J,BODDY L,RANDERSON P F,et al.An evaluation of 18S rDNA approaches for the study of fungal diversity in grassland soils [J].Microb Ecol,2004 ,47(4):385-395.
Establishment of a PCR Assay for Detection of Molds in Dried Meat Products
Aotegenbayaer1,Wulanqiqige1,LU Ji-shuang2,Tenigeer2
(1.Center for Animal Disease Control and Prevention of Etuoke Banner of Inner Mongolia,Etuoke Banne 016100,China;2.College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot 010018,China)
In order to prevent the mildewing of traditional beef jerky in the early stage of retention period, a PCR assay for detection of molds in beef jerky was established,and the specificity and sensibility of the PCR assay were verified.The mouldy fresh beef,yeast,Lactococcus lactis,Lactobacillus and E.coli were used as materials to verify the specificity of the established PCR assay,and a series of different concentration gradients of DNA solutions extracted from mouldy fresh beef were used to identify its sensibility.The results demonstrated that when the DNA extracted from yeast was used as a template,a specific 300 bp amplicon was obtained by the PCR assay;however,no amplicons were obtained using the DNA extracted from other samples as template,which indicated the good specificity of the established PCR assay.The specific bands were observed when the DNA stock solution extracted from mouldy fresh beef samples as well as the 10 times,100 times and 1 000 times diluent of the stock solution were used as template in the PCR assay.The 2 ng/μL of the DNA template was still sensitive to the primers.The PCR assay developed in this study provided a new technique for the rapid detection of molds contamination of saled traditional beefjerky in market.
traditional beef jerky;molds;PCR detection method;specificity;sensibility
TS251.42;TS207.4
A文章顺序编号1672-5190(2016)03-0049-03
2016-02-16
项目来源:蒙古马耐力素质相关基因表达量研究(217-206008)。
敖特根巴雅尔(1974—),男,兽医师,主要从事动物疫病预防控制工作。
乌兰其其格(1974—),女,畜牧师,主要从事家畜品种改良工作。
(责任编辑:钱英红)
