叶黄素对高脂膳食大鼠尿酸代谢及肾脏功能的影响
2016-10-31宋春蕾赵永芳
宋春蕾,王 玲,赵永芳,何 伟
(1.郑州大学公共卫生学院营养与食品卫生教研室,河南郑州 450001;2.河南省人民医院,河南郑州 450003;3.河南省(郑州大学)医药科学研究院营养食品教研室,河南郑州 450052)
叶黄素对高脂膳食大鼠尿酸代谢及肾脏功能的影响
宋春蕾1,王玲1,赵永芳2,何伟3,*
(1.郑州大学公共卫生学院营养与食品卫生教研室,河南郑州 450001;2.河南省人民医院,河南郑州 450003;3.河南省(郑州大学)医药科学研究院营养食品教研室,河南郑州 450052)
目的:探讨叶黄素对高脂膳食大鼠尿酸代谢及肾脏功能的影响。方法:将SD雄鼠随机分为正常对照组和高脂组,分别饲以基础饲料和高脂饲料,4周后,高脂组(HFD)随机分为高脂模型组和叶黄素低、中、高剂量组,以12.5、25.0、50.0 mg/kg·d-1剂量的叶黄素分别对低、中、高剂量组大鼠灌胃4周,测定血尿酸(SUA)、尿素氮(BUN)、肌酐(SCr)水平,同时测定血清和肝组织匀浆中黄嘌呤氧化酶(XOD)和腺苷脱氨酶(ADA)活性,肾脏组织切片经过苏木精-伊红(HE)染色后进行组织病理学观察。结果:叶黄素灌胃4周后,与高脂模型组比较,中、高剂量叶黄素处理组血清SUA水平均显著降低(p<0.05,p<0.01),高剂量组大鼠肝组织匀浆XOD和ADA活性均显著降低(p<0.05),同时各剂量组大鼠血清BUN也显著降低(p<0.05)。组织病理学观察表明,叶黄素各剂量组肾小球病理改变较高脂模型组明显减轻。结论:适宜剂量的叶黄素可降低高脂膳食大鼠血尿酸水平,并对其肾脏有保护作用。
叶黄素,高脂膳食,SD大鼠,尿酸,肾脏
近年来,人们的膳食结构随着生活水平的提高而发生改变,人群中高能量饮食摄入者及脂肪占总能量摄入比例偏高者较为常见,加上膳食纤维摄入量不足以及运动量偏低等因素,导致血脂紊乱者众多,由此引发高血压、动脉粥样硬化性心脑血管疾病、糖尿病等疾病发病率明显增高,而血脂紊乱和高尿酸血症之前常被作为独立的疾病区分对待。目前,多项研究表明血脂紊乱与高尿酸血症存在明显的相关性[1-2]。高尿酸血症不仅是心血管疾病的独立危险因子,还可引起慢性间质性肾炎和肾结石,对肾脏造成损害。
叶黄素又名植物黄体素,广泛存在于深绿色蔬菜、万寿菊及金盏花等植物中。动物实验证实,叶黄素可缓解肝脏氧化应激损害,可能是通过降低组织中的活性氧含量、提高Na+-K+-ATP酶活性、阻断线粒体钙超载等途径实现[3]。因此,近年来对于叶黄素的研究多集中在其对氧化应激的影响,有文献报道叶黄素可通过抗氧化作用减轻顺铂诱导的大鼠急性肾损伤[4],但关于叶黄素对高脂血症模型中尿酸代谢紊乱所致肾功能障碍的研究则鲜有报道。本研究的目的是探讨叶黄素对高脂血症模型血尿酸代谢的影响及对大鼠肾损伤的保护作用,并初步探讨其作用机制。
1 材料与方法
1.1材料与仪器
叶黄素由北京禹光生物科学研究中心有限公司提供,纯度90%;基础饲料河南省实验动物中心;高脂饲料配方:73.5%基础饲料、20%猪油、1%胆固醇、0.5%胆酸钠、5%蛋黄粉;水合氯醛天津市科密欧化学试剂有限公司;羟甲基纤维素钠国药集团化学试剂有限公司;总胆固醇(TC)、甘油三酯(TG)、尿素氮(BUN)、肌酐(SCr)测定试剂盒中生北控生物科技有限公司;尿酸(UA)试剂盒(磷钨酸法)、黄嘌呤氧化酶(XOD)试剂盒、腺苷脱氨酶(ADA)试剂盒南京建成生物工程研究所。
卓越360全自动生化分析仪上海科华生物工程股份有限公司;V-5800PC可见分光光度计上海元析仪器有限公司;5424R台式高速冷冻离心机艾本德中国有限公司;SCIENTZ-2D超声波细胞破碎仪宁波新芝生物科技股份有限公司。
1.2实验方法
1.2.1实验动物及分组处理SPF级4~6周龄SD雄鼠40只,体重(66.91±10.32)g,由河南省动物实验中心提供,实验动物生产许可证:SCXK(豫)2010-0002。喂养期间,饲养室温度(23±2) ℃,相对湿度50%~60%,12 h光照/黑暗交替,动物自由饮水和摄食。适应性喂养7 d后,大鼠按照体重随机分为正常对照组(8只)和高脂组(32只)分别饲以基础饲料(30%玉米,25%豆粕,10%麦麸,10%鱼粉,8.5%标准粉,5%黄豆,5%高粱,2.5%骨粉,2.5%酵母,1%豆油,0.5%盐)和高脂饲料(73.5%基础饲料、20%猪油、1%胆固醇、0.5%胆酸钠、5%蛋黄粉)。第4周末,禁食12 h后断尾采血用于测定血脂,与正常对照组比较,将造模成功大鼠作为高脂组。高脂组大鼠按体重再随机分为4组,每组8只,分别为高脂模型组及叶黄素低、中、高剂量组。其中高脂模型组及叶黄素各剂量组均饲以高脂饲料,正常组仍饲以基础饲料。叶黄素低、中、高剂量组分别以12.5、25.0、50.0 mg/kg·d-1剂量的叶黄素于下午4时定时灌胃,灌胃溶剂为0.4%羟甲基纤维素钠(CMC-Na)溶液,干预期间正常对照组及高脂模型组大鼠以0.4% CMC-Na溶液7 mL/kg·d-1灌胃,共持续4周。
1.2.2称量体重及测定血脂每周称量大鼠体重,饲养4周后,禁食12 h,断尾采血1.5 mL,3000 r/min、4 ℃离心15 min分离血清,测定血清TG、TC,用于判断高脂血症动物造模是否成功。
1.2.3测定叶黄素干预后的血尿酸水平叶黄素灌胃干预4周后,各组大鼠按0.3 mL/100 g体重以10%水合氯醛溶液腹腔注射,麻醉后腹腔静脉采血约5 mL,3000 r/min、4 ℃离心15 min分离出血清,测定UA,测定方法采用试剂盒测定。
1.2.4测定血清尿素氮、肌酐、黄嘌呤氧化酶及腺苷脱氨酶活性叶黄素灌胃第4周末,麻醉后腹腔静脉采血,分离血清测定尿素氮、肌酐、黄嘌呤氧化酶及腺苷脱氨酶。以上所有指标的测定均严格按照试剂盒说明书进行。
1.2.5测定肝组织匀浆黄嘌呤氧化酶及腺苷脱氨酶活性采血后摘取肝脏和肾脏,称取1 g左右肝组织加入9倍体积的预冷生理盐水中,冰水浴条件下用眼科剪剪碎组织。小心移至15 mL离心管中,用超声细胞破碎仪制备成10%的肝组织匀浆,3000 r/min、4 ℃离心15 min,取上清液,移至EP管中,测定黄嘌呤氧化酶及腺苷脱氨酶的活性。
1.2.6观察肾组织切片剪去部分肾脏组织块置于4%多聚甲醛溶液中浸泡固定过夜。次日开始脱水、透明、浸蜡、包埋、切片及苏木精-伊红染色。用光学显微镜对大鼠肾脏组织切片进行观察,每只动物观察3张组织切片,每张切片高倍镜(×100倍)进行观察,各选取10个视野,观察肾脏肾小球及肾小管形态及大小,采用Image-Pro Plus 6.0软件进行图像处理及分析。
1.3统计学处理
2 结果与分析
2.1高脂血症大鼠模型的建立
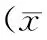
表3 叶黄素对大鼠血清和肝组织匀浆XOD、ADA活性的影响±s)
由表1可知,喂养4周后,高脂组大鼠体重高于正常对照组(p<0.05),血清TC与TG水平均显著高于正常对照组(p<0.01),提示高脂血症大鼠模型建立成功。
2.2叶黄素对大鼠血尿酸水平的影响
由表2可知,叶黄素灌胃干预4周之后,高脂模型组血尿酸水平显著高于正常对照组(p<0.01)。叶黄素中、高剂量组大鼠血尿酸含量均低于高脂模型组(p<0.01,p<0.05)。灌胃期间,由于操作不当,叶黄素中剂量组一只大鼠意外死亡。
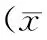
Table 1Body weight and serum levels of TC,

组别n体重(g)TC(mmol/L)TG(mmol/L)正常对照组8306.78±15.451.43±0.130.63±0.11高脂组32322.84±20.60*2.44±0.24**0.92±0.14**
注:与正常对照组相比,*p<0.05,**p<0.01。
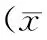
Table 2Effects of lutein on the serum uric acid
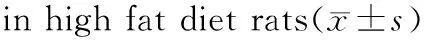
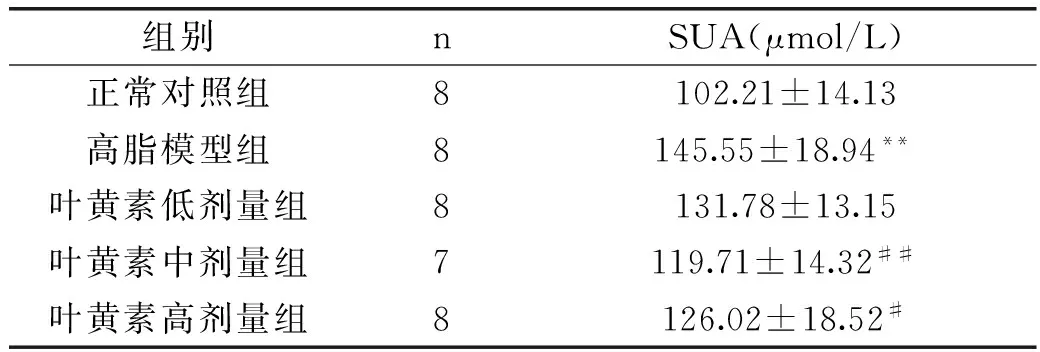
组别nSUA(μmol/L)正常对照组8102.21±14.13高脂模型组8145.55±18.94**叶黄素低剂量组8131.78±13.15叶黄素中剂量组7119.71±14.32##叶黄素高剂量组8126.02±18.52#
注:与正常对照组相比,*p<0.05,**p<0.01。与高脂模型组相比,#p<0.05,##p<0.01,表3、表4同。
2.3叶黄素对大鼠血清和肝组织XOD和ADA活性的影响
高脂模型组血清XOD活性显著高于正常对照组(p<0.01)。与高脂模型组相比,叶黄素高剂量组血清XOD活性降低(p<0.05)。叶黄素各剂量组血清ADA活性低于高脂模型组,但差异无统计学意义(p>0.05)。高脂模型组肝组织XOD活性显著高于正常对照组(p<0.01)。与高脂模型组相比,叶黄素各剂量组肝组织XOD活性均显著降低(p<0.01)。叶黄素低剂量组肝脏XOD的活性高于正常对照组(p<0.05),中剂量组、高剂量组与正常对照组相比无显著差异(p>0.05)。叶黄素各剂量组血清ADA活性低于高脂模型组,但差异无统计学意义(p>0.05),叶黄素高剂量组肝组织ADA活性显著低于高脂模型组(p<0.01)。这些结果提示叶黄素可干预高脂血症大鼠嘌呤的异常代谢。
2.4各组大鼠血清SCr和BUN的测定结果
由表4可知,在SCr水平上,高脂模型组与正常对照组虽无统计学差异(p>0.05),但有升高趋势,高脂模型组血清BUN显著高于正常对照组(p<0.01),表明高脂膳食会降低大鼠的肾脏功能。叶黄素各剂量组血清BUN水平均低于高脂模型组(p<0.05,p<0.01),此结果显示叶黄素能降低高脂血症大鼠尿素氮水平,改善肾功能。
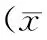
Table 4Effects of lutein on the serum levels of
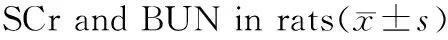
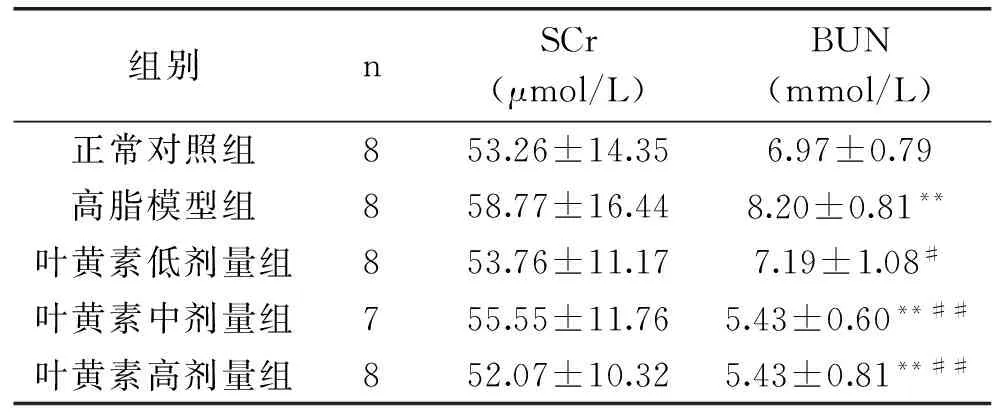
组别nSCr(μmol/L)BUN(mmol/L)正常对照组853.26±14.356.97±0.79高脂模型组858.77±16.448.20±0.81**叶黄素低剂量组853.76±11.177.19±1.08#叶黄素中剂量组755.55±11.765.43±0.60**##叶黄素高剂量组852.07±10.325.43±0.81**##
2.5肾脏组织病理学检查结果
各组大鼠肾脏组织切片苏木精-伊红(hematoxylin-eosin,H-E)染色结果显示:正常对照组肾小球结构清晰,未发现毛细血管球分叶,无系膜区增宽。高脂模型组肾小球体积增大,肾小球毛细血管球呈分叶状,系膜区增宽,基质增多,肾小管细胞肿胀。与高脂模型组相比,叶黄素各剂量组肾小球病理改变得到明显改善(图1)。
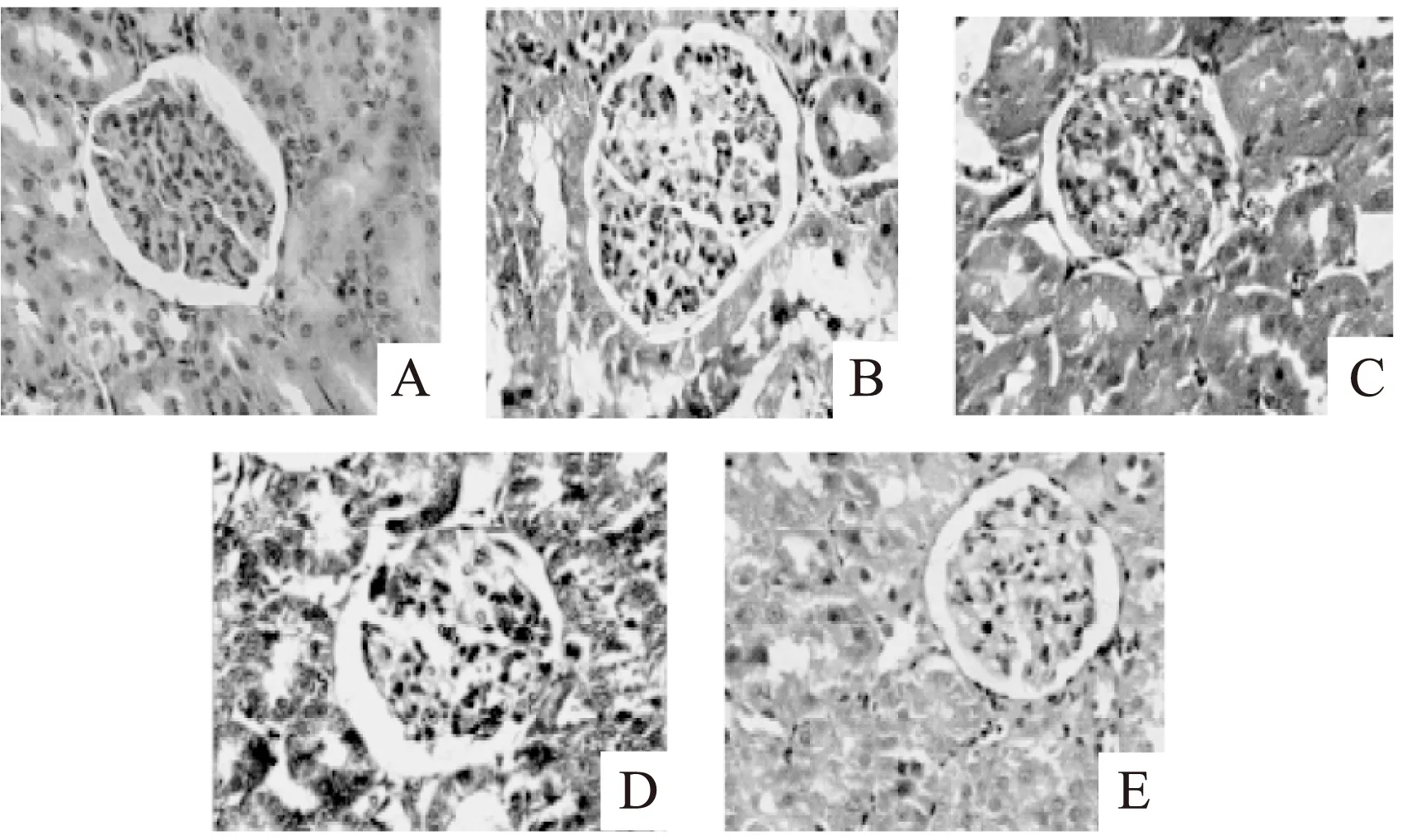
图1 8周时各组大鼠肾脏病理改变(HE×100)Fig.1 The pathological changes of renal tissues in each group at the end of the 8th week(HE×100)注:A:正常对照组;B:高脂模型组;C:叶黄素低剂量组;D:叶黄素中剂量组;E:叶黄素高剂量组。
3 讨论
多项研究表明,高尿酸血症与高脂血症密切相关。动物实验研究发现高脂膳食喂养SD大鼠可导致其血尿酸升高[5]。目前,高脂血症合并高尿酸血症的机制尚不明确,可能由于高脂血症合并高尿酸血症时往往出现胰岛素抵抗,其体内产生的酮体阻碍了尿酸排泄,使血尿酸水平增高[6]。另外,高脂膳食导致能量摄入增加,嘌呤合成增加从而使尿酸产生增加。也有研究报道,高水平的瘦素导致肾功能损伤,瘦素水平与残存肾功能呈负相关[7],肾功能受损时,尿酸排泄受阻,可能是高脂血症常伴有高尿酸血症的原因之一。别嘌醇作为目前我国临床使用治疗高尿酸血症的一线药物,虽然疗效确切,但应用后病人可有发热、过敏性皮疹、腹痛、腹泻,甚至肝功能损害等副作用[8]。因此寻找替代的降尿酸药物或药食同源的食物就显得尤为迫切。在本实验中,叶黄素能明显降低高脂血症大鼠的血尿酸水平,同时叶黄素干预组大鼠肝组织匀浆ADA、XOD的活性也有不同程度降低。ADA和XOD是尿酸代谢的关键酶,直接调控体内尿酸水平的变化。由此可推测叶黄素降低高脂血症大鼠血尿酸水平,可能与其影响ADA及XOD的活性有关,尤其是影响XOD的活性。
BUN是反映肾功能的重要指标,当肾脏发生病变时,BUN排泄受阻,其在血液中含量升高可作为判断肾功能是否损伤的指标。本研究发现,高脂饲料喂养组大鼠BUN显著升高,提示可能出现肾脏功能受损。肾脏组织学的观察结果显示,高脂组大鼠肾脏组织中肾单位形态结构发生明显改变,其可能是肾脏功能改变的形态学基础。早在1982年,Moorhead便提出“脂质肾毒性”作用,认为高脂血症可引发肾损伤。有研究发现长期的高脂血症可以通过内质网应激CHOP通路的激活而引起肾脏的损伤[9]。持续的内质网应激会引起细胞的凋亡[10],肾实质细胞凋亡在高脂血症引起的肾脏损伤中起着重要的作用[11]。本实验中,高脂饲料组大鼠BUN升高的同时,血SUA水平也显著高于其它各组。一项meta分析认为,高尿酸为肾脏疾病发生发展和肾功能恶化的独立危险因素[12]。高尿酸血症可以通过激活肾素-血管紧张素(RAAS)系统来损伤肾脏,RAAS系统过度激活时血管紧张素Ⅱ、醛固酮在机体内大量聚集,导致血管收缩、血管平滑肌增生、肾小管间质纤维化,从而引发肾功能不全[13],而随着肾脏损伤加重,尿酸排谢能力进一步减退,进入恶性循环。同时,尿酸会激活炎症反应,促进炎症细胞释放白介素6(IL-6),IL-6与肾脏系膜细胞表面IL-6受体结合,通过刺激系膜细胞增生,细胞外基质沉积,炎症细胞浸润,最终导致肾小球硬化[14],进一步阻碍了BUN的排泄。在本实验中,经过叶黄素干预后,各剂量组大鼠血清BUN水平均有所下降,肾小球病理改变较高脂模型组明显减轻,提示叶黄素对高脂膳食引起的肾脏损伤有一定的保护作用,这一结果与章清[15]报道相似。
4 结论
适宜剂量的叶黄素干预能降低高脂饲料喂养的大鼠血尿酸水平,并对其肾脏有保护作用。通过本
研究,为将叶黄素开发为新的具有降尿酸作用的保健食品提供了实验依据。
[1]余家会,张蓓古,丽尼扎·哈力阿克帕尔,等. 高尿酸血症与脂代谢紊乱的关系及其民族异质性分析[J]. 国际检验医学杂志,2015,36(2):145-147.
[2]徐宜清. 妊娠早期高尿酸血症的临床意义分析[J]. 检验医学,2012,27(7):606-608.
[3]麦嘉仪,沈新南,施冬云,等. 叶黄素对D-半乳糖致氧化损伤小鼠HO-1、TLR4表达的影响[J]. 卫生研究,2010,39(4):430-432.
[4]张慧珠,刘淑梅,张博男,等. 叶黄素预处理对顺铂所致大鼠急性肾毒性的防治作用[J]. 毒理学杂志,2011,25(4):278-281.
[5]Skak-Nielsen H,Torp-Pedersen C,Finer N,et al. Uric acid as a risk factor for cardiovascular disease and mortality in overweight/obese individuals[J]. PloS one,2013,8(3):e59121.
[6]Gill A,Kukreja S,Malhotra N,et al. Correlation of the serum insulin and the serum uric Acid levels with the glycated haemoglobin levels in the patients of type 2 diabetes mellitus. Journal of clinical and diagnostic research[J]. Journal of Clinical and Diagnostic Research,2013,7(7):1295-1297.
[7]Ficek R,Kokot F,Chudek J,et al. Plasma leptin concentration in patients with acute renal failure[J]. Clinical nephrology,2004,62(2):84-91.
[8]王春辉,李松. 黄嘌呤氧化酶抑制剂的研究进展[J]. 国外医学药学分册,2006,33(5):351-353,357.
[9]常晓东,甘华,杜晓刚,等. 内质网应激在高脂血症引起肾脏损害中的作用[J]. 西安交通大学学报:医学版,2010,31(1):79-83.
[10]Yoshida H. ER stress and diseases[J]. The FEBS journal,2007,274(3):630-658.
[11]刘红燕,贾汝汉,丁国华,等. 细胞凋亡在脂质肾损害中的作用[J]. 中国中西医结合肾病杂志,2001,2(4):196-199.
[12]Li YL,Wang L,Li J,et al. The correlation between uric acid and the incidence and prognosis of kidney diseases:a systematic review and meta-analysis of cohort studies[J]. Zhonghua Nei Ke Za Zhi,2011,50(7):555-561.
[13]Weiner DE,Tighiouart H,Elsayed EF,et al. Uric acid and incident kidney disease in the community[J]. Journal of the American Society of Nephrology,2008,19(6):1204-1211.
[14]Tamouza H,Chemouny JM,Raskova Kafkova L,et al. The IgA1 immune complex-mediated activation of the MAPK/ERK kinase pathway in mesangial cells is associated with glomerular damage in IgA nephropathy[J]. Kidney international,2012,82(12):1284-1296.
[15]章清,沈新南,姚国英,等. 叶黄素对糖尿病大鼠肾损伤的缓解作用[J]. 营养学报,2008,30(4):388-391.
Effects of lutein on serum uric acid and renal function in high-fat-diet induced hyperlipidemia rats
SONG Chun-lei1,WANG Ling1,ZHAO Yong-fang2,HE Wei3,*
(1.Department of Nutrition and Food Hygiene,College of Public Health,Zhengzhou University,Zhengzhou 450001,China; 2.People’s Hospital of Henan Province,Zhengzhou 450003,China; 3.Nutrition Food Laboratory,Henan Academy of Medical and Pharmaceutical Sciences, Zhengzhou University,Zhengzhou 450052,China)
The aim of this study was to investigate the effects of lutein on serum uric acid and renal function in rats administered by high-fat diet. Methods:The male Sprague-Dawley(SD)rats were randomly divided into control group and high fat diet group,fed with lab chow diet and high fat diet respectively for four weeks. Then,the hyperlipidemia rats in high fat diet group were divided into four groups randomly:hyperlipidemia model group,low dose,medium dose and high dose lutein groups respectively. The rats in lutein groups were given the doses of 12.5,25.0,50.0 mg/kg·d-1lutein by gavage for four weeks. Then the levels of serum uric acid(SUA),serum creatinine(SCr)and blood urea nitrogen(BUN),the activities of xanthine oxidase(XOD)and adenosine deaminase(ADA)both in serum and liver were measured. The histological changes of kidney were checked under light microscope after hematoxylin-eosin staining. Results:After four weeks of gavage,compared with hyperlipidemia model group,the levels of SUA in medium and high dose lutein groups were decreased(p<0.05,p<0.01),the activities of liver XOD and ADA were significantly decreased in high dose lutein group,the serum level of BUN in each dose group was significantly decreased(p<0.05). Conclusion:Lutein may ameliorate hyperuricemia as well as renal dysfunction at a appropriate dosage level in high-fat-diet induced hyperuricemic rats.
lutein;high fat diet;SD rats;uric acid;kidney
2016-03-03
宋春蕾(1990-),女,硕士研究生,研究方向:营养与疾病,E-mail:13676932983@163.com。
何伟(1963-),男,博士,研究员,研究方向:营养与疾病,E-mail:weibho@163.com。
TS201.4
A
1002-0306(2016)17-0344-04
10.13386/j.issn1002-0306.2016.17.059
