鼠李糖乳杆菌对互隔交链孢的抑制作用研究
2016-10-31马欢欢吕欣然缪璐欢杜静芳白凤翎葛永红励建荣
马欢欢,吕欣然,缪璐欢,杜静芳,白凤翎,葛永红,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
鼠李糖乳杆菌对互隔交链孢的抑制作用研究
马欢欢,吕欣然,缪璐欢,杜静芳,白凤翎*,葛永红,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
目的:筛选对互隔交链孢具有良好拮抗作用的乳酸菌菌株。方法:采用菌饼法筛选乳酸菌优良菌株。采用酸性实验和热处理实验分析拮抗特性,利用气相测定乳酸菌无细胞上清液(CFS)中有机酸的含量,扫描电镜分析细胞结构完整性。结果:从4株乳酸菌中筛选出1株对互隔交链孢具有较强抑制作用的鼠李糖乳杆菌RH-11,抑菌率为93.41%。在pH3.0~7.0时具有抑菌活性,抑菌物质对热不稳定。经气相色谱分析RH-11 CFS中乳酸、乙酸和苯乳酸含量分别为109.225 μg/mL、7.334 μg/mL和3.712 μg/mL,对互隔交链孢抑制作用的贡献率分别为68.90%、20.03%和11.07%。扫描电镜结果表明RH-11 CFS处理互隔交链孢孢子的细胞膜完整性被破坏。结论:鼠李糖乳杆菌RH-11抑制互隔交链孢的物质主要为乳酸、乙酸和苯乳酸,抑制作用是破坏了孢子的完整性。
鼠李糖乳杆菌,互隔交链孢,抑制作用,有机酸
互隔交链孢(Alternariaalternate)广泛存在于土壤、谷物、水果和蔬菜等自然环境中,污染水果蔬菜后可产生互隔交链孢酚、细交链孢菌酮酸和互隔交链孢酚单甲醚等毒素,引起苹果、柑橘和杏等水果的黑斑病和软腐病[1-2]。针对互隔交链孢引起的采后果蔬病害,利用化学杀菌剂可有效控制这种真菌的侵染,但由于药物残留、产生抗药性和污染环境等问题,应用受到限制。与化学杀菌剂相比,生物防腐剂具有无残留、无毒副作用、无损环保等优势。应用生物制剂控制互隔交链孢引起的果蔬采后病害研究倍受青睐,Gupta等[3]利用海南蒲桃果实的醇提取物对互隔交链孢菌丝生长和孢子萌发的影响,结果表明,当浓度7.5 mg/mL醇提物处理时,菌丝生长完全被抑制,其抑制孢子萌发的小抑菌浓度为0.039 mg/mL。
乳酸菌是公认的GRAS级生物防腐剂,通过营养物和生态位竞争、产生各种拮抗性代谢产物和酸性物质等方式抑制细菌和真菌的生长繁殖[4-6]。乳酸菌抑制植物源性真菌的大部分研究主要针对饲料和食品中的青霉和曲霉,Vijayakumar等[7]从意大利黑麦草饲料中分离植物乳杆菌(LactobacillusplantarumKCC-24),对烟曲霉、青霉、灰霉菌和尖孢镰刀菌的抑菌率分别为73.43%、59.04%、40.23%和52.47%。Lan等[8]从发酵冬瓜中分离出85株乳酸菌,其中食窦魏斯氏菌(Weissellacibaria861006)在6 d内能够有效抑制青霉的生长。Cortés等[9]研究发现干酪乳杆菌(Lb.casei),鼠李糖乳杆菌(Lb.rhamnosus)和嗜酸乳杆菌(Lb.acidophilus)等乳酸菌对黄曲霉、炭疽、扩展青霉和灰霉菌4种真菌具有显著的抑菌效果,分析表明抑菌成分主要是3-苯乳酸。
目前尚无乳酸菌对互隔交链孢抑制作用的研究报道。本文以植物乳杆菌、鼠李糖乳杆菌、瑞士乳杆菌和米酒乳杆菌为供试菌,以自霉变香瓜分离的互隔交链孢为目标菌,采用菌饼法筛选出抑菌效果好的乳酸菌菌株,并分析其主要抑菌活性物质及生理特性和对霉菌孢子的影响。探究应用乳酸菌控制互隔交链孢引起水果黑斑病和软腐病的可能性,为研发高效无毒、无残留、无损的拮抗果蔬腐败性真菌的乳酸菌生物防腐剂奠定基础。
1 材料和方法
1.1材料与仪器
乳酸菌菌株植物乳杆菌(Lb.plantarumC10)、鼠李糖乳杆菌(Lb.rhamnosusRH-11)、瑞士乳杆菌(Lb.helveticusLH-9)、米酒乳杆菌(Lb.sakeDL-11)由本实验室保藏;互隔交链孢(AlternariaalternateBd-12)自腐烂的香瓜果实分离。
MRS培养基、PDA培养基北京奥博星生物技术有限责任公司;脱脂乳碧迪医疗器械(上海)有限公司;胃蛋白酶、中性蛋白酶、木瓜蛋白酶华蓝化学有限公司;戊二醛、苯乳酸、乳酸、乙酸、丙酸等标品sigma公司。
MJ-250霉菌培养箱上海苏达实验仪器有限公司;DL-CJ-2N超级洁净工作台北京市东联哈尔仪器制造有限公司;SPX-250智能生化培养箱宁波海曙赛福实验仪器厂;5804R冷冻高速离心机德国Eppendorf公司;GI54DS高压灭菌锅致微仪器有限公司;ZD-85气浴恒温振荡器金坛市科析仪器有限公司;IKA Vortex GENIUS3振荡器德国IKA公司;安捷伦6890N气相色谱仪安捷伦公司;岛津GC2010气相色谱仪日本岛津公司;E-1045镀金仪、S-4800扫描电镜日本日立公司。
1.2实验方法
1.2.1乳酸菌无细胞上清液(cell-free supernatant,CFS)的制备将保藏于-80 ℃的乳酸菌菌株分别接种10%脱脂乳37 ℃活化后,在MRS 平板上连续培养3代至正常代谢水平。挑取活化后乳酸菌单菌落接种MRS液体培养基中,37 ℃培养24 h后,菌悬液经6000×g 4 ℃离心10 min,上清液经0.45 μm膜过滤获得乳酸菌CFS,4 ℃冰箱保存。
1.2.3乳酸菌对互隔交链孢的抑制作用将乳酸菌CFS和45 ℃的PDA培养基按1∶9比例混匀后倒入灭菌平皿。待冷却后,用Φ7 mm打孔器取培养7 d的互隔交链孢菌落边缘制成的菌饼,在PDA培养基中央点种。以MRS液体培养基作对照,28 ℃避光培养7 d。每天观察菌丝生长,当对照组平板中菌丝长满平板表面时,应用游标卡尺交叉测量实验组菌落生长直径(mm),并按下式计算乳酸菌CFS对互隔交链孢的抑制率。
抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-原菌饼直径)×100
1.2.4影响乳酸菌CFS抑制互隔交链孢因素pH实验:用1.0 mol/L NaOH和1.0 mol/L HCl将乳酸菌CFS分别调至pH3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5和7.0,同时以CFS作为对照,按1.2.3方法进行实验。
热处理实验:取乳酸菌CFS分别经50 ℃处理30 min,100 ℃处理30 min,121 ℃处理15 min,同时以乳酸菌CFS作为对照,按1.2.3方法进行实验。
1.2.5有机酸的测定乙酸、乳酸和丙酸:参照Yuan等[11]方法并稍作修改,应用安捷伦6890N气相色谱仪,色谱条件:色谱柱为CNW CD-ACIDWAX毛细管柱(30 m×0.25 mm×25 μm);升温程序:初温110 ℃,以10 ℃/min升至150 ℃,保持5 min,再以10 ℃/min升至230 ℃,保持15 min;进样口温度为280 ℃;FID检测器温度为;H2流速30 mL/min;N2流速30 mL/min;空气流速300 mL/min;分流比为15∶1;进样量为1 μL。采用直接进样方式,在线性范围内,用外标法峰面积进行定量。
苯乳酸:Zhang等[12]方法并稍作修改,移取标样及待测样品至具塞玻璃管中,加入吡啶摇动使其溶解后,加入BSTFA硅烷化试剂,在100 ℃静置30 min,待测GC;采用岛津GC2010气相色谱仪。色谱条件:色谱柱:Rtx-5石英毛细柱(30 m×0.25 mm×25 μm);升温程序:初温180 ℃,保持20 min,以20 ℃/min升至280 ℃,保持10 min;进样口温度为280 ℃;FID检测器温度为300 ℃;H2流速30 mL/min;N2流速30 mL/min;空气流速300 mL/min;分流比为20∶1;进样量1 μL。在线性范围内,用外标法峰面积进行定量。

表1 乳酸菌CFS对互隔交链孢的抑菌率
注:表中数据为平均值±标准差;a、b、c和d表示不同菌株间在0.05水平存在显著性差异。
1.2.6有机酸抑菌活性分析根据1.2.5测定的结果,应用与乳酸菌CFS中相同浓度的丙酸、乳酸、乙酸、苯乳酸和四种混合酸分别按1.2.3方法进行抑制作用实验,测定抑制率。同时,以乳酸菌CFS作为对照。
1.2.7扫描电镜观察乳酸菌CFS对互隔交链孢孢子作用参照Akocak方法[13]并修改,取1.0 mL 1.0×105孢子/mL互隔交链孢的孢子悬液加入1.5 mL EP管中,4 ℃ 12000×g离心10 min后,去上清液。在EP管中加入1.0 mL的乳酸菌CFS,对照组添加1.0 mL无菌水,置于25 ℃培养7 d。4 ℃ 12000×g离心10 min,收集孢子,孢子用0.1 mol/L PBS(pH7.2)洗涤3次,后加入1.0 mL 2.5%戊二醛4 ℃固定13 h。再用pH5.6的PBS冲洗2次,每次5 min。洗涤后孢子用0.5 mL无菌去离子水悬浮,用胶头滴管吸取1滴于洁净盖玻片上,置于空气中干燥,真空喷金并镜检。
1.2.8实验数据处理所有实验均重复测定3次,数据采用平均值±标准差表示。采用SPSS 18.0软件对实验数据进行统计和显著性分析,采用Origin 8.0软件进行绘图。
2 结果与讨论
2.1乳酸菌对互隔交链孢的拮抗作用
表1是4株乳酸菌CFS对互隔交链孢抑菌结果,从中可以看出,菌株RH-11抑菌率为93.41%,作用最强;LH-9次之,抑菌率为88.35%;菌株C10和DL-11相对较弱,抑菌率分别为77.65%和60. 27%。图1是菌株RH-11 CFS对互隔交链孢的拮抗效果,图中实验组互隔交链孢生长在很小的范围内,而对照组互隔交链孢铺满平板,表明菌株RH-11的CFS对互隔交链孢生长有较强的拮抗作用。因此,选取抑菌活性较好的菌株RH-11进行下面的实验。

图1 鼠李糖乳杆菌RH-11对互隔交链孢的拮抗效果Fig.1 Antagonistic effects of Lb. rhamnosus RH-11 against A. alternate
2.2乳酸菌CFS抑制互隔交链孢作用的影响因素
2.2.1pH实验pH是影响乳酸菌CFS抑菌活性的主要因素之一,一般乳酸菌在酸性条件下,对真菌的抑制作用较强,随着pH的上升,当达到弱碱性时,其抑菌作用逐渐丧失[14]。图2是菌株RH-11 CFS在不同pH条件下对互隔交链孢抑制结果,从中可以看出,在pH 3.0时,菌株RH-11 CFS 的抑菌率最大为96.12%,随着pH的升高,抑菌率逐渐降低,pH 7.0时,抑菌率为25.64%。结果表明,乳酸菌的抑菌活性成分在酸性条件对互隔交链孢具有较强的抑制作用。Li等[15]研究发现干酪乳杆菌(Lb.caseiAST18)抑菌活性物质在低于pH4.0时对青霉具有较强的抑菌作用,随着pH逐渐升高,抑菌活性呈下降的趋势,当pH7.0时,抑菌率为11.87%,本文与文献[15]的研究结果相似。

图2 pH对鼠李糖乳杆菌RH-11 CFS抑菌活性的影响Fig.2 Effect of pH on the antifungal activity of CFS of Lb. rhamnosus RH-11
2.2.2热稳定性实验温度也是影响菌株RH-11 CFS对互隔交链孢抑菌率的因素。图3是菌株RH-11 CFS经热处理后对互隔交链孢抑菌率变化结果,从中可以看出,随温度的升高,抑菌率呈下降趋势,对照组CFS抑菌率最高为93.41%,在50 ℃时,抑菌率较大为76.24%低于对照组,到121 ℃时抑菌率降低至38.47%。结果表明,乳酸菌的抑菌活性物质不具有良好的热稳定性。Li等[15]研究发现干酪乳杆菌(Lb.caseiAST18)CFS中抑制青霉的活性物质对热敏感,经高效液相色谱分析得出,抑菌物质主要为乳酸、乙酸和环肽,与本文结果相似。
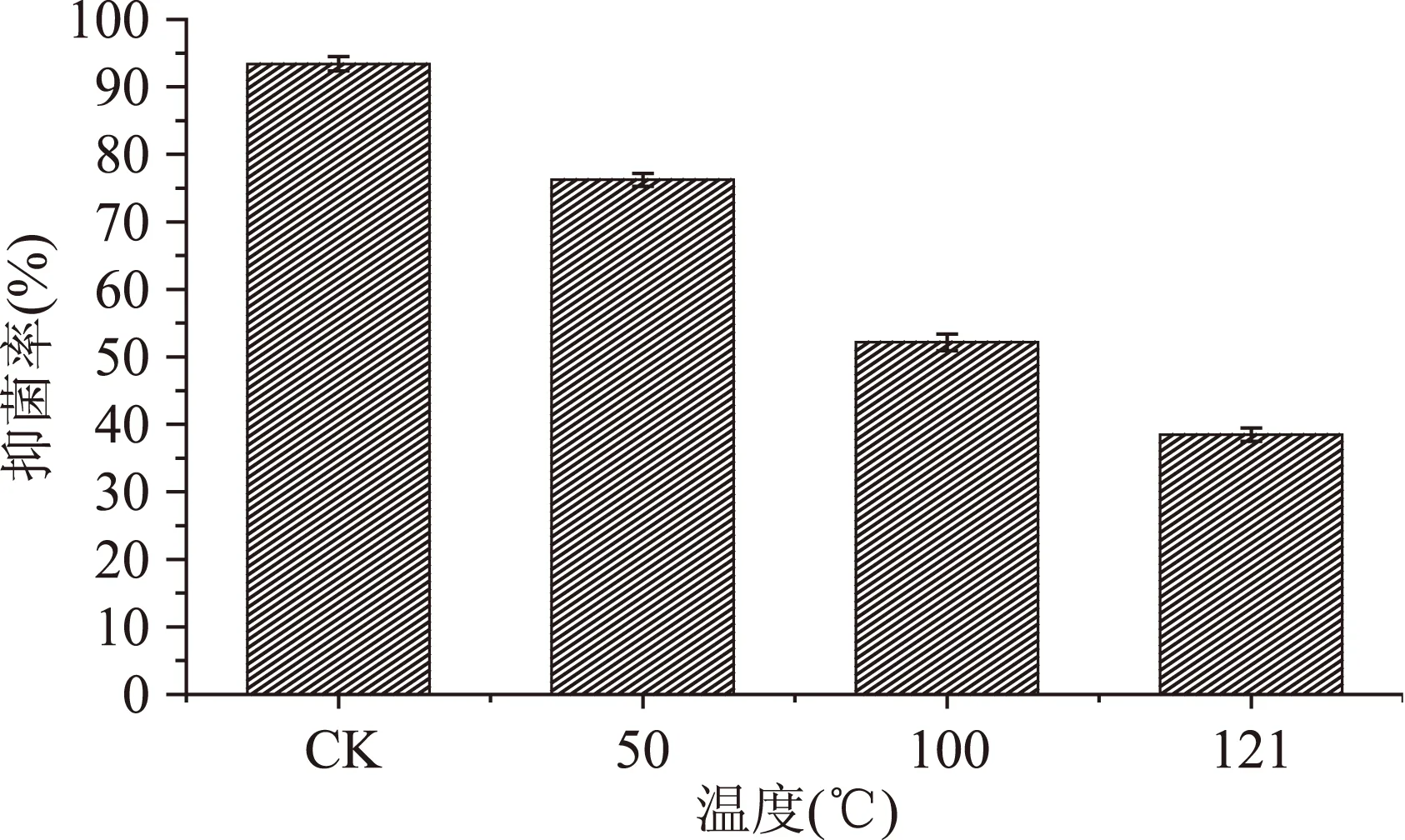
图3 热处理鼠李糖乳杆菌RH-11CFS抑菌活性的影响Fig.3 Effect of heat treatment on the antifungal activity of CFS of Lb. rhamnosus RH-11
2.3有机酸测定
表2是RH-11 CFS中乙酸、乳酸、丙酸和苯乳酸含量及其对互隔交链孢的抑菌结果。从中可以看出,菌株RH-11 CFS中乳酸含量最高为109.225 μg/mL,其次是乙酸折菌率为7.334 μg/mL,苯乳酸含量较低为3.712 μg/mL,丙酸未检出。三种有机酸对互隔交链孢均具有抑制作用,乳酸抑菌率较高为71.38%,贡献率为68.90%;其次是乙酸为20.79%,贡献率20.03%;苯乳酸折菌率为11.65%,贡献率为11.07%。不同有机酸在RH-11 CFS中含量不同,因此抑菌率和贡献率也不同。按照RH-11 CFS中有机酸含量不同进行复配的酸对互隔交链孢抑菌率高于对照组为100%,由于混合酸的pH 1.88明显低于菌株RH-11 CFS pH 3.87,可能是有机酸在CFS中与其它物质存在拮抗作用降低了抑菌活性[15]。通过以上实验表明,乳酸菌RH-11对互隔交链孢具有抑制作用的主要是酸性物质。

表2 鼠李糖乳杆菌RH-11CFS有机酸及抑菌率分析结果
Corsetti等[16]研究表明,旧金山乳杆菌(Lb.sanfranciscoCB1)对镰刀菌、青霉和念珠菌具有较强的抑制作用,其抑菌活性物质主要为己酸、丙酸、丁酸和戊酸以协同的方式抑制霉菌的生长。Prema等[17]从青贮牧草中分离一株具有广谱性的植物乳杆菌(Lb.plantarum),通过核磁共振等方法对抑菌物质进行结构分析得出,抑菌物质为3-苯乳酸。Gerez等[18]筛选出4株对曲霉,镰刀菌和青霉具有较强抑制作用的菌株植物乳杆菌(Lb.plantarumCRL 778)、罗伊氏乳杆菌(Lb.reuteriCRL 1100)、短乳杆菌(Lb.brevisCRL 772)和Lb.brevisCRL 796,分析表明抑菌物质主要为乙酸和苯乳酸。
2.4扫描电镜观察乳酸菌CFS对互隔交链孢孢子的影响
图4是互隔交链孢的孢子经菌株RH-11 CFS处理7 d后用扫描电镜观察的结果,从中可以看出,经菌株RH-11 CFS处理的孢子结构完整性被破坏,表面褶皱模糊不清,四周泛有白光,且孢子一端破裂有内容物流出,可能是CFS中有机酸H+与孢子细胞膜上脂肪酸存在化学间相互作用导致磷脂膜发生改变,降低膜的流动性,从而导致磷脂双分子层损坏细胞崩塌,进一步使细胞内部混合物泄露[19-20],对照组互隔交链孢孢子形态完整,一端呈杆状且表面光滑无白光,另一端则为不规则的多态形,表面有许多明显褶皱。结果表明,菌株RH-11 CFS对互隔交链孢孢子具有损坏作用。Da等[19]应用2.5 mmol/L的水杨酸处理扩展青霉孢子5 min,发现实验组60%的孢子出现荧光性,部分细胞膜被损坏出现蛋白质泄露,对照组不具有荧光性,孢子细胞膜完整无损无泄露,与本文结果相似。

图4 鼠李糖乳杆菌RH-11对互隔交链孢孢子的影响Fig.4 Effect of Lb. rhamnosus RH-11 CFS on the spores of A. alternate
3 结论
本文从4株乳酸菌中筛选到1株对互隔交链孢具有较强抑菌作用的鼠李糖乳杆菌RH-11,其抑菌率到达93.41%。菌株RH-11 CFS在pH3.0时抑菌率最大,为96.12%。在pH3.0~7.0均具有抑菌活性,经121 ℃处理15 min后抑菌率降低至38.47%,表明抑菌活性物质不具有良好的热稳定性。有机酸分析表明菌株RH-11 CFS中乳酸含量最高,其次是乙酸和苯乳酸。乳酸抑菌率较高为71.38%,贡献率占68.90%,其次乙酸和苯乳酸也具有一定的抑制作用。按照菌株RH-11 CFS中测得有机酸的含量进行复配的混合酸对互隔交链孢抑菌率高于对照组,为100%,表明乳酸菌RH-11对互隔交链孢具有抑菌作用的主要是酸性物质。扫描电镜结果表明菌株RH-11 CFS可破坏互隔交链孢孢子细胞的完整性,使其内容物泄漏,从而抑制其生长和繁殖。通过实验研究表明乳酸菌对互隔交链孢具有抑制作用,抑菌物质主要为酸性代谢产物,因此,乳酸菌可作为控制水果中互隔交链孢导致的黑斑病和软腐病的生物防腐剂的重要资源。
[1]崔娜,黄思良,岑贞陆,等. 杀菌剂对细交链孢菌的室内抑菌效果[J]. 南方农业学报,2006,37(4):394-396.
[2]刘康栋,马艳英,赵继敏,等. 互隔交链孢霉素对NIH/3T3细胞毒性的作用[J]. 毒理学杂志,2008,22(6):409-412.
[3]Gupta M,Bhadauria S S R. Fungitoxic activity of fruit extracts of Syzygium cumini(L.)skeels against plant pathogenic fungiAlternariaalternateandFusariumoxysporum[J]. Archives of Phytopathology and Plant Protection,2014,48(11):354-364.
[5]Li D,Ni K,Pang H,et al. Identification and antimicrobial activity detection of lactic acid bacteria isolated from corn Stover silage[J]. Asian Australasian Journal of Animal Sciences,2015,28(5):620-631.
[6]Kim J Y,Young J A,Gunther N W,et al. Inhibition of salmonella by bacteriocin producing lactic acid bacteria derived from U.S. Kimchi and Broiler chicken[J]. Journal of Food Safety,2015,35(1):1-12.
[7]Vijayakumar M,Ilavenil S,Kim D H,et al. In-vitro assessment of the probiotic potential ofLactobacillusplantarumKCC-24 isolated from Italian rye-grass(Loliummultiflorum)forage[J]. Anaerobe,2015,32:90-97.
[8]Lan W T,Chen Y S,Wu H C,et al. Bio-protective potential of lactic acid bacteria isolated from fermented wax gourd[J]. Folia Microbiologica,2012,57(2):99-105.
[9]Cortés Z O,López M A,Hernández M A,et al. Antifungal activity of Lactobacilli and its relationship with 3-phenyllactic acid production[J]. International Journal of Food Microbiology,2014,173(3):30-35.
[11]Yuan K,Kong H,Guan Y,et al. A GC-based metabonomics investigation of type 2 diabetes by organic acids metabolic profile[J]. Journal of Chromatography B,2007,850(1):236-240.
[12]Zhang K. GC-MS determination of flavonoids and phenolic and benzoic acids in human plasma after consumption of cranberry juice[J]. Journal of Agricultural and Food Chemistry,2004,52(2):222-227.
[13]Akocak P B,Churey J J,Worobo R W. Antagonistic effect of chitinolyticPseudomonasandBacilluson growth of fungal hyphae and spores of aflatoxigenicAspergillusflavus[J]. Food Bioscience,2015,10:48-58.
[14]李院,蔻莉萍,王静,等. 抑制青霉菌乳酸菌的分离,鉴定及抑菌物质初步分析[J]. 食品科学,2015,36(21):150-155.
[15]Hong-Juan L I,Liu L,Zhang S W,et al. The antifungal properties ofLactobacilluscaseiAST18 and its application as adjunct culture in Yogurt[J]. Scientia Agricultura Sinica,2011,44(19):4050-4057.
[16]Corsetti A,Gobbetti M,Rossi J,et al. Antimould activity of sourdough lactic acid bacteria:identification of a mixture of organic acids produced byLactobacillussanfranciscoCB1[J]. Applied Microbiology and Biotechnology,1998,50(2):253-256.
[17]Prema P,Smila D,Palavesam A,et al. Production and characterization of an antifungal compound(3-phenyllactic acid)produced byLactobacillusplantarumstrain[J]. Food and Bioprocess Technology,2008,3(3):379-386.
[18]Gerez C L,Torino M I,Rollán G,et al. Prevention of bread mould spoilage by using lactic acid bacteria with antifungal properties[J]. Food Control,2009,20(2):144-148.
[19]Da R N A,Maraschin M,Di P R. Antifungal activity of salicylic acid againstPenicilliumexpansumand its possible mechanisms of action[J]. International Journal of Food Microbiology,2015,215:64-70.
[20]Chen A,Zeng G,Chen G,et al. Plasma membrane behavior,oxidative damage,and defense mechanism in Phanerochaete chrysosporium under cadmium stress[J]. Process Biochemistry,2014,49(4):589-598.
Effects of the inhibitory activity ofLactobacillusrhamnosusagainstAlternariaalternate
MA Huan-huan,LV Xin-ran,MIAO Lu-huan,DU Jing-fang,BAI Feng-ling*,GE Yong-hong,LI Jian-rong
(College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province; National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou 121013,China)
Objective:To isolate lactic acid bacteria(LAB)with outstanding inhibitory activity againstAlternariaalternate. Methods:LAB with inhibitory activity againstA.alternatewas screened using the bacteria-cake method. The antibacterial substance was analyzed by acid test,heat-treated test,the contents of organic acids were analyzed by the gas chromatography. The integrity of cellular structure was observed by scanning electron microscope. Results:The inhibitory rate ofLactobacillusrhamnosusRH-11 toA.alternatewas 93.41%. The inhibitory substance was instability after thermal treatment and effective within pH 3.0~7.0. The contents of lactic acid,acetic acid and phenyl lactic acid in CFS of strain RH-11 were 109.225 μg/mL,7.334 μg/mL and 3.712 μg/mL using gas chromatography analysis,and the contribution rate of antagonistic activity toA.alternatewere 68.90%,20.03% and 11.07%,respectively. The scanning electron microscope images revealed that the cell membrane of the spores ofA.alternatewas damaged by CFS treatment. Conclusion:Lactic acid,acetic acid and phenyl lactic acid were the main inhibitory substances,which can damage the integrity of cell.
Lactobacillusrhamnosus;Alternariaalternate;inhibition;organic acids
2016-03-18
马欢欢(1991-),女,硕士研究生,研究方向:食品安全与质量控制,E-mail:mahuanhuan14@163.com。
白凤翎(1964-)男,博士,教授,研究方向:食品安全与质量控制和食品微生物学,E-mail:baifling@163.com。
“十二五”国家科技支撑计划课题(2015BAD17B05)。
TS201.3
A
1002-0306(2016)17-0180-05
10.13386/j.issn1002-0306.2016.17.027
