500 mg氟维司群治疗既往接受芳香化酶抑制剂治疗的复发转移性乳腺癌患者的回顾性研究
2016-10-27赵燕南龚成成胡夕春王中华王磊苹陶中华王碧芸
赵燕南,龚成成,胡夕春,王中华,张 剑,王磊苹,曹 君,陶中华,王碧芸
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
500 mg氟维司群治疗既往接受芳香化酶抑制剂治疗的复发转移性乳腺癌患者的回顾性研究
赵燕南,龚成成,胡夕春,王中华,张剑,王磊苹,曹君,陶中华,王碧芸
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:第三代芳香化酶抑制剂(aromatase inhibitors,AI)是绝经后激素受体阳性患者内分泌治疗的常规用药。在既往AI治疗后进展的患者中,500 mg氟维司群存在一定获益。该研究旨在探索500 mg氟维司群在既往接受AI治疗的复发转移性乳腺癌患者中临床实际应用时的疗效及安全性。方法:收集2011年7月—2015年12月复旦大学附属肿瘤医院收治的188例经500 mg氟维司群治疗的既往接受AI治疗的激素受体阳性的复发转移性乳腺癌患者的临床资料。主要观察疗效指标为无进展生存时间(progression-free survival,PFS),次要观察疗效指标包括客观缓解率(objective response rate,ORR)、临床获益率(clinical beneft rate,CBR)以及安全性。结果:中位随访 11.3 个月,患者的中位PFS为5.9个月(95%CI:4.2~7.5);CBR为40.0%,ORR为3.4%。COX多因素分析提示,患者的PFS与转移部位数目(HR=1.92, 95%CI:1.2~2.9,P=0.002)以及既往是否接受转移后化疗(HR=1.52,95%CI:1.0~2.1,P=0.022)有关。6例患者因不良事件停用氟维司群治疗。结论:500 mg氟维司群治疗既往接受AI治疗的复发转移乳腺癌患者的疗效和安全性肯定。
氟维司群;转移性乳腺癌;雌激素阳性;芳香化酶抑制剂
乳腺癌是中国女性发病率最高的恶性肿瘤[1]。随着乳腺癌分子分型的应用以及精准化医疗的推广,内分泌治疗在激素受体阳性的乳腺癌患者的辅助及转移后治疗中已经成为常规的治疗方法[2]。第三代芳香化酶抑制剂(aromatase inhibitors,AI)在绝经后与绝经前高危患者的辅助治疗以及进展缓慢的转移后患者的治疗中已经取代三苯氧胺,成为内分泌治疗的首选用药[2-3]。而在接受AI治疗后进展的患者应该选用何种治疗方案,是乳腺癌内分泌治疗的重要问题。《中国抗癌协会乳腺癌诊治指南与规范(2015版)》提示[4],对于此类患者换用不同机制的AI、500 mg氟维司群、依维莫司+依西美坦以及三苯氧胺都是可考虑的选择。有研究报道,在既往接受AI治疗后换用不同机制的AI的无进展生存时间(progression-free survival,PFS)仅为2.8~3.7个月[5-7]。CONFIRM研究在既往接受内分泌治疗中进展的激素受体阳性的复发转移性乳腺癌中对比了500与250 mg氟维司群的疗效[8-9]。结果显示,500 mg氟维司群较250 mg能显著延长患者的PFS,由5.5个月延长至6.5个月(P=0.006)。且在亚组分析中,既往AI治疗失败的亚组接受500 mg氟维司群治疗后同样可得到一定程度的获益,但并未给出PFS的具体数值。在中国的CONFIRM研究中[10],在总体人群接受500 mg氟维司群治疗获益的情况下,既往接受AI的患者的PFS为5.8个月,较使用250 mg氟维司群的PFS延长了两倍(HR:0.65;95%CI:0.42~1.03)。且500 mg氟维司群在既往接受AI的亚组的获益情况较既往接受抗雌激素治疗亚组明显(AI组,HR:0.65;AO组,HR:0.86)。根据以上研究结果,500 mg氟维司群在治疗既往接受AI治疗后出现进展的患者中存在一定获益。本研究旨在探索500 mg氟维司群在既往接受AI治疗的复发转移性乳腺癌患者中的疗效及安全性,为500 mg氟维司群的应用提供更多依据。
1 资料和方法
1.1临床资料
回顾性分析 2011年7月—2015年12月复旦大学附属肿瘤医院收治的188例经500 mg氟维司群治疗,且既往接受AI治疗后进展的激素受体阳性的复发转移性乳腺癌患者的临床资料。既往接受AI治疗包括AI辅助治疗及转移后治疗。激素受体阳性定义为原发灶和(或)转移灶经病理证实的雌激素受体(estrogen receptor,ER)阳性和(或)孕激素(progesterone receptor,PR)阳性。绝经前患者均接受去势手术或联合卵巢功能抑制剂治疗。氟维司群治疗方案为:氟维司群500 mg于首日及第14、 28天肌内注射,随后每28 d重复(28 d 为1个周期),至少2个周期。治疗至患者出现疾病进展、出现的不良事件不可耐受、患者拒绝用药或失访。纳入的患者均有基本完整的临床记录,包括基线评估,用药以及不良事件记录。
1.2观察指标及评价标准
主要观察疗效指标为PFS,次要观察疗效指标包括客观缓解率(objective response rate,ORR)、临床获益率(clinical beneft rate,CBR)以及安全性。
PFS的定义为从患者接受氟维司群治疗开始至肿瘤进展或患者死亡的时间。患者疗效评价按照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1对治疗效果进行评价。疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾 病 稳 定 (stable disease,SD)以及疾病进展(progression disease,PD)。ORR是指发生CR+PR的患者例数与总例数的比值;CBR是指CR、PR与SD维持时间大于等于24周的患者例数与总例数的比值。
1.3统计学处理
所有数据均采用SPSS 19.0统计软件进行分析。PFS使用Kaplan-Meier方法进行生存分析以及95%CI估计。亚组分析中单因素比较采用Log-rank检验,分析的亚组因素包括年龄、转移灶数目、单纯骨转移、内脏转移、内分泌敏感情况、转移后内分泌以及化疗线数。转移后未接受以及仅接受一线内分泌治疗的患者,可根据其前一线内分泌敏感情况分为原发耐药、继发耐药、敏感及无法评估。原发耐药定义为辅助内分泌治疗2年内出现复发,或转移后一线内分泌治疗6个月内出现进展。继发耐药定义为完成辅助内分泌治疗后1年内出现复发,且辅助内分泌治疗时间大于2年;或转移后一线内分泌治疗大于等于6个月出现进展。敏感定义为完成辅助内分泌治疗后大于等于1年出现复发或初始Ⅳ期未经内分泌治疗。多因素分析采用COX比例风险回归模型,将Log-rank检验中可能影响本组患者PFS的因素纳入COX比例风险回归模型进行分析。COX最大似然法P>0.100为标准剔除变量。所有P值及95%CI均采用双侧检验,P<0.05为差异有统计学意义。
1.4安全性
安全性观察仅评价使用500 mg氟维司群治疗后因不良事件停药的患者,临床不良事件分级按照美国国立癌症研究所通用毒性标准(National Cancer Institute Common Toxicity Criteria,NCI.CTC)4.03 进行评估[11]。
2 结 果
2.1患者特征
本组患者的年龄为 31~85岁,中位年龄为58岁。在45例绝经前患者中,23例(12.2%)接受卵巢功能抑制剂(ovarian function suppression,OFS)进行药物去势,22例(11.7%)接受手术去势。142例(75.5%)患者为HER-2阴性,17例(9.0%)患者为HER-2阳性,29例(15.4%)无法评估HER-2状态。15例(7.9%)患者为初治Ⅳ期,35例(18.6%)患者术后未接受辅助内分泌治疗,138例(73.4%)患者既往曾接受辅助内分泌治疗。82例(43.6%)患者无可测量病灶,106例(56.4%)患者有可测量病灶。存在内脏转移者为120例(63.8%),无内脏转移的患者为68例(36.2%)。72例(38.3%)患者既往接受两线及以上转移后内分泌治疗,35例(18.6%)患者曾接受三线及以上化疗。伴随用药中,7例(3.7%)患者联合阿那曲唑治疗,2例(1.1%)患者联合来曲唑治疗,6例(3.2%)患者联合依西美坦治疗,3例(1.6%)患者联合依维莫司治疗,6例(3.2%)患者联合节拍卡培他滨治疗,4例(2.1%)患者联合常规剂量卡培他滨治疗,4例(2.1%)患者联合静脉化疗,47例(25.0%)患者联合唑来膦酸骨保护治疗,2例(1.1%)患者应用地诺单抗进行骨保护治疗。患者其他基线特征见表1。
2.2疗效评价
中位随访 13.1个月,其中有17例(9.0%)患者失访,132例(70.2%)患者出现PD。 氟维司群中位治疗时间为4.5个月,患者的中位 PFS 为5.9个月 (95%CI:4.2~7.5)(图1)。在175例有疗效评价的患者中,无患者出现CR,6例(3.4%)患者评价为PR,91例(52.0%)患者评价为SD,其中64例(36.6%)疾病稳定时间大于等于24 周。有78例(44.5%)患者在初次评价疗效时即出现PD(表2)。
2.3单因素分析
亚组分析显示,患者的转移部位数目越多,其PFS显著缩短(P=0.001)。既往接受化疗线数越多的患者,其PFS越短(P=0.019)。患者的PFS与年龄、是否单纯骨转移、是否有内脏转移、既往内分泌线数以及患者对既往内分泌治疗的敏感性差异无统计学意义(P>0.05)。但在数值上,年龄大于等于60岁、单纯骨转移、无内脏转移、既往未接受转移后内分泌治疗以及既往内分泌治疗敏感的患者的PFS有所延长(表3)。
2.4 多因素分析
COX 比例风险回归分析中,纳入年龄、转移数目、单纯骨转移、内脏转移和既往是否接受化疗作为分析变量。其中,转移部位数目分为转移数目小于等于1以及大于等于2两分类变量。结果显示,经氟维司群治疗后,患者的PFS与转移数目以及既往是否接受转移后化疗有关。转移部位大于等于2处、既往曾接受转移后化疗是PFS的独立危险因素。转移数目大于等于2个其进展风险为转移数目小于等于1个的患者的1.92倍(95%CI:1.2~2.9);既往接受转移后化疗者其出现进展的风险为未接受化疗者的1.52倍(95%CI:1.0~2.1)(表4)。

表 1 188例患者的临床特征Tab. 1 Patient characteristics

图 1 患者PFS的Kaplan-Meier曲线Fig. 1 Kaplan-Meier curves for progression-free survival

表 2 疗效评价Tab. 2 Evaluation of efcacy
表 3 亚组分析Tab. 3 Subgroup analysis
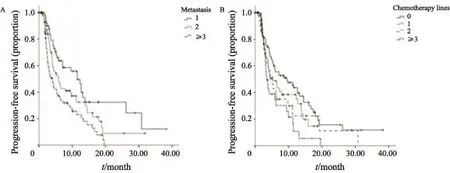
图 2 患者PFS的Kaplan-Meier曲线Fig. 2 Kaplan-Meier curves for progression-free survivalA: For patients stratifed by number of metastatic site; B: For patients stratifed by lines of chemotherapy for metastatic breast cancer

表 4 患者无进展生存的 COX 回归分析结果Tab. 4 Cox regression analysis of PFS
2.5安全性
有6例患者因不良事件停药。1例因3度纳差停药;1例出现3度头晕,2度恶心,1度发热,1度骨关节疼痛,在排除了脑转移可能后,予以停药;1例出现3度乏力后患者自行停药,并服用来曲唑治疗;1例出现3度总胆红素升高,2度乳酸脱氢酶升高,1度AST升高后停药;2例患者因出现3度及以上贫血后停药。以上患者在停药后均接受相应对症治疗后均好转。
3 讨 论
接受AI治疗后产生耐药是转移性乳腺癌内分泌治疗失败的重要原因,这类患者应该选用怎样的治疗是临床实践中亟待解决的问题。CONFIRM研究不仅提示500 mg氟维司群治疗既往接受三苯氧胺治疗的患者有着优越的疗效,而且在既往接受AI治疗的患者中也有着一定的疗效[8]。而中国CONFIRM研究的亚组分析中给出了这类亚组人群的PFS时间为5.8个月[10]。而既往仅有少数几个大型临床试验的对照组给出了既往接受AI治疗的患者接受500 mg氟维司群治疗的疗效数据,其PFS为4.6~5.6个月[12-13,15]。而本研究的PFS为5.9个月(95%CI:4.2~7.5),ORR为3.6%,CBR为40.0%。PFS以及CBR数据与既往文献报道一致。本研究中7.4%患者联合化疗治疗,7.9%的患者联合AI治疗,而1.6%的患者联合靶向药物依维莫司治疗,这些联合治疗可能引起PFS的延长。而ORR报道偏低与本研究回顾观察了大量的仅有非靶病灶的患者有关,因非靶病灶的评估仅存在CR、非CR非PD以及PD三类,ORR因非靶病灶无PR的疗效评价,在仅有非靶病灶患者比例较高的本研究中偏低。仅有非靶病灶的患者在本研究中的比例为43.6%,而在CONFIRM研究为33.7%。
在亚组分析中,单因素分析中转移数目越多,既往接受化疗线数越多的患者,其PFS明显缩短,其差异有统计学意义(P<0.05)。多因素分析中,同样验证了转移数目以及化疗线数对疗效的影响,转移部位大于等于2处,既往曾接受转移后化疗是PFS的独立危险因素。转移数目越多,肿瘤的转移范围越广泛,其转移以及增殖能力越强,生物学行为越恶劣,对内分泌治疗的反应不佳。而既往接受转移后化疗治疗的激素受体阳性的乳腺癌患者,存在着疾病进展迅速,肿瘤负荷大,或有症状的内脏转移,或经多线AI以及其他内分泌药物治疗后进展的情况,仅使用内分泌治疗不易控制。日本学者在关于500 mg氟维司群治疗转移后乳腺癌患者的回顾性研究中观察到了与本研究一致的现象[13],既往接受化疗的患者对于500 mg氟维司群的疗效要差于未接受化疗的患者。且本研究显示,既往接受化疗线数越多,线数越晚,500 mg氟维司群的疗效越差,所以对激素受体阳性的适合内分泌治疗的患者,应在转移后早期使用内分泌药物进行治疗。根据前一线内分泌治疗的反应将患者划分为原发、继发耐药以及内分泌敏感,亚组分析中PFS与敏感性并未出现统计学差异,可能与观察到的内分泌治疗敏感的患者过少有关。但在数值上,既往内分泌治疗敏感的患者的PFS有延长的趋势。
指南及专家共识推荐在既往接受AI治疗后进展且需内分泌治疗的激素受体阳性的转移性乳腺癌患者[2-3,14],初次复发的长无病间期(disease-free interval,DFI)患者或前一线转移后内分泌治疗稳定时间大于等于6个月的患者,可考虑内分泌治疗。而对于短DFI或前一线转移后内分泌治疗稳定时间小于6个月的患者,若仍考虑内分必治疗,建议联合靶向药物,如帕博昔布(palbociclib)、依维莫司。氟维司群联合细胞周期素依赖激酶(cyclin dependent kinase,CDK)4/6抑制剂palbociclib在这类人群中的应用,PALOMA-3研究的AI治疗后进展的亚组给出了循证医学证据[15],对比氟维司群单药,氟维司群联合palbociclib显著延长患者的PFS,联合组与对照组的PFS分别为9.4和3.7个月(HR=0.39,95%CI:0.27~0.57)。而依维莫司联合依西美坦在BOLERO-2研究中证实了在既往接受非甾体AI的患者中优于依西美坦单药的疗效[5],但与500 mg氟维司群并未有头对头的大型前瞻性临床试验进行比较,仅有回顾性研究对此问题进行了探讨,依维莫司联合内分泌治疗对比氟维司群单药,能显著延长患者的PFS(HR=0.71;P=0.045)[16]。在palbociclib上市前,500 mg氟维司群以及依维莫司联合内分泌治疗都是AI治疗后进展的患者的获益选择。伴随着palbociclib的上市,这类患者又多了一种新的选择。而在中国,palbociclib目前仍未上市,上述两种内分泌治疗方案对于既往接受AI治疗的中国患者皆可选择。
500 mg 氟维司群治疗既往接受AI治疗的复发转移乳腺癌患者的疗效和安全性肯定。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] CARDOSO F, COSTA A, NORTON L, et al. ESO-ESMO 2ndinternational consensus guidelines for advanced breast cancer(ABC2) dagger[J]. Ann Oncol, 2014, 25(10): 1871-1888.
[3] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast cancer, V.2.2016. Available at http://www.nccn.org/professionals/physician_gls/ PDF/breastcancer.pdf. Accessed May 14, 2016[EB/OL].
[4] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J]. 中国癌症杂志, 2015, 25(9): 692-754.
[5] BASELGA J, CAMPONE M, PICCART M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer[J]. N Engl J Med, 2012, 366(6): 520-529.
[6] CHIA S, GRADISHAR W, MAURIAC L, et al. Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptorpositive, advanced breast cancer: results from EFECT[J]. J Clin Oncol, 2008, 26(10): 1664-1670.
[7] JOHNSTON S R, KILBURN L S, ELLIS P, et al. Fulvestrant plus anastrozole or placebo versus exemestane alone after progression on non-steroidal aromatase inhibitors in postmenopausal patients with hormone-receptor-positive locally advanced or metastatic breast cancer (SoFEA): a composite, multicentre, phase 3 randomised trial[J]. Lancet Oncol, 2013, 14(10): 989-998.
[8] DI LEO A, JERUSALEM G, PETRUZELKA L, et al. Results of the CONFIRM phase Ⅲ trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer[J]. J Clin Oncol, 2010, 28(30): 4594-4600.
[9] DI LEO A, JERUSALEM G, PETRUZELKA L, et al. Final overall survival: fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial[J]. J Natl Cancer Inst, 2014,106(1): 337.
[10] JIANG Z. A phase Ⅲ study of fulvestrant 500 mg versus 250 mg in postmenopausal Chinese women with advanced breast cancer and disease progression following failure on prior antiestrogen or aromatase inhibitor therapy: supporting superior clinical benefit for the 500 mg dose: The 2014 San Antonio Breast Cancer Symposium, 2014[C].
[11] NCI Common Terminology Criteria for Adverse Events(CTCAE) v.4,03. Available from: URL:http://evs.nci.nih.gov/ ftp1/CTCAE/About.html. Accessed May, 17, 2010[EB/OL].[12] ZAMAN K, WINTERHALDER R, MAMOT C, et al. Fulvestrant with or without selumetinib, a MEK 1/2 inhibitor, in breast cancer progressing after aromatase inhibitor therapy:a multicentre randomised placebo-controlled double-blind phase Ⅱ trial, SAKK 21/08[J]. Eur J Cancer, 2015, 51(10):1212-1220.
[13] ARAKI K, ISHIDA N, HORII R, et al. Efficacy of fulvestrant 500 mg in Japanese postmenopausal advanced/recurrent breast cancer patients and factors associated with prolonged time-to-treatment failure[J]. Expert Opin Pharmacother, 2015, 16(17): 2561-2568.
[14] REINERT T, BARRIOS C H. Optimal management of hormone receptor positive metastatic breast cancer in 2016[J]. Ther Adv Med Oncol, 2015, 7(6): 304-320.
[15] CRISTOFANILLI M, TURNER N C, BONDARENKO I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER-2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial[J]. Lancet Oncol, 2016.
[16] HAO Y, LIN P L, XIE J, et al. Real-world effectiveness of everolimus-based therapy versus fulvestrant monotherapy in HR(+)/HER-2(-) metastatic breast cancer[J]. J Comp Eff Res, 2015, 4(4): 315-326.
A retrospective study of 500 mg fulvestrant in recurrent or metastatic breast cancer patients pretreat-
ed with the third generation of aromatase inhibitors
WANG Zhonghua, ZHANG Jian, WANG Leiping, CAO Jun, TAO Zhonghua, WANG Biyun (Department of Medical Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Correspondence to: WANG Biyun E-mail: wangbiyun0107@hotmail.com
Background and purpose: The third generation of aromatase inhibitors (AI) in postmenopausal hormone receptor-positive patients is the routine treatments in endocrine therapy. The 500 mg fulvestrant showed clinical benefts in patients with previous AI treatment. This study aimed to access the efcacy and safety of 500 mg fulvestrant in estrogen receptor (ER) positive postmenopausal patients who had previous AI treatments with locally advanced and metastatic breast cancer. Methods: This study retrospectively analyzed the clinical data from 188 post-AI ER positive and (or) progesterone receptor (PR)-positive locally advanced and metastatic breast cancer patients treated with 500 mg fulvestrant in Fudan University Shanghai Cancer Center from Jul. 2011 to Dec. 2015. Primary end point was progression-free survival (PFS). Secondary end points were objective response rate (ORR), clinical beneft rate (CBR)and safety profle. Results: After the median follow-up of 11.3 months, median PFS was 5.9 months (95%CI: 4.2-7.5),CBR was 40.0% and ORR was 3.4%. COX proportional hazards regression analysis indicated that PFS was correlated with the number of metastatic sites (HR=1.92, 95% CI: 1.2-2.9, P =0.002) and previous lines of chemotherapy (HR=1.52,95%CI:1.0-2.1, P=0.022). Six patients stopped the treatment for intolerable adverse events. Conclusion: The treatment of 500 mg fulvestrant has a favorable efcacy and safety in treatment of post-AI ER positive postmenopausal patientswith metastatic breast cancer.
ZHAO Yannan, GONG Chengcheng, HU Xichun,
Fulvestrant; Metastatic breast cancer; Estrogen receptor positive; Aromatase inhibitor
10.19401/j.cnki.1007-3639.2016.09.009
R737.9
A
1007-3639(2016)09-0777-07
2016-06-30
2016-08-10)
王碧芸 E-mail:wangbiyun0107@hotmail.com
