甲磺酸阿帕替尼治疗进展性碘难治性甲状腺癌的短期疗效及安全性初步报告
2016-10-27林岩松
林岩松,王 宸,李 慧,梁 军
1.中国医学科学院北京协和医学院核医学科,北京 100730;2.北京大学国际医院肿瘤内科,北京 102206
甲磺酸阿帕替尼治疗进展性碘难治性甲状腺癌的短期疗效及安全性初步报告
林岩松1,王宸1,李慧1,梁军2
1.中国医学科学院北京协和医学院核医学科,北京 100730;2.北京大学国际医院肿瘤内科,北京 102206
背景与目的:碘难治性甲状腺癌(radioactive iodine-refractory diferentiated thyroid cancer,RAIRDTC)是目前临床诊疗的难点与热点,目前国际指南中推荐的靶向治疗药物仅有索拉非尼及乐伐替尼。该研究报告具有我国自主知识产权的靶向药物甲磺酸阿帕替尼治疗进展性碘RAIR-DTC 8周后的短期疗效及安全性。方法:纳入10例进展性RAIR-DTC患者予阿帕替尼治疗(750 mg,每天1次,口服)。每2周复查甲状腺球蛋白(thyroglobulin,Tg),每4周CT监测靶病灶(target lesions,TL)。观察甲状腺癌血清标志物Tg水平变化,采用实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors,RECIST 1.1)评估疗效。初步评估患者经药物治疗的短期不良事件(adverse event,AE)以评估安全性。结果:8例Tg可评价的患者,在治疗2周后Tg即出现下降,在治疗8周后较基线平均降幅达68%,达到“生化部分缓解”。10例患者共18个TL,治疗4周后即出现缩小,在8周后较基线平均缩小达40%,9例患者(9/10,90%)达到部分缓解,1例(1/10,10%)呈疾病稳定,客观缓解率及疾病控制率分别达90%和100%。最常见的3级以上AE主要包括手足皮肤反应、高血压和低钙血症,分别占50%、30%和20%,未观察到与药物相关的严重AE。结论:甲磺酸阿帕替尼可安全用于RAIR-DTC治疗,且在8周治疗中从血清学及结构影像学角度证实快速有效,客观缓解率高。
阿帕替尼;酪氨酸激酶抑制剂;碘难治性甲状腺癌
甲状腺癌是头颈部最常见的恶性肿瘤之一,以发病率逐年增高而引起全球性关注。起源于甲状腺滤泡上皮的分化型甲状腺癌(differentiated thyroid cancer,DTC)占甲状腺癌的95%以上[1]。多数DTC患者经过规范化的手术治疗,选择性131I治疗(radioactive iodine,RAI)及甲状腺刺激激素(thyroid stimulating hormone,TSH)抑制治疗后预后良好[2]。然而,有1%~23%的DTC患者会出现远处转移,其中30%的患者会进展为碘难治性甲状腺癌(radioactive iodine-refractory diferentiated thyroid cancer,RAIR-DTC)[3-4],其10年生存率不足10%[4-5],故RAIR-DTC的后续诊治成为临床焦点。RAIR-DTC的发生机制涉及多种基因突变及信号通路的异常激活,如Braf、TERT等,针对不同靶点的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)相继问世[1,5-7]。我们前期采用反映肿瘤新生血管生成的整合素受体(99mTc-RGD)单光子发射型计算机断层显像的研究提示,RAIR-DTC病灶肿瘤新生血管生成活跃[8]。有研究报道,甲状腺癌组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)表达较正常甲状腺组织高[9-11]。这些结果为采用抗血管生成靶向药物在RAIR-DTC的应用提供了分子影像学依据。甲磺酸阿帕替尼片作为具有我国自主知识产权的小分子TKI,主要作用于参与调控肿瘤新生血管生成的血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR),并在前期的研究中已证实其治疗胃癌的有效性[12-13]。目前,有关阿帕替尼在甲状腺癌治疗中的应用尚未见报道,故本单臂前瞻性研究旨在探索甲磺酸阿帕替尼治疗进展性RAIR-DTC的短期疗效及安全性。
1 资料和方法
1.1临床资料
本研究已通过中国医学科学院北京协和医院伦理委员会的审批。所有患者在入组前均被告知研究的相关利弊及风险,并签署知情同意书(伦理批号:北京协和医院HS-970)。
1.1.1入组标准
⑴ 年龄:大于等于18岁,性别不限。⑵ 局部晚期或转移性DTC(乳头状、滤泡状、Hurthle细胞及低分化癌),至少有1个经治疗的可测量病灶,计算机断层显像(computed tomography,CT)扫描长径大于等于10 mm,符合实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors 1.1,RECIST 1.1)的要求,包括:完全缓解(complete response)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)、疾病控制率(disease control rate,DCR)和客观缓解率(objective response rate,ORR)等。⑶ 在入选之前14个月内出现疾病进展(必须使用RECIST 1.1作为疾病进展的评估依据)。⑷ 放射性碘难治(满足下述条件之一):① 靶病灶(target lesions,TL)在放射性碘治疗中完全丧失摄碘能力;② 患者12个月内接受单次放射碘治疗(大于等于3.7 GBq)且靶病灶疾病进展;③ 患者每两次放射性碘治疗时间间隔小于12个月,剂量大于等于3.7 GBq,至少有1次碘治疗后超过12个月疾病进展;④ 累计接受放射性碘治疗剂量大于等于22.2 GBq(大于等于600 mCi)。
1.1.2排除标准
⑴ DTC外的其他甲状腺癌组织学亚型(例如髓样癌、淋巴瘤或肉瘤)。⑵ 6个月内使用过VEGFR-TKI小分子药物,如凡德他尼(vandetanib)、卡巴唑替尼(cabozantinib)、乐伐替尼(lenvatinib)、舒尼替尼(sunitinib)及索拉非尼(sorafenib)等治疗的患者。⑶ 患有高血压,经降压药物治疗无法降至正常范围者(收缩压大于140 mmHg,舒张压大于90 mmHg),患有大于等于Ⅱ级的冠心病、心律失常(包括QTc间期延长男性大于450 ms,女性大于470 ms)及心功能不全。⑷ 具有影响口服药物吸收的多种因素(比如无法吞咽、恶心呕吐、慢性腹泻和肠梗阻等)。⑸ 具有胃肠道出血风险的患者不可入组,包括下列情况:① 有活动性消化溃疡病灶,且大便潜血(++);② 3个月内有黑便、呕血病史者。⑹ 凝血功能异常(INR>1.5×ULN、APTT>1.5×ULN),具有出血倾向者。⑺ 既往接受化疗抗甲状腺癌治疗(允许使用低剂量化疗进行放射增敏)或沙利度胺及其衍生物治疗。⑻ 怀孕或哺乳期妇女。
1.2患者资料
共10例患者的18个靶病灶纳入评价,患者平均年龄54.9(32~76)岁,男性∶女性=1∶1。所有的患者均行甲状腺全切及淋巴结清扫,并经病理证实为甲状腺乳头状癌。基线TL平均直径21.6 mm(11.5~33.2 mm)。基线甲状腺球蛋白(thyroglobulin,Tg)水平为0.43~7 591.00 ng/mL。临床病理特征见表1。
1.3治疗方案
阿帕替尼750 mg,每天1次,口服。每4周定义为1个治疗周期。每个治疗周期允许停药不大于2次,累计不超过14 d。允许下调1次剂量至500 mg,但不允许上调剂量。患者持续给药直至病情进展或不能耐受药物引起的不良事件(adverse event,AE)。
1.4疗效监测
所有患者均于入组时检测Tg水平及靶病灶CT。并于治疗随访中每两周复查Tg及甲状腺球蛋白抗体(thyroglobulin antibody,TgAb),并计算Tg同比下降率,定义为:(Tg-Tg基线)/Tg基线;每个治疗周期复查CT,以监测靶病灶变化,并计算病灶同比缩小率,定义为:(TL-TL基线)/ TL基线。
2 结 果
2.1有效性
2.1.1血清学评估
10例患者中8例患者Tg水平可用于评估,另2例患者,因1例TgAb大于4 000 U/mL影响了Tg的检测,1例Tg过低(0.43 ng/mL)未纳入评价。75%(6/8)的患者治疗2周后Tg即开始下降,较基线平均同比下降21%;治疗8周后8例患者Tg水平均出现下降,同比下降达68%。随访中有4例患者因3级AE暂停服药后出现Tg一过性升高,恢复服药治疗后Tg水平又出现下降(图1)。
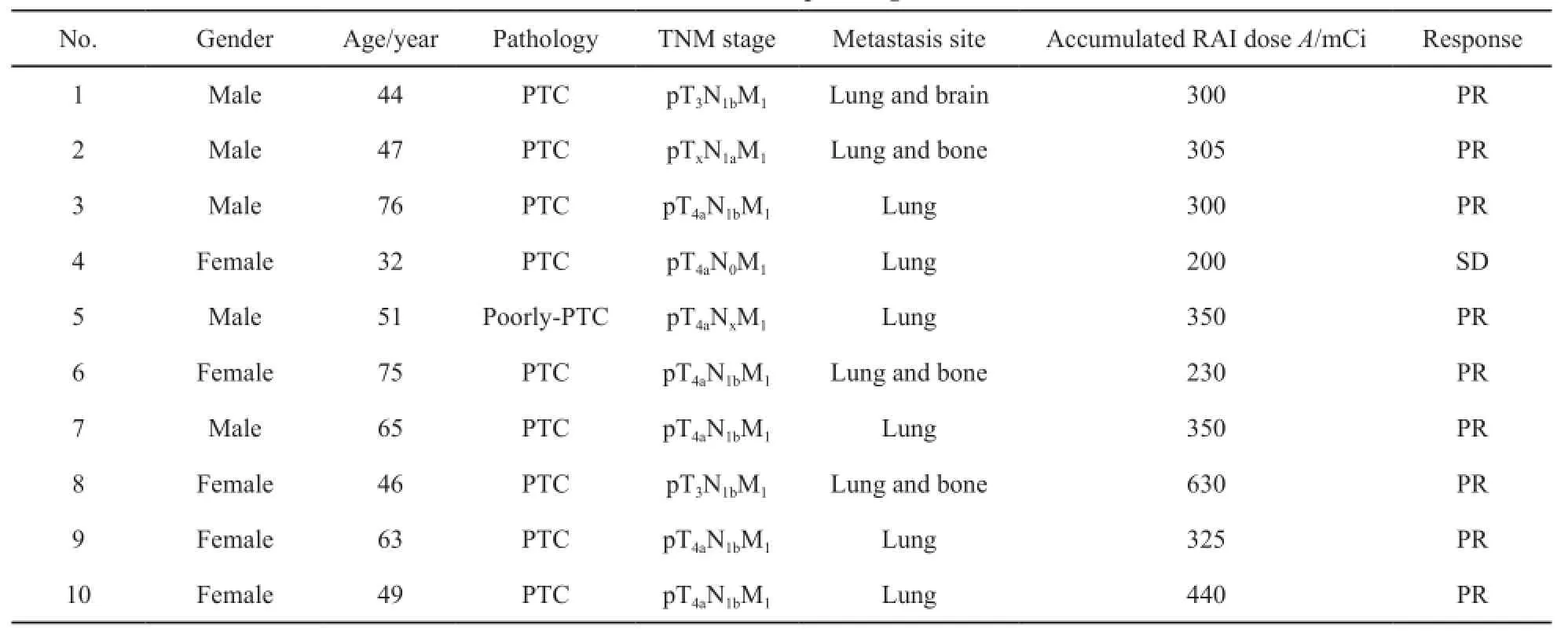
表 1 患者临床病理特征Tab. 1 Clinical and pathological data

图 1 Tg变化趋势Fig. 1 The changes of Tg
2.1.2基于RECIST 1.1评估标准
18个TL的基线直径均值为21.6 mm,经过4周治疗后TL即开始缩小,直径均值为14.8 mm,治疗8周后TL直径均值为12.4 mm,相较于基线,平均同比下降分别达33.9%和40.0%。在治疗8周结束后,9例患者(9/10,90%)达部分缓解,1例患者(1/10,10%)为病情稳定。疾病控制率为100%,客观缓解率为90%(图2)。经阿帕替尼治疗后典型病例的CT变化见图3。

图 2 TL的变化情况Fig. 2 The changes of TL
2.2安全性
本研究中,所有的AE均为1~3级,未出现与药物有关的4级AE及严重不良事件(serious adverse event,SAE)。最常见的AE为手足皮肤反应(hand-food-skin reaction,HFSR),见于9例患者。3级AE共出现17人次,包括HFSR、高血压、蛋白尿、中性粒细胞减少、血小板减少、低钙血症、咽喉疼痛、吞咽困难和腹泻。其中HFSR、高血压和低钙血症发生率分别为 50%、30%和20%,其余3级AE的发生率均为10%。
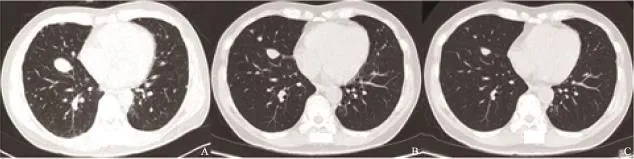
图 3 典型病例靶病灶的CT变化Fig. 3 The changes of the target lesions in CT of a typical caseA: Baseline; B: Four weeks; C: Eight weeks
3 讨 论
鉴于RAIR-DTC预后很差,10年生存率不足10%,故其诊治已成为临床工作中的难点与热点。近年来,随着对甲状腺癌分子机制的深入研究,多种TKI不断问世,并已经临床试验证实可不同程度地延长RAIR-DTC患者的无进展生存期(progression-free survival,PFS)[1,5]。美国食品药品监督管理局(Food and Drug Administration,FDA)相继批准索拉非尼及乐伐替尼用于治疗RAIR-DTC,其中乐伐替尼获得的PR率在目前经FDA批准药物中最高,为64.7%[1,5]。甲磺酸阿帕替尼作为一种新型的小分子TKI,作用于VEGFR。VEGF及VEGFR在新生血管生成中起重要调节作用。VEFGR包括3种膜受体,VEGFR-1、VEGFR-2和VEGFR-3,其中VEGFR-2在很多肿瘤的血管生成中起重要作用[10,14]。阿帕替尼可以高选择性地阻断VEGFR-2及其下游信号通路,从而抑制血管内皮细胞的增殖及迁移,以达到抑制肿瘤的效果[12-13]。本研究在治疗8周后即观察到90%的入组患者达到了部分缓解,疾病控制率达100%,明显优于索拉非尼、乐伐替尼等靶向药物在RAIR-DTC中的客观反应率和疾病控制率。获得该快速疗效的具体机制尚不明确,推测这可能直接或间接与多种机制相关,如该药物可高选择性阻断VEGFR-2及其下游信号通路,同时体外研究亦显示,阿帕替尼具有较目前经FDA批准用于RAIR-DTC并获得最佳疗效的乐伐替尼更低的半抑制浓度(IC50:1 nmol/L vs 4 nmol/L)[15-16]。虽然观察期尚短,但这一结果初步提示,甲磺酸阿帕替尼有望成为RAIR-DTC治疗中第一个具有我国自主知识产权的药物,相较于进口药物高昂的价格,其低廉的价格、明确的疗效将更易成为我国RAIR-DTC患者的挽救治疗手段,并为局部晚期复发性RAIR-DTC的术前辅助治疗提供了新的可能。
不同于以往的临床试验在TKI治疗后至少2个月才开始观察治疗疗效,本研究首次在2周及4周后即从血清学及影像学两方面来监测药物治疗后的早期反应,旨在早期明确疗效、及时终止不必要的TKI治疗及其所伴随的药物不良反应。Tg是DTC术后、131I治疗后灵敏的监测肿瘤复发及转移的血清学指标[17-19]。本研究发现,经TKI治疗2周后,75%的患者即出现Tg水平的明显下降,提示Tg可作为辅助早期预测TKI治疗疗效的灵敏血清学指标。在随访过程中,4例患者曾在因3级AE导致的停药过程中出现了Tg水平一过性增高,恢复阿帕替尼治疗后Tg又呈下降趋势,这提示阿帕替尼可快速作用于RAIRDTC病灶干预Tg的合成与分泌,停药可能导致病情反弹。经过4周阿帕替尼治疗后,RECIST 1.1评估即显示靶病灶出现明显缩小,直径均值为14.8 mm,平均同比下降33.9%,达到部分缓解,这一早期评估结果提示,以往临床研究中所采用的至少2个月后的RECIST 1.1评估有可能错过对患者早期疗效的监测,不利于病情的及时评估,或及时终止价格昂贵并具AE的不必要靶向治疗。
在随访期间,我们亦密切观察并记录了阿帕替尼所有常见的AE,包括HFSR、高血压、蛋白尿、中性粒细胞减少、血小板减少、低钙血症、咽喉疼痛、吞咽困难及腹泻。其中HFSR最为常见,出现于90%的患者,部分患者曾因3级以上的AE中断服药,并于中断服药后1周左右降至1级。由于尿素霜、降压药物、钙剂、维生素D和蒙脱石散等可以改善HFSR、高血压、低钙血症和腹泻等AE,这提示我们可以通过辅助使用降压药物、尿素霜等对症治疗措施在患者治疗获益的同时,预防或及时改善药物给患者带来的AE。此外,在阿帕替尼治疗期间应密切关注并及时对症处理其AE。在观察期内所有患者均未出现与药物相关的SAE,显示阿帕替尼在RAIR-DTC治疗中具有耐受性和安全性。
综上,本单臂前瞻性研究初步提示,甲磺酸阿帕替尼可安全用于RAIR-DTC,且在8周治疗中从血清学及结构影像学角度证实其快速有效,客观缓解率高。早期血清Tg监测可辅助预测治疗反应,4周的RECIST评估可用于及时了解治疗反应,及时终止不必要且具AE的靶向治疗。鉴于目前入组例数较少,疗效观察时间较短,尚需扩大样本量,其长期疗效及AE仍在进一步观察中。
[1] BROSE M S, NUTTING C M, JARZAB B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomized, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319-328.
[2] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer[J]. Thyroid, 2016, 26(1): 1-133.
[3] SCHLUMBERGER M, BROSE M, ELISEI R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer[J]. Lancet Diabetes Endocrinol, 2014, 2(5):356-358.
[4] DURANTE C, HADDY N, BAUDIN E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy[J]. J Clin Endocrinol Metab, 2006, 91(8): 2892-2899.
[5] SCHLUMBERGER M, TAHARA M, WIRTH L J, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 12, 372(7): 621-630.
[6] VOLANTE M, RAPA I, GANDHI M, et al. RAS mutations are the predominant molecular alteration in poorly differentiated thyroid carcinomas and bear prognostic impact[J]. J Clin Endocrinol Metab, 2009, 94(12): 4735-4741.
[7] RICARTE-FILHO J C, RYDER M, CHITALE D A, et al. Mutational profile of advanced primary and metastatic radioactive iodine-refractory thyroid cancers reveals distinct pathogenetic roles for BRAF, PIK3CA, and AKT1[J]. Cancer Res, 2009, 69(11): 4885-4893.
[8] ZHAO D, JIN X, LI F, et al. Integrin αvβ3 imaging of radioactive iodine-refractory thyroid cancer using99mTc-3PRGD2[J]. J Nucl Med, 2012, 53(12): 1872-1877.
[9] KLEIN M, PICARD E, VIGNAUD J M, et al. Vascular endothelial growth factor gene and protein: strong expression in thyroiditis and thyroid carcinoma[J]. J Endocrinol, 1999, 161(1): 41-49.
[10] FERRARA N, GERBER H P, LECOUTER J. The biology of VEGF and its receptors[J]. Nat Med, 2003, 9(6): 669-676.
[11] JING F J, LIANG J, LIANG Z Y, et al. BRAFV600E mutation is not a positive predictor for distant metastasis in sporadic papillary thyroid carcinoma[J]. Chin Med J, 2013, 126(16):3013-3018.
[12] LI J, QIN S, XU J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219-3225.
[13] LI J, QIN S, XU J, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016 , 34(13): 1448-1454.
[14] PATEL-HETT S, D'AMORE P A. Signal transduction in vasculogenesis and developmental angiogenesis[J]. Int J Dev Biol, 2011, 55(4-5): 353-363.
[15] TIAN S, QUAN H, XIE C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374-1380.
[16] WIEGERING A, KORB D, THALHEIMER A, et al. E7080(Lenvatinib), a multi-targeted tyrosine kinase inhibitor, demonstrates antitumor activities against colorectal cancer xenografts[J]. Neoplasia, 2014, 16(11): 972-981.
[17] CASTAGNA M G, MAINO F, CIPRI C, et al. Delayed risk stratification, to include the response to initial treatment (surgery and radioiodine ablation), has better outcome predictivity in differentiated thyroid cancer patients[J]. Eur J Endocrinol, 2011, 165(3): 441-446.
[18] TUTTLE R M. Risk-adapted management of thyroid cancer[J]. Endocr Pract, 2008, 14(6): 764-774.
[19] MALANDRINO P, LATINA A, MARESCALCO S, et al. Second-generation Tg assay for thyroid cancer[J]. J Clin Endocrinol Metab, 96(6): 1703-1709.
The preliminary report about the efcacy and safety evaluation of apatinib in progressive radioactive
LIN Yansong1, WANG Chen1, LI Hui1, LIANG Jun2 (1.Department of Nuclear Medicine, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China; 2.Department of Oncology, Peking University International Hospital, Beijing 102206, China)
LIANG Jun E-mail: liangjun1959@aliyun.com
Background and purpose: Radioactive iodine-refractory diferentiated thyroid cancer (RAIR-DTC)is a big challenge in the management of thyroid cancer. Sorafenib and lenvatinib are the 2 tyrosine kinase inhibitors(TKIs) recently approved by FDA, which could not be afordable for most of the Chinese patients. This pilot study aimed to evaluate the short term efcacy and safety of apatinib, a Chinese domestic TKI targeted vascular endothelial growth factor receptor (VEGFR), in advanced RAIR-DTC. Methods: Ten patients who were identifed as progressive RAIR-DTC were enrolled in this study. Patients received oral apatinib 750 mg once daily. Both thyroglobulin (Tg) and/ or Tg antibody (TgAb) levels were monitored every 2 weeks after the treatment. Computed tomography (CT) was performed every 4 weeks after apatinib treatment to evaluate the response according to response evaluation criteria in solid tumor version 1.1 (RECIST 1.1). Within 8 weeks after apatinib treatment, therapeutic response was evaluated in terms of Tg, a sensitive biochemical tumor marker for DTC, and RECIST 1.1 assessment. Meanwhile, the adverse events (AE)were monitored during the therapy. Results: The Tg levels declined after the frst 2 weeks of apatinib treatment, and a mean decline rate of 68% could be observed in 8 patients with Tg available for evaluation after 8 weeks, which repre-sented a biochemical partial response. Eighteen target lesions (TL) of 10 patients were evaluated and followed up. The diameter of TL began to decrease after 4 weeks, and a mean decline of 40% could be observed after 8 weeks' apatinib treatment. A total of 9 patients (9/10) achieved partial response according to RECIST 1.1 criteria and 1 patient with stable disease, with 90% objective response rate and 100% disease control rate. The most common AE beyond grade 3 included hand-foot-skin reactions, hypertension and hypocalcemia, which accounted for 50%, 30% and 20% of the cases, respectively. No severe AE related to apatinib was observed during the treatment. Conclusion: A safe and rapid response and high partial response rate in terms of biochemistry, RECIST 1.1 could be observed in RAIR-DTC patients within 8 weeks of apatinib treatment.
Apatinib; Tyrosine kinase inhibitors; Radioactive iodine-refractory diferentiated thyroid cancer
10.19401/j.cnki.1007-3639.2016.09.001
R736.1
A
1007-3639(2016)09-0721-06
2016-06-30
2016-08-10)
国家自然科学基金(81571714)。
梁 军 E-mail: liangjun1959@aliyun.com
