不同浓度IL-2对体外诱导肽特异性细胞毒性T淋巴细胞培养体系的影响
2016-10-27李桉琪祁元明周哲骏高艳锋
李桉琪,祁元明,周哲骏,,高艳锋,张 震,张 毅,,4
1.郑州大学第一附属医院生物治疗中心,河南 郑州 450052;
2.郑州大学生命科学学院,河南 郑州450001;
3.郑州大学第一附属医院肿瘤科,河南 郑州 450052;
4.河南省肿瘤免疫治疗工程技术研究中心,河南 郑州 450052
不同浓度IL-2对体外诱导肽特异性细胞毒性T淋巴细胞培养体系的影响
李桉琪1,3,祁元明2,周哲骏1,2,高艳锋2,张震1,张毅1,2,4
1.郑州大学第一附属医院生物治疗中心,河南 郑州 450052;
2.郑州大学生命科学学院,河南 郑州450001;
3.郑州大学第一附属医院肿瘤科,河南 郑州 450052;
4.河南省肿瘤免疫治疗工程技术研究中心,河南 郑州 450052
背景与目的:细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)介导的特异性细胞免疫在抗肿瘤免疫过程中发挥着主要作用。该研究探讨不同浓度IL-2(50、200和1 000 U/mL)对体外诱导表位肽特异性CTL培养体系培养的细胞亚群比例和功能的影响,以及高剂量IL-2是否会诱导该体系中的调节性T细胞(regulatory cell,Treg)的富集。方法:选取HLA-A2超型的肿瘤患者和健康供者各10例,取外周血分离外周血单核细胞,使用环氧合酶-2(Cox-2)来源的CTL表位肽P321(ILIGETIKI)与不同浓度IL-2体外诱导肽特异性CTL。运用流式细胞仪检测细胞的增殖能力、CD4+T淋巴细胞和CD8+T淋巴细胞亚群的比例、Treg细胞亚群的比例,以及CD8+T淋巴细胞分泌穿孔素(perforin)、颗粒酶B(granzyme-B)、干扰素IFN-γ的能力。使用Elispot实验检测实验组细胞分泌IFN-γ的能力。结果:高浓度的IL-2有利于细胞的增殖。肿瘤患者组的CD4+T淋巴细胞比例高于健康供者组,而CD8+T淋巴细胞比例较健康供者组低;不同浓度IL-2对CD4+T淋巴细胞、CD8+T淋巴细胞和Treg细胞亚群比例以及CD8+T淋巴细胞分泌穿孔素、颗粒酶B、IFN-γ的能力没有影响。随着IL-2浓度的增高,Elispot实验出现的阳性斑点数越多。结论:不同浓度IL-2条件对体外诱导表位肽特异性CTL培养体系培养出的细胞亚群比例和功能没有影响,在50~1 000 U/mL IL-2浓度范围内,高剂量的IL-2不会诱导该体系中的Treg的富集。但高浓度的IL-2可以提高细胞的增殖能力,并且促进细胞分泌IFN-γ,而高浓度的IL-2可以使培养体系中存在的NK细胞或NKT细胞能够非特异性产生IFN-γ,从而对Elispot实验产生干扰。因此,在体外诱导肽特异性CTL时选用50 U/mL的IL-2浓度可以很好地维持T细胞的增殖和存活,并且最大程度地降低对Elispot实验的干扰。
IL-2;细胞毒性T淋巴细胞;多肽疫苗;调节性T细胞;细胞毒活性
肿瘤多肽疫苗因制作工序简单、化学性质稳定、无致癌性等优点而成为肿瘤免疫治疗的新方法。细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)表位肽疫苗能被抗原呈递细胞(antigen presenting cell,APC)以抗原肽-MHC-I类分子的复合物的形式递呈给以CD8作为细胞表面标志的CTL。幼稚的T细胞在APC递呈的多肽-MHC分子复合物和共刺激分子双信号的作用下转化为成熟的效应细胞,迁移到炎症、肿瘤部位从而启动有效的杀伤反应,通过穿孔素/颗粒酶和Fas/Fas-L途径溶解靶细胞[1]。体外通过使用多肽疫苗刺激外周血单核细胞(peripheral blood mononuclear cell,PBMCs)可以诱导培养出表位肽特异性的CTL。
过继性免疫细胞治疗是指将体外激活的自体或异体免疫效应细胞输注给患者,以杀伤患者体内的肿瘤细胞。体外诱导扩增培养的肿瘤特异性CTL回输是清除肿瘤、治疗癌症的新策略。IL-2对维持T细胞的生存和促进T细胞的增殖发挥了必不可少的作用[2]。在体外诱导培养CTL时,需要加入一定剂量的IL-2以维持T细胞的生存和生长。目前CTL体外诱导培养中采用的IL-2浓度为10~50 U/mL[3-6]。由于体外诱导肽特异性CTL时,细胞的增殖速率很慢,因此,如何优化培养体系、提高细胞的增殖速率和免疫功能,是目前有待解决的问题。然而,有大量报道指出,在体内实验中使用高剂量的IL-2会诱导调节性T细胞(regulatory cell,Treg)的发生,Treg是体内的一种对效应性T细胞具有抑制作用的调节性T细胞,主要为一群CD4+CD25+FOXP-3+的T淋巴细胞[10-12]。因此,减少Treg的富集是优化培养体系时必须考虑的因素。该研究探讨了不同浓度IL-2条件对体外诱导的表位肽特异性CTL的增殖能力、细胞亚群比例和细胞毒活性功能的影响,并对高剂量的IL-2(50~1 000 U/mL)是否会诱导该体系中的Treg的富集进行了初步的探讨。
1 材料和方法
1.1研究材料
选择2012年1月至2012年9月在河南省郑州大学第一附属医院生物细胞治疗中心接受生物细胞治疗的HLA-A2超型肿瘤患者10例,以及于上述时间内在河南省红十字血液中心献血的健康供者10例。在无菌条件下用肝素钠抗凝管采集外周血10 mL。
1.2试剂和仪器
淋巴细胞分离液购自上海华精生物高科技有限公司,重组IL-2购自北京双鹭药业股份有限公司,Hyclone IMDM培养基购自赛默飞世尔生物化学制品(北京)有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,人β2微球蛋白购自德国默克公司,人γ干扰素(IFN-γ)Elispot试剂盒购自深圳市达科为生物技术股份有限公司,羧基荧光素二醋酸盐琥珀酰亚胺(CFSE)购自美国Sigma公司,破膜剂、阻断剂BFA购自美国Biolegend公司,0.9%氯化钠注射液购自河南太龙药业股份有限公司。免疫荧光标记抗体:anti-CD3-PE-cy7、anti-CD4-APC-cy7、anti-CD8-Percp、anti-CD25-PE、anti-FOXP3-APC、anti-Granzyme-B-PE、anti-Perforin-FITC、anti-IFN-γ-APC、ISO-Type(PE-cy7、APC-cy7、Percp、PE、APC和FITC),均购自美国BD Pharmingen 公司。
FASCantoⅡ流式细胞仪购自美国BD公司,倒置显微镜购自美国Leica公司,培养箱购自美国Thermo公司,离心机购自赛默飞世尔科技(中国)有限公司,百级超净台购自珠海市再鑫仪器有限公司,微量振荡仪购自海门市其林贝尔仪器制造有限公司。
1.3PBMCs的分离和效应CTL的体外诱导与培养
将采集的10 mL外周血用0.9%氯化钠溶液等体积稀释,经Ficoll密度梯度离心法分离淋巴细胞,提取白膜层,用0.9%氯化钠溶液充分洗涤。离心收集细胞沉淀,用含体积分数10%胎牛血清的IMDM培养基重悬细胞,调整PBMC浓度为2×106个/mL,铺于24孔板,分离PBMCs后的第2天加入终质量浓度为10 μg/mL的Cox-2来源的CTL表位肽P321(ILIGETIKI),每孔加入0.5 μg β2微球蛋白。第3日加入不同浓度的IL-2(50、200和1 000 U/mL)。每2 d加1次IL-2,每7 d重新一轮刺激。共刺激2轮,培养第11天,收集CTL进行功能检测。
1.4CFSE染色检测淋巴细胞增殖
取分离PBMCs后培养第3天的细胞,调整细胞密度为2×106个/mL,离心弃上清液,加入1 mL无血清IMDM 培养基重悬,避光加入终浓度为5 mmol/L的CFSE,37 ℃温育10 min,加入20%胎牛血清,4 ℃放置8 min,终止染色。取出1×105个细胞做流式细胞术检测,连续检测8 d。运用Modift软件进行分析,增殖指数(proliferation index,PI)可以从该软件中直接得到。
1.5CD4+T淋巴细胞和CD8+T淋巴细胞亚群分析
取培养第11天的效应CTL 1×105个,加入细胞表面抗体(抗CD3-PE-cy7抗体、抗CD8-percp抗体和抗CD4-APC-cy7抗体)染色,避光温育15 min后,上机检测。
1.6IFN-γ分泌的检测
取培养第11天的效应CTL 1×105个与1×105个荷肽4 h的T2A2细胞混合铺入Elispot板中,37 ℃温育18 h。温育后,根据孔中的斑点数目,分析各实验组细胞IFN-γ的分泌情况。
1.7细胞因子表达水平的检测
① IFN-γ、颗粒酶B(granzyme-B)、穿孔素(perforin)的检测:取体外诱导培养第11天的细胞1×106个重悬于IMDM培养基中,按照50∶1的效靶比加入靶细胞食管癌细胞系EC9706(HLA-A2+、COX-2+),同时加入阻断剂Brefeldin A(1∶1 000)置于37 ℃培养箱温育4~5 h。温育完成后,收集细胞。加入细胞表面抗体(抗CD3-PE-cy7抗体、抗CD8-percp抗体)染色,避光温育15 min,加入200 μL 4%多聚甲醛固定20 min,破膜剂破膜后加入胞内抗体(抗IFN-γ-APC抗体、抗granzyme-B-PE抗体、抗perforin-FITC抗体)共温育30 min,上机检测细胞因子表达水平。②Treg检测:取体外诱导培养第11天的细胞1×106个,加入细胞表面抗体染色(抗CD3-PE-cy7抗体、抗CD4-APC-cy7抗体、抗CD8-Percp抗体和抗CD25-PE抗体)避光15 min,多聚甲醛固定20 min,破膜剂破膜后加入抗FOXP-3-APC抗体,共温育30 min后,上机检测。
1.8统计学处理
采用SPSS 17.0进行数据分析。两样本均数间比较时,样本符合正态分布,均数方差齐,各样本测量值相互独立,可采用成组t检验,若不符合t检验标准,可行Mann-Whitney U检验,两因素多组间均数比较采用双因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度IL-2对细胞增殖能力的影响
体外培养7 d内,细胞增殖速率较缓,不同IL-2浓度组增殖速率基本一致。培养第10天,随着IL-2浓度的增加PI数值逐渐增高,即增殖速度逐渐增高,IL-2浓度1 000 U/mL组PI数值明显高于50 U/mL组(P<0.05)。结果表明,1 000 U/mL浓度IL-2组细胞的增殖能力更强(图1,n=10)。
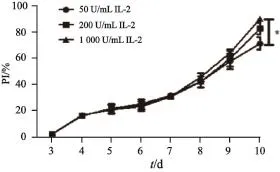
图 1 不同浓度IL-2条件下细胞增殖指数曲线Fig. 1 Proliferation index of CTL cells at diferent concentration of IL-2 *: P<0.05
2.2不同浓度IL-2对CD4+T淋巴细胞和CD8+T淋巴细胞亚群的影响
第11天取在不同浓度IL-2条件下体外诱导培养的表位肽CTL细胞,检测其CD4+T淋巴细胞和CD8+T淋巴细胞亚群比例。不同浓度IL-2组CD4+淋巴细胞和CD8+T淋巴细胞亚群差异无统计学意义(图2A、B,n=10,P>0.05)。患者组的CD8+T细胞比例较健康供者组低(图2C,n=10,P<0.05),而CD4+T细胞比例较健康供者组高(图2D,n=10,P<0.05)。
2.3不同浓度IL-2对Treg细胞亚群的影响
Treg是一群表达CD4、CD25、Foxp3分子的具有免疫调节功能的细胞。取不同浓度IL-2条件下、体外表位肽诱导培养第11天的细胞,进行细胞内因子染色后通过流式细胞仪检测Treg的比例(图3)。不同浓度IL-2条件下,各实验组中Treg亚群的比例差异无统计学意义(图3A,n=10,P>0.05)。另外,患者组与健康供者组在各个IL-2浓度下的Treg比例差异无统计学意义(图3B,n=10,P>0.05)。
2.4细胞因子检测结果
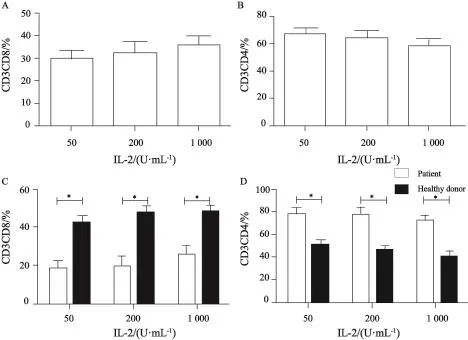
图 2 CD4+T细胞亚群和CD8+T细胞亚群检测结果Fig. 2 Diferent subtypes of CD4+T cells and CD8+T cells A-B: Diferent concentrations of IL-2 had no efect on CD8+T cells and CD4+T cells; C: Patients had lower CD8+T cells than healthy donors at diferent concentrations; D: Patients had higher CD4+T cells than healthy donors at diferent concentrations; *: P<0.05
Perforin、granzyme-B、IFN-γ是在细胞内合成,分泌到细胞外发挥生物学功能的细胞因子。这些细胞因子的分泌情况反映了细胞毒活性。选取体外培养第11天的细胞,通过与靶细胞EC9706共温育4 h,能很好地刺激体外诱导的CTL分泌perforin、granzyme-B和IFN-γ。图4的统计学分析结果显示各实验组中perforin+CD8+、granzyme-B+CD8+和IFN-γ+CD8+的T细胞占CD8+T淋巴细胞的比例差异无统计学意义(n=10,P>0.05)。
2.5Elispot检测IFN-γ分泌情况
取培养第11天的细胞与荷肽的T2A2细胞共温育,检测IFN-γ的分泌,综合分析所有样本的分泌情况。图5显示,随着IL-2浓度的增高,出现的斑点显著增加,IFN-γ的分泌增多(n=10,P<0.05)。

图 3 Treg细胞检测结果Fig. 3 Detection of Treg cellsA: Diferent concentrations of IL-2 had no efect on Treg cells; B: No diference of Treg cells between healthy donors and patients at diferent concentrations of IL-2
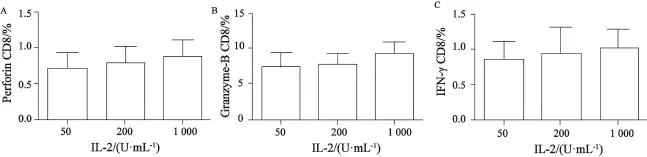
图 4 细胞因子统计学分析结果Fig. 4 Diferent concentrations of IL-2 had no efect on cytokines productionA: IL-2 concentration had no efect on perforin production; B: IL-2 concentration did not afect granzyme-B production; C: IFN-γ did not change at diferent IL-2 concentrations

图 5 IFN-g Elispot实验结果Fig. 5 Elispot assayA: Result of Elispot assay; B: Statistical graph of Elispot result;n=10, P<0.05
3 讨 论
体外诱导肽特异性CTL时,应最大程度地减少Treg,最大限度地富集CD8+T淋巴细胞。因此,选用合适的IL-2浓度可以提高体外诱导肽特异性CTL的功能和效率。IL-2对维持Treg的功能和存活有着重要的作用,在体内实验时,运用高剂量的IL-2可以很好地诱导Treg细胞。并且,运用IL-2和其他的一些细胞因子,可以在体外诱导培养诱导型Treg(iTerg),其相对于体内自然产生的Treg(nTerg)具有更强的免疫抑制功能[13]。而在体外诱导培养肽特异性CTL时,采用的IL-2浓度一般为50 U/mL。
因此,本研究采用50、200和1 000 U/mL IL-2浓度,探讨了不同浓度IL-2条件对体外诱导肽特异性CTL培养体系培养出的细胞亚群比例和功能产生的影响。CFSE染色淋巴细胞增殖实验结果显示,加入IL-2之后的4 d内,各实验组的PI指数相近,细胞增殖情况一致。加入IL-2之后第5天开始,随着IL-2剂量的增加,PI指数增幅增大,细胞增殖能力增强。在培养第10天,50、200和1 000 U/mL IL-2浓度组的PI指数分别为65.77±4.63、77.14±3.98和87.86±4.35。因此,在50~1 000 U/mL IL-2浓度范围内,高浓度的IL-2更利于细胞的扩增。CD3+CD8+T淋巴细胞为细胞毒性T淋巴细胞,在细胞免疫中发挥了重要的作用,能通过释放perforin、granzyme-B和IFN-γ等细胞因子达到杀伤靶细胞的目的。CD3+CD4+T淋巴细胞主要为辅助性T细胞,起到免疫调节的作用,一般负调控机体的免疫反应。因此,通过检测CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞亚群的比例,可以一定程度地反映培养的细胞体系的免疫功能。本实验选取经过两轮表位肽刺激,不同浓度IL-2条件下诱导培养第11天的细胞,检测其CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞亚群比例,发现不同浓度的IL-2对CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞亚群比例影响不大。但肿瘤患者组的CD3+CD4+T细胞比例较健康供者组高(P<0.05),而CD3+CD8+T细胞比例较健康供者组低(P<0.05)。对于同一个体,体外诱导培养第0天与第11天的CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞亚群比例差异无统计学意义(P>0.05)。因此,上述结果产生的差异为个体本身存在的CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞亚群差异。推测可能由于肿瘤患者体内免疫系统受抑制,从而诱导了CD3+CD4+T淋巴细胞亚群比例的升高和CD3+CD8+T淋巴细胞亚群比例的降低。因此,选用健康人的PBMCs可以更好地获得CD3+CD8+T淋巴细胞,从而诱导肽特异性CTL生成。Treg是体内的一种对效应性T细胞具有抑制作用的调节性T细胞,它的主要功能是参与抑制正常机体中的自身反应性T淋巴细胞和自身反应性B淋巴细胞的活化,维持外周耐受。
目前,认为CD4+CD25+Foxp3+的T细胞为Treg。由于Treg的在外周环境中的生存需要IL-2来维持,并且有文献报道,在体内实验中使用高剂量的IL-2可以诱导Treg细胞的发生[14]。本实验通过胞内因子染色实验检测了不同浓度IL-2肽特异性CTL体系培养第11天的细胞,结果显示,不同浓度对Treg细胞亚群的比例没有影响。50~1 000 U/mL IL-2浓度范围内,高剂量的IL-2并不能诱导富集Treg细胞。Kulhankova等[15]的研究发现,树状突细胞(dendritic cells,DCs)通过近分泌将IL-2传递给Treg,从而调控Treg的增殖和免疫抑制功能。这种DCs对Treg的调控方式是空间依赖的,需要细胞与细胞接触。由于体外诱导肽特异性CTL体系中DCs只能存活几天,从而缺少了将IL-2传递给Treg并对其进行调控的媒介。因此,在本实验培养体系下,使用不同浓度的IL-2对Treg细胞亚群的比例没有影响。CD3+CD8+T淋巴细胞主要通过释放perforin、granzyme-B、IFN-γ等细胞因子发挥其细胞毒活性。实验结果显示,50~1 000 U/mL IL-2浓度范围内,不同浓度的IL-2组细胞中perforin+CD8+、granzyme-B+CD8+和IFN-γ+CD8+T细胞比例没有明显区别。因此,选用不同浓度IL-2,对于CTL的细胞因子分泌功能没有影响。IFN-γ Elisopt实验可以更加灵敏地检测出分泌IFN-γ的细胞,Elisopt实验结果显示,随着IL-2浓度的升高,实验孔中的阳性斑点数明显增多。由于各实验组的IFN-γ+CD8+T淋巴细胞比例差异无统计学意义,因此推测Elispot实验中产生的阳性斑点可能由NK细胞或NKT细胞产生[16]。尽管在50~1 000 U/mL浓度范围内,高浓度的IL-2可以很好地扩增细胞,但其培养体系中存在的NK细胞或NKT细胞能够非特异性产生IFN-γ,从而对Elispot实验产生干扰。
综上所述,在50~1 000 U/mL浓度范围内,使用高浓度的IL-2不会诱导培养体系中Treg的富集,并且IL-2的浓度对诱导培养出的CTL功能没有影响,根据实验结果推测选用高浓度的IL-2可以很好地扩增NK细胞或NKT细胞。因此,在体外诱导肽特异性CTL时选用50 U/mL的IL-2浓度可以很好地维持T细胞的增殖和存活,并且最大程度地降低对Elispot实验的干扰。
[1] SMITH K L, TRISTRAM A, GALLAGHER K M, et al. Epitope specificity and longevity of a vaccine-induced human T cell response against HPV18 [J]. Int Immuno, 2005, 17(2):167-176.
[2] LE CAMPION A, POMMIER A, DELPOUX A, et al. IL-2 and IL-7 determine the homeostatic balance between the regulatory and conventional CD4+ T cell compartments during peripheral T cell reconstitution [J]. J Immunol, 2012, 189(7): 3339-3346.
[3] MONJI M, NAKATSURA T, SENJU S, et al. Identification of a novel human cancer/testis antigen, KM-HN-1, recognized by cellular and humoral immune responses [J]. Clin Cancer Res, 2004, 10(18): 6047-6057.
[4] AYYOUB M, HESDORFFER C S, METTHEZ G, et al. Identification of an SSX-2 epitope presented by dendritic cells to circulating autologous CD4 T cells [J]. J Immunol, 2004, 172(11): 7206-7211.
[5] GAO Y F, SUN Z Q, QI F, et al. Identification of a new broadspectrum CD8+ T cell epitope from over-expressed antigen COX-2 in esophageal carcinoma [J]. Cancer Lett, 2009, 284(1): 55-61.
[6] HUARTE E, SAROBE P, LU J, et al. Enhancing immunogenicity of a CTL epitope from carcinoembryonic antigen by selective amino acid replacements [J]. Clin Cancer Res, 2002, 8(7): 2336-2344.
[7] LIU L, ZHANG W, QI X, et al. Randomized study of autologous cytokine-induced killer cell immunotherapy in metastatic renal carcinoma [J]. Clin Cancer Res, 2012, 18(6): 1751-1759.
[8] MESIANO G, TODOROVIC M, GAMMAITONI L, et al. Cytokine-induced killer (CIK) cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors[J]. Expert Opin Biol Ther, 2012, 12(6): 673-684.
[9] SANGIOLO D. Cytokine induced killer cells as promising immunotherapy for solid tumors [J]. J Cancer, 2012, 2:363-368.[ Epub 2011 Jun 15].
[10] DE LA ROSA M, RUTZ S, DORNINGER H, et al. Interleukin-2 is essential for CD4+CD25+regulatory T cell function [J]. Eur J Immunol, 2004, 34(9): 2480-2488.
[11] WEISS L, LETIMIER F A, CARRIERE M, et al. In vivo expansion of naive and activated CD4+CD25+FOXP3+ regulatory T cell populations in interleukin-2-treated HIV patients [J]. Proc Natl Acad Sci U S A, 2010, 107(23):10632-10637.
[12] BRANDENBURG S, TAKAHASHI T, DE LA ROSA M, et al. IL-2 induces in vivo suppression by CD4+CD25+Foxp3+ regulatory T cells [J]. Eur J Immunol, 2008, 38(6): 1643-1653.
[13] GUO X, JIE Y, REN D, et al. In vivo-expanded CD4+CD25highFoxp3+ regulatory T cells controls corneal allograft rejection [J]. Hum Immunol, 2012, 73(11): 1061-1067.
[14] CESANA G C, DE RAFFELE G, COHEN S, et al. Characterization of CD4+CD25+ regulatory T cells in patients treated with high-dose interleukin-2 for metastatic melanoma or renal cell carcinoma [J]. J Clin Oncol, 2006, 24(7):1169-1177.
[15] KULHANKOVA K, ROUSE T, NASR M E, et al. Dendritic cells control CD4+CD25+Treg cell suppressor function in vitro through juxtacrine delivery of IL-2 [J]. PLoS One, 2012, 7(9): e43609.
[16] FU G F, CHEN X, HU H Y, et al. Emergence of peripheral CD3+CD56+ cytokine-induced killer cell in HIV-1-infected Chinese children [J]. Int Immunol, 2012, 24(3): 197-206.
The infuence of diferent concentrations of IL-2 on the cultivation system for peptide-specifc CTL induction in vitro
LI Anqi1,3, QI Yuanming2, ZHOU Zhejun1,2, GAO Yanfeng2, ZHANG Zhen1, ZHANG Yi1,2,4(1. Biotherapy Center, the First Afliated Hospital, Zhengzhou University, Zhengzhou 450052, Henan Province, China; 2. School of Life Sciences, Zhengzhou University, Zhengzhou 450001, Henan Province,China; 3. Department of Oncology, the First Afliated Hospital, Zhengzhou University, Zhengzhou 450052,Henan Province, China; 4. Engineering and Technology Research Center for Tumor Immunotherapy of Henan Province, Zhengzhou 450052, Henan Province, China)
ZHANG Yi E-mail: yizhang@zzu.edu.cn
Background and purpose: Cytotoxic T lymphocyte (CTL) plays a vital role in the process of antitumor immunology. The aim of this study was to investigate whether changes in concentration of IL-2 (50, 200 and 1 000 U/mL) would affect the sub-population and cytotoxic function of cells cultivated by peptide-specific CTL induction system in vitro and also observe whether using the concentration of IL-2 at a range of 50-1 000 U/mL isbenefcial to regulatory cells (Tregs) enrichment. Methods: Peripheral blood from 10 healthy donors and 10 cancer patients that were HLA-A2 positive, were collected in the study. HLA-A2 restricted CTL epitope P321 (ILIGETIKI)derived from COX-2 pulsed with diferent concentrations of IL-2 were used to induce peptides-specifc CTL in vitro. Flow cytometry was performed to analyze the proliferative capability, the proportion of different T-cell subsets,and secretion of perforin, granzyme B and IFN-γ. IFN-γ secretion was assessed by ELISpot assay. Results: High concentration of IL-2 increased the proliferative activity. The percentage of CD4+ T cells of cancer patient group was signifcantly higher than that of healthy donor group, while the percentage of CD8+ T cells of cancer patient group was signifcantly lower than that of healthy donor group. And there was no signifcant diference in the percentages of CD4+ T cells, CD8+ T cells and Tregs among groups with diferent IL-2 concentrations. No diference was seen in cytokine (perforin, granzyme B, IFN-γ) secretion capacity of CD8+ T cells. ELISpot study revealed that high-dose IL-2 resulted in the increasing of IFN-γ secretion. Conclusion: The sub-population and the function of cells cultured by peptide-specifc CTL induction system in vitro are not afected by diferent concentrations of IL-2. Furthermore, high concentrations of IL-2 (50-1 000 U/mL) do not provide the enrichment for Tregs. Higher concentration of IL-2 is likely to cause high secretion of IFN-γ in ELISpot assay. In order to exclude the distraction of NK cells or NKT cells, the concentration of 50 U/mL is better choice.
IL-2; CTL; Polypeptide vaccine; Treg; Cytotoxicity
10.3969/j.issn.1007-3969.2016.09.006
R73-35
A
1007-3639(2016)09-0756-07
2015-09-27
2015-12-30)
国家自然科学基金面上项目(81171986);国家自然科学基金国际(地区)合作与交流项目(81261120402)。通信作者:张毅 E-mail:yizhang@zzu.edu.cn
