基于小鼠全身动态PET扫描估算16α-18F-17β-雌二醇的人体内辐射剂量
2016-10-27张建平1何思敏1顾丙新1王明伟1
张建平1, 2, 3, 4,何思敏1, 2, 3, 4,顾丙新1, 2, 3, 4,王明伟1, 2, 3, 4,
张勇平1, 2, 3, 4,杨忠毅1, 2, 3, 4,章英剑1, 2, 3, 4
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学生物医学影像研究中心,上海 200032;
3.上海分子影像探针工程技术研究中心(筹),上海 200032;
4. 上海市质子重离子医院核医学科,上海 201321
基于小鼠全身动态PET扫描估算16α-18F-17β-雌二醇的人体内辐射剂量
张建平1, 2, 3, 4,何思敏1, 2, 3, 4,顾丙新1, 2, 3, 4,王明伟1, 2, 3, 4,
张勇平1, 2, 3, 4,杨忠毅1, 2, 3, 4,章英剑1, 2, 3, 4
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学生物医学影像研究中心,上海 200032;
3.上海分子影像探针工程技术研究中心(筹),上海 200032;
4. 上海市质子重离子医院核医学科,上海 201321
背景与目的:由小鼠全身动态PET显像数据获得药物在小鼠体内的生物分布,利用器官内剂量评估/指数模型分析软件(organ level inter dose assessment/exponential model,OLINDA/EXM) 估算18F-fluoroestradiol,18F-FES)在人体内的吸收剂量、全身有效剂量和有效剂量当量。方法:健康雌性KM小鼠尾静脉注射18F-FES后行160 min动态PET采集,经3D-OSEM/MAP算法重建获得PET图像。再行高分辨率CT显像,在PET/CT融合图像上,选取各脏器勾画感兴趣体积(volume of interest,VOI),获得相应时间-活度曲线和其曲线下面积、滞留时间、成年女性体模对应各器官的滞留时间。依据美国核医学会医用内照射剂量学委员会提出的内照射剂量计算方法(MIRD体系),利用OLINDA/EXM软件计算18F-FES在人体内的吸收剂量、全身有效剂量和有效剂量当量。最后所得数据与已公开发表计算18F-FES内照射剂量的文献数据行配对t检验,验证本文方法的有效性。结果:人体内胆囊壁、膀胱壁、小肠、上部大肠和肝脏的吸收剂量最高,分别为0.072 5、0.044 5、0.043 0、0.031 5和0.028 2 mGy/MBq。大脑、皮肤、乳腺、心脏壁和甲状腺吸收剂量最低,分别为0.005 2、0.001 1、0.001 2、0.001 2和0.001 3 mGy/MBq。对放射性敏感的器官如骨原细胞、胸腺和红骨髓的吸收剂量均较低,范围为0.001 4~0.021 8 mGy/MBq。全身平均吸收剂量为0.014 7 mGy/MBq,全身有效剂量当量为0.025 0 mGy/MBq,全身有效剂量为0.019 0 mSv/MBq。对于常规注射185 MBq18F-FES,人体有效剂量为3.515 0 mSv。与直接测量18F-FES在健康人体各主要脏器内吸收剂量的文献行配对t检验,差异无统计学意义(t=1.478,P=0.153)。结论:利用OLINDA/EXM软件根据小鼠全身动态PET/CT数据可有效估算18F-FES在人体内的吸收剂量和有效剂量。18F-FES可安全地用于人体,其有效剂量低于允许范围上限。该研究可为临床放心使用18F-FES提供依据。
16α-18F-17β-雌二醇; 体内生物分布; 内照射吸收剂量; 小鼠
雌二醇分子因具有不同生物活性的手性差异而分为α型和β型。α型雌二醇与DNA核酸结合后,可作为一个基因开关,激活或阻断一些基因的表达。16位α型雌二醇的H原子被18F取代后即得16α-18F-17β-雌二醇(18F-fluoroestradiol,18F-FES),其与雌激素受体(estrogen receptor,ER)的亲和力最强,能准确反映活体内ER空间分布、密度、亲和力及生物活性[1]。目前,约有20种18F标记的雌激素衍生物可被用于PET显像,如18F-βFMOX[2]等,但18F-FES仍被认为是最佳的ER靶向探针[3]。18F-FES最早于1984年由Kiesewetter等[4]标记成功,后经Lim等[5]改进提高了产出率,但制备过程仍然比较复杂,总的合成时间较长。为了简化合成,本中心研发了两步-两锅法自动化合成18F-FES[6-7],随后又结合自制的固相萃取装置,实现了“一锅法”合成和分离[8-9]。18F-FES作为一种PET显像剂可用于乳腺癌的诊断[10-13]、观察内分泌药物对ER的作用[14-15]和报告基因的显像[16]等。然而,18F-FES作为评价放射性药物安全性不可或缺的重要指标,在内照射吸收剂量方面研究甚少。本文利用18F-FES在小鼠体内分布,利用内照射计算软件OLINDA/EXM推算其在人体各器官的吸收剂量、全身有效剂量当量和有效剂量,为临床放心使用18F-FES提供依据。
1 材料和方法
1.1主要仪器、动物和软件
18F-FES由复旦大学附属肿瘤医院PET中心基于德国Siemens公司Explora FDG4合成模块[7]制作,放化纯在95%以上。小动物PET/ CT为德国Siemens公司生产的Inveon PET/CT。CRC-15R型活度仪为美国CAPINTEC公司产品。3只健康雌性KM小白鼠,由复旦大学上海医学院实验动物中心提供。内照射剂量估算软件为OLINDA/EXM /EXM 1.1,购自美国范德堡大学(Vanderbilt University)。
1.2小鼠动态PET/CT显像及数据重建
将3只小鼠用2.0%的异氟烷麻醉后置于PET/ CT检查床上,移动检查床使之置于PET视野内,然后经尾静脉弹丸式注射活度为(9.77±1.63)MBq,体积为0.1 mL的18F-FES,同时开始采集动态PET图像,采集160 min。再进行用于PET数据衰减校正的CT采集,用时约5 min。最后进行高分辨率CT采集,用时约20 min。全过程中小鼠均处于麻醉状态。
1.3 数据分析
首先将PET原始数据分出27帧(8×1、8×2、6×6和5×20 min),后使用3D-OSEM/MAP算法重建这些帧得到PET图像。重建后的PET图像与高分辨率CT图像融合后,使用西门子自带的数据处理软件包:Inveon Research Workplace,在脑、肺、肝脏、心脏、肾脏、小肠、上部大肠、下部大肠和膀胱手动勾画感兴趣体积(volume of interest,VOI)。为了减少PET图像在各临近器官的容积效应的影响,每一个VOI的大小要略小于实际器官。将勾画好的所有VOI投影到动态PET图像中,生成各靶器官的时间-活度曲线。
1.4小鼠体内放射性滞留时间
滞留时间分注射后160 min内和注射后160 min到无限长两部分时间。第一部分的滞留时间可利用梯形法计算时间-活度曲线下的面积而得到。在第二部分滞留时间内假设只有物理衰变没有生物衰变,于是其滞留时间可通过(ID%)160min/λ计算,此处(ID%)160min/λ为注射后160 min时刻某器官的百分注射剂量,λ为18F衰变常数。剩余器官滞留时间可通过所有器官物理允许的最大滞留时间2.62 h减去所有靶器官的滞留时间得到[17](此处2.62 h的获得见如下推导过程)。

1.5人体内的放射性滞留时间和吸收剂量计算
根据公式(1)可将小鼠各器官滞留时间转化成56.9 kg成年女性标准人体对应源器官滞留时间[18]。
将公式1计算出的各源器官不同时间点的滞留时间、全身剩余组织的滞留时间输入到OLINDA/EXM软件中,即可计算出成年女性体模各器官的吸收剂量和有效剂量当量。有效剂量可通过计算加权后的剂量当量获得[18]。
1.6统计学处理
本研究采用SPSS 11.5软件对数据进行处理。对得到的18F-FES各主要器官吸收剂量及全身有效剂量当量与文献[20]的相应数据行配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1小鼠各源器官时间-ID%曲线
从图1可知,18F-FES在肝脏、胆囊、大肠腔、小肠腔和膀胱的分布较多,其中肝脏的摄取高峰出现在注射后5 min左右,随后快速代谢,而在大肠、小肠、膀胱和胆囊随着时间的增加,滞留的放射性在增加,这主要是因为18F-FES是通过肝胆和泌尿系统代谢。在肺、心脏、大脑和肾脏的分布较少,摄取高峰为注射后5 min左右,随后快速的代谢,约20 min后,上述器官ID%均低于1%。
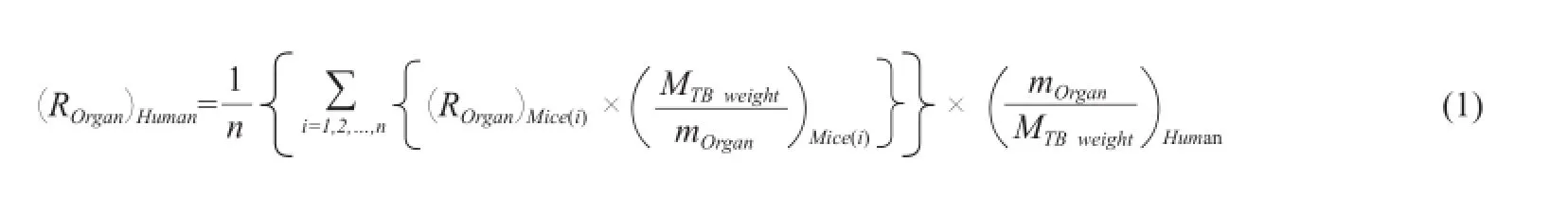

图 1 小鼠各源器官时间-ID%曲线Fig. 1 Activity-time curves in normal mice major organsULI: Upper large intestine; LLI: Lower large intestine
2.2小鼠各源器官体内放射性滞留时间
表1列出了18F-FES在小鼠各源器官内的放射性滞留时间(单位:MBq·h/MBq)。18F-FES在小肠、剩余组织、肝脏、胆囊、膀胱的滞留时间较长,分别为0.784 0、0.944 0、0.391 0、0.126 0和0.192 0。在心脏、大脑、肺和肾脏的滞留时间较短,分别为0.007 7、0.009 7、0.015 8和0.020 2。

表 1 18F-FES在小鼠各源器官内的滞留时间Tab. 1 Residence times of18F-FES for selected organs and remainder of body
2.3在人体内的滞留时间和剂量学研究结果
表2列出了18F-FES在成年女性人体体模内各源器官的放射性滞留时间。18F-FES在剩余组织、小肠、肝脏、肺和膀胱的滞留时间较长,分别为2.130 0、0.116 0、0.131 0、0.059 4和0.048 2。在心脏、下部大肠内容物、肾脏和大脑的滞留时间较短,分别为0.003 3、0.009 0、0.007 9和0.010 7。
根据各源器官放射性滞留时间,利用OLINDA/EXM软件计算得56.9 kg成年女性体模各器官吸收剂量及全身有效剂量见表3。胆囊壁、膀胱壁、小肠、上部大肠和肝脏的吸收剂量最高,分别为:0.072 5、0.044 5、0.043 0和0.031 5 mGy/MBq。大脑、皮肤、乳腺、心脏壁和甲状腺吸收剂量最低,分别为0.005 2、0.001 1、0.001 2和0.001 3 mGy/MBq。对放射性敏感的器官像骨原细胞、胸腺和红骨髓的吸收剂量均较低,范围为0.001 4~0.021 8 mGy/ MBq。全身平均吸收剂量为0.014 7 mGy/MBq,全身有效剂量当量为0.025 mSv/MBq,全身有效剂量为0.019 mSv/MBq。
与直接测量18F-FES在健康人体各主要脏器内吸收剂量的文献行配对t检验,差异无统计学意义(t =1.478,P=0.153)。
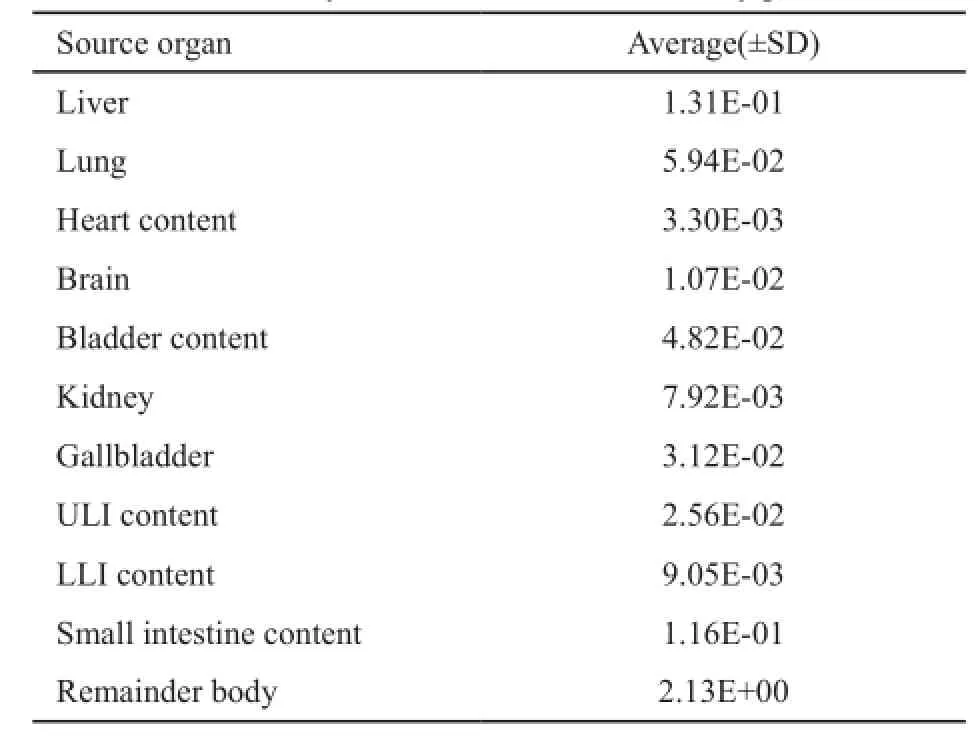
表 2 18F-FES在成年女性人体体模中各源器官内的滞留时间Tab. 2 Residence times of18F-FES for selected organs and reminder of body in normal adult female body phantoms

表 3 18F-FES致人体吸收剂量和有效剂量Tab. 3 Estimates of human absorbed dose and efective dose of18F-FES with adult phantoms
3 讨 论
各种PET/CT检查中新型的放射性药物不断涌现,致使各种放射性药物临床前安全评价显得非常重要。一种新型的PET/CT示踪剂药物在应用到临床之前,药物在人体内的生物分布和剂量学数据是必要的,这可以获得药物对人体各器官的吸收剂量。临床前小动物PET/CT可获得放射性药物在小动物体内的生物分布并得到在动物体内各器官的滞留时间,通过小动物与人体滞留时间转换公式得到该药物在人体内的生物分布和剂量分布是可行的[21-23]。本研究通过小动物PET/CT得到18F-FES在雌性小鼠体内分布,随即经过数学处理得到小鼠各靶器官的滞留时间,后采用由Kirschner等在 1975 年提出的将药物在动物体内的生物分布数据转到该药物在人体内的分布的方法,将小鼠靶器官滞留时间转换成18F-FES在人体各器官滞留时间,最后通过OLINDA/EXM软件得到18F-FES在成年女性体内各器官的吸收剂量并得到全身有效剂量当量和有效剂量[18]。Kirschner方法也有可能会引入误差,例如本研究利用该方法计算的18F-FES致人体肝脏的吸收剂量明显低于其他报道[21-22],但该方法简单省时而被广泛应用。此外,我们假设放射性分布可瞬间均匀分布于各器官,我们还假设所有没有测量器官的放射性活度归于剩余组织。在计算滞留时间的过程中,我们采用膀胱未排空模型,这样会导致各器官吸收剂量被高估,尤其是膀胱壁及膀胱周围组织。
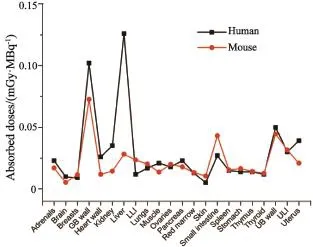
图 2 本研究结果与体外PET诊断的放射剂量数据比较[20]Fig. 2 Comparison of radiation dose estimate from an in vivo human PET study with18F-FES
18F-FES在雌性小鼠体内分布数据显示,其主要通过肝胆消化系统排泄,辅助以泌尿系统排泄。在肝脏、胆囊、小肠、大肠的放射性滞留明显多于膀胱和肾脏。160 min后除肠道、胆囊和膀胱外,其他器官放射性滞留均较少。在计算滞留时间过程中,我们采用了梯形法计数时间-活度曲线下的面积,这样有可能会低估各器官的放射性剂量。
将本研究获得的18F-FES致人体各器官吸收剂量及全身有效剂量当量与文献报道的通过直接人体PET/CT获得的全身各器官吸收剂量和全身有效剂量当量进行比较[20],结果发现,两种方法在肝脏、胆囊和小肠吸收剂量差别较大,这可能主要有两种原因:首先,药物在小鼠体内的代谢与在人体内的代谢不完全一致,18F-FES主要通过肝胆系统代谢,因此肝胆系统相较于其他器官得到的结果差异更大;其次,直接推算的方法本身也可能存在一些不足。其余组织两种方法获得的数据差别非常小,尤其所计算的全身有效剂量当量基本相同。配对t检验结果说明两组数据差异无统计学意义,这表明通过小鼠PET/CT动态数据可有效估算18F-FES在人体内的吸收剂量及有效剂量当量。另按一次静脉给药185 MBq计算,注射18F-FES致全身有效剂量低于5 mSv。本研究为18F-FES估算在人体内辐射安全性提供了重要的参考资料,同时也提供了一种非直接测定人体内照射吸收剂量的方法。
[1] MANKOFF D A, TEWSON T J, EARY J F, et al. Analysis of blood clearance and labeled metabolites for the estrogen receptor tracer [F-18]-16 alpha-fluoroestradiol (FES)[J]. Nucl Med Biol, 1997, 24(4): 341-348.
[2] JONSON S D, BONASERA T A, DEHDASHTI F, et al. Comparative breast tumor imaging and comparative in vitro metabolism of 16 alpha-[18F]fluoroestradiol-17beta and 16beta-[18F]fluoromoxestrol in isolated hepatocytes[J]. Nucl Med Biol, 1999, 26(1): 123-130.
[3] SUNDARARAJAN L, LINDEN H M, LINK J M, et al.18F-fluoroestradiol [J]. Semin Nucl Med, 2007, 37(6): 470-476.
[4] KIESEWETTER D O, KILBOURN M R, LANDVATTER S W, et al. Preparation of four fluorine-18-labeled estrogens and their selective uptakes in target tissues of immature rats [J]. J Nucl Med, 1984, 25(11): 1212-1221.
[5] LIM J L, ZHENG L, BERRIDGE M S, et al. The use of 3-methoxymethyl-16 beta, 17 beta-epiestriol-O-cyclic sulfone as the precursor in the synthesis of F-18 16 alpha fluoroestradiol[J]. Nucl Med Biol, 1996, 23(7): 911-915.
[6] 王明伟, 张勇平, 章英剑, 等. 乳腺癌雌激素受体分子影像探针16α-[18F]氟-17β-雌二醇的自动化合成 [J].核技术, 2009, 32(11): 839-844.
[7] 张勇平, 章英剑, 王明伟, 等. 基于Explora GN/LC双模块的16α-[18F]氟-17β-雌二醇全自动化合成 [J]. 中华核医学杂志, 2011, 31(3): 196-199.
[8] 杨忠毅, 王明伟, 张勇平, 等.18F-FES在正常大鼠及荷乳腺癌裸鼠体内的生物分布和显像 [J]. 上海医学影像, 2011, 20(3): 234-238.
[9] 孙艺斐, 杨忠毅, 张勇平, 等.18F-FES在乳腺癌患者体内摄取与病理免疫组化的关系[J]. 中国癌症杂志, 2014, 24(2): 128-134.
[10] PETERSON L M, MANKOFF D A, LAWTON T, et al. Quantitative imaging of estrogen receptor expression in breast cancer with PET and18F-fluoroestradiol [J]. J Nucl Med, 2008, 49(3): 367-374.
[11] GEMIGNANI M L, PATIL S, SESHAN V E, et al. Feasibility and predictability of perioperative PET and estrogen receptor ligand in patients with invasive breast cancer [J]. J Nucl Med, 2013, 54(10): 1697-1702.
[12] MINTUN M A, WELCH M J, SIEGEL B A, et al. Breast cancer: PET imaging of estrogen receptors [J]. Radiology, 1988, 169(1): 45-48.
[13] VAN KRUCHTEN M, DE VRIES E G, BROWN M, et al. PET imaging of oestrogen receptors in patients with breast cancer[J]. Lancet Oncol, 2013, 14(11): 465-475.
[14] PAQUETTE M, TREMBLAY S, BÉNARD F, et al. Quantitative hormone therapy follow-up in an ER+/ERαKD mouse tumor model using FDG and [11C]-methionine PET imaging [J]. EJNMMI Res, 2012, 2(1): 61.
[15] LINDEN H M, KURLAND B F, PETERSON L M, et al. Fluoroestradiol positron emission tomography reveals differences in pharmacodynamics of aromatase inhibitors, tamoxifen, and fulvestrant in patients with metastatic breast cancer [J]. Clin Cancer Res, 2011, 17(14): 4799-4805.
[16] FURUKAWA T, LOHITH T G, TAKAMATSU S, et al. Potential of the FES-hERL PET reporter gene system basic evaluation for gene therapy monitoring [J]. Nucl Med Biol, 2006, 33(1): 145-151.
[17] VAN LAERE K, KOOLE M, SANABRIA B S, et al. Whole-body biodistribution and radiation dosimetry of the human cannabinoid type-1 receptor ligand18F-MK-9470 in healthy subjects [J]. J Nucl Med, 2008, 49(3): 439-445.
[18] STABIN M G, SPARKS R B, CROWE E. OLINDA/EXM: the second-generation personal computer software for internal dose assessment in nuclear medicine [J]. J Nucl Med, 2005, 46(6):1023-1027.
[19] KEENAN M A, STABIN M G, SEGARS W P, et al. RADAR realistic animal model series for dose assessment [J]. J Nucl Med, 2010, 51(3): 471-476.
[20] MANKOFF D A, PETERSON L M, TEWSON T J, et al.18F-fluoroestradiol radiation dosimetry in human PET studies[J]. J Nucl Med, 2001, 42(4): 679-684.
[21] CONSTANTINESCU C C, GARCIA A, MIRBOLOOKI M R, et al. Evaluation of18F-nifene biodistribution and dosimetry based on whole-body PET imaging of mice[J]. Nucl Med Biol, 2013, 40(2): 289-294.
[22] CONSTANTINESCU C C, SEVRIOUKOV E, GARCIA A, et al. Evaluation of18F-Mefway biodistribution and dosimetry based on whole-body PET imaging of mice [J]. Mol Imaging Biol, 2013, 15(2): 222-229.
[23] ZHANG J P, ZHANG Y J, XU J Y, et al. Radiation dosimetry estimates of 18F-fluoroacetate based on biodistribution data of rats[J]. Appl Radiat Isot, 2012, 70(1): 332-335.
Radiation dosimetry estimates of18F-fluoroestradiol based on whole-body PET imaging of mice
ZHANG Jianping1,2,3,4, HE Simin1,2,3,4, GU Bingxin1,2,3,4, WANG Mingwei1,2,3,4, ZHANG Yongping1,2,3,4, YANG Zhongyi1,2,3,4, ZHANG Yingjian1,2,3,4(1. Department of Nuclear Medicine, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Center for Biomedical Imaging, Fudan University, Shanghai 200032, China; 3. Shanghai Engineering Research Center for Molecular Imaging Probes, Shanghai 200032, China; 4. Shanghai Proton and Heavy Ion Center, Shanghai 201321, China)
ZHANG Yingjian E-mail: yjzhang111@aliyun.com
Background and purpose: In preparation for using this tracer in humans, this study estimated thedosimetry of18F-FES with the method established by MIRD based on whole-body PET imaging of mice. Methods:Three female mice received Ⅳ tail injections of18F-FES and were scanned for 160 min in an Inveon dedicated PET/ CT scanner. This study selected some important organs (brain, lung, liver, heart wall, small intestine, large intestine,kidney and urinary bladder), computed their residence times. Then, the residence times in mice organs were converted to human values using scale factors based on diferences between organ and body weights. OLINDA/EXM 1.1 software was used to compute the absorbed human doses in multiple organs for both adult female and adult male body phantoms. Results: The highest absorbed doses in gallbladder wall, urinary bladder wall, small intestine, upper large intestine and liver are 0.072 5, 0.044 5, 0.043 0, 0.031 5 and 0.028 2 mGy/MBq, respectively. The organs which have the lowest absorbed doses were brain (0.005 2 mGy/MBq), followed by skin (0.001 1 mGy/MBq), breast (0.001 1 mGy/MBq), heart wall (0.001 2 mGy/MBq) and thyroid (0.001 2 mGy/MBq). The mean absorbed doses for the other major organs ranged from 0.009 5 to 0.023 5 mGy/MBq. The total mean efective dose is 0.019 0 mSv/MBq and the mean efective doses equivalent is 0.025 0 mGy/MBq. A 370-MBq injection of18F-FES leads to an estimated efective dose of 7.03 mSv for the female. There was no statistical diference in the doses results obtained from direct measurement of18F-FES absorption in normal people between previous publications by others and our work. Conclusion: The whole-body mouse imaging can be used as a preclinical tool for initial estimation of the absorbed doses of18F-FES in humans. Furthermore,the potential radiation risk associated with18F-FES imaging is well within the accepted limits.
18F-FES; Biodistribution; Radiation dosimetry; Mice
10.19401/j.cnki.1007-3639.2016.09.008
R730.44
A
1007-3639(2016)09-0770-06
2015-05-15
2016-01-10)
上海市科委项目(12431900208;上海市分子影像探针工程技术研究中心项目(14DE2251400))。通信作者:章英剑 E-mail:yjzhang111@aliyun.com
