多倍体金线莲一次性成苗及移栽
2016-10-26何碧珠吴沙沙邹双全兰思仁
何碧珠, 吴沙沙, 邹双全, 兰思仁
(1.福建农林大学园艺学院;2.福建农林大学海峡兰花保育中心;3.福建农林大学园林学院,福建 福州 350002)
多倍体金线莲一次性成苗及移栽
何碧珠1,2, 吴沙沙2,3, 邹双全2, 兰思仁2,3
(1.福建农林大学园艺学院;2.福建农林大学海峡兰花保育中心;3.福建农林大学园林学院,福建 福州 350002)
筛选多倍体金线莲一次性成苗的最佳培养基配方并探讨不同基质对移栽苗生长的影响.结果表明:MS+1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆+3%蔗糖+0.65%琼脂+0.15%活性炭为最佳一次性成苗培养基配方;经120 d培养即可获得生长、生根同步完成的组培瓶苗,具有长势一致(株高5~7 cm),茎节多且粗(茎粗1.19 cm),根系发达(每株2~3条根)等优势;最佳移栽基质为:泥炭土∶碎松树皮=1∶1(体积比),移栽苗成活率(92%)最高,长势最好,植株增高(1.53 cm)、增重(0.43 g)均达到最大,折干率(13.31%)相对较高.
金线莲; 多倍体; 一次性成苗; 移栽
金线莲(Anoectochilusroxburghii)为兰科(Orchidaceae)开唇兰属(Anoectochilus)地生兰[1-2],在民间素有“药王”、“神药”和“金草”等美称,主要用于治疗高血压、糖尿病、心脏病、肺炎、急慢性肝炎和肾炎等症,具有广泛的药用价值和保健作用[3],市场需求量大,但在自然条件下结实率低、自身繁殖能力差、生长缓慢、抗性弱[4].多倍体植株具有根、茎、叶等营养器官较二倍体大,植株生长速率和有机物合成速率快,抗逆性增强及有效药用成分增加的优势[5].多倍体金线莲产业化生产对于满足市场需求具有重要意义.
目前生产上所用的金线莲种苗均来源于组培繁育苗,需经增殖、壮苗和生根等多个阶段[6-7],生长周期长,且瓶苗存在生长弱小、茎节徒长、炼苗时间长、栽培适应性差、缓苗速度慢和成活率低等问题,成为金线莲产量、有效成分积累以及产品品质提升的限制因子,增加了企业生产成本和种植难度,影响产业发展.一次性成苗方法在朱顶兰(Amryllisvittata)[8]和枣树(Ziziphusjujuba)[9]等植物组织培养中有报道过,具有成苗时间短和成本低等优点,但有关多倍体金线莲一次性成苗快速繁殖技术及在产业化生产中的应用尚未见报道.
本试验以经鉴定的多倍体金线莲继代植株茎段作为外植体,进行一次性成苗培养基和移栽基质的筛选,研究结果对于缩短培养时间、降低培育成本、减少工作量、提高产品品质、增加有效活性成分和产量具有重要的实践意义.
1 材料与方法
1.1材料

A.野生植株;B.四倍体无菌植株.图1 金线莲植株Fig.1 A.roxburghii
以福建永泰藤山自然保护区的野生金线莲(图1A)为试材建立无菌体系,在培养基中添加一定量的秋水仙素诱变多倍体植株.对变异植株的株高,茎节粗细程度、数量,叶片数量、大小、厚度等形态学特征进行初步筛选,经细胞学鉴定确定后,将四倍体无菌植株(图1B)用于一次性成苗繁育和移栽研究.
1.2多倍体植株一次性成苗的诱导
在超净工作台上将高6~8 cm,具3~4个节间、3~4片叶的粗壮植株从丛生芽中选出,切成带一个茎节,长1~2 cm的茎段接种到经高压灭菌的一次性成苗培养基上,接种茎段有序平放在培养基上,以增加培养材料与培养基的接触面积及有效苗的形成.以MS为基本培养基,加入0.65%琼脂和0.15%活性炭,设计6-BA(0、1.0、2.0 mg·L-1)、NAA(0.5、1.0、1.5 mg·L-1)和有机添加物(3 mg·L-1花宝1号、150 g·L-1土豆泥、3 mg·L-1蛋白胨)三因素三水平的正交设计,共设1~9号处理,每处理接种7瓶,每瓶4个芽,重复4次.培养室温度(23±2) ℃,接种后第1周置于黑暗培养10 d,后光照培养11 h·d-1,光照度1 500~2 000 lx.培养120 d后对各组苗的生长情况进行记录,测定其增殖芽数、株高(用游标卡尺测定茎基部至最高芽顶端的长度)、茎粗(用游标卡尺测定茎中部直径)和生根数(每个处理所有植株根系总条数/植株总数).株高5~7 cm、根数>1.5条的植株为有效苗,有效苗/%=有效苗数/接种数×100.
1.3炼苗与移栽
将一次性成苗培养基培养4个月的瓶苗(苗高6~8 cm,单株苗重1.05 g,具有2~3条根系,根长1.0~2.0 cm)移到自然光条件下炼苗(夏季用黑色遮荫网搭建炼苗棚)5~7 d后从瓶内取出,用自来水清洗根部附着的残留培养基,将清洗干净的小苗放入竹框中置阴凉处阴干至不滴水为止,根部用1%多菌灵浸泡消毒5~10 min后用于移栽.
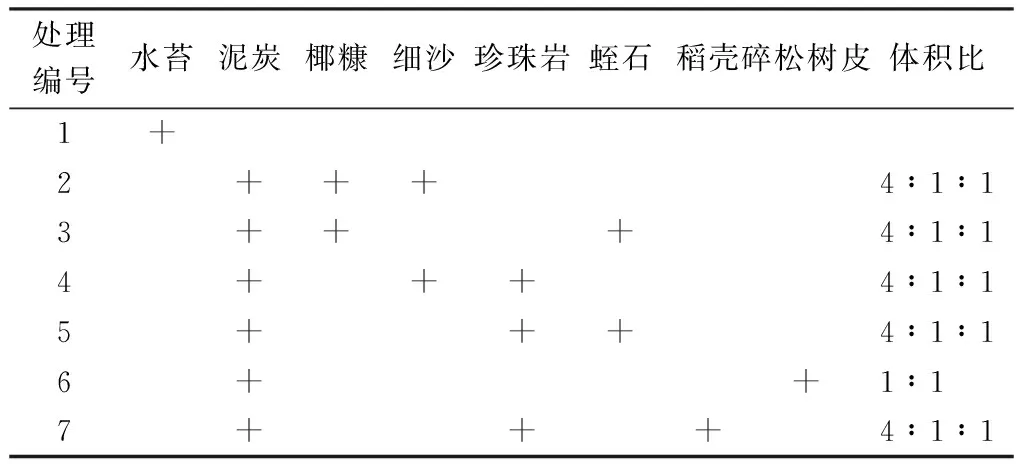
表1 不同移栽基质的配方Table 1 Composition of different cultivation matrixes
移栽基质选用泥炭、碎松树皮、蛭石、珍珠岩、椰糠、稻壳、细沙和水苔,按不同体积比混合(表1).移栽基质经过消毒后装入50孔穴盘(规格:5 cm×10 cm)中,挑选生长一致的瓶苗进行移栽,每种基质种植50株,移栽后浇足定根水.将移栽好的穴盘置于塑料大棚中,大棚光照度控制在3 000 lx左右,温度控制在25~28 ℃,日常管理中根据土壤干湿程度进行浇水.种植3个月后统计移栽成活率,把苗挖出、洗净、擦干,测量每株株高和鲜重,然后在80 ℃的恒温干燥箱中烘干至恒重,测量其干重,计算净增高、净增重和折干率.折干率%=(鲜种-干重)/鲜种×100.
1.4数据处理
试验数据采用Excel和SPSS 19.0软件进行分析.
2 结果与分析
2.1不同培养基对金线莲一次性成苗培养的影响
将带一个茎节,长1~2 cm的茎段接种到一次性成苗培养基中,接种40 d后茎节处萌发出1~3个芽,随后芽体生长,新叶伴随长出;培养3个月,植株长成具有3~4个节的小苗,在基部第1和2节处分布许多白色绒毛并长出根系;随着茎节不断生长,根系也逐渐变长,根颜色由白色转为深绿色,部分根系扎入培养基中;培养120 d可获得生长与生根同时完成且植株生长一致可直接进行移栽的健壮瓶苗.
不同培养基一次性成苗的培养情况如图2所示.从表2可知:不定芽增殖倍数最大的是9号处理,培养120 d不定芽增殖2.91个(图2I),其他依次为6、5、7、8、4、1、2和3号处理,长出有效芽较少,生长不一致(图2A~H);株高和茎粗最大的是6号处理,其株高和茎粗分别为7.08、1.19 cm,其他依次为2、7、3、8、4、9、5和1号处理,有效芽较少,生长不一致导致株高和茎粗存在较大差异;生根数最多的是3号处理,培养4个月后生根2.21条,其他依次为6、2、5、4、1、8、9和7号处理.

A~I依次为1~9号处理培养120 d的生长状态.
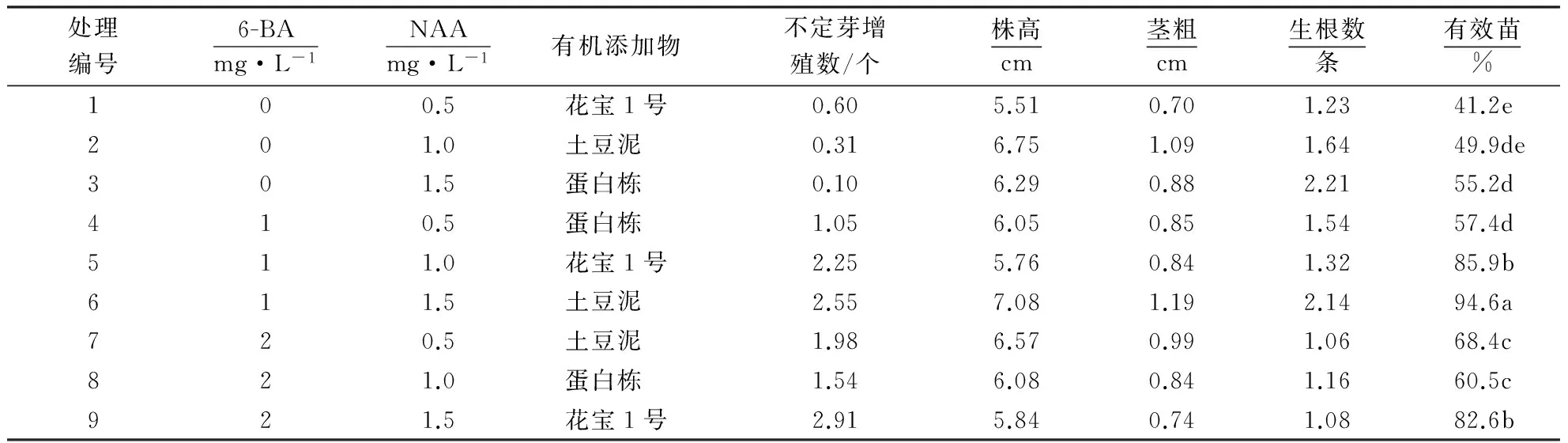
处理编号6-BAmg·L-1NAAmg·L-1有机添加物不定芽增殖数/个株高cm茎粗cm生根数条有效苗%100.5花宝1号0.605.510.701.2341.2e201.0土豆泥0.316.751.091.6449.9de301.5蛋白栋0.106.290.882.2155.2d410.5蛋白栋1.056.050.851.5457.4d511.0花宝1号2.255.760.841.3285.9b611.5土豆泥2.557.081.192.1494.6a720.5土豆泥1.986.570.991.0668.4c821.0蛋白栋1.546.080.841.1660.5c921.5花宝1号2.915.840.741.0882.6b
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
对表2中不定芽增殖数进行极差分析,从极差R的大小(表3)可以看出,3个因素对不定芽增殖数影响程度大小为:6-BA>有机添加物>NAA.由K的大小和不定芽增殖数可知,培养基的最优组合为2.0 mg·L-16-BA+1.5 mg·L-1NAA+2.0 mg·L-1花宝1号.
类似地,3个因素对株高影响程度大小为:有机添加物>NAA>6-BA.比较K的大小和株高可知,培养基较佳组合为1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆.3个因素对茎粗影响程度大小为:有机添加物>6-BA>NAA.比较K的大小和茎粗可知,培养基较佳组合也是1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆.3个因素对生根数影响程度大小为:6-BA>NAA>有机添加物.比较K的大小和株高可知,培养基较佳组合为0.0 mg·L-16-BA+1.5 mg·L-1NAA+2.0 mg·L-1蛋白胨.

表3 4个测量指标的极差分析Table 3 Extreme difference analysis on 4 parameters of one-step seedling formation
2.23个因素对金线莲4个测量指标的效应检验和多重比较
为进一步了解不同处理因素对一次性成苗不同考查指标的影响,以便找出更佳的一次性成苗培养基,对表2、3作进一步分析,进行各因素主体间的效应检验和多重比较,结果如表4、5所示.

表4 4个测量指标的效应检验Table 4 Tests of between-subjects effects on 4 parameters
从表4可知:因素A对不定芽增殖数的影响达到极显著水平,因素B、C对不定芽增殖数的影响达到显著水平.从F的大小看出,3个因素对不定芽增殖数影响程度大小为:6-BA>有机添加物>NAA,其结果与极差R的比较结果一致.对影响不定芽增殖数的3个因素3个水平进行SSR检验,结果(表5)显示:在0.05水平上,因素6-BA的第1水平与第2、3水平存在显著差异,第2水平与第3水平的差异不显著;因素NAA和因素有机添加物的第3水平与第1、2水平存在显著差异,第1水平与第2水平的差异不显著.

表5 4个测量指标的SSR检验Table 5 SSR test on 4 index in orthogonal experiment
从表4可知:因素B、C对株高的影响达到极显著水平,因素A对株高的影响达到显著水平.从F的大小看出,3个因素对株高影响程度大小为:有机添加物>NAA>6-BA,其结果与极差R的比较结果一致.对影响株高的3个因素3个水平进行SSR检验,结果(表5)显示:在0.05水平上,因素6-BA的第2水平与第1、3水平存在显著差异,第1水平与第3水平的差异不显著;因素NAA和因素有机添加物3个水平间的差异极显著.
从表4可知:因素C对茎粗的影响达到极显著水平,因素A、B对茎粗的影响达到显著水平.从F的大小看出,3个因素对茎粗影响程度大小为:有机添加物>6-BA>NAA,其结果与极差R的比较结果一致.对影响茎粗的3个因素3个水平进行SSR检验,结果(表5)显示:在0.05水平上,因素6-BA的第2水平与第1、3水平存在显著差异,第1水平与第3水平的差异不显著;因素NAA的第1水平与第2、3水平存在显著差异,第2水平与第3水平的差异不显著;因素有机添加物3个水平间的差异极显著.
从表4可知:因素A、B对生根数的影响达到极显著水平,因素C对生根数的影响不显著.从F的大小看出,3个因素对生根数影响程度大小为:6-BA>NAA>有机添加物,其结果与极差R的比较结果一致.对影响生根数的3个因素3个水平进行SSR检验,结果(表5)显示:在0.05水平上,因素6-BA的第3水平与1、2水平存在显著差异,第1水平与第2水平的差异不显著;因素NAA的第3水平与第1、2水平存在显著差异,第1水平与第2水平的差异不显著;因素有机添加物的第1水平与第2、3水平存在显著差异,第2水平与第3水平的差异不显著.
综合评价6-BA、NAA、有机添加物对不定芽增殖数、株高、茎粗和生根数的影响,对茎段培养4个月后诱导出的不定芽增殖数、株高、茎粗和生根数进行极差分析、4个测量指标的效应检验和SSR检验.结果表明:对不定芽增殖数影响程度大小为:6-BA>有机添加物>NAA,最优组合为2.0 mg·L-16-BA+1.5 mg·L-1NAA+2.0 mg·L-1花宝1号;对株高影响程度大小为:有机添加物>NAA>6-BA,最优组合为1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆;对茎粗影响程度大小为:有机添加物>6-BA>NAA,最优组合为1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆;对生根数影响程度大小为:6-BA>NAA>有机添加物,最优组合为0 mg·L-16-BA+1.5 mg·L-1NAA+2.0 mg·L-1蛋白胨.一次性成苗的培养目标是有效芽数量多,茎节纤维多且粗壮,长势一致,根系粗壮且多,综合考虑这些指标,一次性成苗培养的最优培养基为MS+1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1土豆+ 3%蔗糖+0.65%琼脂+0.15%活性炭.
2.3不同基质对金线莲移栽苗生长的影响
从表6和图3可以看出,6(泥炭+碎松树皮)、1(水苔)和5号(泥炭+珍珠岩+蛭石)基质移栽苗的成活率均高于90%,且长势相对较好.6号基质移栽苗长势最好,叶片大、饱满,顶芽长出新叶,茎粗壮、较硬(图3F),植株增高(1.53 cm)和增重(0.43 g)均达到最大,折干率(13.31%)相对较高;1号基质移栽苗虽长势较好,叶片大,有新叶长出,但基部叶片枯萎(图3A),折干率(9.53%)低;5号基质移栽苗长势优良,叶片饱满,部分叶片发黄脱落,顶芽长出新叶,茎杆挺直.7号基质(泥炭+珍珠岩+稻壳)移栽苗与5号基质移栽苗的长势相当,7号基质加入稻壳对茎的生长有利,茎段纤维含量高,折干率最高,同时成活率高于85%.4(泥炭+珍珠岩+细沙)、3(泥炭+椰糠+蛭石)和2号基质(泥炭+椰糠+细沙)移栽苗的成活率均低于80%.其中,4和3号基质移栽苗的长势较差,基部叶片发黄掉落,茎杆细弱;2号基质移栽苗的长势最弱,生长现象不明显,大部分叶片脱落,叶片柔软,茎细小,净增高、净增重和折干率均最低.

表6 不同基质对金线莲移栽苗生长的影响1)Table 6 Effects of different media on growth of A.roburghii
1)数据以平均值±标准差表示;同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).

A~G分别为1~7号基质移栽苗栽培3个月的生长情况.
3 讨论与结论
3.1金线莲一次性成苗与分段成苗的差异
金线莲分段成苗一般需经增殖培养和生根培养两个诱导过程才能完成,增殖培养需要120 d左右,生根培养需要30 d,为了增加增殖系数,激素用量比较大,从而使有效苗所占比例减少[10-15].分段成苗的植株生长弱小(单株重0.875 g)、茎节徒长、炼苗时间长(需30 d)、环境适应力差、缓苗速度慢、成活率低(60%~70%)、抵御病虫害能力差、连续生长时间短(大量存活仅60~90 d),直接影响产量、品质和内含物的变化,增加生长成本和种植难度.一次性成苗从茎段开始培养到成苗、生根再到可移栽的时间只需120 d,一次性完成生长过程,在培养期间无需更换培养基,获得培养时间短(培养4个月后直接移栽)、扩繁系数高、植株生长一致、炼苗时间短(7~10 d)、适应性强、缓苗速度快(7~10 d)、病虫害少、茎粗(直径4 mm)、根系发达(3根以上)、叶片颜色深且绒毛状明显、叶脉金线明晰、连续生长时间长(2 a以上)的植株,培育时间缩短1/5,节约能耗30%,节约劳动力50%.
金线莲分段成苗的繁殖系数一般为2.5~5.2[16-18],而一次性成苗的增殖率虽然仅为2.55,但一次性成苗的有效成苗率、移栽成活率比前者高.从育苗成本上看,由于分段培养添加了大量激素,植株表现为茎细小、水分含量高、自身营养积累欠缺、苗体弱、根系发育不良,因此在规模化生产上要想提高成活率的有效方法是延长炼苗时间,分段成苗的炼苗时间需30~40 d[19],而一次性成苗的炼苗时间仅为7~10 d.在生产实践中增加炼苗时间并不是提高移栽苗成活率的主要因素,更直接的因素是不定芽诱导培养基的合理构成及有机添加物的合理配比,才能使苗生长得更加健壮.
3.2金线莲一次性成苗培养基的选择
兰科植物组织培养中常用的有机添加物都是一些成分较复杂的天然复合物,如土豆含有脂肪、蛋白质及少量的Ca、Mg、K等多种营养成分;蛋白胨含有机氮化合物、维生素和糖类物质;花宝一号含有N、P、K等丰富的矿质元素.这些有机添加物的使用有利于生根和壮苗.鉴于有机添加物在兰科植物生长发育中的作用,本试验在金线莲一次性成苗的培养基中分别添加了土豆泥、蛋白胨和花宝一号,随着有机添加物比例的增加促进了株高、茎粗、生根数和有效成苗率的提高.有机添加物在瓶苗培养过程中的效果依次为土豆泥、花宝一号、蛋白胨.
金线莲一次性成苗培养综合考虑的是在同一空间同一时间内生长有效芽数多、生长健壮、长势一致、根系发达等指标,选择出最优的培养基为MS+1.0 mg·L-16-B+1.5 mg·L-1NAA+150 g·L-1土豆泥+3%蔗糖+0.65%琼脂+0.15%活性炭,一次性成苗每个茎段成苗数2.55株,每株根数2.14条.此结果与江建铭[10]的“金线莲一步成苗中每个外植体增殖4.8株、每株根数2.5条”结果差异较大,可能由培养基成分构成及外植体接种方式不同引起.金线莲一次性成苗培养采用平放接种茎段的方式诱导有效芽.
3.3金线莲移栽苗和移栽基质的选择
瓶苗的质量对移栽成活率的影响很大,移栽时要选择株高适中(6~7 cm)、茎粗壮、具2条以上根系的瓶苗进行移栽.若苗过小,根系发育不好,移栽后缓苗时间长,适应力差,抵抗病虫害能力差,容易死亡;苗过大,移栽后地上部分蒸腾作用大,遇高温天气时容易萎蔫.此结果与黄慧莲等[12]的研究结果相近.移栽时应选择株高5 cm以上、茎径0.18 cm以上、具2~4条根系、生长状况良好的苗,才能保证有高的成活率.
金线莲属浅根性植物,根系不发达,生长在土壤表层,要求土质疏松、透气、有机质含量高等,且金线莲瓶苗生长在无菌、营养丰富的环境下,适宜外界环境的能力较差,移栽时基质的选择很关键.胥学峰[13]认为,单一基质(蛭石或木屑)较适宜金线莲移栽苗的生长,移栽成活率高达95%;吴坤林[14]认为,细沙、珍珠岩和泥炭按一定比例混合用于金线莲种植,成活率可达90%.不同移栽基质对金线莲成活率及生长的影响不同,这与基质构成、种植品种的不同有关.本试验结果表明,泥炭与碎松树皮按1∶1的体积比混合最适宜金线莲生长,成活率达92%,生长良好.泥炭保水能力好,但透气性差,易板结;而碎松树皮呈细块状,吸水性差,孔隙度大,二者结合互相取长补短,防止基质板结,保水透气性好.
[1] 陈裕,林坤瑞.金线莲生长发育与光照强度关系[J].福建热作科技,1996,2(4):22-23.
[2] 蔡文燕,肖华山,范秀珍.金线莲研究进展[J].亚热带植物科学,2003,32(3):68-72.
[3] 江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1985:2008.
[4] 马志杰, 胡宏友. 民间药材金线莲研究动态(综述)[J]. 亚热带植物科学, 2002, 31(S): 27-31.
[5] 陶抵辉.植物多倍体的研究与应用[J].生物技术通报,2010(7):22-27.
[6] 王建明,王松良,詹巧杰,等.金线莲组织培养的条件优化研究[J].中国现代中药,2013,15(1):45-46.
[7] 黄德贵,陈振东.金线莲组织培养与人工栽植研究:无菌外植体建立技术和配方[J].福建热作科技,1993(3):11-14.
[8] 储成才,李大卫,余慧琳.朱顶兰组织培养一次成苗[J].植物生理学通讯,1989(3):47.
[9] 陈宗礼,薛皓,延志莲,等.枣树试管苗一次成苗培养基的研究[J].西北植物学,2005,25(1):57-63.
[10] 江建铭.一种药用金线莲组织培养一步成苗快速繁殖:200810059233.3[P].2008-07-09.
[11] CUMPIENKO G S, PAVIOVA N A. Characteristics of the distant of gamma-irradiation of seeds for diploid and poly-ploidy paints [J]. Radiasionnaya Biologiya Radioekologiya, 1995,35(4):518.
[12] 黄慧莲,刘贤旺.金线莲试管苗移栽试验研究[J].江西科学,2001,19(1):52-54.
[13] 胥学峰.金线莲的种苗繁育及栽培技术的研究[D].延吉:延边大学,2007.
[14] 吴坤林.金线莲快繁及工厂化生产中间试验[J].中药材,1997,20(12):595-597.
[15] 孟志霞,郭顺星,于雪梅,等.植物生长调节剂对福建金线莲丛生芽增殖的影响[J].中国药学杂志,2008,43(23): 1 777-1 780.
[16] 梁丽凤,林晓林,伍宇雁,等.金线莲增殖和生根培养条件的优化[J].仲恺农业工程学院学报,2014,27(3):5-8,13.
[17] 祁永琼,王丽莉,罗瑞芳,等.金线莲不同外植体组织培养成苗技术探讨[J].江苏农业科学,2014,42(8):57-59.
[18] 刘荣,申刚,罗晓青,等.金线莲丛生芽增殖的液体悬浮培养条件优化[J].江苏农业科学,2015,43(8):61-62,102.
[19] 陈汉鑫.金线莲组培苗设施栽培技术[J].南方园艺,2015,26(1):60-62.
(责任编辑:施晓棠)
One-step seedling formation and transplanting of polyploidAnoectochilusroxburghii
HE Bizhu1,2, WU Shasha2,3, ZOU Shuangquan2, LAN Siren2,3
(1.College of Horticulture; 2.Orchid Conservation Center of Straits between Taiwan and Mainland; 3.College of Landscape Architecture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
PolyploidAnoectochilusroxburghiihas bigger vegetative organs than its diploid plant, such as roots, stems, leaves, besides which it also has higher growth rate and organics synthesis rate, stronger resistance, and higher medicinal ingredients. In this study, one-step seedling formation culture medium and transplanting of polyploidA.roxburghiiwere studied. The results showed: MS+1.0 mg·L-16-BA+1.5 mg·L-1NAA+150 g·L-1potato. mud+3% sucrose+0.65% agar+0.15% activated carbon is the optimum culture medium for one-step seedling formation. Fully growing plants formed from one stem, 5-7 cm in height, 1.19 cm in stem diameter, and 2-3 healthy roots can be gained after 120 d′s cultivation. The optimum transplanting medium is matrix peat∶bark=1∶1 (v∶v) with 92% transplanting survival rate, 1.53 cm increase in height, 0.43 g increase in weight, and 13.31% dry discount rate. To solve transplanting problem of polyploidAnoectochilusroxburghiibecause of its larger vegetative organs and high growth rate, one-step seedling formation culture medium and transplanting of polyploidA.roxburghiiwere studied. The results showed that MS with 1.0 mg·L-16-BA, 1.5 mg·L-1NAA,150 g·L-1potato mud, 3% sucrose, 0.65% agar and 0.15% activated carbon was the optimal culture medium for one-step seedling formation. After 120 d cultivation, plants fully developed to 5~7 cm in height, 1.19 cm in stem diameter, and 2~3 healthy roots. The optimum transplanting medium was matrix peat : bark = 1∶ 1 (v∶v) with 92% transplanting survival rate. Moreover, it resulted in 1.53 cm increase in height, 0.43 g increase in weight, and high dry discount rate at 13.31%.
Anoectochilusroxburghii; polyploid; one-step seedling formation; transplanting
2016-03-28
2016-04-26
中央财政林业科技推广示范项目([2014]YC14号).
何碧珠(1960-),女,高级实验师.研究方向:植物生物技术及遗传资源.Email:954196684@qq.com.通讯作者兰思仁(1963-),男,教授,博士生导师,博士.研究方向:园林植物资源.Email:lsr9636@163.com.
S567.23+9
A
1671-5470(2016)05-0522-07
10.13323/j.cnki.j.fafu(nat.sci.).2016.05.008
