大鼠颈动脉体免疫组化实验方法
2016-10-26贾祥磊李超红蔡瑞艳姜淑娴刘玉珍
贾祥磊 李超红 蔡瑞艳 冯 杰 姜淑娴 刘玉珍
(新乡医学院第一附属医院 河南省神经病学研究所,河南 卫辉 453100)
大鼠颈动脉体免疫组化实验方法
贾祥磊李超红蔡瑞艳冯杰姜淑娴刘玉珍
(新乡医学院第一附属医院河南省神经病学研究所,河南卫辉453100)
目的运用石蜡切片免疫组化试验方法检验大鼠颈动脉体。方法通过对颈动脉体的固定,石蜡包埋,切片。分析切片的质量及其原因,运用免疫组化方法标记大鼠颈动脉体标记物——酪氨酸羟化酶。结果大鼠颈动脉体在100%的酒精和二甲苯的脱水时间18 min为宜。将颈动脉体水平放置包埋和修剪之后更好进行石蜡切片操作。结论应用免疫组化方法研究颈动脉体的过程需要小心操作,反复练习,及时总结,才能熟能生巧,最终掌握适用于颈动脉体的研究方法。
颈动脉体;石蜡切片;免疫组化
颈动脉体外周化学感受器通过感受外周血氧分压的变化介导睡眠呼吸暂停综合征、高血压及慢性心力衰竭等病理状况下的交感神经活性增强。大鼠模型常被用来研究颈动脉体在上述疾病状况下功能变化的机制。为检测信号分子水平的变化,免疫组化为最常用研究方法之一,但是由于颈动脉体体积微小且难与周围组织区分,在做免疫组化的过程中,往往会出现颈动脉体丢失或误认等问题,最终导致实验失败〔1~6〕。本文拟探讨大鼠颈动脉体石蜡切片和免疫组化染色过程的各个环节,为颈动脉体研究提供方法学保障。
1 材料和方法
1.1动物雄性SD大鼠,由河南省实验动物中心提供(No.41003100001855),每5只一笼饲养,体重220~280 g。光照条件:每天明暗12 h交替。摄食饮水自由,垫料更换1次/w。
1.2试剂兔抗酪氨酸羟化酶(Abcam)、二抗试剂盒(中山金桥,PV-9001)、二氨基联苯胺(DAB)显色试剂盒(万类生物,WLA022)、苏木素(上海标本模型厂)、伊红(上海试剂三厂)、磷酸二氢钠、磷酸氢二钠、无水碳酸钠、甘油、硫酸镁(天津致远化学试剂有限公司)、醋酸(天津市北辰方正试剂厂)、无水乙醇(天津市恒兴化学试剂制造有限公司)、二甲苯(天津市永大化学试剂有限公司)、硫酸铝钾(天津基准化学试剂有限公司)、碘酸钠(天津市化学试剂三厂)、甲醛(烟台市双双化工有限公司)、中性树胶(中国上海懿洋仪器有限公司)、载玻片。
1.3器材石蜡切片机(Thermo,Finesse 325)、烤片机(Leica,HI1220)、显微镜(Nikon)、微波炉(格兰仕)、烘箱(上海精宏实验设备有限公司)、蠕动泵(保定兰格恒流泵有限公司,BT00-300T)、pH仪(Sartorius,PB-10),冷凝台(孝感市宏业医用仪器有限公司,BM-IX)、体视显微镜(XYH-4A)。
1.4方法
1.4.1组织固定用10%的水合氯醛麻醉大鼠(腹腔注射,3.4 ml/kg),把大鼠固定在灌流架上,开胸。灌流针头从心尖穿入左心室,一直穿入到主动脉弓。剪开右心耳,快速灌流生理盐水。灌流生理盐水速度为120 ml/min,灌流量为500 ml。然后,用4%中性甲醛进行固定。灌流速度为10 ml/min,灌流量为200 ml。灌流结束后,从颈部分离出颈动脉分叉,为了不损伤颈动脉体,颈内动脉和颈外动脉尽量留长一些。将分离的颈动脉分叉室温放置于4%中性甲醛溶液中,不低于2 h。然后取出颈动脉分叉置于生理盐水中。在体视镜下分离与颈内动脉伴行的迷走神经。在颈外动脉上,离颈总动脉分叉很近的部位有一根细小的血管,为枕动脉,将其从颈内动脉的根部修剪下来。在颈动脉分叉的腹面,有一个橄榄型胶质状的组织,为颈上神经节。将颈上神经节分离。此时,在颈总动脉分叉靠近颈内动脉一侧观察到有一团半透明的组织,为颈动脉体;把颈动脉体周边的结缔组织分离干净,只留下颈动脉体和分叉。
1.4.2组织包埋把颈动脉分叉置于包埋盒中,开始脱水。逐一浸在60%酒精、80%酒精、95%酒精1、95%酒精2、各1 h。依次在100%酒精1、100%酒精2、二甲苯1、二甲苯2,每个液体中浸18 min。脱水完成后,开始浸蜡,浸蜡时间不低于7 h(68℃)。然后在组织包埋机上进行包埋。包埋时尽量让颈动脉分叉和蜡盒的平面保持平行,这样有利于在切片机上切出较理想的颈动脉体切片。将包埋盒放在冷凝台上,室温下冷凝10 min。冷凝后修蜡块,去除周围多余的蜡。置于4℃冰箱中过夜。次日,将蜡块置于-20℃冰箱冷却保存。
1.4.3石蜡切片和脱蜡蜡块从-20℃冰箱中取出固定到石蜡切片机上修片,修到血管处,放回-20℃冰箱进行降温。降温5 min后,取出蜡块,切片厚度调整为5 μm,开始切片。每切3~5片,将最后1片贴在载玻片上,放在显微镜下观察。观察到颈动脉体的片子后,收取以后的石蜡切片。将片子放在自来水中展开,自来水中滴加几滴酒精有利于展片,用载玻片从自来水中取出切片,置于45℃水中进一步展片,石蜡切片完全展开后,贴到载玻片上。将载玻片置于室温晾干。晾干后也可放在盒子中室温保存。做苏木素-伊红染色(HE)或者免疫组化实验时,把载玻片放到65℃烤片机上烤片90 min。然后进行梯度脱蜡,先置于二甲苯1、二甲苯2内各5 min,依次置于无水酒精、95%酒精、80%酒精各1 min。自来水洗1 min。整个脱蜡过程不要让组织干。脱蜡完成后,直接做HE染色或者免疫组化实验的抗原修复步骤。
1.4.4HE染色和免疫组化HE染色:浸在苏木素6 min,去离子水浸泡1 min;分化液3 s,去离子水浸泡10 min;促蓝液1 min,去离子水浸泡1 min;染伊红10 s,去离子水浸泡1 min。室温下晾干,用中性树胶封片。HE染色完成。
免疫组化实验:脱蜡后用柠檬酸钠缓冲液进行抗原修复,玻片置于500 ml的柠檬酸钠缓冲液中(0.01 mol/L,pH6.0),微波炉加热沸腾10 min,冷却至室温,磷酸盐缓冲液(PBS)洗涤3次,每次5 min 。3%H2O2室温孵育15 min去除内源性过氧化物酶,暗盒避光。然后PBS洗涤3次,每次5 min。加0.2%的Triton-X100(Triton-X100溶解在0.01 mol/L的PBS)通透10 min。滴加10%山羊血清(用0.01 mol/L的PBS配制)封闭,室温孵育20 min。然后滴加酪氨酸羟化酶(TH)抗体(稀释比例1∶500),阴性对照滴加PBS,4℃过夜。PBS洗涤3次,每次5 min。滴加中衫金桥PV-9001二抗试剂,室温孵育20 min,PBS洗涤3次,每次5 min。按照试剂盒说明配制DAB显色液,显色时需镜下观察确定,发现目的蛋白显色发生变化,立即浸泡在去离子水中,终止反应。然后进行核染。苏木素溶液中染色4 min,去离子水浸泡1 min。放到显微镜下观察核的颜色,若染色过深在分化液中浸3 s,去离子水洗涤5 min。促蓝1 s,去离子水浸泡1 min。再放到镜下观察核的颜色;如果核的颜色过浅,可再用苏木素复染,直到染出理想的颜色。核染以后,在室温晾干片子,浸二甲苯透明,中性树胶封片。将玻片晾干,在显微镜下拍片。
2 结 果
2.1HE染色颈动脉体呈不规则的椭圆形,借结缔组织连于血管壁上(图1A),主要由成簇聚集的细胞,丰富血管网以及疏松的结缔组织构成(图1B);细胞核较大,结构致密(图1C)。
2.2免疫组化染色表达TH的Ⅰ型细胞成团聚集。对照组未加TH抗体,TH未被抗体标记,只呈现核染色(图2)。
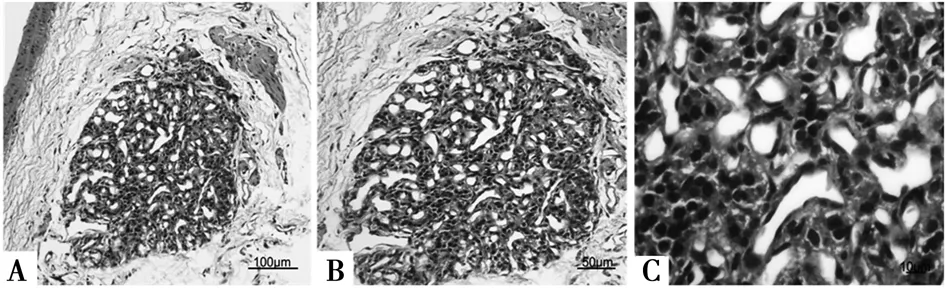
胞质为伊红染色,胞核为苏木素染色图1 颈动脉体HE染色

图2 颈动脉体免疫组织化学染色
3 讨 论
由于颈动脉体体积微小,应用免疫组化方法对其研究的过程中,许多初学者耗费大量的时间和精力学习和总结颈动脉体石蜡切片制作的技巧性操作,否则将会导致实验失败。经验表明,理想的切片是成功的关键。首先,灌注完成后,在体视镜下要把颈动脉体周围的组织修除干净,因大鼠颈动脉体较小,对于初学者来说,在做免疫组化石蜡切片时,往往因为误判出现切不到颈动脉体的现象。为了提高制备颈动脉体切片的成功性,组织固定后尽量把组织分离的只剩下颈动脉体和血管。其次,颈动脉体在无水酒精和二甲苯中的脱水时间各保持18 min为宜(图3A)。如果脱水时间过短,则会导致脱水不足,蜡不易浸透组织;时间过长(20 min),会出现组织过硬,切片易碎且有刀痕(图3B)。刀痕过重就会出现颈动脉体受损,做不出理想的片子。石蜡包埋的时间不低于7 h,避免由于浸蜡时间不足而造成组织块过硬。包埋时,尽量把颈动脉分叉水平放置于包埋盒底部,使所获蜡块中的颈动脉分叉结构与蜡块表面呈平行关系。
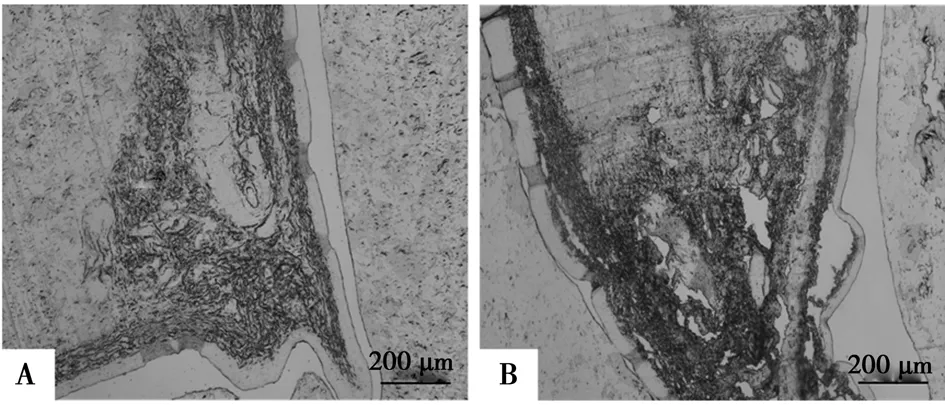
A为理想的颈动脉体切片;B为脱水20 min颈动脉体切片图3 颈动脉体石蜡切片
切片前,准备好所需全部物品,避免由于准备不足导致切片过程延长,因为在操作过程中,最初在冰箱中变硬的蜡块在室温下会慢慢变软,从而导致切下来的组织切片卷在一起,难以切出完整的片子。切片时,刀片尽量与石蜡包块中的颈动脉分叉结构保持平行关系,以便切片过程中根据颈动脉分叉处的结构关系定位出颈动脉体,减少切片时由于误判导致的颈动脉体遗失。切片速度不宜过快,始终保持手腕力度均匀,以保证所得石蜡切片的完整及厚度均一。切的过程中及时在显微镜下观察切片是否已经含有颈动脉体,因为其体积微小,稍有疏忽即可造成部分或整个颈动脉体组织已经切掉还没有发现的情况。在切片过程中由于蜡块温度高而切不成片时,需将蜡块取下,放回-20℃冰箱,再次降温后重新开始。在水中展片时,可用柔软小毛刷将切片小心移至载玻片上,在贴片过程中防止石蜡切片碎裂,一张载玻片上可以贴3张切片。一般情况下,从一个SD大鼠颈动脉体可以获得5 μm厚度含颈动脉体石蜡切片27张。
做HE染色时,及时过滤染料,避免因为染料中出现的沉淀导致后续染色结果不均一,最终影响图像的质量。做免疫组化染色时,避免切片干燥,要动作柔和,小心操作,防止因操作不当引起的切片损伤或切片脱落造成的实验失败。用DAB发色时,需及时在显微镜下观察色素的变化,根据所检测蛋白的特性决定何时终止反应。用苏木素复染时,应在显微镜下观察核的着色是否达到理想效果,避免核染色过深影响到检测蛋白的着色表现。如果颜色偏深,可重复去分化后促蓝步骤。如果核颜色较浅,可以用苏木素重新染色。
综上所述,应用免疫组化方法研究颈动脉体的过程需要小心操作,反复练习,及时总结,才能熟能生巧,最终掌握适用于颈动脉体的研究方法。
1Kumar P,Prabhakar NR.Peripheral chemoreceptors:function and plasticity of the carotid body〔J〕.Compr Physiol,2012;2(1):141-219.
2Prabhakar NR.Sensing hypoxia:physiology,genetics and epigenetics〔J〕.J Physiol,2013;591(9):2245-57.
3Pardal R,Ortega-Saenz P,Duran R,etal.Glia-like stem cells sustain physiologic neurogenesis in the adult mammalian carotid body〔J〕.Cell,2007,131(2):364-77.
4Bairam A,Neji H,De-Grandpre P,etal.Autoreceptor mechanism regulating carotid body dopamine release from adult and 10-day-old rabbits〔J〕.Respir Physiol,2000;120(1):27-34.
5Kim DK,Prabhakar NR,Kumar GK.Acetylcholine release from the carotid body by hypoxia:evidence for the involvement of autoinhibitory receptors〔J〕.J Appl Physiol,2004;96(1):376-83.
6Bisgard GE.Carotid body mechanisms in acclimatization to hypoxia〔J〕.Respir Physiol,2000;121(2-3):237-46.
〔2016-02-17修回〕
(编辑袁左鸣)
国家自然科学基金(81470271)
刘玉珍(1964-),女,博士,教授,主要从事阻塞性睡眠呼吸暂停综合征研究。
贾祥磊(1985-),男,硕士,主要从事神经电生理研究。
Q34;Q5-33;Q593+.2
A
1005-9202(2016)15-3621-03;doi:10.3969/j.issn.1005-9202.2016.15.005
