γ-氨基丁酸产生菌的分离及发酵条件优化
2016-10-26汪祥燕徐海燕辛国芹汪孟娟董佩佩赵影谷巍
汪祥燕,徐海燕,辛国芹,汪孟娟,董佩佩,赵影,谷巍
(山东宝来利来生物工程股份有限公司,山东泰安271000)
添加剂
γ-氨基丁酸产生菌的分离及发酵条件优化
汪祥燕*,徐海燕,辛国芹,汪孟娟,董佩佩,赵影,谷巍
(山东宝来利来生物工程股份有限公司,山东泰安271000)
γ-氨基丁酸(GABA)是哺乳动物体内的一种抑制性神经递质,具有许多重要的生理功能。利用酸菜、酸奶等食品进行乳酸菌的分离,通过纸层析法筛选得到1株产GABA量较高的菌株Y-3,经16SrDNA鉴定该菌株为短乳杆菌。单因素试验和正交试验确定的菌株Y-3最佳发酵条件为:葡萄糖1.5%、酵母膏0.5%、胰蛋白胨1.5%、L-谷氨酸钠1.0%、丁二酸钠0.5%,初始pH为6.0,接种量6%,37℃静置培养48 h,GABA产量达12 g/L以上,比优化前产量提高了近5倍。
γ-氨基丁酸;分离;短乳杆菌;发酵
γ-氨基丁酸(GABA)是一种天然存在的非蛋白氨基酸,属强神经抑制性氨基酸,具有镇静、催眠、抗惊厥、降血压的作用(Li等,2010)。应用于畜牧生产中能有效地提高动物抗应激能力和抗缺氧能力,改善动物生产性能和动物产品品质(谭良溪等,2012;吴俊锋和李吕木,2011)。通过减少动物的无意识运动以减少能量消耗,达到促生长的目的(吴凡和谭青松,2015;徐秋良等,2009)。GABA广泛存在于植物、动物、微生物中,合成制备方法主要有化学合成、植物富集和微生物发酵3种(Dhakal等,2012)。目前GABA的生产主要采用发酵法,而安全性高的乳酸菌可以利用体内的谷氨酸脱羧酶,将L-谷氨酸钠经α-脱羧后产生GABA,开发前景广阔。陆小雪等(2009)从泡菜和酸奶中分离出3株产GABA的乳酸菌,分别为乳酸乳球菌乳酸亚种、乳酸乳球菌乳酸亚种和唾液链球菌嗜热亚种,其发酵液中GABA含量分别达到3.680、3.341、2.700 g/L。蒋冬花等(2007)分离出相对高产GABA的植物乳杆菌,在最佳发酵条件下发酵液中GABA含量可达4 g/L。本试验从泡菜、酸奶等食品中分离高产GABA菌株,对其进行分子生物学鉴定,并优化菌株的发酵条件,为微生物发酵富集GABA的研究及相关产品的开发提供理论依据。
1 材料与方法
1.1试验材料泡菜、酸菜及各品牌的酸奶(伊利、蒙牛、亚奥特)等。
1.2培养基
1.2.1分离培养基胰蛋白胨10 g/L、酵母膏5 g/L、葡萄糖5 g/L、吐温-80 1 g/L、K2HPO42 g/L、醋酸钠5 g/L、柠檬酸二胺2 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·H2O 0.05 g/L、pH 6.5~6.8,37℃培养48 h。
1.2.2种子培养基K2HPO42 g/L,柠檬酸三铵2 g/L,无水乙酸钠5 g/L,MnSO4·H2O 0.25 g/L,MgSO4·7H2O 0.58 g/L,葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L。
1.2.3TYG发酵培养基胰蛋白胨5 g/L,酵母膏5 g/L,葡萄糖10 g/L,丁二酸钠5 g/L,L-谷氨酸钠10 g/L,pH 6.6~6.8。
1.3试验方法
1.3.1乳酸菌的分离分别取泡菜汁、酸菜汁及伊利、蒙牛、亚奥特酸奶各1 mL,接种于50 mL分离培养基中富集培养3 d,取富集培养液各1 mL,分别稀释至10-1、10-2、10-3、10-4、10-5浓度,将所有样品稀释液各取0.3 mL,倒入已灭菌的平皿中,然后倒入冷却至50℃左右的分离培养基混匀,凝固后置30℃培养箱中培养3 d,挑取带有溶钙圈的菌落,接种于MRS斜面培养基。
1.3.2乳酸菌的筛选将初筛得到的菌株转接于液体MRS种子培养基中,37℃静置培养12~15 h,然后以2%的接种量接入到含1%L-谷氨酸钠的TYG发酵培养基中,37℃静置培养24 h。将发酵液离心后进行检测分析。
1.3.3分析方法
1.3.3.1γ-氨基丁酸含量的测定GABA含量的测定采用纸层析-比色法。(1)展开:采用新华3号滤纸,每个样品点样4 μL,在室温下用不饱和法展开,展开剂用(苯酚∶水=4∶1)上行法展开;(2)定量:配制0.5%的GABA标准品,点样4 μL;菌株发酵液经离心后,取上清液点样4 μL,放入层析缸中展开;(3)显色:展开结束后自然晾干,用0.5%的茚三酮无水乙醇溶液喷淋,在65℃显色30 min;(4)比色测定:剪下GABA显色条带,用5 mL硫酸铜乙醇溶液(0.1%硫酸铜溶液∶75%乙醇=2∶38)浸泡30 min,然后测定520 nm波长下的吸光值(A)。根据标准品的A值和样品的A值即可计算出样品的GABA含量。
1.3.3.2菌株生长量的测定发酵培养过程中,在一定时间取培养液,以空白培养基作对照,于600 nm波长下测定吸光值(OD600)。
1.3.3.3pH的测定采用PHS-3C型精密pH计测定。
1.3.4发酵条件优化采用单因素试验和正交试验优化发酵条件。
1.3.5菌株的鉴定
1.3.5.116SrDNA扩增与序列分析目的菌株接种于新鲜的种子培养基中培养12 h,采用天根公司的试剂盒提取菌体DNA,并对其进行16S rDNA序列扩增。所用引物为通用引物:1492r 5'-GGTTACCTTGTTACGACTT-3'27f 5'-AGAGTTG ATCCTGGCTCAG-3';PCR反应体系(50 μL)为:Mixture 25 μL(含Taq DNA聚合酶及dNTP等,天根生化科技有限公司),上下游引物各1 μL,模板DNA 2 μL,超纯水21 μL。PCR扩增程序为94℃预变性5 min,94℃变性1 min,52℃退火1 min,72℃延伸2 min,30个循环,72℃延伸10 min。PCR产物送北京博尚生物技术有限公司进行序列测定。
1.3.5.2系统发育分析登录GenBank(http:// www.ncbi.nlm.nih.gov),利用Blast对菌株16SrDNA测序结果进行检索,并下载相关属种的16SrDNA序列,采用DNAMAN、DNAclub、MEGA5.2等软件进行同源性分析,并构建系统进化树。
2 结果与分析
2.1菌株筛选样品经处理后,利用乳酸菌选择培养基从各分离源中共分离纯化出113株乳酸菌,并编号保存。采用纸层析-比色法初筛,得到8株能够利用L-谷氨酸钠转化生成γ-氨基丁酸的菌株。
由表1可知,不同菌株产γ-氨基丁酸的能力有一定差别,仅2株菌的GABA产量高于1 g/L,其中Y-3在未经培养优化的条件下,可产生GABA 2.21 g/L。将Y-3菌株传接10代,分别测定Y-3菌株1~10代发酵后GABA产量,发现其GABA产量稳定,为(2.36±0.22)g/L,后续对菌株Y-3进行发酵条件优化。

表1 菌株筛选结果
2.2菌株Y-3发酵条件的优化
2.2.1接种量对发酵生产γ-氨基丁酸的影响由图1看出,接种量对Y-3菌株发酵生产GABA有较大的影响。接种量为2%~4%时,GABA产量在2.20 g/L左右;接种量增大至6%后,GABA产量明显提高,达4.46 g/L,提高2倍;接种量大于6%后,GABA产量降低,反而不利于菌株生产GA-BA。所以,菌株Y-3最优接种量确定为6%。

图1 接种量对Y-3菌株GABA产量的影响
2.2.2pH对发酵生产γ-氨基丁酸的影响将发酵培养基起始pH分别调为4.0、5.0、6.0和自然pH(6.70左右),研究发酵培养基起始pH对Y-3菌株生长、pH及GABA产量的影响,结果见图2。随着发酵培养基起始pH增大,Y-3菌株的菌体量和发酵液pH逐渐增大。发酵培养基起始pH为4.0时,发酵结束时菌体密度仅有1.084;而在起始pH为6.0时,发酵结束时菌体密度为2.109,两者相比,菌体密度增大了1倍。随着发酵培养基起始pH升高,GABA产量为先升高后降低,在pH=6.0时达最大,为3.10 g/L。在pH=6.0时菌体密度也较大,菌体量大代表有更多菌体参与GABA生产,因而GABA产量才会提高。虽然自然pH时(6.70左右)菌体生长量大于pH为6.0时,但是此时的发酵液pH较低,降低了谷氨酸脱羧酶的活性,GABA产量反而没有pH=6.0时高。综合分析,发酵培养基起始pH确定为6.0。

图2 发酵培养基起始pH对Y-3菌株生长、pH及GABA产量的影响
2.2.3发酵时间对发酵生产γ-氨基丁酸的影响发酵时间对于菌株Y-3和PS-9生产GABA有很大的影响,结果见图3。随着发酵时间延长,菌株Y-3的菌体密度逐渐增大,24 h达到最大,为2.109,之后处于基本稳定状态。发酵液pH在 24 h时最低,仅为2.94,然后升高,之后处于基本稳定。分析原因可能是:24 h前菌株增殖速度快,处于菌体积累阶段,菌株会迅速消耗葡萄糖,将其分解为小分子酸,使得发酵液pH降低,之后菌株Y-3会利用H+,在谷氨酸脱羧酶作用下将L-谷氨酸钠转化为GABA,又提高了发酵液的pH。且在一定范围内,GABA产量是随着发酵时间延长逐渐增大的,在48 h时达到最大,为3.57 g/L。此后,GABA产量有下降但不明显。从培养周期和成本等工业扩大生产因素考虑,培养时间不宜过长,确定菌株Y-3最佳发酵时间为48 h。

图3 发酵时间对Y-3菌株生长、pH及GABA产量的影响
2.3菌株Y-3发酵培养基的优化
2.3.1碳源对发酵生产γ-氨基丁酸的影响以TYG发酵培养基为基础,分别选取葡萄糖、蔗糖、麦芽糖、可溶性淀粉及丁二酸钠为唯一碳源,添加量为10 g/L,发酵培养48 h后检测发酵液的GABA含量,结果见图4。结果显示,对于菌株Y-3,葡萄糖作为发酵培养基的碳源最为适合,麦芽糖、可溶性淀粉和丁二酸钠次之,蔗糖最差。葡萄糖作为可快速利用的碳源为菌株Y-3的生长和GABA生产提供能量来源,故以其作碳源,无论是菌株生长,还是GABA产量都优于其他碳源。

图4 碳源对Y-3菌株生长和GABA产量的影响
2.3.2氮源对发酵生产γ-氨基丁酸的影响以TYG发酵培养基为基础,分别选取胰蛋白胨、牛肉膏、酵母膏、蛋白胨、玉米浆、硫酸铵及硝酸钠为唯一氮源,添加量为10 g/L,发酵培养48 h检测发酵液的GABA含量。由图5可知,对于菌株Y-3,有机氮效果比无机氮效果好。硫酸铵、硝酸钠两种无机氮源发酵效果最差,纸层析图上基本看不出条带。酵母膏作为单一氮源发酵效果最好,GABA最高为5.95 g/L,其次是牛肉膏、蛋白胨和胰蛋白胨,玉米浆的效果较差。酵母膏中含有多种成分,相对于其他氮源,酵母膏的营养成分可能更有利于乳酸菌的生长,且其可能含有刺激谷氨酸脱羧酶活性的因子,因此GABA产量较高。

图5 氮源对Y-3菌株生长和GABA产量的影响
进一步,以TYG发酵培养基为基础,在以酵母膏作氮源的基础上分别复合蛋白胨、牛肉膏和胰蛋白胨为复合氮源,发酵培养48 h,以纸层析-比色法测定上清中GABA含量。由图6可知,对于菌株Y-3,以酵母膏和胰蛋白胨复合时发酵效果最好,GABA的产量达6.26 g/L,比酵母膏作唯一氮源时产量提高5%。所以,菌株发酵产GABA试验选择酵母膏复合胰蛋白胨作氮源。

图6 复合氮源对Y-3菌株生长和GABA产量的影响
2.3.3正交试验设计优化发酵培养基以葡萄糖为碳源,酵母膏和胰蛋白胨为复合氮源,添加L-谷氨酸钠,进行L9(34)正交试验设计。正交试验设计及结果分析见表2。
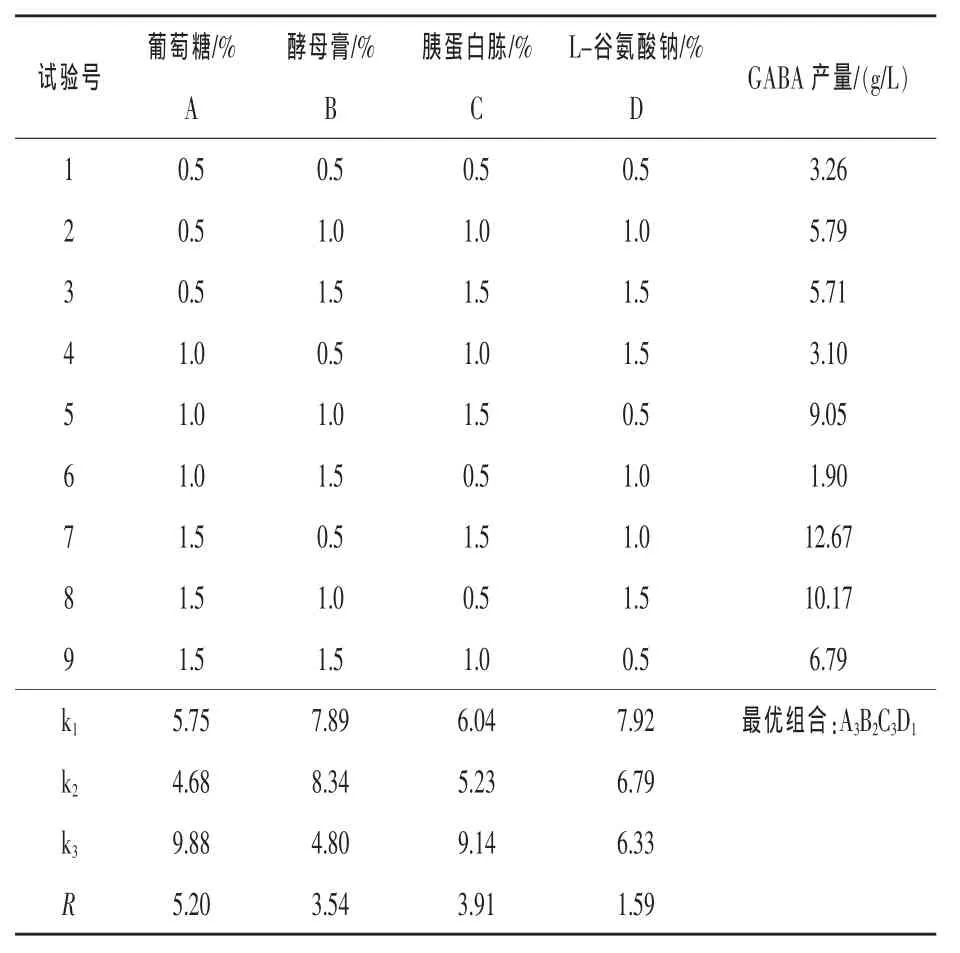
表2 L9(34)正交试验设计及结果分析
由表2可知,葡萄糖添加量对于GABA的产量影响最大。各成分对GABA产量的影响顺序为:葡萄糖>胰蛋白胨>酵母膏>L-谷氨酸钠,极差分析的最优组合为A3B2C3D1。试验中最优组合为A3B1C3D2,GABA产量为12.67 g/L。由于最佳的培养基组成在试验中没有进行,所以根据正交试验给出的最佳培养基成分进行发酵,产量与7号试验相比没有明显提高。考虑成本等因素,确定菌株Y-3发酵配方为:葡萄糖1.5%、酵母膏0.5%、胰蛋白胨1.5%、L-谷氨酸钠1.0%、丁二酸钠0.5%,pH 6.0。
2.4发酵液处理及冻干粉γ-氨基丁酸含量测定按照优化结果发酵培养菌株Y-3,在发酵结束后将发酵液冻干处理,计算100 mL发酵液的冻干粉比例,并以纸层析-比色法测定冻干粉中GABA的含量。结果显示,100 mL发酵液冻干后可得到3.72 g冻干粉,冻干粉中GABA含量为4.6%左右。
2.5菌株Y-3的鉴定
2.5.1菌落及菌体形态该菌株在分离培养基上培养24 h,其菌落形态扁平,白色不透明,边缘光滑,表面湿润,显微镜下观察菌体为短杆状,大多成对出现,革兰氏染色阳性。
2.5.216SrDNA序列和系统发育分析该菌株的PCR产物电泳图见图7,条带在1000~2000 bp处,约为1500 bp,与预期结果一致。

图7 菌株Y-3扩增产物琼脂凝胶电泳图
将菌株Y-3的16SrDNA序列在NCBI中进行BLAST比对分析,结果显示菌株Y-3与Lactobacillus brevis的序列同源性达到100%。鉴定该菌株属于短乳杆菌(Lactobacillus brevis)。
从Genebank中调取并下载与菌株Y-3同源性较高的该属内其他相关菌株的16S rDNA,利用MEGA5.2软件的Neighboring-joining方法,构建系统进化树(图8)。
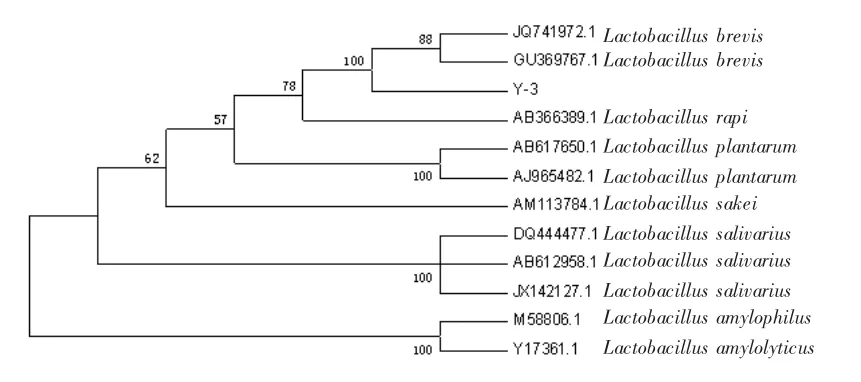
图8 菌株Y-3与相关菌株的系统进化关系
3 小结
从泡菜、酸菜及不同品牌酸奶等分离源中分离纯化得到113株乳酸菌,并以TYG培养基为基础发酵,筛选到8株能产GABA的菌株。通过单因素试验和正交试验对培养基和发酵条件进行优化,确定菌株Y-3最佳培养基组合和发酵条件为:葡萄糖1.5%、酵母膏0.5%、胰蛋白胨1.5%、L-谷氨酸钠1.0%、丁二酸钠0.5%,初始pH为6.0,接种量6%,37℃静置培养48 h,此时发酵液中GABA含量达12 g/L以上,比优化前产量增加了近5倍。对发酵液进行冻干处理,Y-3菌株100 mL发酵液冻干后可得4 g左右冻干粉,冻干粉中GABA含量为4.6%左右。通过16S rDNA鉴定,菌株Y-3为一株短乳杆菌。
[1]蒋冬花,后加衡,黄大年,等.酸菜中高产γ-氨基丁酸乳酸菌的筛选[J].微生物学杂志,2007,27(1):35~39.
[2]陆小雪,解春艳,顾振新.产γ-氨基丁酸乳酸菌的分离与鉴定[J].南京农业大学学报,2009,32(1):121~125.
[3]谭良溪,张铭,张复生.γ-氨基丁酸及其在畜禽生产中的研究进展[J].中国畜牧兽医,2012,39(8):132~135.
[4]吴凡,谭青松.γ-氨基丁酸在动物营养中的研究进展[J].饲料研究,2015,2:61~65.
[5]吴俊锋,李吕木.饲用γ-氨基丁酸研究进展[J].中国饲料,2011,16:28~30.
[6]徐秋良,张庆莉,唐国盘,等.γ氨基丁酸对高温环境下生长肥育猪生产性能及激素水平的影响[J].家畜生态学报,2009,6:28~32.
[7]Dhakal R,Bajpai V K,Baek K H.Production of GABA(γ-aminobutyric acid)by microorganisms:A review[J].Brazilian Journal of Microbiology,2012,43(4):1230~1241.
[8]Li H,Qiu T,Huang G D,et al.Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batchfermentation[J].Microbial Cell Factories,2010,9(9):85.
γ-amino butyric acid(GABA)as a putative inhibitory in the vertebrate nervous system,has many important physiological functions.Using filter paper chromatography method,a lacto-bacteria Y-3 highly yielding GABA was isolated from different foods such as pickled vegetable and yoghourt.Y-3 was identified as Lactobacillus brevis by its cultural characteristics,morphological characteristics and 16S rDNA sequence.The optimal fermentation medium composition by single factor and orthogonal test showed as follows:glucose 1.5%,yeast extract 0.5%,tryptone 1.5%,L-sodium glutamate 1.0%,sodium succinate 0.5%.The better fermentation conditions were as follows:initial pH 6.0,inoculation amount 6%,temperature 37℃,fermentation 48 h.Using this optimization conditions,the GABA yield was over 12 g/L,which increased nearly 5 times than that before optimization.
γ-amino butyric acid;isolation;Lactobacillus brevis;fermentation
S816.7
A
1004-3314(2016)04-0027-05
10.15906/j.cnki.cn11-2975/s.20160407
