人脐带间充质干细胞外泌小体保护缺氧复氧损伤的心肌细胞*
2016-10-26黄然然
李 佳, 辛 毅, 崔 巍, 刘 飒, 黄然然, 陈 娟, 周 洁△, 李 娜△
(1首都医科大学附属北京安贞医院,北京 100029; 2华中科技大学同济医学院生物化学与分子生物学系,湖北 武汉 430030; 3北京市心肺血管疾病研究所,北京 100029)
·论著·
人脐带间充质干细胞外泌小体保护缺氧复氧损伤的心肌细胞*
李佳2,辛毅1,3,崔巍1,3,刘飒1,3,黄然然1,3,陈娟2,周洁2△,李娜1,3△
(1首都医科大学附属北京安贞医院,北京 100029;2华中科技大学同济医学院生物化学与分子生物学系,湖北 武汉 430030;3北京市心肺血管疾病研究所,北京 100029)
目的: 研究人脐带间充质干细胞(human umbilical mesenchymal stem cells,HUMSCs)外泌小体对心肌细胞缺氧复氧损伤后细胞凋亡的作用,并分析外泌小体内具有心脏保护作用的微小RNA(microRNA,miRNA)表达水平。方法:酶消化法培养HUMSCs并对其免疫表型进行流式细胞术鉴定;收集培养的第3代HUMSCs上清液,利用试剂盒提取外泌小体,电镜观察其形态结构,并采用Western blot 法鉴定试剂盒所提物质CD63蛋白水平的表达;用提取的外泌小体处理缺氧复氧条件下的心肌细胞,流式细胞术Annexin V-FITC/PI标记法观察外泌小体对心肌细胞凋亡的影响;实时荧光定量PCR 检测外泌小体中miRNA的表达水平;miR-22抑制剂处理缺氧复氧条件下的心肌细胞,流式细胞术检测心肌细胞的凋亡。结果:流式细胞术检测第3代HUMSCs的CD105、CD73和CD90呈高表达,而CD45、CD34、CD11b、CD79a、CD19和HLA-DR 的表达阳性率低,说明第3代培养的HUMSCs具有间充质干细胞的特异性表型特征。向骨细胞分化诱导HUMSCs,钙结节形成明显,经茜素红染色呈红色结节,分化率为(92.5±5.1)%以上。经向脂肪细胞分化,细胞见脂滴形成,油红染色将脂滴染成红色,分化率为(91.6±3.8)%以上,说明第3代培养的HUMSCs具有间充质干细胞的多向分化能力。扫描电镜观察可见外泌小体球状结构,并且外泌小体特异性蛋白CD63表达强阳性。 缺氧复氧导致心肌细胞凋亡率明显增加(P<0.05)。在缺氧复氧条件下,外泌小体处理使心肌细胞凋亡率显著降低(P<0.05)。不同浓度外泌小体处理心肌细胞,其抗细胞凋亡作用无明显变化(P>0.05)。实时荧光定量PCR 检测外泌小体中富含miR-1a、miR-22、miR-24、miR-133a 和miR-139-5p,其中miR-22表达水平最高;在缺氧复氧条件下miR-22抑制剂处理心肌细胞,细胞凋亡率明显增加(P<0.05)。 结论:人脐带间充质干细胞外泌小体可有效减少缺氧复氧条件下的心肌细胞凋亡,其抗凋亡作用与外泌小体富含的miR-22密切相关。
人脐带间充质干细胞; 外泌小体; 微小RNA; 心肌细胞; 缺氧; 复氧
缺氧复氧损伤引起心肌细胞凋亡、心脏纤维化和心室重构,最终导致心衰,严重威胁人类健康和生命。间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能、并可通过旁分泌作用改善心梗局部炎症反应、抑制心肌细胞的凋亡而成为干细胞治疗心肌梗死的潜能细胞。大量的临床试验结果表明,MSCs 移植治疗急性心肌梗死和慢性心衰可使患者的心脏射血分数提高4.5%~11.3%[1]。但MSCs在心肌缺氧复氧损伤中发挥心脏保护功能的相关机制尚不甚清楚。深入研究MSCs 发挥心脏保护功能的机制对于MSCs 治疗心肌缺血性疾病具有重要的临床指导意义。
外泌小体(exosome)是一种直径在30~120 nm、含有RNA和蛋白质的微小囊泡,具有脂质双层膜结构,由几乎所有类型的细胞分泌而来,同时在体液如血液、唾液、尿液和乳汁中大量发现。最近研究表明外泌小体可以起到间接传递信号分子给其它细胞从而改变其细胞功能的作用,如肿瘤的生长与迁移、组织损伤的修复等[2]。但是HUMSCs外泌小体对于心肌细胞在缺氧复氧条件下的保护作用及其内相关microRNA表达尚不甚清楚。本研究利用人脐带间充质干细胞(human umbilical mesenchymal stem cells,HUMSCs)外泌小体处理小鼠心肌细胞,观察其对心肌细胞凋亡的作用,并进一步研究HUMSCs外泌小体中与心脏保护作用相关microRNA的表达,探讨HUMSCs通过旁分泌机制保护心肌细胞减少凋亡的机制。
材 料 和 方 法
1实验动物和材料
SPF级C57BL/6乳小鼠,雌雄不限,1~2日龄,体质量1.2~1.5 g来源于斯贝福(北京)实验动物科技有限公司;人脐带标本取自首都医科大学附属北京安贞医院妇产科当日剖宫产健康婴儿,产妇体健,年龄<35岁,胎龄为38~40周,无肝炎、梅毒、艾滋病等传染病,无遗传性疾病史,产妇及家属对脐带用于实验研究均知情同意,并经北京安贞医院伦理委员会批准。
2主要试剂
DMEM/F12 培养基、胎牛血清(fetal bovine se-rum,FBS)、Ⅱ型胶原酶和胰蛋白酶购自Gibco;青、链霉素混合液购自Solaribio;0.01 mmol/L 磷酸盐缓冲溶液(PBS)购自HyClone;成脂和成骨诱导试剂盒购自Millipore;心肌细胞培养基(cardiac myocyte me-dium,CMM)购自ScienCell;外泌小体提取试剂盒和外泌小体RNA与蛋白分离试剂盒均购自Life Technologies;CD63兔多克隆抗体购自Santa Cruz;逆转录试剂盒购自Thermo;IRDye标记的山羊抗兔IgG购自LI-COR;流式细胞术采用的荧光团标记的小鼠抗人抗体: FITC-CD90、PE-CD105、FITC-CD73、PE-CD45、APC-CD34、PECD79a、APC-CD11b、APC-CD19、PEcy5;5-HLA-DR 及同型对照抗体、FITC Annexin V凋亡检测试剂盒购自BD;实验中所用引物U6、miR-1a、miR-22、miR24、miR-133a 和miR-139-5p,以及inhibitor negative control # 22和miR-22 inhibitor均购自广州市锐博生物科技有限公司。
3主要方法
3.1原代人脐带间充质干细胞的培养将符合入选标准的新鲜脐带置于预冷的含10%双抗的1×PBS的培养皿中清洗3次,分别剪取脐带4 cm两段,剖开脐带去除其内的动脉及静脉血管后得到脐带华通胶组织,再次分别置于含10%双抗的1×PBS中清洗3次,去除血污抗菌,将脐带剪碎成约1 mm×1 mm×1 mm的组织块,加入2 g/L Ⅱ型胶原酶与2 g/L透明质酸酶(1∶1) 混合消化液,37 ℃、100 r/min 水浴摇床消化60~90 min,用移液管轻柔吹打,重复消化2~3 次,过200 目铜网纯化。收集溶液,1 000 r/min离心5 min,弃上清,将沉淀溶解,细胞接种于培养瓶中,置于5% CO2、37 ℃培养箱中培养,隔日更换培养基,适时传代[3]。
3.2原代心肌细胞的培养取新生C57乳鼠的心脏置于含有10%双抗的1×PBS 中,去除心脏组织中的血及杂质,将心脏组织剪碎,加入0.2%的胶原酶Ⅱ消化,37 ℃条件下孵育30 min,用移液管轻柔吹打混匀,过200目铜网,收集溶液,1 000 r/min离心5 min,弃上清,将沉淀溶解,细胞种于培养皿中,孵箱中贴壁1 h,收集未贴壁细胞,计数,以5×105/cm2接种于培养板中。
3.3HUMSCs外泌小体的提取HUMSCs传至第3代后,以5×106个细胞接种于75 cm2的培养瓶中,加入10 mL无血清培养基,培养3 d后,收集无血清培养基,将培养基10 000 r/min离心30 min,去除细胞残渣和杂质,吸取上清,按每1 mL细胞培养基体积,加入500 μL外泌小体提取试剂充分混匀,4 ℃孵育过夜,10 000×g离心1 h,沉淀即为外泌小体,以1 mL的初始细胞培养基体积加入25 μL的1×PBS重悬沉淀,以此作为外泌小体实验原液,-20 ℃保存备用。
3.4细胞缺氧复氧(anoxia/reoxygenation,A/R)模型的建立心肌细胞的培养基更换成经氮气处理的低氧低血清培养基,置于Thermo的低氧培养箱内进行缺氧处理60 min 后更换成含10% FBS的DMEM培养基,置于5% CO2、37 ℃细胞培养箱内复氧6 h, 进行下一步实验检测。
3.5电镜观察外泌小体的结构收集培养人脐带间充质干细胞的上清液,经外泌小体提取试剂盒提纯外泌小体,离心后在管底可见少量的白色沉淀物。用1×PBS溶解,经2.5%戊二醛固定、脱水后,利用扫描电镜观察。
3.6Western blot 法检测HUMSCs外泌小体蛋白水平CD63的表达溶于1×PBS的外泌小体置于冰上,加入5×SDS-PAGE,30 min混匀,经SDS-PAGE 蛋白分离后,将其转移至0.45 μm孔径NC膜上,转膜2 h,50 g/L 脱脂奶粉室温封闭1 h; 分别加入CD63抗体(1∶200),4 ℃过夜;TBST洗膜8 min×3 次,分别加入IRDye标记的山羊抗兔IgG(1∶8 000),室温孵育2 h; TBST洗膜8 min×3次,Bio-Rad凝胶成像系统进行图像扫描和分析。
3.7实时荧光定量PCR 检测HUMSCs外泌小体microRNA的表达利用外泌小体总RNA分离试剂盒提取微小RNA,应用逆转录试剂盒合成cDNA ,反转录进行PCR 扩增。利用Bio-Rad实时定量PCR仪检测,反应程序设定为94 ℃ 5 min;94 ℃ 18 s, 60 ℃ 18 s,55 ℃ 6 s,扩增40 个循环;从55 ℃ 开始绘制熔解曲线。
3.8心肌细胞凋亡的检测将1×106个心肌细胞接种于24孔板中,培养24 h后更换心肌细胞培养液,1%胎牛血清的DMEM培养基进行饥饿处理24 h,按实验分组分别加入不同浓度外泌小体处理24 h、miR-22抑制剂处理48 h后,用2.5 g/L 胰蛋白酶消化,1 000 r/min离心5 min,弃上清,利用Annexin V-FITC/PI检测试剂盒中的1×buffer重悬细胞,1 000 r/min 离心5 min,弃上清,一组空白,一组只加5 μL FITC 标记的Annexin V,一组只加5 μL碘化丙啶(propidium iodide,PI)溶液,其它各组分别加入5 μL FITC 标记的Annexin V和5 μL 浓度为20 mg/L 的PI溶液,混匀后室温避光孵育15 min,加入300 μL 1×buffer终止反应,混匀,立即用流式细胞仪检测分析。
4统计学处理
应用统计学软件Prism GraphPad进行统计学分析,实验数据以均数±标准误(mean±SEM)表示,2 组比较采用t检验,多组比较采用单因素方差分析,方差分析后各组间的两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1人脐带间充质干细胞的分离与鉴定
用流式细胞术检测第3代HUMSCs 的CD105、CD73和CD90 表达阳性率高,分别为(99.4±1.62)%、(99.1±2.41)%和(99.5±2.41)%,而CD45、CD34、CD11b、CD79a、CD19和HLA-DR 的表达阳性率低,分别为(0.2±0.08)%、(0.8±0.09)%、(0.2±0.08)%、(0.2±0.06)%、(0.2±0.04)%和(0.1±0.08)%,说明第3代培养的HUMSCs具有MSCs特异性表型特征,见图1A;向骨细胞分化诱导HUMSCs可见钙结节形成明显,经茜素红染色呈红色结节,分化率为(92.5±5.1)%以上,见图1B;经向脂肪细胞分化的细胞见脂滴形成,油红染色将脂滴染成红色,分化率为(91.6±3.8)%以上,见图1C,说明培养的第3代HUMSCs具有MSCs多向分化能力。

Figure 1.Phynotype and differentiation of HUMSCs. A: phenotype of HUMSCs; B: differentiation of HUMSCs towards the osteogenic progenitors (Alizarin red staining, ×100); C: HUMSCs differentiated into adipocytes (oil red O staining).
图1人脐带间充质干细胞的分离与鉴定
2间充质干细胞外泌小体的分离与鉴定
经外泌小体提取试剂盒提纯的外泌小体经离心后在管底可见少量的白色沉淀物。用25 μL 1×PBS溶解,经2.5%戊二醛固定、脱水后,利用扫描电镜观察,可清晰地看到外泌小体的球状结构,见图2A;Western blot检测外泌小体中的CD63蛋白表达水平,并利用细胞培养上清作为阴性对照。从灰度图中可看出沉淀即提取物在CD63蛋白水平上表达强阳性,见图2B,提取的外泌小体高表达外泌小体特异性标志物CD63。
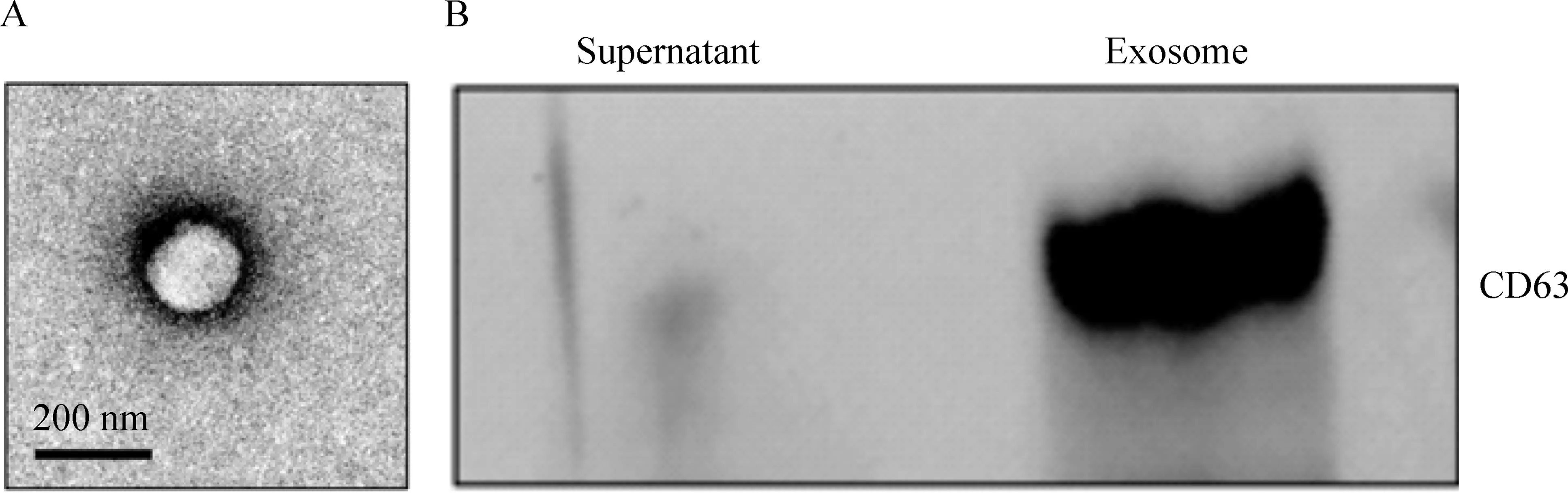
Figure 2.Isolation and identification the exosome of the HUMSCs. A: scanning electron microscopy showed the globular structure of the exosome; B: the exosome-specific protein CD63 was strongly positive identified by Western blot.
图2间充质干细胞外泌小体的分离与鉴定
3外泌小体对心肌细胞缺氧复氧后细胞凋亡的作用
心肌细胞经Annexin V-FITC/PI标记采用流式细胞术检测凋亡,缺氧复氧处理后的心肌细胞凋亡率明显增加(P<0.05),利用外泌小体处理缺氧复氧组可显著减少细胞的凋亡率(P<0.05);为观察不同浓度的外泌小体对心肌细胞凋亡的作用,将外泌小体实验原液与培养基以1∶100、2∶100、3∶100混合后处理心肌细胞,观察其是否仍具有同样的抗细胞凋亡作用,结果显示差异无统计学显著性,见图3。

Figure 3.Apoptosis of the cardiomyocytes treated with HUMSCs exosomes (EXO) after anoxia and reoxygenation (A/R). Mean±SEM.n=4.*P<0.05,**P<0.01vscontrol.
图3外泌小体对心肌细胞缺氧复氧后细胞凋亡的作用
4实时荧光定量 PCR验证MSCs外泌小体中microRNA表达
我们利用实时荧光定量PCR 检测HUMSCs外泌小体中与心脏保护相关microRNA的表达水平。 实验结果显示外泌小体富含miR-1a、miR-22、miR-24、miR-133a和miR-139p,其中miR-22的表达水平最高,达到内参照U6的(270.4±9.7)倍,见图4。

Figure 4.The microRNA expression levels in the exosomes detected by real-time PCR. Mean±SEM.n=4.
图4Real-time PCR验证HUMSCs外泌小体中microRNA的表达
5miR-22抑制心肌细胞凋亡
利用miR-22抑制剂处理心肌细胞可增加缺氧复氧后细胞凋亡率(P<0.05),说明外泌小体中富含的miR-22可有效抑制心肌细胞的凋亡,见图5。

Figure 5.Apoptosis of the cardiomyocytes treated with miR-22 inhibitor after anoxia and reoxygenation (A/R). miR-22 INC: miR-22 inhibitor negative control; miR-22 INH: miR-22 inhibitor. Mean±SEM.n=3.*P<0.05vsA/R+miR-22 INC.
图5miR-22抑制缺氧复氧后心肌细胞的凋亡
讨 论
心肌缺血再灌注损伤导致氧自由基增加和细胞钙超载引起心肌细胞凝固型坏死、间质细胞水肿、大量炎症细胞浸润等,从而导致患者心功能的严重受损[4]。研究结果表明,MSCs 发挥心脏保护功能主要是通过旁分泌细胞因子、生长因子等,抑制心肌缺血区局部炎症的级联反应、抑制心肌细胞凋亡、促进局部血管新生[5]。MSCs不仅旁分泌细胞因子,而且能够旁分泌具有生物活性的microRNA,在抑制心肌细胞凋亡、拮抗心肌肥大、改善血管新生等方面起重要的调控作用。
本研究成功培养具有MSCs特异性表型特征的人脐带间充质干细胞。并且发现外泌小体处理缺氧复氧条件下的心肌细胞,其凋亡率较单纯缺氧复氧组有显著降低,说明外泌小体在缺氧复氧条件下抑制心肌细胞的凋亡起到了一定的关键性作用;不同浓度外泌小体处理心肌细胞后,其抗细胞凋亡作用并无明显变化,外泌小体的作用达到生物学剂量后,对细胞凋亡的影响趋向于稳定,继续增加剂量其抗凋亡作用不会进一步增加。
MicroRNA 广泛参与心脏病理和生理过程的调节。既往研究成果显示microRNA 在心肌细胞和血管内皮细胞的分化、心肌细胞凋亡、心肌缺血区炎症级联反应等方面都起到重要的调控作用[6]。心肌梗死急性发作时, miR-1、miR-133a、miR-499 和miR-208a在患者血清中表达迅速增加,参与心肌细胞缺血预适应,可作为急性心肌梗死的预警标志物[7]。过表达miR-499 和miR-1 可间接上调肌球蛋白重链(myosin heavy chain,MHC)和心肌转录因子Mef2c,促进MSCs 向心肌细胞方向分化[8]。miR-1 通过靶向性抑制Bcl-2 减少细胞凋亡率,从而降低大鼠心肌缺血再灌注损伤[9]。miR-133、miR-210 和miR-21 通过抑制caspase 级联反应从而抑制心肌细胞凋亡[10]。本实验通过对外泌小体内可能与心脏保护作用相关microRNAs的分析,发现外泌小体富含miR-1a、miR-22、 miR-24、miR-133a和miR-139p,说明microRNA可能是外泌小体起到心脏保护作用的重要因素。
近来研究发现,miR-22在肿瘤发生、细胞凋亡、心肌细胞肥大中起重要的调控作用。在神经系统中,miR-22过表达通过抑制丝裂原活化蛋白激酶(MAPK14/p38)和肿瘤蛋白p53诱导核蛋白1(tumor protein p53-inducible nuclear protein 1,Tp53inp1) 能够有效抑制细胞凋亡,从而起到神经细胞保护作用[11]。在后负荷增加条件下,miR-22基因敲除鼠肌浆网钙负荷降低较容易发生心肌细胞肥大和心室扩张[12]。最近研究表明,缺氧导致MSCs分泌富含miR-22的外泌小体可通过下调Mecp2而减少心肌细胞凋亡[13]。以上研究结果提示miR-22是参与调控细胞凋亡的重要因子。
我们发现外泌小体富含miR-1a、miR-22、miR-24、miR-133a和miR-139p。其中miR-22表达水平最高,达到内参照U6的(270.4±9.7)倍,提示外泌小体发挥作用可能与外泌小体内的miR-22有关;在缺氧复氧条件下miR-22抑制剂处理心肌细胞后,其细胞凋亡率明显增加,说明miR-22在心肌细胞缺氧复氧损伤下起到了一定的保护作用。
本课题组前期已证实脐带MSCs 较骨髓MSCs 具有较强的增殖能力及分化潜能[14],而且多次尾静脉注射HUMSCs,未引起大鼠Th1、Th2 细胞免疫和体液免疫系统的变化,Th1/Th2 轴无明显改变;移植的HUMSCs 能较长时间地存活于大鼠骨髓内,具有较好的免疫相容性[15]。故本实验取材于人脐带间充质干细胞,该材料具有方便的可获得性,对受试对象无伤害,免疫原性低、不涉及法律伦理问题的优势,为减少心肌缺氧复氧损伤提供了另一种可有效利用的材料。我们成功提取人脐带间充质干细胞外泌小体,并验证了外泌小体在心肌缺氧复氧条件下减少心肌细胞凋亡,对心肌细胞起到了一定的保护作用。与此同时,本实验进一步提示外泌小体起到心肌细胞保护作用的关键性因素可能源于外泌小体富含的miRNA-22。本研究为临床干细胞治疗心脏缺血再灌注损伤提供了一个新的理论基础。外泌小体中富含的miR-22可能成为干细胞治疗的新靶点。
[1]Strauer BE, Steinhoff G. 10 years of intracoronary and intramyocardial bone marrow stem cell therapy of the heart: from the methodological origin to clinical practice[J]. J Am Coll Cardiol, 2011, 58(11):1095-1104.
[2]Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820(7):940-948.
[3]辛毅,李娜,黄益民,等. 人脐带间充质干细胞的原代培养及多向分化潜能的研究[J]. 细胞与分子免疫学杂志, 2013, 29(10):1087-1093.
[4]Frank A, Bonney M, Bonney S, et al. Myocardial ischemia reperfusion injury: from basic science to clinical bedside[J]. Semin Cardiothorac Vasc Anesth,2012, 16(3):123-132.
[5]Wen Z, Zheng S, Zhou C, et al. Repair mechanisms of bone marrow mesenchymal stem cells in myocardial infarction[J]. J Cell Mol Med, 2011, 15(5):1032-1043.
[6]Wen Z, Zheng S, Zhou C, et al. Bone marrow mesenchymal stem cells for post-myocardial infarction cardiac repair: microRNAs as novel regulators[J]. J Cell Mol Med, 2012, 16(4):657-671.
[7]Tijsen AJ, Pinto YM, Creemers EE. Circulating microRNAs as diagnostic biomarkers for cardiovascular diseases[J]. Am J Physiol Heart Circ Physiol, 2012, 303(9):H1085-H1095.
[8]Takaya T, Nishi H, Horie T, et al. Roles of microRNAs and myocardial cell differentiation[J]. Prog Mol Biol Transl Sci, 2012, 111:139-152.
[9]Tang Y, Zheng J, Sun Y, et al. MicroRNA-1 regulates cardiomyocyte apoptosis by targeting Bcl-2[J]. Int Heart J, 2009, 50(3):377-387.
[10]王家骥,贾竹青,周春燕. microRNA 在心脏发育和心脏疾病中的作用[J]. 中国科学, 2012, 42(12): 957-966.
[11]Jovicic A, Zaldivar Jolissaint JF, Moser R, et al. MicroRNA-22 (miR-22) overexpression is neuroprotective via general anti-apoptotic effects and may also target specific Huntington′s disease-related mechanisms[J]. PLoS One, 2013, 8(1):e54222.
[12]Huang ZP, Chen J, Seok HY, et al. MicroRNA-22 regulates cardiac hypertrophy and remodeling in response to stress [J]. Circ Res, 2013, 112(9): 1234-1243.
[13]Feng Y, Huang W, Wani M, et al. Ischemic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J]. PLoS One, 2014, 9(2):e88685.
[14]辛毅,李娜,张颖,等. 绿色荧光蛋白转基因小鼠不同源性间充质干细胞原代培养及生物学特性比较[J]. 中国病理生理杂志, 2014, 30(6) : 1141-1147.
[15]李娜,辛毅,林筝,等. 多次移植人脐带间充质干细胞对大鼠Th1和Th2比值影响[J]. 心肺血管病杂志, 2013, 32(6):789-793.
(责任编辑: 陈妙玲, 罗森)
Exosomes secreted by human umbilical mesenchymal stem cells protect cardiomyocytes from anoxia-reoxygenation injury
LI Jia2, XIN Yi1,3, CUI Wei1,3, LIU Sa1,3, HUANG Ran-ran1,3, CHEN Juan2, ZHOU Jie2, LI Na1,3
(1CapitalMedicalUniversityAffiliatedBeijingAnzhenHospital,Beijing100029,China;2DepartmentofBiochemistryandMolecularBiology,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China;3BeijingInstituteofHeart,Lung&BloodVesselDiseases,Beijing100029,China.E-mail:lina82002@126.com)
AIM: To investigate the anti-apoptosis effects of exosomes secreted by human umbilical mesenchymal stem cells (HUMSCs) in anoxia-reoxygenation injury and to analyze the protective microRNA expression levels in the exosomes. METHODS: HUMSCs were isolated and cultured until the 3rd generation, and the immunophenotype were identified by flow cytometry. The culture supernatant was collected, and the exosomes were purified using a Total Exosome Isolation kit. The morphology of the exosome was observed under electron microscope. The protein expression level of exosome-specific marker CD63 in the extract was determined by Western blot. The cardiomyocytes were treated with the exosomes under the anoxia and reoxygenation conditions and the apoptosis was studied by flow cytometry with Annexin V-FITC/PI staining. The expression levels of the cardioprotective microRNAs in the exosomes were detected. The apoptosis of the cardiomyocytes treated with miR-22 inhibitor was analyzed. RESULTS: The 3rd generation of HUMSCs highly expressed CD105, CD73 and CD90, but negatively expressed CD45, CD34, CD11b, CD79a, CD19 and HLA-DR, indicating that the culture of the 3rd generation of HUMSCs had the specific phenotype characteristics of MSCs. The differentiation percentage of the HUMSCs towards osteocytes was more than (92.5±5.1)%. In the adipocyte differentiation assay, the lipid droplets in the cells were observed and the differentiation rate was more than (91.6±3.8)%, indicating that the HUMSCs had multipotent differentiation capacity. Scanning electron microscopy showed globular structure of the exosomes which also strongly expressed the exosome-specific protein CD63. Anoxia and reoxygenation induced higher apoptosis of cardiomyocytes (P<0.05). The exosome treatment significantly decreased the apoptosis of cardiomyocytes (P<0.05). The anti-apoptotic effects of the exosomes at different concentrations, were almost the same (P>0.05). The high levels of miR-1a, miR-22, miR24, miR-133a and miR-139-5p were detected in the exosomes, among which the expression level of miR-22 was the highest, (270.4±9.7) times as high as the internal reference U6. Under the anoxia and reoxygenation conditions, the apoptosis of cardiomyocytes was significantly increased after miR-22 inhibitor treatment (P<0.05). CONCLUSION: Exosomes secreted by HUMSCs effectively reduce the apoptosis of cardiomyocytes from anoxia-reoxygenation injury. It might be related to high expression level of miR-22 in the secreted exosomes.
Human umbilical mesenchymal stem cells; Exosomes; MicroRNAs; Cardiomyocytes; Anoxia; Reoxygenation
1000- 4718(2016)04- 0577- 07
2015- 10- 27
2015- 12- 18
国家自然科学基金资助项目(No. 81370228);省部共建重点教育部心血管重塑相关疾病重点实验室项目(No. 110267);北京市卫生系统高层次卫生技术人才培养计划(No. 2014-3-045)
Tel: 010-64456059; E-mail: lina82002@126.com
R363.2
A
10.3969/j.issn.1000- 4718.2016.04.001
杂志网址: http://www.cjpp.net
