白杨素对大鼠主动脉舒张作用的影响*
2016-10-26田晴晴张夏丽高雪梅张明升张轩萍
田晴晴, 罗 乐, 张夏丽, 陈 敏, 李 洁, 高雪梅, 张明升, 张轩萍△
(1山西医科大学药理教研室, 2山西职工医学院生理学教研室,山西 太原 030001)
白杨素对大鼠主动脉舒张作用的影响*
田晴晴1,罗乐1,张夏丽1,陈敏1,李洁1,高雪梅2,张明升1,张轩萍1△
(1山西医科大学药理教研室,2山西职工医学院生理学教研室,山西 太原 030001)
目的: 研究白杨素(chrysin)对离体大鼠主动脉肌源性反应的影响,并探讨其作用机制。方法:分离SD大鼠主动脉,采用离体血管环灌流装置观察chrysin对血管环的基础张力及对60 mmol/L KCl预收缩血管的舒张作用,并结合不同抑制剂处理,探讨其作用于血管环的可能机制。结果:Chrysin(10-6mol/L、3×10-6mol/L、10-5mol/L、3×10-5mol/L 和10-4mol/L)对基础状态血管无明显影响,但对60 mmol/L KCl预收缩的血管环具有浓度依赖性舒张作用,并且去内皮组舒张作用弱于内皮完整组(P<0.05)。NOS抑制剂L-NAME(10-4mol/L)处理血管后,chrysin的舒张血管作用部分被抑制(P<0.05),COX抑制剂吲哚美辛(10-5mol/L)处理血管后无明显抑制作用。钾通道阻滞剂4-氨基吡啶(10-3mol/L)、氯化钡(10-4mol/L)、格列苯脲(10-5mol/L)和四乙胺(10-3mol/L)预孵后,chrysin舒张血管作用均被部分抑制(P<0.05)。Chrysin(10-6mol/L、10-5mol/L和10-4mol/L)可浓度依赖性抑制2.5 mmol/L CaCl2引起的主动脉收缩。结论:Chrysin能够浓度依赖性舒张大鼠主动脉,其作用机制可能与促进一氧化氮释放、激活4种K+通道及减少细胞内钙离子浓度有关。
白杨素; 主动脉环; 一氧化氮合酶; 环氧合酶; 钾通道; 钙
白杨素(chrysin)是从紫葳科植物木蝴蝶中提取的一种天然食源性黄酮,广泛存在于多种植物、蜂蜜和蜂胶中[1-3]。Chrysin具有广泛的药理学作用,包括抗病毒[4]、抗高血糖[5]、抗高血压[6]、抗肿瘤[7]、抗糖尿病肾病[8]等,是合成抗癌、抗菌、防治心脑血管疾病、降血脂、消炎等药物的原料。血管疾病是目前影响人类健康的主要疾病之一,导致血管产生疾病的原因多样,其中大部分是由于病变使管腔狭窄,继而发生受供器官或肢体的缺血以至坏死。大量临床资料表明,chrysin对动脉粥样硬化、高血压等血管疾病有治疗作用[5-6, 9],但其具体作用机制尚不明确。本实验利用离体器官恒温灌流系统,观察chrysin对大鼠离体主动脉环静息张力及对氯化钾(KCl,60 mmol/L)预收缩血管的舒张作用,同时,通过研究chrysin对去内皮、一氧化氮合酶(nitric oxide synthase,NOS)抑制剂、环氧合酶(cyclooxygenase,COX)抑制剂、钾离子通道抑制剂等引起的血管收缩作用的影响,进一步探讨其舒张血管作用的可能机制,为chrysin的临床应用及进一步研究、利用及开发新药提供理论依据。
材 料 和 方 法
1实验动物
Sprague-Dawley成年雄性大鼠,体重200~240 g,由山西医科大学实验动物中心提供,许可证号为SCXK(晋)2009-0001。动物饲养环境温度为22~23 ℃,湿度50%~55%,自由摄食饮水。
2主要试剂
乙酰胆碱(acetylcholine,ACh)、苯肾上腺素(phenylephrine,PE)、氯化钡(BaCl2)、四乙胺(tetraethylammonium,TEA)、4-氨基吡啶(4-aminopyridine, 4-AP)、格列本脲(glibenclamide,Gli)、左旋硝基精氨酸甲酯(L-nitroarginiemethylester,L-NAME)、吲哚美辛(indometacin,Indo)、二甲基亚砜(dimethyl sulpho-xide,DMSO)和HEPES均购自Sigma;白杨素购自大连美仑生物;其余试剂均为分析纯,购自武汉博士德公司。
3实验仪器
PowerLab 生物信号采集分析系统、DMT张力记录仪(澳大利亚埃德公司); HSS-1B 数字式超级恒温泵(成都仪器厂);微量加样器(上海求精生化试剂仪器有限公司);精密天平(北京赛多利斯仪器有限公司); PHS-3C 精密pH 计(上海雷磁);SartoriusBS124S 精密天平(北京赛多利斯)。
4主要方法
4.1血管环的制备大鼠断头处死后,立刻取其主动脉,置于4 ℃ 100% O2饱和的PSS液中,PSS液具体成分为:NaCl 144 mmol/L,KCl 5.8 mmol/L,CaCl22.5 mmol/L,MgCl24.2 mmol/L,Glucose 11.1 mmol/L,HEPES 5 mmol/L,pH 7.4。去除离体主动脉周围结缔组织及脂肪后,剪成长度3 mm~4 mm 的血管环。主动脉环随机分为去内皮组和内皮完整组,去内皮组采用与血管内径相适的棉棒去除其内壁的内皮细胞,内皮完整组不做处理。将制备好的主动脉环用2根不锈钢微型挂钩贯穿血管管腔,将离体主动脉水平悬挂在10 mL 浴漕内,下方固定,上方以一细钢丝连于张力换能器。Powerlab 生物信号测定系统记录血管张力变化。浴管内持续通以100% O2、37 ℃的PSS液5 mL。调整基础张力至2 g,平衡1 h,每15 min 换1次PSS溶液。
4.2血管内皮功能检测所有血管环用60 mmol/L KCl 进行刺激,待其稳定后, 即连续2次刺激所引起的收缩幅度差别小于5%,用PE(10-6mol/L)预收缩,收缩平稳后加入10-5mol/L 的Ach,舒张幅度不超过收缩幅度的5%时,认为内皮去除完全[10]。
4.3Chrysin对大鼠主动脉环基础张力的影响待血管环稳定后,按照浓度累加法加入chrysin(10-7mol/L、10-6mol/L、10-5mol/L、10-4mol/L和10-3mol/L) 或等量的PSS液,观察不同浓度的chrysin对大鼠主动脉血管环基础张力的影响。
4.4Chrysin对KCl 预收缩的内皮完整组和去内皮组血管环的影响血管环稳定后,内皮完整组和去内皮组加入60 mmol/L KCl,收缩达坪值后,分别累积加入chrysin (10-6mol/L、3×10-6mol/L、10-5mol/L、3×10-5mol/L和10-4mol/L),对照组加入相同剂量的PSS液。以60 mmol/L KCl 诱发的主动脉环最大收缩幅度作为100%,计算在加入不同浓度chrysin后舒张百分比变化,建立浓度效应曲线。
4.5L-NAME 和Indo 对chrysin舒张作用的影响用L-NAME(10-4mol/L)或Indo(10-5mol/L) 孵育内皮完整的血管环30 min,以KCl 预收缩,观察chrysin(10-6mol/L、3×10-6mol/L、10-5mol/L、3×10-5mol/L 和10-4mol/L)对血管的舒张作用,对照组加入相同剂量PSS 液。以高钾诱发的最大收缩幅度为100%,建立浓度效应曲线。
4.6钾通道阻断剂对chrysin舒张作用的影响用4-AP(10-3mol/L)、BaCl2(10-4mol/L)、Gli(10-5mol/L)或TEA(10-3mol/L)孵育内皮完整的血管环30 min,高钾预收缩,观察chrysin对血管环的舒张作用,对照组加入相同剂量PSS液。以高钾诱发的最大收缩幅度为100%,建立浓度效应曲线。
4.7Chrysin对外钙内流引起主动脉收缩的影响血管环稳定后,用含 EGTA 的无钙 PSS液洗脱血管环。20 min 后,当血管环张力回到基线时,将浴液更换为不含 EGTA 的无钙PSS 液。10 min 后,将浴液换为无钙的60 mol/L KCl,孵育 10 min,向浴槽内加入 2.5 mmol/L CaCl2,待血管环收缩达稳定的坪台时,仍然用含 EGTA的无钙PSS液去洗脱。20 min后,当血管环张力再次回到基线时,将浴液更换为不含 EGTA 的无钙 PSS 液。10 min 后,向浴槽内分别加入chrysin(10-6mol/L、10-5mol/L和10-4mol/L, chrysin一直存在于浴槽内),孵育 15 min,然后将浴液换为无钙的60 mmol/L KCl,孵育10 min,再次向浴槽内加入 2.5 mmol/L CaCl2。以孵育chrysin前含钙液中60 mmol/L KCl的收缩幅度为100%。
5统计学处理
结果以均数±标准差(mean±SD)表示。采用GraphPad Prism 6 作图,采用SPSS 20.0进行统计分析,两样本之间比较采用t检验,多组间比较釆用one-way ANOVA及SNK法进行显著性检验,以P<0.05 为差异有统计学意义。通过非线性回归计算IC50值(抑制50%最大收缩时所需要的药物浓度)或RC50值(产生50%舒张时所需要的药物浓度)。
结 果
1Chrysin对大鼠主动脉环基础张力的影响
Chrysin (10-7mol/L、10-6mol/L、10-5mol/L、10-4mol/L和10-3mol/L)对基础状态血管张力无明显影响,见图1。

Figure 1.The effect of chrysin on basic tension of normal rat aortic rings. Mean±SD.n=6.
图1白杨素对大鼠离体主动脉环基础张力的影响
2Chrysin对KCl预收缩的内皮完整组和去内皮组主动脉血管环的影响
Chrysin 对60 mmol/L KCl预收缩的血管环产生浓度依赖性的舒张作用,并且内皮完整组和去内皮组chrysin (10-4mol/L)的最大舒张率分别是(99.69±3.78)%和(58.94±9.62)%,RC50值分别为6.38×10-6mol/L和1.64×10-5mol/L;空白对照组几乎对血管环张力没有影响。两两比较,差异有统计学显著性(P<0.01),见图2。
3L-NAME和Indo对chrysin舒张作用的影响
Indo(10-5mol/L)组中,chrysin(10-4mol/L)最大舒张率是(94.10±10.18)%,RC50值为8.35×10-6mol/L,与对照组相比对chrysin的舒张作用无明显影响;而L-NAME(10-4mol/L)组中,chrysin(10-4mol/L)最大舒张率是(63.04±8.67)%,RC50值为4.81×10-5mol/L,与对照组相比差异有统计学显著性(P<0.05),见图3。

Figure 2.Chrysin-induced vasorelaxation in endothelium-intact (End+) or -denuded (End-) rat aorta rings precontracted with KCl. Relaxations were expressed as percentages of the maximal tension induced by 60 mmol/L of KCl. Mean±SD.n=6.**P<0.01vsEnd++ vehicle group;△△P<0.01vsEnd-+ vehicle vehicle group;##P<0.01vsEnd++chrysin group.
图2白杨素对KCl预收缩的内皮完整组和去内皮组主动脉血管环的影响
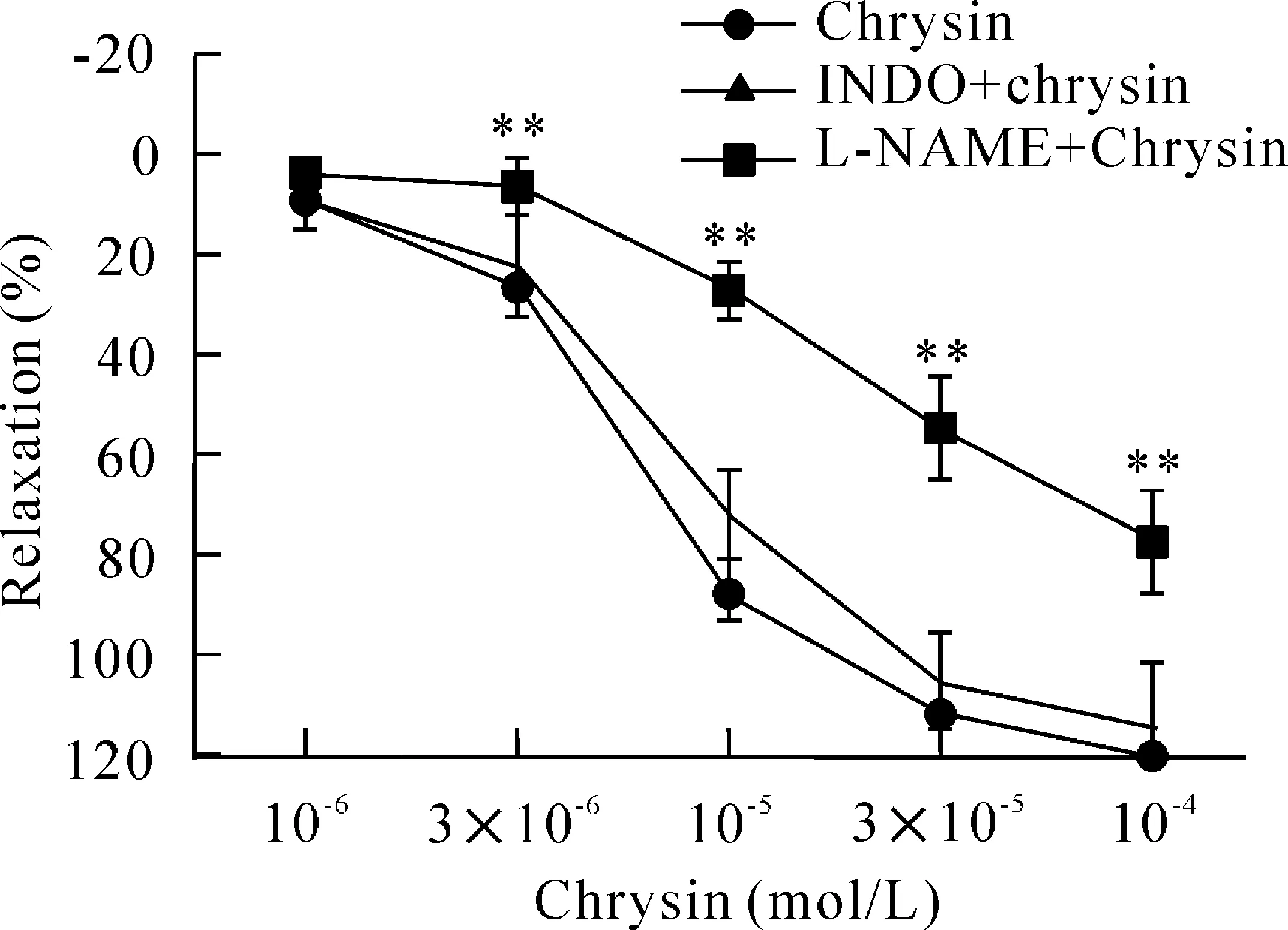
Figure 3.The effects of nitric oxide synthase inhibitor NG-nitro-L-arginine methyl ester (L-NAME, 10-4mol/L) and cyclooxygenase inhibitor indomethacin (Indo, 10-5mol/L) on the relaxation induced by chrysin in isolated thoracic aorta rings precontracted with KCl at 60 mmol/L. Mean±SD.n=6.**P<0.01vschrysin group.
图3L-NAME和Indo对白杨素舒张大鼠胸主动脉血管环作用的影响
4钾通道阻断剂对chrysin舒张作用的影响
BaCl2(10-4mol/L)、TEA(10-3mol/L)、4-AP(10-3mol/L)和Gli(10-5mol/L)分别可以特异性阻断KIR通道、KCa通道、KV通道及KATP通道。在钾通道阻断剂的基础上,chrysin的最大舒张率分别为71.06%±8.95%、66.21%±14.65%、49.41%±5.69%和53.40%±8.99%;RC50值分别为3.16×10-5mol/L、4.43×10-5mol/L、9.72×10-5mol/L和4.43×10-5mol/L。结果表明BaCl2、TEA、Gli 和4-AP 均能抑制chrysin的舒张血管作用(P<0.05),见图4。

Figure 4.The effects of BaCl2(10-4mol/L), TEA (10-3mol/L), Gli (10-5mol/L) and 4-AP (10-3mol/L) on chrysin-induced vasorelaxation in isolated rat thoracic aortic rings precontracted with KCl at 60 mmol/L. Mean±SD.n=6.**P<0.01vschrysin group.
图4钾通道阻断剂对白杨素舒张大鼠离体主动脉血管环作用的影响
5Chrysin对外钙内流引起主动脉收缩的影响
在无钙液中,60 mmol/L KCl 几乎不引起主动脉发生收缩,加入 2.5 mmol/L CaCl2后,血管发生收缩,且其收缩幅度与之前正常 PSS液中 60 mmol/L KCl引起的收缩幅度基本相当。提前孵育chrysin(10-6mol/L、10-5mol/L和10-4mol/L)可浓度依赖性地抑制 2.5 mmol/L CaCl2引起的血管收缩,其IC50值为 4.84×10-5mol/L,见图5。

Figure 5.The effects of chrysin on KCl (60 mmol/L)-induced contraction of isolated rat thoracic aorta rings with 2.5 mmol/L CaCl2. The vessels were incubated with chrysin at 10-6mol/L, 10-5mol/L and 10-4mol/L, and the vehicle for 15 min before addition of KCl. Mean±SD.n=6.**P<0.01vscontrol group.
图5白杨素对外钙内流引起主动脉收缩的影响
讨 论
血管疾病主要包括心血管疾病、脑血管疾病和周围血管疾病,具有发病率高、致死率高和致残率高的特点,危害极大。资料表明,chrysin是一种黄酮类化合物,具有抗氧化、抗焦虑、抗炎症、抗肿瘤、化疗增敏等多种药理作用[9, 11-13],而其抗氧化以及抗炎作用被认为对动脉粥样硬化、糖尿病等引起的心血管病变具有抑制作用,但其对血管的具体作用机制尚不明确。
课题组已经证明chrysin对大鼠离体肾动脉具有舒张作用[14]。本实验旨在研究chrysin对大鼠主动脉的作用及作用机制,结果显示chrysin对SD大鼠主动脉静息张力无明显影响,对KCl预收缩的内皮完整血管环和去内皮血管环均有显著舒张作用,并且对内皮完整血管环的舒张作用更明显,呈剂量依赖性。因此,chrysin对血管的舒张作用可能由两部分组成,部分作用于血管内皮,部分直接作用于血管平滑肌。
血管内皮可通过释放血管舒张因子和血管收缩因子主动调节血管张力。其中内皮细胞释放的NO 和前列环素是调节血压的主要因子,在维持血管基础张力的过程中发挥重要的作用[15]。本实验应用非特异性一氧化氮合酶抑制剂L-NAME 作用于大鼠主动脉环后,chrysin的血管舒张作用部分被阻断,提示NO 参与chrysin的舒张血管作用。前列环素通过激活腺苷酸环化酶,进而可以激活cAMP 依赖性的蛋白激酶A,从而介导其舒张血管等生理效应。前列环素由花生四烯酸在血管内皮细胞COX和前列环素合酶的作用下生成,其中,COX是花生四烯酸代谢过程中的重要限速酶之一。然而Indo 对chrysin的舒张作用无明显影响,提示chrysin的舒张作用和前列环素无关。
Ca2+是导致血管平滑肌收缩的重要因子,通过细胞内释放和细胞外流入产生,Ca2+内流途径主要有受体调控的钙通道和电压依赖性钙通道[16-17]。高钾引起血管平滑肌收缩机制是由于细胞外高浓度K+引起细胞膜去极化,电压依赖性钙通道开放,从而促使细胞外液中或与细胞膜疏松结合的Ca2+内流,因此K+通道活性的改变可使血管平滑肌细胞膜电位超极化或去极化,是参与血管舒张和收缩调节的重要机制。
迄今为止,血管平滑肌上已经发现有4种类型的钾通道,它们是电压依赖性钾通道(KV)、钙激活的钾通道(KCa)、ATP敏感性钾通道(KATP)和内向整流钾通道(KIR)[18]。结果显示,4-AP(10-3mol/L)、TEA(10-3mol/L)、BaCl2(10-4mol/L)和Gli(10-5mol/L)均可抑制chrysin的舒血管的作用,提示chrysin的舒血管作用可能与其开放4种钾通道有关。而孵育chrysin,可浓度依赖性地抑制 2.5 mmol/L CaCl2引起的血管收缩,提示chrysin舒张血管作用可能通过抑制电压依赖性钙通道的开放,减少细胞外钙内流,使细胞内Ca2+浓度下降而舒张血管。
[1]Jaganathan SK, Mandal M. Antiproliferative effects of honey and of its polyphenols: a review[J]. J Biomed Biotechnol, 2009, 40(10):1155-1167.
[2]Manzolli ES, Serpeloni JM, Grotto D, et al. Protective effects of the flavonoid chrysin against methylmercury-induced genotoxicity and alterations of antioxidant status,invivo[J]. Oxid Med Cell Longev, 2015, 2015:602360.
[3]Sun YM, Wu HI, Wang JY, et al. Simultaneous determination of eight flavonoids in propolis using chemometrics-assisted high performance liquid chromatography-diode array detection[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 962:59-67.
[4]Suresh Babu K, Hari Babu T, Srinivas PV, et al. Synthesis and biological evaluation of novel C (7) modified chrysin analogues as antibacterial agents[J]. Bioorg Med Chem Lett, 2006, 16(1):221-224.
[5]El-Bassossy HM, Abo-Warda SM, Fahmy A. Chrysin and luteolin attenuate diabetes-induced impairment in endothelial-dependent relaxation: effect on lipid profile, AGEs and NO generation[J]. Phytother Res, 2013, 27(11):1678-1684.
[6]Li XW, Wang XM, Li S, et al. Effects of chrysin (5,7-dihydroxyflavone) on vascular remodeling in hypoxia-induced pulmonary hypertension in rats[J]. Chin Med, 2015, 10:4.
[7]Premratanachai P, Chanchao C. Review of the anticancer activities of bee products[J]. Asian Pac J Trop Biomed, 2014, 4(5):337-344.
[8]Ahad A, Ganai AA, Mujeeb M, et al.Chrysin, an anti-inflammatory molecule, abrogates renal dysfunction in type 2 diabetic rats[J]. Toxicol Appl Pharmacol, 2014, 279(1):1-7.
[9]Wang HK, Xia Y, Yang ZY, et al. Recent advances in the discovery and development of flavonoids and their analogues as antitumor and anti-HIV agents[J]. Adv Exp Med Biol, 1998, 439:191-225.
[10]Denniff M, Turrell H, Vanezis A, et al.The time-of-day variation in vascular smooth muscle contractility depends on a nitric oxide signalling pathway[J]. J Mol Cell Cardiol, 2014, 66:133-140.
[11]Oleary KA, Pascual-Teresa S, Needs PW, et al. Effect of flavonoids and vitamin E on cyclooxygenase-2 (COX-2) transcription[J]. Mutat Res, 2004, 551(2):245-254.
[12]Woodman O, Chan EC. Vascular and anti-oxidant actions of flavonols and flavones[J]. Clin Exp Pharmacol Physiol, 2004, 31(11):786-790.
[13]Gyemant N, Tanaka M, Antus S, et al.Invitrosearch for synergy between flavonoids and epirubicin on multidrug-resistant cancer cells[J]. In Vivo, 2005, 19(2):367-374.
[14]秦小江,侯晓敏,梁泰刚. 白杨素对大鼠离体肾动脉的舒张作用[J]. 中国药物与临床, 2014, 14(8):1009-1011.
[15]Vita JA. Endothelial function[J]. Circulation, 2011, 124(25):e906-e912.
[16]Harraz OF, Altier C. STIM1-mediated bidirectional regulation of Ca2+entry through voltage-gated calcium channels (VGCC) and calcium-release activated channels (CRAC)[J]. Front Cell Neurosci, 2014, 8:43.
[17]Stutzmann G, Mattson MP. Endoplasmic reticulum Ca2+handling in excitable cells in health and disease[J]. Pharmacol Rev, 2011, 63(3):700-727.
[18]Silva MT, Ribeiro FP, Medeiros MA, et al. The vasorelaxant effect ofp-cymene in rat aorta involves potassium channels[J].Sci World J, 2015, 2015:458080.
(责任编辑: 陈妙玲, 罗森)
Effect of chrysin on relaxation of isolated rat aortic ring
TIAN Qing-qing1, LUO Le1, ZHANG Xia-li1, CHEN Min1, LI Jie1, GAO Xue-mei2, ZHANG Ming-sheng1, ZHANG Xuan-ping1
(1DepartmentofPharmacology,ShanxiMedicalUniversity,2DepartmentofPhysiology,ShanxiMedicalCollegeforConti-nuingEducation,Taiyuan030001,China.E-mail:yaolizxp@163.com)
AIM: To determine the effect of chrysin on the relaxation of isolated rat aortic rings and its mechanisms. METHODS: Onexvivoaortic ring perfusion device, the influence of chrysin on isolated aortic ring at basic condition or contraction of the aorta induced by KCl (60 mmol/L) was observed, and the effects of chrysin on the blood vessel reaction induced by various drugs were recorded. RESULTS: Chrysin (10-6mol/L, 3×10-6mol/L, 10-5mol/L, 3×10-5mol/L and 10-4mol/L) had no effect on isolated aortic ring at basic condition. Chrysin had stronger vasodilatation effect in intact group than that in non-intact group (P<0.05). Treatment of the arterial rings with eNOS inhibitor L-NAME, but not with indomethecin or endothelium denudation, obviously affected the relaxant effects of chrysin (P<0.05). When the contractions were induced by KCl, 4-aminopyridine (10-3mol/L), BaCl2(10-4mol/L), glibenclamide (10-5mol/L), and tetraethylammonium (10-3mol/L) weakened chrysin-induced diastolic effect (P<0.05). Chrysin significantly inhibited contracting effect of KCl on aorta rings in 2.5 mmol/L Ca2+medium (P<0.05). CONCLUSION: Chrysin exerts vasodilating effect on rat isolated aorta rings in a dose-dependent manner. The mechanism might be related to promoting NO release, activating K+channels and decreasing the concentration of cytoplasmic Ca2+.
Chrysin; Aorta rings; Nitric oxide synthase; Cyclooxygenase; Potassium channels; Calcium
1000- 4718(2016)04- 0618- 05
2015- 10- 20
2015- 12- 17
山西省自然科学基金资助项目(No. 2011011034-3);山西省卫生科研课题(No. 2015109)
Tel: 0351-4135423; E-mail: yaolizxp@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.04.007
杂志网址: http://www.cjpp.net
