基于诱导HAP结晶的强化生物除磷工艺厌氧上清液中磷的回收
2016-10-24代洪亮吕锡武高琪娜
代洪亮 吕锡武 高琪娜
(东南大学能源与环境学院, 南京210096)(无锡太湖水环境工程研究中心, 无锡214135)
基于诱导HAP结晶的强化生物除磷工艺厌氧上清液中磷的回收
代洪亮 吕锡武 高琪娜
(东南大学能源与环境学院, 南京210096)(无锡太湖水环境工程研究中心, 无锡214135)
以方解石为晶种,采用诱导羟基磷酸钙(HAP)结晶的方式在气曝式结晶反应柱内回收强化生物除磷工艺厌氧沉淀池上清液中的磷,系统考察了预处理曝气量及曝气时间、Ca/P摩尔比、反应时间、曝气强度、晶种粒径和投加量对磷回收效率的影响.优化实验结果表明:当晶种粒径为100~150目、晶种投加量为30 g/L、n(Ca)/n(P)为2.5、反应时间为35 min时,系统磷回收率可达68.82%,微晶产率下降到21.32%.通过30 d连续动态进水对装置稳定性能的考察发现,磷的平均回收率维持在73.43%.运用扫描电子显微镜(SEM)、X 射线能谱仪(EDS)和 X 射线衍射仪(XRD)对结晶产物表征,表明磷主要以HAP及其前驱物形态回收.
磷回收;厌氧上清液;诱导结晶;羟基磷酸钙
磷是水体富营养化的主要元素,但也属稀缺资源[1].随着世界人口增长和工农业生产发展,磷矿资源日渐枯竭,而城镇生活污水中含有较丰富的磷,回收潜力巨大.如果将污水中的磷回收,不仅能避免水体富营养化,还能实现磷资源的循环利用,具有经济和环境双重效益[2-3].采用诱导结晶法回收城镇污水中的磷可获得高品质含磷产物,该方法受到广泛重视[4].诱导结晶回收污水中的磷主要有磷酸铵镁(MAP)结晶法和羟基磷酸钙(HAP)结晶法[5-6].MAP法适用于氮磷浓度较高的废水,而HAP法则适用于中低浓度含磷废水,且特别适合于生物强化除磷工艺厌氧池出水中磷(浓度约为20 mg/L)的回收[7-8].目前主要的磷结晶反应器有DHV结晶反应器、CSIR流化床结晶柱和 Kurita固定床结晶柱等[9-11],其中以曝气为搅拌动力的流态化反应器因操作简单、无需添加碱性药剂提高反应体系pH值、回收率高等优点而备受关注[12].国内关于采用气曝式流态化结晶反应器回收低浓度含磷污水的研究还较少,研究局限于表观参数的优化,对工艺长期稳定运行性能和结晶产物的特性并未进行深入的考察.因此,本文采用课题组设计的以曝气为动力的流态化诱导结晶柱回收强化生物脱氮除磷工艺(A2N双污泥工艺)厌氧沉淀池上清液中的磷.首先,优化了影响磷回收效率的主要因素(预处理曝气量及曝气时间、n(Ca)/n(P)、反应时间、曝气强度、晶种粒径和投加量);然后,考察了体系最优条件下长期动态进水工艺稳定运行性能;最后,利用扫描电镜(SEM)、X 射线能谱仪(EDS)和X 射线衍射仪(XRD)对结晶产物进行分析.研究结果为污水磷回收工艺的开发奠定基础,同时为生物除磷和化学磷回收工艺的耦合、实现污水中磷的去除及部分回收提供参考.
1 材料与方法
1.1实验装置
本研究采用的气曝式诱导结晶柱由反应区、缓冲区和沉淀区3部分组成,有效工作体积为2.5 L(见图1)[13].反应区是构晶离子形成HAP的场所;缓冲区口径增大使溶液流速降低,有助于晶种沉淀;沉淀区用于晶种沉淀及出水.实验水质是生活污水稳定运行的强化生物脱氮除磷工艺(A2N双污泥系统)厌氧沉淀池上清液,其主要特性见表1.实验所用 CaCl2溶液由去离子水配制.
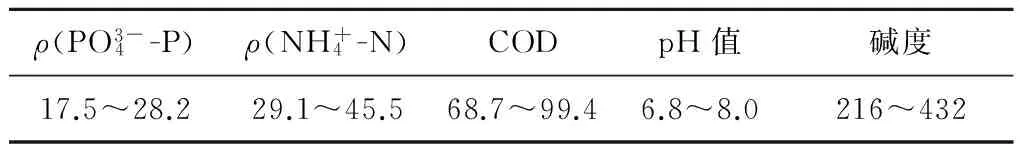
表1 A2N工艺中厌氧上清液水质招标 mg/L
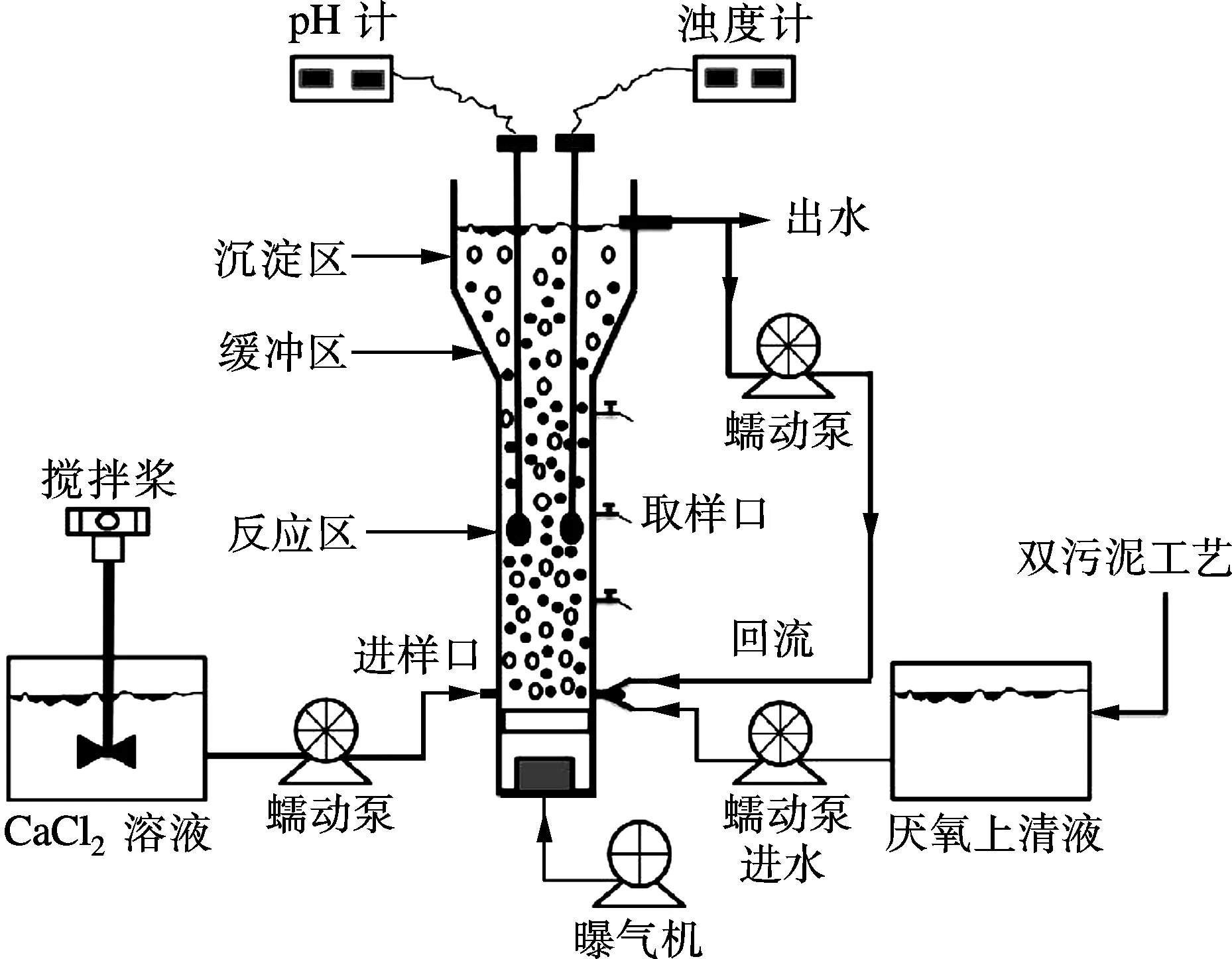
图1 气曝式诱导结晶工艺示意图
1.2实验设计
批式实验考察预曝气强度(100,200,300,400 L/h)和时间(0~120 min)对厌氧上清液pH值提升的影响.优化影响HAP结晶效率因素时,考察如下参数:①n(Ca)/n(P)=1,2,3,4;② 晶种粒径为60~80,80~100,100~150,150~200目;③ 曝气量为150,200,250,300,350,400 L/h;④ 晶种投加量为10,20,30,40,50,60 g/L.考察装置稳定运行性能时,采用连续30 d动态进水.
1.3测定方法及磷平衡计算
反应结束时取10 mL样品于取样瓶内,测定出水总磷(TP)含量后,立即加入1 mL盐酸(浓度为2 mol/L)进行酸化.测定溶解态磷(SP)含量时,采用0.45 μm(Millipore HAWP01300,USA)滤膜过滤后进行测量.反应体系中磷浓度的测定采用钼锑抗分光光度法[14].实验装置运行30 d后,取出结晶产物,经冷冻干燥处理,采用含有X射线能谱仪的扫描电子显微镜(Hitach S-4800,Japan)和 X 射线衍射仪(Bruker D8 Advance AXS,Germany)对结晶产物形态、组分以及结构进行分析.系统磷平衡计算中,回收率XR、微晶产率XM、磷转化率XT的计算公式分别为
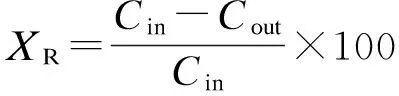
(1)
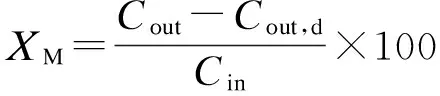
(2)
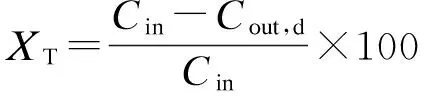
(3)
XT=XR+XM
(4)
式中,Cin为进水磷浓度;Cout为出水总磷浓度;Cout,d为0.45μm滤膜过滤后溶解磷浓度.
2 结果与分析
2.1曝气量及时间对厌氧上清液pH值的影响
在HAP诱导结晶反应过程中钙、磷浓度和pH值是影响反应的主要因素,其中pH 值对诱导结晶反应至关重要[15].pH值较低时,由于饱和度较低,不能发生结晶反应.pH值过高时,溶液处于过饱和状态,易发生均相沉淀,不利于磷回收.厌氧沉淀池上清液含有较丰富的磷(约20 mg/L),其pH值小于HAP形成的最合适的pH值8.5.因此,在HAP结晶磷回收前应对其进行预处理[16].研究发现,曝气吹脱不仅能降低厌氧上清液中悬浮物浓度,还可提高其pH值[13,16].
在稳定运行的A2N工艺中,取4 L厌氧沉淀池上清液,分别置于4组平行的结晶反应器内,在曝气量分别为100,200,300,400 L/h的条件下,考察曝气强度和时间对厌氧上清液pH值提升的影响.厌氧沉淀池上清液在不同曝气量下pH值变化趋势如图2所示.增加曝气量,厌氧沉淀上清液的pH值上升速率加快.随着曝气时间的延长,厌氧沉淀上清液最终pH值保持在8.58~8.71.pH值上升的主要原因是通过向结晶柱内的反应体系曝气,CO2被吹脱出水体,破坏了水中原有碳酸化合物的平衡体系,该体系可以表示为[5,16]
(5)
(6)
(7)
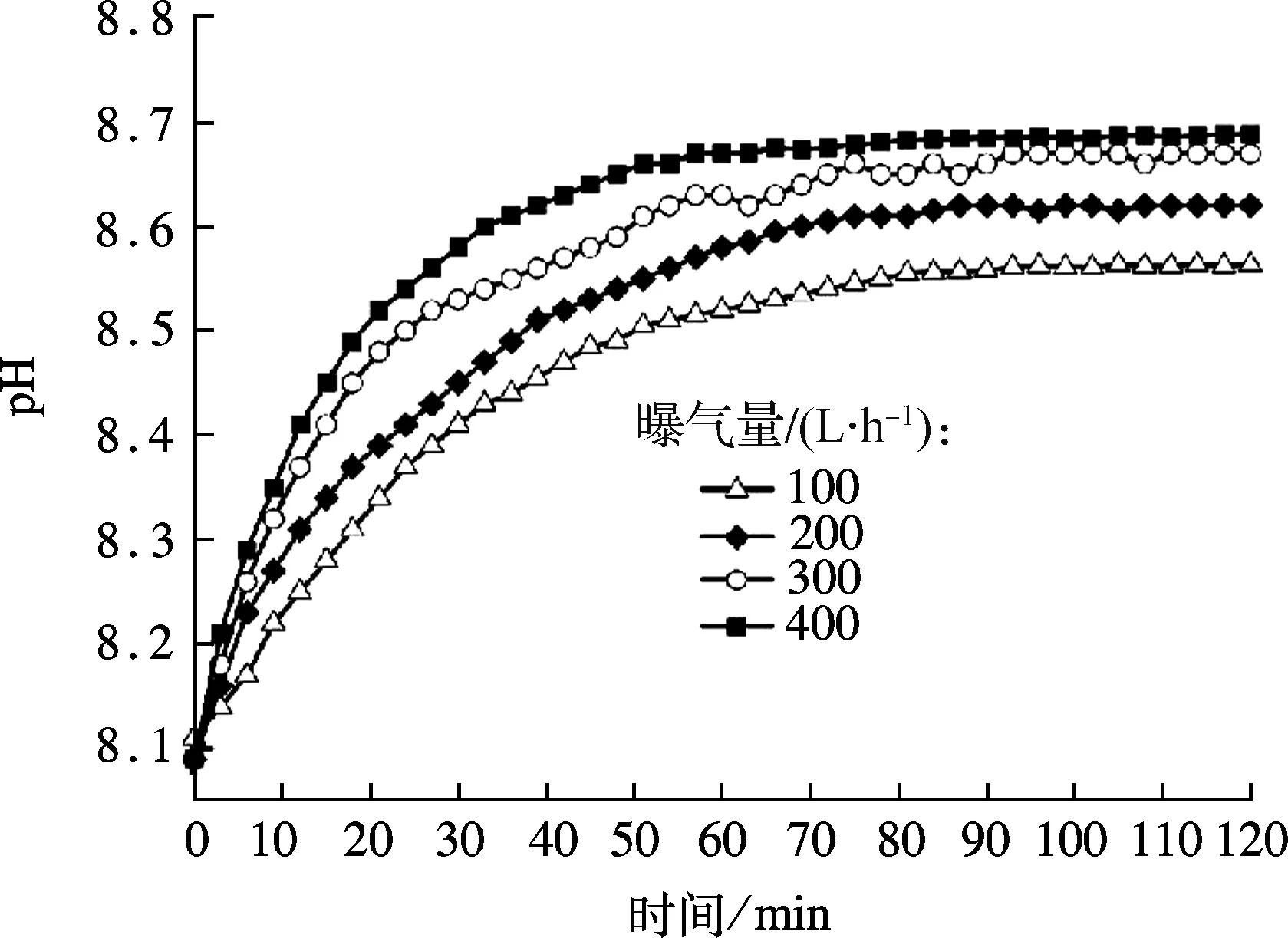
图2 不同曝气量及时间对厌氧沉淀上清液pH值的影响
可见,吹脱CO2,反应式平衡向右移动,造成H+消耗,从而使水体pH值上升.曝气强度越大,CO2被吹脱的速率越大,因而pH值的上升速率越快.研究表明,当曝气强度超过300 L/h时,经过40 min吹脱,厌氧上清液的pH值可达8.58.
2.2n(Ca)/n(P)、反应时间及诱导结晶柱投量优化
在稳定运行的A2N工艺中,当晶种粒径为80~100目、投加量为20 g/L、曝气量为300 L/h时,结晶柱内一次性投加不同浓度的CaCl2溶液控制n(Ca)/n(P)以考察投药量对结晶磷回收的影响.通过检测出水磷浓度和磷回收效率来确定工艺最佳投药量.如图3所示,加入沉淀剂,TP在反应器内快速下降.当反应至90 min时,TP浓度由 24.5 mg/L 分别降低至 14.5,12.3,10.7 和9.87 mg/L,磷回收率XR分别为40.81%,49.79%,56.35% 和59.62%(见图4).随着n(Ca)/n(P)的升高,系统内微晶产率分别为8.27%,18.56%,28.36%和32.97%,原因是采用一次性投药方式,系统内构晶离子浓度过大,溶液处于过饱和状态,发生了均相沉淀,产生大量沉降性差的微晶[10].微晶的产生虽能有效提高磷转化率,但严重影响磷回收效率[15].
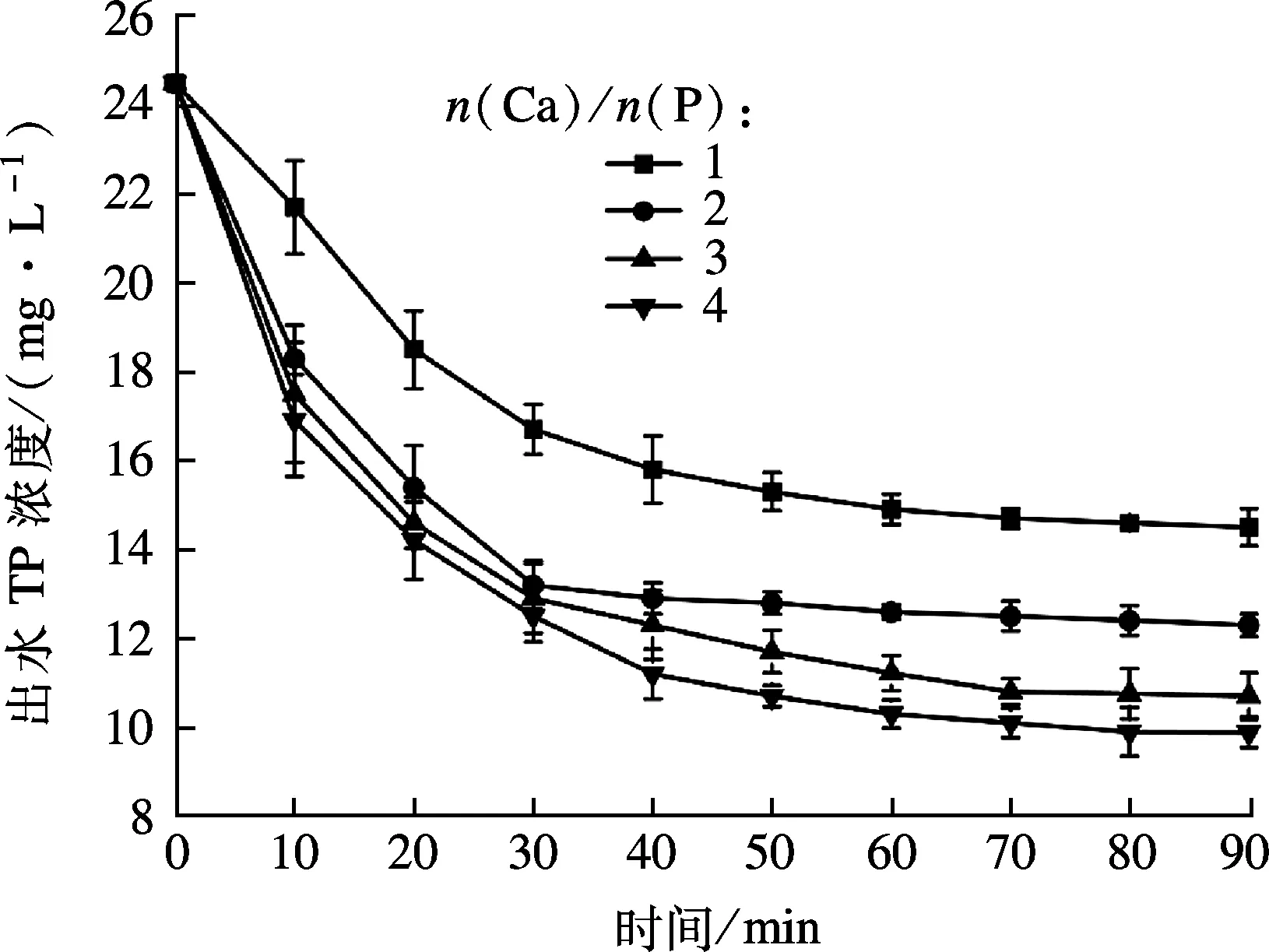
图3 不同投药量对出水TP浓度的影响
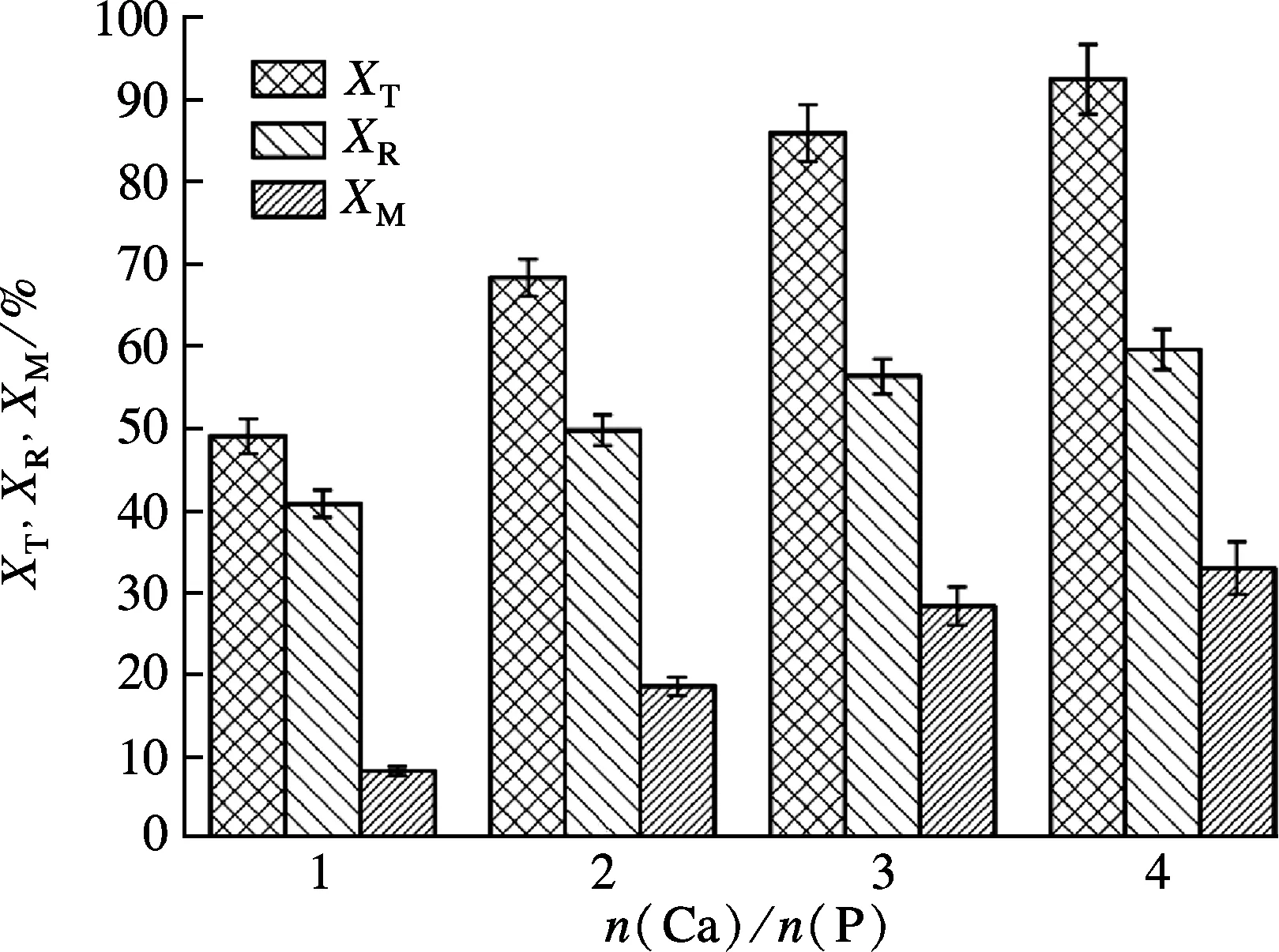
图4 不同投药量对磷回收效率的影响
根据上述实验结果还可得出,当n(Ca)/n(P)>3后,溶液中过高的钙离子浓度无法有效提升结晶率,同时还增加了形成均相结晶的可能.根据文献[17]报道,体系中碱性环境下投加高浓度钙离子可生成CaCO3沉淀,易造成结垢和Ca2+损耗.综上所述,本文后续研究采用n(Ca)/n(P)=2.5,反应时间35 min.
2.3晶种粒径及曝气强度对诱导结晶磷回收的影响
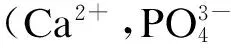
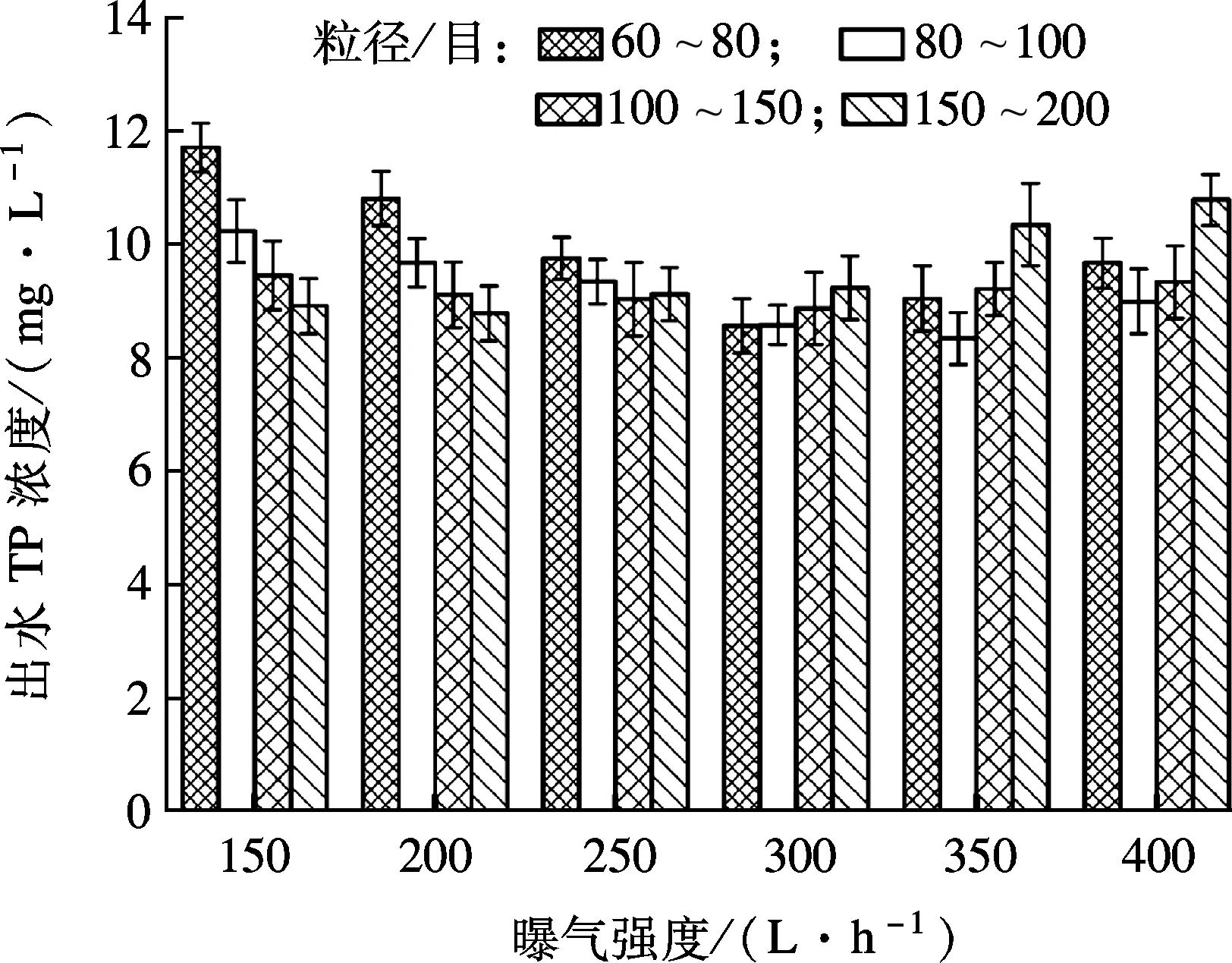
图5 晶种粒径和曝气量对出水总磷的影响
系统磷回收率XR和微晶产率XM随晶种粒径变化情况如图6所示,当粒径为60~150目时,晶体颗粒越大,系统磷回收率越高.当晶种粒径为100~150目时,磷的最高回收效率达到67.23%,但当晶种粒径为150~200目时,XR下降为63.17%.这是由于在曝气量一定的条件下,晶种粒径较小,沉降性变差,结晶产物会随着水流流出结晶柱;晶种粒径太大,结晶柱内反应物流化程度较差,构晶离子不能与晶种充分接触,降低了磷的回收效率.另外,研究发现,晶种粒径对微晶产率影响较小,微晶产率保持在约21%.综上所述,当曝气量为300 L/h、晶种粒径为100~150目时,磷回收效果较好.
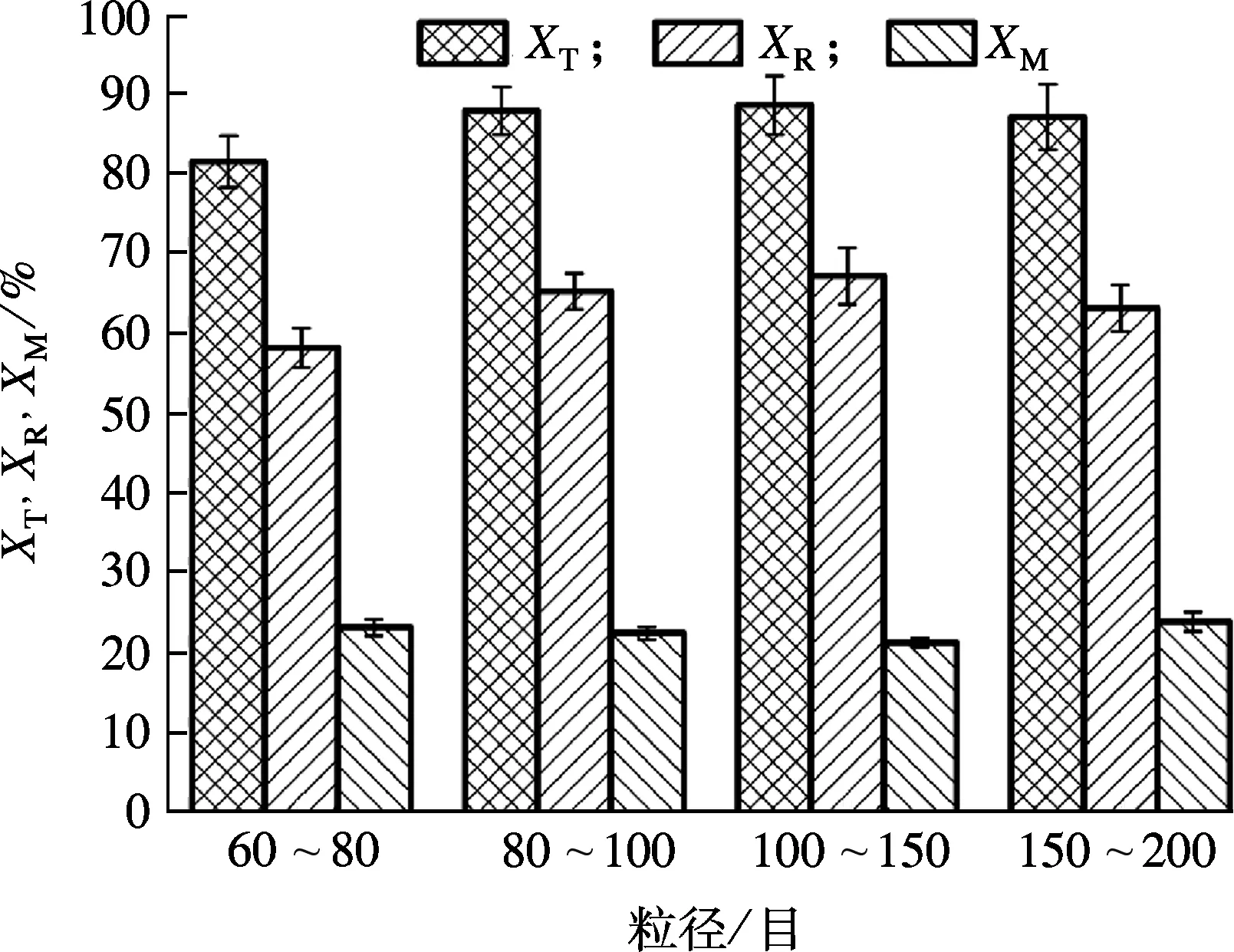
图6 晶种粒径和曝气量对磷回收率的影响
2.4晶种投加量对诱导结晶磷回收的影响
在结晶柱中分别加入10,20,30,40,50,60 g/L的方解石作为晶种,曝气强度为300 L/h,保持反应器内呈流化状态,反应时间为35 min,n(Ca)/n(P)=2.5,晶种粒径为100~150目,考察晶种粒径和曝气量对结晶回收磷效率的影响.由图7可知,当晶种投加量由10 g/L增加到60 g/L时,磷回收率XR由50.43%上升到 69.89%,表明溶液中增加晶种量可为构晶离子提供更多的吸附表面积,使结晶反应从均相向非均相转变,磷回收效率增加.然而,当进水中磷浓度不变时,进一步提高晶种投加量,系统内磷回收效率增加缓慢.当晶种投加量大于40 g/L 时,XR保持在约69%.过高的晶种投加量使晶种颗粒间的摩擦力加大,易造成晶体脱落,影响磷的回收效率.因此,系统晶种投加量选择30 g/L,此时XR为68.82%,XM为21.32%.
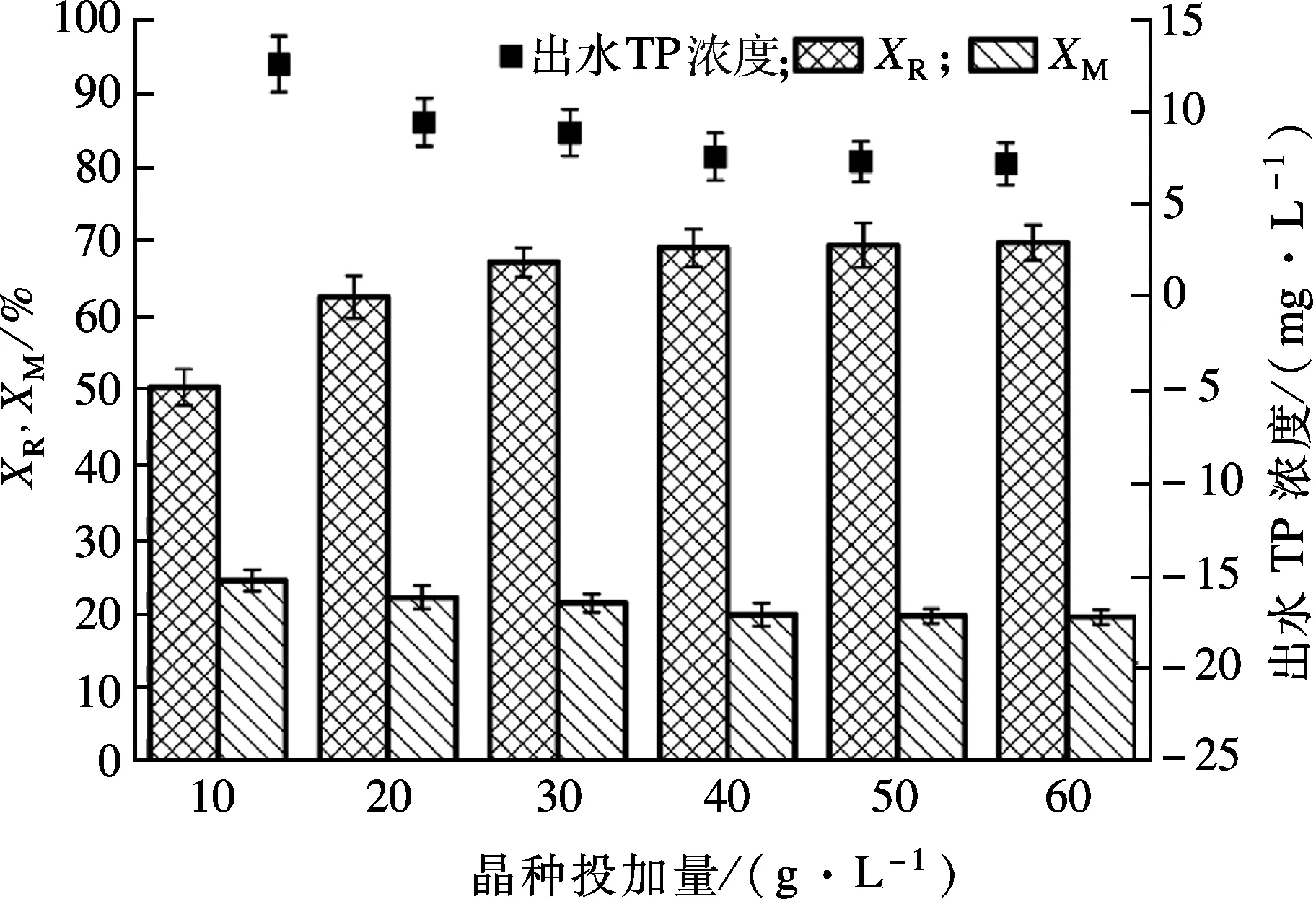
图7 晶种投加量对工艺性能的影响
2.5系统稳定运行性能和结晶产物特性
最优工艺条件下连续30 d动态进水,考察系统磷回收效率及稳定性.如图8所示,工艺运行过程保持着较高的磷回收效率和较低的微晶产率.磷回收效率XR在68.79%~74.31%之间,平均回收率为73.43%;微晶产率XM维持在18.87%~23.32%,平均值为20.17%.随着系统的运行,XR不断升高,运行5 d后从初始的68.83%上升到73.21%,这是由于工艺运行初期,晶体与晶种表面存在较大的错配度,导致微晶不能较好地吸附于晶种表面,随着晶种表面逐渐被结晶产物覆盖,其与诱晶载体表面错配率下降,结晶产物能更好地生长在晶种表面[21].Aldaco等[22]研究诱导结晶去除污水中Cu2+时也发现相似的现象,随着工艺运行时间的延长,铜离子的回收率有所增高.
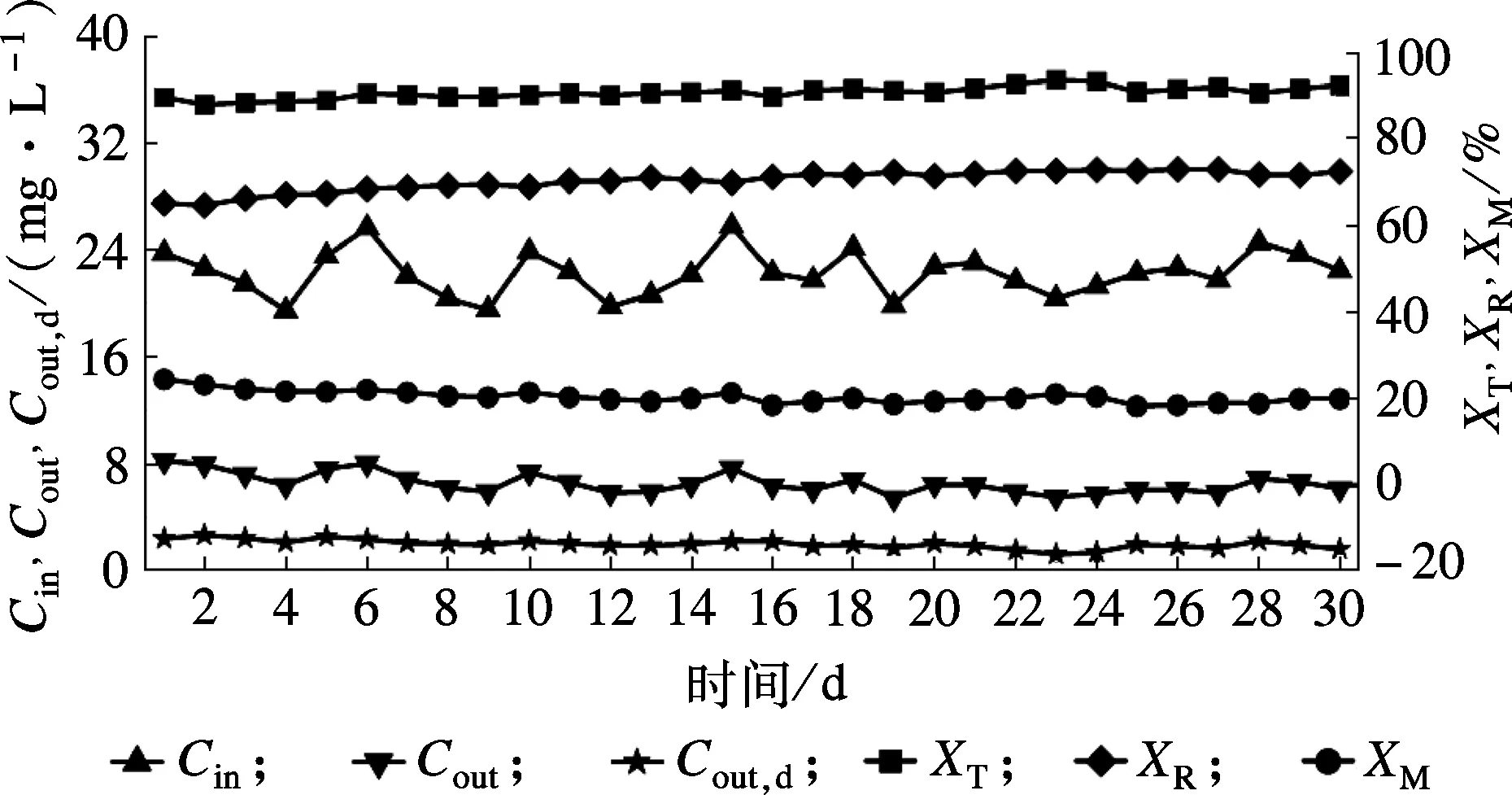
图8 气曝式结晶反应器连续30 d动态进水条件下磷回收性能
运用SEM,EDS,XRD技术对A2N工艺运行30 d后的结晶产物进行分析,结果如图9~图11所示.图9为晶种结晶前和诱导结晶反应后的对比图,可以看出,晶种表面覆盖了一层无定形状的粗糙结晶产物.相比于结晶后的晶种表面,微晶结构更加松散.EDS元素定量分析结果表明,晶种、结晶产物及微晶的主要成分为钙(15.26%~37.23%)、磷(5.98%~18.78%)和微量镁(约0.01%)、氯(约0.01%)等元素.如图10(b)、(c)所示,结晶产物和微晶的n(Ca)/n(P)摩尔比分别为2.81和1.64,而理论HAP以及其前驱体的n(Ca)/n(P)为1.33~1.67[23].结晶产物有较高的n(Ca)/n(P)可能是由于晶种的主要成分为碳酸钙.EDS图谱表明,结晶产物中存在少量镁,可能系统发生了磷酸钙和磷酸铵镁共沉淀.图11中的XRD图谱表明,结晶产物和微晶的峰型与HAP标准峰ICCD(国际衍射数据中心,PDF73-0293)有较高的匹配度.但是衍射峰较宽,表明晶型发育尚不完全,晶化程度较低.这可能是由于结晶过程中形成了HAP前驱物 (ACP,OCP 和 DCPD)[24],类似结果也出现在其他HAP晶体研究中[25-28].此外,XRD图谱中还出现了碳酸钙的衍射峰,表明系统发生了碳酸盐和磷共沉淀[17,29].图11中没有出现磷酸铵镁的衍射峰,可能是由于生活污水中镁离子含量较低.
3 结论
1) 曝气吹脱CO2可提高A2N工艺厌氧沉淀池上清液pH值.当曝气强度为300 L/h,经40 min吹脱,厌氧上清液的pH值可达8.58.
2)n(Ca)/n(P)影响溶液的过饱和度,过高的n(Ca)/n(P)导致体系发生均相沉淀,产生大量沉降性差的微晶.微晶的产生虽能提高磷转化率,但严重影响磷回收效率.
3) 优化实验结果得出,当晶种粒径为100~150目、晶种投加量为30 g/L、n(Ca)/n(P)为2.5、反应时间为35 min时,系统磷回收率达68.82%,微晶产率下降到21.32%.

图9 晶种、结晶产物和微晶的SEM图
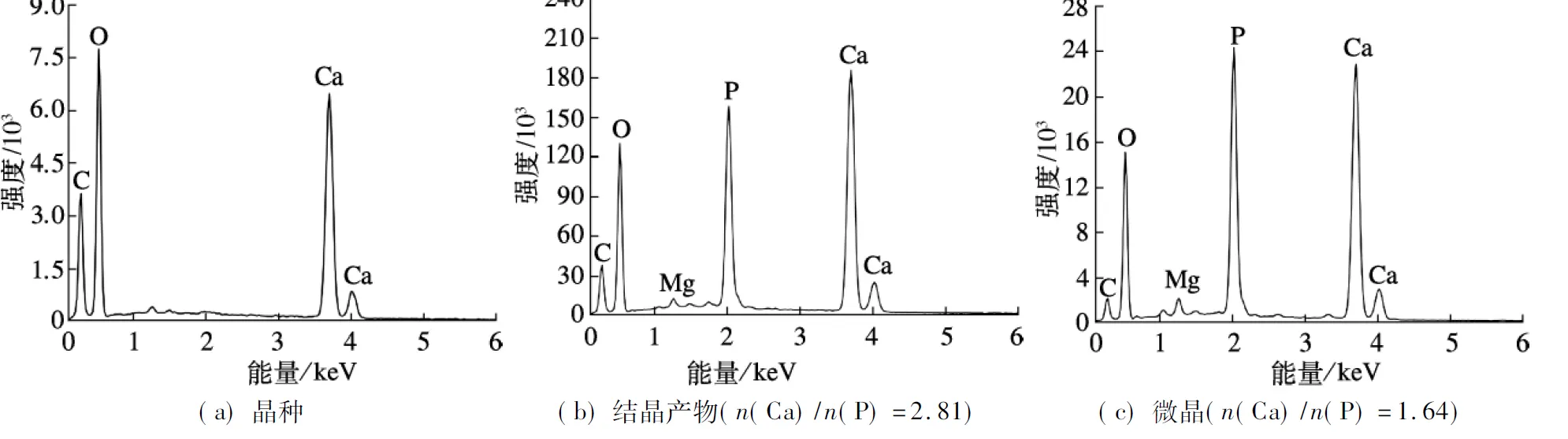
图10 晶种、结晶产物和微晶的EDS能谱分析图
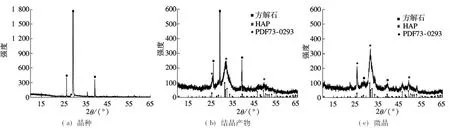
图11 晶种、结晶产物和微晶的XRD衍射图谱
4) 工艺最优条件下连续30 d动态进水,系统一直保持着较高磷回收效率(73.43%).SEM,EDS和XRD图谱分析结果显示,结晶产物为HAP及其前驱物.
5) 实验证实,通过诱导HAP结晶回收污水中的磷具有可行性,但微晶产率及磷回收效率还有进一步提升空间.
References)
[1]Conley D J, Paerl H W, Howarth R W, et al. Controlling eutrophication: Nitrogen and phosphorus [J].Science, 2009, 323(5917): 1014-1015. DOI:10.1126/science.1167755.
[2]郝晓地, 衣兰凯, 王崇臣,等. 磷回收技术的研发现状及发展趋势[J]. 环境科学学报, 2010, 30(5):897-907.
Hao Xiaodi, Yi Lankai, Wang Chongchen, et al. Situation and prospects of phosphorus recovery techniques [J].ActaScientiaeCircumstantiae, 2010, 30(5):897-907. (in Chinese)
[3]Withers P J A, Elser J J, Hilton J, et al. Greening the global phosphorus cycle: How green chemistry can help achieve planetary P sustainability [J].GreenChemistry, 2015, 17(4): 2087-2099. DOI:10.1039/c4gc02445a.
[4]Moerman W, Carballa M, Vandekerckhove A, et al. Phosphate removal in agro-industry: Pilot-and full-scale operational considerations of struvite crystallization [J].WaterResearch, 2009, 43(7): 1887-1892. DOI:10.1016/j.watres.2009.02.007.
[5]Suzuki K, Tanaka Y, Kuroda K, et al. Recovery of phosphorous from swine wastewater through crystallization [J].BioresourceTechnology, 2005, 96(14): 1544-1550. DOI:10.1016/j.biortech.2004.12.017.
[6]Kim E H, Yim S B, Jung H C, et al. Hydroxyapatite crystallization from a highly concentrated phosphate solution using powdered converter slag as a seed material [J].JournalofHazardousMaterials, 2006, 136(3): 690-697. DOI:10.1016/j.jhazmat.2005.12.051.
[7]Angela M, Beatrice B, Mathieu S. Biologically induced phosphorus precipitation in aerobic granular sludge process[J].WaterResearch, 2011, 45(12): 3776-3786. DOI:10.1016/j.watres.2011.04.031.
[8]Yuan Z, Pratt S, Batstone D J. Phosphorus recovery from wastewater through microbial processes [J].CurrentOpinioninBiotechnology, 2012, 23(6): 878-883. DOI:10.1016/j.copbio.2012.08.001.
[9]van Houwelingen G, Bond R, Seacord T, et al. Experiences with pellet reactor softening as pretreatment for inland desalination in the USA[J].DesalinationandWaterTreatment, 2010, 13(1): 259-266. DOI:10.5004/dwt.2010.1097.
[10]Randall D G, Nathoo J, Lewis A E. A case study for treating a reverse osmosis brine using eutectic freeze crystallization: Approaching a zero waste process [J].Desalination, 2011, 266(1): 256-262.DOI:10.1016/j.desal.2010.08.034.
[11]Moriyama K, Kojima T, Minawa Y, et al. Development of artificial seed crystal for crystallization of calcium phosphate [J].EnvironmentalTechnology, 2001, 22(11):1245-1252.
[12]Suzuki K, Tanaka Y, Osada T, et al. Removal of phosphate, magnesium and calcium from swine wastewater through crystallization enhanced by aeration [J].WaterResearch, 2002, 36(12): 2991-2998. DOI:10.1016/s0043-1354(01)00536-x.
[13]邹海明, 吕锡武, 李婷. 诱导 HAP 结晶回收污水中磷主要影响因素分析[J]. 东南大学学报(自然科学版), 2013, 43(5): 1005-1010. DOI:10.3969/j.issn.1001-0505.2013.05.018.
Zou Haiming, Lü Xiwu, Li Ting. Analysis of major influential factors on phosphorus recoveryfrom wastewater using induced HAP crystallization process [J].JournalofSoutheastUniversity(NaturalScienceEdition),2013,43(5):1005-1010. DOI:10.3969/j.issn.1001-0505.2013.05.018. (in Chinese).
[14]李国刚, 吕怡兵, 李娟. 水和废水污染物分析测试方法[M].北京: 化学工业出版社,2012: 219-221.
[15]Karapinar N, Hoffmann E, Hahn H H. P-recovery by secondary nucleation and growth of calcium phosphates on magnetite mineral [J].WaterResearch, 2006, 40(6): 1210-1216. DOI:10.1016/j.watres.2005.12.041.
[16]史静, 吕锡武, 许正文, 等. A2N-IC工艺诱导结晶柱位置选择及投药量优化[J]. 东南大学学报(自然科学版), 2015, 45(1): 103-108. DOI:10.3969/j.issn.1001-0505.2015.01.019.
Shi Jing, Lü Xiwu, Xu Zhengwen, et al. Optimizations of induced crystallization reactor position and calcium dosage in A2N-IC process [J].JournalofSoutheastUniversity(NaturalScienceEdition),2015, 45(1):103-108. DOI:10.3969/j.issn.1001-0505.2015.01.019. (in Chinese)
[17]Song Y, Weidler P G, Berg U, et al. Calcite-seeded crystallization of calcium phosphate for phosphorus recovery [J].Chemosphere, 2006, 63(2): 236-243. DOI:10.1016/j.chemosphere.2005.08.021.
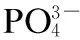
[19]葛杰, 钱锋, 宋永会, 等. 白云石石灰流化结晶污水除磷工艺[J]. 环境科学学报,2014, 34(6): 1480-1488. DOI:10.13671/j.hjkxxb.2014.0539.
Ge Jie, Qian Feng, Song Yonghui, et al. Process of phosphorus removal from wastewater by dolomite fluidized crystallization [J].ActaScientiaeCircumstantiae, 2014, 34(06):1480-1488. DOI:10.13671/j.hjkxxb.2014.0539. (in Chinese)
[20]李佳凤, 吕锡武, 徐微, 等. 诱导结晶反应器回收富磷上清液中磷的研究[J]. 中国给水排水, 2010, 26(1):13-15.
Li Jiafeng, Lü Xiwu, Xu Wei, et al. Study on operation parameters of fluidized induced crystallizer for phosphorus recovery [J].ChinaWater&Wastewater, 2010, 26(1):13-15. (in Chinese)
[21]陈坚, 袁鹏, 蔡思鑫, 等. 碳酸盐体系中pH对Cu2+诱导结晶过程的影响[J]. 环境科学研究, 2015, 28(1):96-102.
Chen Jian, Yuan Peng, Cai Sixin, et al. Impacts of pH on the process of crystallization induced by copper in carbonate system [J].ResearchofEnvironmentalSciences, 2015, 28(1):96-102. (in Chinese)
[22]Aldaco R, Garea A, Irabien A. Calcium fluoride recovery from fluoride wastewater in a fluidized bed reactor [J].WaterResearch, 2007, 41(4): 810-818. DOI:10.1016/j.watres.2006.11.040.
[23]Kim E H, Lee D W, Hwang H K, et al. Recovery of phosphates from wastewater using converter slag: Kinetics analysis of a completely mixed phosphorus crystallization process [J].Chemosphere, 2006, 63(2): 192-201. DOI:10.1016/j.chemosphere.2005.08.029.
[24]Tervahauta T, van der Weijden R D, Flemming R L, et al. Calcium phosphate granulation in anaerobic treatment of black water: A new approach to phosphorus recovery [J].WaterResearch, 2014, 48(1): 632-642. DOI:10.1016/j.watres.2013.10.012.
[25]Combes C, Rey C. Amorphous calcium phosphates: Synthesis, properties and uses in biomaterials [J].ActaBiomaterialia, 2010, 6(9): 3362-3378. DOI:10.1016/j.actbio.2010.02.017.
[26]Qiu G, Law Y M, Das S, et al. Direct and complete phosphorus recovery from municipal wastewater using a hybrid microfiltration-forward osmosis membrane bioreactor process with seawater brine as draw solution [J].EnvironmentalScience&Technology, 2015, 49(10): 6156-6163. DOI:10.1021/es504554f.
[27]Shi J, Lu X, Yu R, et al. Nutrient removal and phosphorus recovery performances of a novel anaerobic-anoxic/nitrifying/induced crystallization process [J].BioresourceTechnology, 2012, 121(2): 183-189. DOI:10.1016/j.biortech.2012.06.064.
[28]Harris W G, Wilkie A C, Cao X, et al. Bench-scale recovery of phosphorus from flushed dairy manure wastewater [J].BioresourceTechnology, 2008, 99(8): 3036-3043. DOI:10.1016/j.biortech.2007.06.065.
[29]Song Y, Hahn H H, Hoffmann E. Effects of solution conditions on the precipitation of phosphate for recovery: A thermodynamic evaluation [J].Chemosphere, 2002, 48(10): 1029-1034. DOI:10.1016/s0045-6535(02)00183-2.
Phosphorus recovery from anaerobic supernatant of EBPR process based on HAP crystallization
Dai Hongliang Lü Xiwu Gao Qina
(School of Energy and Environment, Southeast University, Nanjing 210096, China) (ERC Taihu Lake Water Environment, Wuxi 214135, China)
With calcite as seed crystal, an induced hydroxyapatite (HAP) crystallization process was developed for phosphorus recovery from anaerobic supernatant of EBPR (enhanced biological phosphorus removal) in air-agitated crystallization columns. The influences of the pre-aeration rate and time, molar ratio of Ca/P, reaction time, aeration intensity, seed crystal size, and loads on the recovery rate were systematically investigated. The optimal test results show that when the seed diameter in mesh is 100 to 150, the seed dosage is 30 g/L, then(Ca)/n(P) is 2.5 and the reaction time is 35 min, the phosphorus recovery rate of 68.82% is obtained, and the yield of microcrystalline drops to 21.32%. During the system stability by continuous water input for 30 d, the reaction system maintains an average recovery rate of 73.43%. Morphologies and structures of crystallized products characterized by SEM, EDS and XRD show that HAP and its intermediates are the main products.
phosphorus recovery; anaerobic supernatant; induced crystallization; hydroxyapatite
10.3969/j.issn.1001-0505.2016.05.021
2016-03-04.作者简介: 代洪亮(1987—),男,博士生;吕锡武(联系人),男,博士,教授,博士生导师,xiwulu@seu.edu.cn.
“十二五”国家水体污染控制与治理科技重大专项资助项目(2012ZX07101-005)、国家自然科学基金资助项目(51078074)、中央高校基本科研业务费专项资金资助项目:江苏省普通高校研究生科研创新计划 (KYLX15-0073).
X703.1
A
1001-0505(2016)05-1020-07
引用本文: 代洪亮,吕锡武,高琪娜.基于诱导HAP结晶的强化生物除磷工艺厌氧上清液中的磷回收[J].东南大学学报(自然科学版),2016,46(5):1020-1026. DOI:10.3969/j.issn.1001-0505.2016.05.021.
