生长分化因子5基因真核表达质粒pcDNA3.1(+)/hGDF5的构建、鉴定及其活性检测
2016-10-22杨治,张铭,刘林,彭侃,许鹏
杨 治, 张 铭, 刘 林, 彭 侃, 许 鹏
(西安交通大学医学院附属红会医院关节外科, 西安 710054)
生长分化因子5基因真核表达质粒pcDNA3.1(+)/hGDF5的构建、鉴定及其活性检测
杨治, 张铭, 刘林, 彭侃, 许鹏
(西安交通大学医学院附属红会医院关节外科, 西安710054)
目的构建生长分化因子5(growth/differentiation factor 5,GDF5)基因的真核表达质粒pcDNA3.1(+)/hGDF5,并对其进行鉴定和活性检测。方法根据Genbank中人GDF5序列设计并合成引物,以pCA350-hGDF5质粒为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增获得GDF5基因,并与pcDNA3.1(+)质粒连接构建真核表达质粒pcDNA3.1(+)/hGDF5。pcDNA3.1(+)/hGDF5经限制性内切酶消化、PCR扩增进行鉴定。将pcDNA3.1(+)/hGDF5分别转染MC615细胞及293细胞,利用PCR、Western blotting及免疫荧光法检测GDF5 mRNA及蛋白的表达。结果真核表达质粒pcDNA3.1(+)/hGDF5经限制性内切酶酶切、PCR扩增表明构建成功,PCR、Western blotting及免疫荧光实验结果显示真核表达质粒pcDNA3.1(+)/hGDF5能在MC615细胞及293细胞中稳定表达。结论成功构建了真核表达质粒pcDNA3.1(+)/hGDF5,为进一步研究GDF5的功能奠定了基础。
生长分化因子5; 质粒; 活性; 鉴定
生长分化因子5(growth/differentiation factor 5,GDF5)又称软骨形态发生蛋白1(cartilage-derived morphogenetic protein-1,CDMP -1),属于转化生长因子-β(transforming growth factor-β,TGF-β)超家族成员,是机体软骨形成、骨骼发育的重要调节因子之一,可以促进脂肪来源的间充质干细胞分化成骨、软骨及肌腱[1-4]。本课题组前期研究结果表明GDF5可刺激成熟软骨细胞的增殖,促进Ⅱ型胶原和蛋白多糖的合成,并能维持软骨细胞的生物学特性[5];同时研究还发现GDF5可促进骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的增殖,在成软骨诱导体系中,GDF5可使单层培养的BMSCs聚集诱导并其向软骨细胞分化,并形成软骨小结[6]。为了进一步研究GDF5在体内的作用,本研究构建了pcDNA3.1(+)/hGDF5重组质粒,同时对pcDNA3.1(+)/hGDF5重组质粒进行了鉴定和活性检测。
1 材料与方法
1.1主要试剂与仪器pCA350-hGDF5质粒由德国Erlangen-Nurnberg大学 Klaus von der Mark 教授惠赠,pcDNA3.1(+)、软骨细胞系MC615和293细胞及大肠杆菌DH5а由西安交通大学医学部公共卫生学院地方病研究所保存。转染试剂FuGENE6为德国Roche 公司产品,限制性内切酶BamHⅠ、NotⅠ及抗GDF5抗体为德国Santa Cruz Biotech产品,TRIzol液为美国Invitrogen公司产品,逆转录试剂盒试剂盒为立陶宛Fermentas公司产品,PCR试剂为TaKaRa生物科技有限公司产品,PCR引物由上海生工生物工程技术服务有限公司合成。紫外分光光度计购自美国Thermo Scientific公司,PCR扩增仪购自美国Bio-Rad公司,冷冻高速离心机购自德国Eppendorf公司,蛋白电泳分析系统购自美国Bio-Rad公司。
1.2实验方法
1.2.1真核表达质粒pcDNA3.1(+)/hGDF5的构建登录Genbank 获得人 GDF5 基因序列,根据GDF5基因和真核表达载体pcDNA3.1(+)的序列和限制性内切酶位点,设计并合成引物,并在引物5′端和3′端分别引入BamHⅠ、NotⅠ酶切位点,上游引物为5′-GCTGTTCTGGATCCTGTCATTCAGGGGCTGGCC-3′,下游引物为5′-TATTCTTACGCCGGCGGCCAGTGCTGCTACCTGCAGC-3′。以pCA350-hGDF5质粒为模板扩增GDF5基因,PCR产物及pcDNA3.1(+)质粒分别经BamHⅠ、NotⅠ双酶切,经T4DNA 连接酶连接后得到真核表达质粒pcDNA3.1(+)/hGDF5。
1.2.2真核表达质粒pcDNA3.1(+)/hGDF5的鉴定将真核表达质粒pcDNA3.1(+)/hGDF5转化大肠杆菌DH5а,经过氨苄青霉素筛选阳性克隆,利用限制性内切酶BamHⅠ、NotⅠ进行酶切后,采用1%琼脂糖进行凝胶电泳。采用Primer5.0软件设计GDF5 PCR反应引物,上游引物:5′-CAG AGC GGG CCT TAA TCT-3′,下游引物:5′-CGT GGT CAG GAA GCA GAG-3′,产物长度为443 bp。以真核表达质粒pcDNA3.1(+)/hGDF5为模板进行PCR扩增,PCR反应条件为:94℃ 5 min预变性; 94℃ 45 s、50℃ 45 s、72℃ 45 s,30个循环;72℃延伸6 min。PCR扩增产物经1.5%琼脂糖凝胶电泳后紫外线分析仪下观察,并用计算机图像分析系统拍摄相片。
1.2.3FuGENE6介导真核表达质粒pcDNA3.1(+)/hGDF5转染MC615及293细胞6孔培养板每孔接种5×105个MC615细胞或293细胞,分为真核表达质粒pcDNA3.1(+)/hGDF5转染组和空载体转染组。接种12 h后换新鲜培养液,40 min后进行转染。每孔转染液为100 μL DMEM液(不含FCS及P/S)、3 μL FuGENE及质粒DNA 1 μg,将转染液均匀滴于培养液中,培养板放于37℃、5% CO2细胞培养箱中培养;6 h后换新鲜培养液,继续培养并观察。1.2.4聚合酶链式反应(polymerase chain reaction,PCR)检测细胞中GDF5 mRNA的表达6孔培养板转染细胞培养48 h后收集细胞,加入1 mL的Trizol液提取细胞总RNA,利用逆转录试剂盒合成cDNA第一链,严格按照试剂盒说明书进行操作。20 μL PCR反应体系包括10 μL PCR反应Mix(2×)、上下游引物各1 μL、模板1 μL及双蒸水7 μL;PCR反应条件为:94℃ 5 min预变性; 94℃ 45 s、50℃ 45 s、72℃ 45 s,30个循环;72℃延伸6 min。PCR扩增后反应产物经1.5%琼脂糖凝胶电泳后紫外线分析仪下观察,并用计算机图像分析系统拍摄相片。
1.2.5Western blotting检测细胞中GDF5蛋白的表达6孔培养板转染细胞培养48 h后收取细胞,加入RIPA裂解液提取细胞总蛋白,利用12%SDS-PAGE电泳分离蛋白,转PVDF膜后加入5%脱脂奶粉封闭1 h,加入抗GDF5抗体后4℃孵育过夜,利用TBST洗涤3次后加入二抗,37℃孵育1 h后TBST洗涤3次后加入化学发光液上机检测。
1.2.6免疫荧光检测基因转染细胞GDF5蛋白的表达6孔培养板转染细胞培养48 h,利用PBS洗涤2次细胞后加入甲醇固定5 min;加入PBS液洗涤3次细胞,加入1∶4的山羊血清室温下封闭30 min;加入PBS液洗涤3次细胞,加入1∶100的抗GDF5抗体,室温下孵育60 min;PBS液洗涤3次细胞后加入FITC标记的二抗,室温下避光孵育60 min;加入Roti○R-Histolitt后利用荧光显微镜下观察拍照。
2 结果
2.1真核表达质粒pcDNA3.1(+)/hGDF5的鉴定结果真核表达质粒pcDNA3.1(+)/hGDF5经双酶切后进行1.5%琼脂糖凝胶电泳,电泳图出现约5.3 kb和1.5 kb 2条片段,而单酶切电泳获6.8 kb大小片段,和质粒载体及hGDF5基因大小符合,见图1。利用真核表达质粒pcDNA3.1(+)/hGDF5为模板进行GDF5基因的PCR扩增,结果显示在相当于443 bp处有明显电泳条带,和预计值一致,见图2。

1、3:BamHⅠ和NotⅠ双酶切;2:BamHⅠ单酶切; M:DNA Marker
图1真核表达质粒pcDNA3.1(+)/hGDF5酶切电泳图
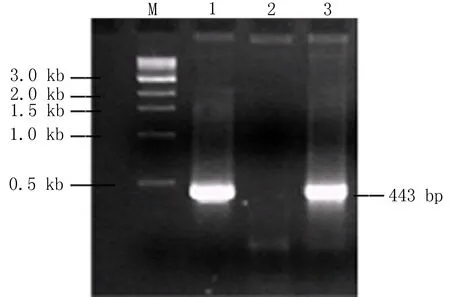
M:DNA Marker; 1、3:真核表达质粒pcDNA3.1(+)/hGDF5;2:pcDNA 3. 1 (+) 质粒
图2真核表达质粒pcDNA3.1(+)/hGDF5的PCR扩增鉴定
2.2真核表达质粒pcDNA3.1(+)/hGDF5转染细胞后GDF5 mRNA表达结果FuGENE6介导基因转染48 h后PCR结果显示,真核表达质粒pcDNA3.1(+)/hGDF5转染的MC615细胞组和293细胞组出现443 bp电泳条带,且MC615细胞组泳带明显于293细胞组;而转染pcDNA3.1(+)空载体的MC615细胞组和293细胞组未出现443 bp电泳条带,见图3。

M:DNA Marker;1:pcDNA3.1(+) /hGDF5重组质粒转染MC615细胞组;2:pcDNA3.1(+)空载体转染MC615细胞组;3:pcDNA3.1(+)/hGDF5重组质粒转染293细胞组;4:pcDNA3.1(+)空载体转染293细胞组
图3真核表达质粒pcDNA3.1(+)/hGDF5转染细胞后GDF5基因扩增反应产物
2.3真核表达质粒pcDNA3.1(+)/hGDF5转染细胞后GDF5蛋白的表达结果FuGENE6介导基因转染48 h后Western blotting结果显示,真核表达质粒pcDNA3.1(+)/hGDF5转染的MC615细胞组和293细胞组出现分子量大小约55.6 ku的明显条带,且MC615细胞组的条带明显粗于293细胞组;而转染pcDNA3.1(+)空载体的MC615细胞组和293细胞组未出现55.6 ku条带,见图4。
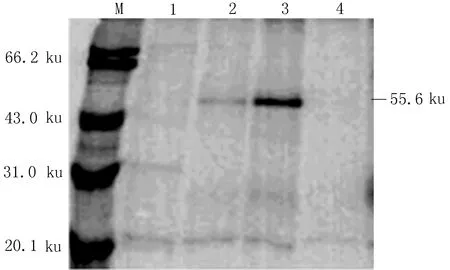
M:Marker;1:pcDNA3.1(+)空载体转染293细胞;2:真核表达质粒pcDNA3.1(+)/hGDF5转染293细胞;3:真核表达质粒pcDNA3.1(+)/hGDF5转染MC615细胞;4:pcDNA3.1(+)空载体转染MC615细胞
图4真核表达质粒pcDNA3.1(+)/hGDF5转染细胞GDF5蛋白检测结果
2.4真核表达质粒pcDNA3.1(+)/hGDF5转染细胞后GDF5蛋白免疫荧光检测结果基因转染后48 h荧光显微镜下观察可见:真核表达质粒pcDNA3.1(+)/hGDF5转染MC615细胞组有约40%细胞胞浆中散在的绿色荧光,293细胞组有约30%细胞胞浆中散在的绿色荧光,见图5。


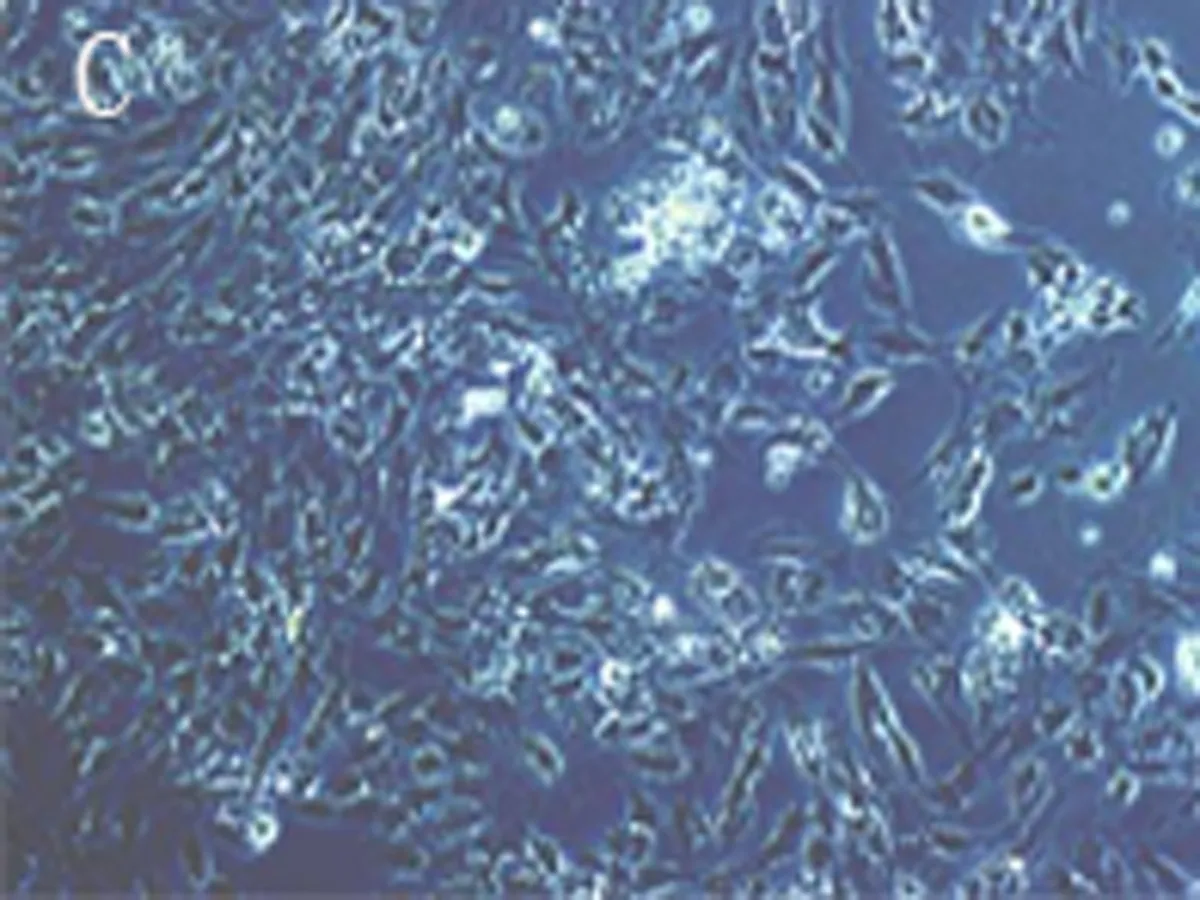

A:荧光显微镜下真核表达质粒pcDNA3.1(+)/hGDF5转染MC615细胞B:荧光显微镜下真核表达质粒pcDNA3.1(+)/hGDF5转染293细胞C:光镜下真核表达质粒pcDNA3.1(+)/hGDF5转染MC615细胞D:光镜下真核表达质粒pcDNA3.1(+)/hGDF5转染293细胞
图5真核表达质粒pcDNA3.1(+)/hGDF5转染细胞后GDF5蛋白免疫荧光检测(100×)
3 讨论
GDF5基因是由Hotten等[7]于1994年首先从人胎儿cDNA文库中克隆获得,GDF5基因突变或缺失可引起严重的肢体畸形,如鼠的短肢、短耳畸形和人的hunter-thompson肢端发育不良、Grebe畸形以及C型短肢症等[8-12],这与GDF5功能缺乏导致的软骨细胞黏附、增殖力下降,从而使机体在发育阶段不能形成正常软骨有关。由于GDF5在机体软骨、骨骼发育中所具有的重要作用[1-4],使人们对外源GDF5可能具有的生物学作用产生了浓厚兴趣。有人将外源性的GDF5和胶原基质复合移植动物皮下和肌肉,结果形成了软骨样和肌腱样组织[13];而用生物可降解材料负载GDF5移植骨和软骨缺损处能显著提高组织的愈合速度和质量[14-15];还有研究发现将GDF5用于损伤的肌腱和韧带的修复,也取得了满意的效果[16-18]。
生长因子及其外源重组蛋白在体内代谢快、难以持续稳定表达,作用效率不高,且费用昂贵,在实际应用中受到一定限制。随着现代分子生物学技术及转基因技术的不断发展,可以利用基因转染手段将外源基因(如生长因子基因)转入载体细胞,使其获得较为稳定和有效的表达,持续不断的分泌目的蛋白质,发挥生物学效应。本实验根据Genbank上GDF5 cDNA序列,以pCA350-hGDF5质粒为模板经PCR扩增得到GDF5基因,经BamHⅠ、NotⅠ双酶切及T4DNA连接酶连接,获得了真核表达质粒pcDNA3.1(+)/hGDF5。并将真核表达质粒pcDNA3.1(+)/hGDF5进行酶切及PCR扩增,证实真核表达质粒pcDNA3.1(+)/hGDF5构建成功。有效的基因治疗依赖于目的基因在靶细胞中高效、稳定的表达,而这在很大程度上取决于基因治疗采用的载体系统。目前比较成熟的转染技术有病毒感染法和非病毒感染法,非病毒感染法又包括磷酸钙共沉淀法、电穿孔法、以及脂质体介导法等,FuGENE6是Roche公司开发的一种以脂质为主的多种成分的转染反应剂,它具有对多种普通类型细胞感染率高、对多种细胞(包括原代细胞)无细胞毒性、在有血清或无血清时均发挥作用及转染条件要求低等优点,在实验研究中被广泛应用。本实验利用FuGENE6将真核表达质粒pcDNA3.1(+)/hGDF5转入软骨细胞系MC615细胞和293细胞中,分别采用PCR、Western blotting及免疫荧光法检测到了细胞中GDF5 mRNA及蛋白的表达。实验结果表明真核表达质粒pcDNA3.1(+)/hGDF5可以通过FuGENE6转染能够进入细胞,并合成GDF5。实验还观察到FuGENE6转染的细胞并未出现大的异常变化,转染后细胞外形的一些变化很快就转为正常,这表明FuGENE6转染是相对安全和有效的。
综上所述,本研究成功构建了真核表达质粒pcDNA3.1(+)/hGDF5,采用FuGENE6介导真核表达质粒pcDNA3.1(+)/hGDF5转染的MC615细胞和293细胞能够表达GDF5基因,产生GDF5蛋白,这为进一步体内研究GDF5的功能奠定了基础。
[1]Gruber HE, Hoelscher GL, Ingram JA, et al. Growth and differentiation factor-5 (GDF-5) in the human intervertebral annulus cells and its modulation by IL-1β and TNF-α in vitro[J]. Exp Mol Pathol, 2014, 96(2):225-229.
[2]Feng C, Liu H, Yang Y, et al. Growth and differentiation factor-5 contributes to the structural and functional maintenance of the intervertebral disc[J]. Cell Physiol Biochem, 2015, 35(1):1-16.
[3]Svala E, Thorfve AI, Ley C, et al. Effects of interleukin-6 and interleukin-1β on expression of growth differentiation factor-5 and Wnt signaling pathway genes in equine chondrocytes[J]. Am J Vet Res, 2014, 75(2):132-140.
[4]张文婷, 罗飞宏. 生长分化因子5调控细胞分化机制研究新进展[J]. 医学综述, 2014, 20(2): 199-203.
[5]张小卫, 王金堂, 李萌, 等, 生长分化因子-5对大鼠关节软骨细胞生长代谢的影响[J]. 中医正骨, 2010, 22(10): 17-21.
[6]刘林, 许珂, 姚建锋, 等, 生长分化因子5对大鼠骨髓间质干细胞生长分化的影响[J]. 新疆医科大学学报, 2015, 38(10): 1237-1241.
[7]Hotten G, Neidhardt H, Jacobowsky B, et al. Cloning and expression of recombinant human growth/differentiation factor 5[J]. Biochem Biophys Res Commun, 1994,204(2):646-652.
[8]Storm EE, Huynh TV, Copeland NG, et al. Limb alterations in brachypodism mice due to mutationsin a new member of the TGF-beta superfamily [J]. Nature, 1994,368(6472): 639-643.
[9]Uyguner ZO, Kocaoglu M, Toksoy G, et al. Novel indel mutation in the GDF5 gene is associated with brachydactyly type C in a four-generation turkish family[J]. Mol Syndromol, 2014, 5(2):81-86.
[11]Takahara M, Harada M, Guan D, et al. Developmental failure of phalanges in the absence of growth/differentiation factor 5[J]. Bone, 2004,35(5):1069-1076.
[12]Degenkolbe E, König J, Zimmer J, et al. A GDF5 point mutation strikes twice--causing BDA1 and SYNS2[J]. PLoS Genet, 2013, 9(10):e1003846.
[13]Zhang B, Yang S, Sun Z, et al. Human mesenchymal stem cells induced by growth differentiation factor 5: an improved self-assembly tissue engineering method for cartilage repair[J]. Tissue Eng Part C Methods, 2011, 17(12):1189-1199.
[14]Jahng TA, Fu TS, Cunningham BW, et al. Endoscopic instrumented posterolateral lumbar fusion with Healos and recombinant human growth/differentiation factor-5[J]. Neurosurgery,2004,54(1):171-180.
[15]Raleigh SM, Posthumus M, O'Cuinneagain D, et al. The GDF5 gene and anterior cruciate ligament rupture [J]. Int J Sports Med, 2013, 34(4):36436-36437.
[16]Chen B, Li B, Qi YJ, et al. Association study between growth differentiation factor 5 polymorphism and non-contact anterior cruciate ligament rupture in Chinese Han population[J]. Int J Clin Exp Med, 2015, 8(12):22484-22490.
[17]Lee J, Wikesjö UM. Growth/differentiation factor-5: pre-clinical and clinical evaluations of periodontal regeneration and alveolar augmentation-review [J]. J Clin Periodontol, 2014, 41(8):797-805.
[18]Ozasa Y, Gingery A, Thoreson AR, et al. A comparative study of the effects of growth and differentiation factor 5 on muscle-derived stem cells and bone marrow stromal cells in an in vitro tendon healing model [J]. J Hand Surg Am, 2014, 39(9):1706-1713.
(本文编辑王艳)
Construction identification and activity assay of eukaryotic expression plasmid pcDNA3.1(+)/hGDF5 containing growth/differentiation factor 5 gene
YANG Zhi, ZHANG Ming, LIU Lin, PENG Kan, XU Peng
(DepartmentofJointSurgery,HongHuiHospital,XianJiaotongUniversityCollegeofMedicine,Xian710054,China)
ObjectiveTo construct and identify eukaryotic expression plasmid pcDNA3.1(+)/hGDF5 containing growth/differentiation factor 5 gene. The activity of pcDNA3.1(+)/hGDF5 was detected. Met-hodsAccording to the sequence of GDF5 in Genbank, the primers were designed and synthesized. The product was cloned with pcDNA3.1(+) vector after amplification with polymerase chain reaction (PCR). The eukaryotic expression plasmid pcDNA3.1(+)/hGDF5 was identified by double restrictive edonuclease and PCR. The eukaryotic expression plasmids were transferred into MC615 and 293 cells. The expression of GDP5 mRAN and protein were detected by PCR, Western blotting and immunofluorescence. ResultsThe eukaryotic expression plasmid pcDNA3.1(+)/hGDF5 was successfully constructed and identified by double restrictive edonuclease digestion and PCR. The expression of GDF5 mRAN and protein could be detected in MC615 and 293 cells by PCR, Western blotting and immunofluorescence. ConclusionThe eukaryotic expression plasmid pcDNA3.1(+)/hGDF5 was successfully established, which lays the foundation for the function research of GDP5.
growth/differentiation factor 5; plasmid; activity; identification
陕西省科技计划项目(2013K12-17-03)
杨治(1977-),男,博士研究生,副主任医师,研究方向:关节外科方向。
许鹏,男,主任医师,博士生导师,研究方向:关节外科方向,E-mail:yangzhihonghui@126.com。
R681.3
A
1009-5551(2016)10-1277-05
10.3969/j.issn.1009-5551.2016.10.016
2016-07-01]
