大豆胰蛋白酶抑制剂粗提物对凡纳滨对虾冷藏期间肌肉流变学与热学特性的影响
2016-10-21郑鸯鸯吉薇吉宏武苏伟明刘书成
郑鸯鸯,吉薇,吉宏武,2,3,4,苏伟明,2,3,刘书成,2,3,4
1(广东海洋大学 食品科技学院,广东 湛江,524088)2 (广东省水产品加工与安全重点实验室,广东 湛江,524088) 3 (广东省海洋食品工程技术研究中心,广东 湛江,524088) 4 (水产品深加工广东省普通高校重点实验室,广东 湛江,524088)
大豆胰蛋白酶抑制剂粗提物对凡纳滨对虾冷藏期间肌肉流变学与热学特性的影响
郑鸯鸯1,吉薇1,吉宏武1,2,3,4,苏伟明1,2,3,刘书成1,2,3,4
1(广东海洋大学 食品科技学院,广东 湛江,524088)2 (广东省水产品加工与安全重点实验室,广东 湛江,524088)3 (广东省海洋食品工程技术研究中心,广东 湛江,524088) 4 (水产品深加工广东省普通高校重点实验室,广东 湛江,524088)
为了评价大豆胰蛋白酶抑制剂粗提物对凡纳滨对虾冷藏期间肌肉特性的影响,以注射和未注射大豆胰蛋白酶抑制剂粗提物的凡纳滨对虾分别为实验组和空白组,利用动态流变仪和差示扫描量热仪(differentialscanningcalorimeter,DSC)分别探究该粗提物对凡纳滨对虾在贮藏(0 ℃)期间肌肉特性的影响。动态流变仪测定结果表明,两组凡纳滨对虾肌肉蛋白均能形成热凝胶,凝胶开始形成温度为47 ℃,最终形成凝胶温度为78 ℃左右,且降温有利于热诱导凝胶的进一步加固;贮藏2、4、6天时,注射组的弹性模量G’值总体上大于空白组,凝胶弹性比空白组好。DSC结果显示,贮藏0、2天时两组凡纳滨对虾主要有3个热吸收峰,对应变性温度大约为48、68、79 ℃,随贮藏时间延长在53℃左右出现了1个新的热吸收峰;不过,注射组4个热吸收峰的变性温度总体上大于空白组,且2、4天的变性温度差异显著(P< 0.05),虾肉蛋白的热稳定性得到了提高。因此大豆胰蛋白酶抑制剂粗提物在凡纳滨对虾贮藏前期(< 6天)能提高热凝胶的弹性和蛋白的热稳定性,起到了延缓虾肉软化和蛋白变性的作用。
大豆胰蛋白酶抑制剂粗提物;凡纳滨对虾;动态流变学;弹性模量;差示扫描量热法;变性温度
凡纳滨对虾是我国主要的对虾品种,深受消费者的欢迎,目前主要以鲜销和冷链的方式进行销售。但是运输销售过程中凡纳滨对虾死后极易发生组织软化、肌肉自溶,这大大降低了其市场价格,缩短了贮藏时间。研究发现来源于虾头中肝胰脏的内源蛋白酶—类胰蛋白酶的扩散是贮藏期间肌肉组织软化、品质下降的主要原因[1]。因此如何抑制虾头中类胰蛋白酶的活性从而延缓组织软化、肌肉自溶是凡纳滨对虾保鲜技术亟待解决的重大问题。目前,国内外常用的水产品保鲜技术主要有低温保鲜、化学保鲜、气调保鲜、辐照保鲜和生物保鲜等。在这些保鲜方法中, 以低温保鲜和化学保鲜应用最为广泛。但是低温保鲜会使虾肉蛋白变性给解冻后虾的外观和口感带来不良影响,而化学保鲜的安全性越来越引起人们的担忧,所以生物保鲜技术就这样逐渐进入人们视野。生物保鲜剂在水产品中的保鲜机理可以笼统概括:杀菌作用、抗氧化作用、抑制酶活作用、成膜作用[2]。常用的生物保鲜剂一般来源于动植物、微生物,其中茶多酚、溶菌酶、壳聚糖、乳酸链球菌素与葡萄糖氧化酶等生物保鲜剂在水产品保鲜中应用较广泛[3]。但仍然存在一些问题,如生物保鲜剂成本较高、植物提取率低、提取物中含有多种不明成分、提取过程困难、推广应用性差等。其中,植物源生物保鲜剂因其从植物中天然提取,具有来源广,成本低,安全无毒,应用前景良好等优点[4]。豆科、禾本科和茄科类植物种子富含蛋白酶抑制剂[5]。SRIKET和BENJAKUL等[6]通过抑制活性测定、凝胶电泳研究发现大豆、花生、红豆和赤豆中的胰蛋白酶抑制剂提取物均能抑制罗氏沼虾中的类胰蛋白酶,其中大豆中抑制剂含量最高。这些文献表明大豆提取物富含胰蛋白酶抑制剂,对对虾具有保鲜作用,但是目前国内外关于大豆胰蛋白酶抑制剂粗提物对对虾肌肉特性的影响仍鲜有报道。
凝胶化是虾糜加工中的重要环节,直接关系到虾糜制品的品质,而热特性又直接关系到对虾的热加工处理环节。为此,本文以凡纳滨对虾为原料,采用动态流变仪和差示扫描量热仪(differentialscanningcalorimeter,DSC)探究大豆胰蛋白酶抑制剂物粗提物对凡纳滨对虾肌肉流变学和热学特性的影响,从而为开发凡纳滨对虾生物保鲜技术提供理论基础。
1 材料与方法
1.1材料与试剂
凡纳滨对虾 ( Litopenaeus vannamei),30~35只/kg,购于广东省湛江市霞山区水产批发市场,保活运送至广东省水产品加工与安全重点实验室;大豆(Glycine max)安徽燕之坊食品有限公司;Lowry法试剂盒 上海荔达生物技术有限公司;BAPNASigma公司;DMSOAmresco公司;正己烷、氯化钠,湛江市林达科技有限公司,均为分析纯。
1.2仪器与设备
HAAKEMARSⅢ流变仪,美国ThermoFisherScientific公司;TAQ2000差示扫描量热仪(DSC),美国TA公司;KK22F57TI型冰箱,西门子有限公司;AvantiJ-26XP型冷冻离心机,Beckman公司;T25 型匀浆机,德国IKA公司;HHS21-8-S水浴锅,上海新苗医疗器械制造有限公司。
1.3实验方法
1.3.1大豆胰蛋白酶抑制剂粗提物的提取
根据BENJAKUL和VISESSANGUAN[7]方法并稍作修改制备大豆粗提物。大豆粉碎过筛至20目,倒入5倍的正己烷(w/v),搅拌10min后抽滤,再把抽滤后的滤渣用3倍的正己烷(w/v)进行3次同样操作以去掉残余脂肪。脱脂的大豆粉置于通风厨里风干,直至正己烷完全挥发。用0.15mol/LNaCl溶液混合大豆粉,室温下磁力搅拌3h后以6 500g离心30min去除残渣,上清液在90 ℃热变性处理10min后用冰水冷却,再以 8 000g离心10min,上清液透析后冷冻干燥,置于-20 ℃保存。
1.3.2样品预处理
用蒸馏水将鲜活的凡纳滨对虾清洗后立即冰猝致死。将虾分成空白组和实验组,在实验组对虾头部肝胰脏的中下部位注射5mg/mL的大豆胰蛋白酶抑制剂粗提物300μL,空白组对虾注射等量蒸馏水。置于0 ℃冰箱中贮藏,取样时间依次为0、2、4、6、8、10天。
1.3.3 动态流变学测定
将已到取样时间的凡纳滨对虾去头、壳和肠线,切碎后用匀浆机把虾肉绞碎。用干净的钥匙将样品均匀涂布于测试台。流变仪设定条件参考LIU[8]并做稍微改动:转子型号P35TiL,振荡模式(Osc),频率为0.1Hz,应变为1%,平行板间距为1mm;温度范围10 ~100 ℃,升温速率为2 ℃/min,在100 ℃恒温20min后再以相同速率降温至10 ℃。加样后滴加石蜡油防止水分蒸发。
1.3.4热特性分析
差示扫描量热法采用美国TAQ2000的差示扫描量热仪。将已到取样时间的凡纳滨对虾去头、壳和肠线,切取第二腹节的虾肉放在氧化铝坩埚中进行称量、加盖密封,以空坩埚为参比。测试参数为:温度范围10~100 ℃,升温速率以 5 ℃/min,样品室氮气流量为50mL/min。通过TA软件分析变性温度,每个样品至少测试2次以确保再现性。
1.4数据处理与统计分析
所有数据采用Origin8.0和SPSS22软件进行分析和绘图。组间比较采用t检验,P< 0.05为差异显著。
2 结果与分析
2.1虾肉动态流变学特性
肌原纤维蛋白是肌肉中的主要蛋白,也是形成弹性凝胶的主要成分,而肌球蛋白又是肌原纤维蛋白中形成热诱导凝胶的最主要蛋白质,单独条件下可形成好的凝胶。其的肌原纤维蛋白质如肌动蛋白、调节蛋白和细胞骨骼蛋白不能形成凝胶,但是对肌球蛋白形成凝胶的粘弹性具有重要的影响[9]。LIU、XIONG和FRETHEIM等在研究不同种类牛肉、鸡肉和猪肉的黏弹性时发现,加热过程中G’值随温度上升呈现波浪状,增加、下降、再上升,温度为85 ℃时凝胶强度最强[10]。这3个过程可以划分为凝胶预备区、凝胶弱化区和凝胶加强区,这种现象也同样存在于鱼类等其他蛋白凝胶中,这是肌原纤维蛋白和肌球蛋白热诱导凝胶典型的流变学转变过程。
在温度扫描中,随着温度的上升虾肉蛋白发生了向凝胶态的转变,导致蛋白的流变特性也发生了相应的改变。由图1可以看出,空白组和注射组凡纳滨对虾肌肉蛋白均能形成热凝胶,凝胶开始形成温度为47 ℃,最终形成凝胶温度为78 ℃左右,且降温有利于热诱导凝胶的进一步加固;在整个温度范围内,两组肌肉蛋白的弹性模量G’都随贮藏时间逐渐降低,且升温时流变学曲线出现4个拐点温度(InflectionPoints,IP),依次在47、55、62和78 ℃左右。G’的变化可分成大致3个区域,55 ℃之前G’增加(凝胶预备期),55~62 ℃下降(凝胶弱化区),62~78 ℃再上升(凝胶强化区),G’总的变化趋势符合肌原纤维蛋白典型的流变转变过程。凝胶从47 ℃开始形成,然后G’从47 ℃快速上升直到55 ℃,弹性模量到达第一个峰值,弹性模量快速增加可能是由于肌球蛋白分子头部的重酶解肌球蛋白或其亚基变性,纤丝之间不可逆的相互作用增强,凝胶强度增加[11]。随后G’快速下降直到62 ℃,然后又一直呈上升至78 ℃第2次达到峰值。55~62 ℃范围G’下降,很可能是因为肌球蛋白中的轻酶解肌球蛋白变性,导致纤丝之间形成强度不大的黏性胶,因此流动性增加而弹性减小[12-13]。62~78 ℃范围G’再次上升,表明蛋白变性最后阶段完成,巯基含量急速下降,共价结合的二硫化合物和疏水相互作用形成了不可逆的三维凝胶网状结构[14]。最后在降温过程中G’呈现持续增长的趋势,说明降温有利于热诱导凝胶的进一步加固,主要是因为冷却有利于氢键的形成。鲤鱼、金枪鱼[15]G’值的总体变化趋势也呈现波浪状,李艳青研究发现鲤鱼[16]蛋白在加热到 46 ℃时G’达到一个最大值,接着从 46~54 ℃,G’急剧下降,直到 80 ℃趋于稳定。不同来源的肌球蛋白其变性时的转变温度不同,从猪肉、鸡肉、牛肉和火鸡中提取的肌球蛋白,其转变温度一般在45~55 ℃,鱼类略低[17]。虽然不同原料肉的G’突变点所对应的温度存在差异,但是G’总的变化趋势仍符合肌原纤维蛋白的典型流变学特性。

a-空白组;b-注射组图1 贮藏过程中两组凡纳滨对虾的流变学特性变化Fig.1 Changes of rheological properties of Litopeneaus vannamei during storage

a-2天;b-4天;c-6天;d-8天;e-10天图2 贮藏过程中两组凡纳滨对虾的G’值变化Fig.2 Changes of G’ value of two groups of Litopeneaus vannamei during storage
由图2可知,对比相同贮藏时间下2个处理组虾肉蛋白G’值的总体趋势可以发现,贮藏2、4、6天时注射组G’值总体上大于空白组,说明注射组虾肉最终形成的凝胶弹性比空白组好,从而揭示了大豆胰蛋白酶抑制剂粗提物发挥了效用,在一定程度了抑制了虾头中的类胰蛋白酶、延缓了虾肉的软化。但是在贮藏2天时,注射组在78 ℃左右最终形成凝胶和降温过程中G’值却开始低于空白组,可能是因为贮藏时间短导致大豆胰蛋白酶抑制剂粗提物发挥作用慢,也可能是其他因素造成,这仍需要进一步的研究。贮藏8、10天时,两组G’值的总体趋势相似,注射组G’值低于空白组。这是因为贮藏后期微生物作用加强,占据主导作用,李蕾蕾等[18]在研究南美白对虾菌相变化时也发现冰温贮藏(-0.8 ℃)2、4、6天时菌落总数保持稳定,而6天以后菌落总数迅速上升。
2.2虾肉热学特性
图3揭示了肌肉热转变的3个主要转变区,A、B和C区。第1个热转变A在40~60 ℃有最大热吸收峰,已经证实是肌球蛋白引起;第2个热转变B发生在60~70 ℃,由胶原蛋白和肌浆蛋白引起;第3个热转变是肌动蛋白的热吸收,在80 ℃之间[19-22]。SIMS和BAILEY也研究指出肌球蛋白的整个变性过程在40~60 ℃之间,它是肌肉中3种主要结构蛋白中最不稳定的蛋白[23]。

A-肌球蛋白亚基;B-肌浆蛋白和胶原蛋白;C-肌动蛋白图3 一个典型的肌肉热曲线图[24]Fig.3 A typical thermal curve of muscle is composed of three major zones
从图4的DSC图可以看出,未经处理的空白组凡纳滨对虾主要有3个热吸收峰,这与图3揭示的肌肉热转变的3个主要转变区是相符的。表1列举了两组对虾的热变性温度,贮藏0、2天时,两组凡纳滨对虾虾肉均有3个热吸收峰,对应变性温度在48、68、79 ℃左右,依次对应图4-a中的峰1、峰2和峰3,而随着贮藏时间延长,从第4天开始在53 ℃左右增加了1个新的热吸收峰(峰4),见图4-b,这主要是肌球蛋白的逐渐降解引起的。这是因为肌球蛋白含有多个亚基,其球形头部和螺旋尾部的分子结构十分不同,所以肌球蛋白显示一个或多个热转变过程。而且肌球蛋白亚基会随环境变化而变化,其中pH和离子强度对其亚基构象的稳定性具有重要作用[25]。根据图3最后可以推测出表1中的峰1、峰4是肌球蛋白的热吸收峰,峰2是胶原蛋白和肌浆蛋白的热吸收峰,峰3是肌动蛋白的热吸收峰。
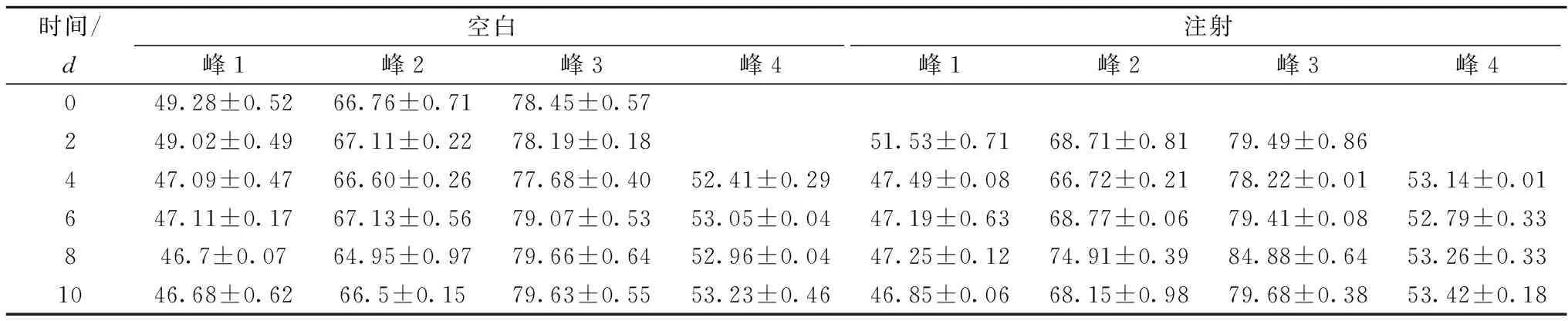
表1 两组凡纳滨对虾虾肉蛋白的热变性温度 单位:℃
由表1可以看出,在相同贮藏时间下,注射组凡纳滨对虾的4个热吸收峰的变性温度总体上大于空白组的变性温度。由此可以说明注射组的凡纳滨对虾的蛋白稳定性总体上比空白组要高,注射大豆胰蛋白酶抑制剂粗提物有助于提升虾肉蛋白的稳定性。另外,对同一贮藏时间下两个处理组对虾的变性温度依次进行配对样本T检验,置信区间的百分比设为95%。配对检验结果表明,贮藏2、4、6、8、10天的差异显著性水平分别为0.038、0.04、0.358、0.178、0.881,其中贮藏2、4天时差异显著(P<0.05),说明在贮藏前期(2、4天)注射大豆胰蛋白酶抑制剂粗提物对凡纳滨对虾的热特性有显著影响,能提高虾肉蛋白的热稳定性。而在贮藏后期由于其他因素如微生物等的影响,该粗提物不再发挥显著性作用。
3 结论
大豆胰蛋白酶抑制剂粗提物能够影响凡纳滨对虾冷藏前期(< 6天)的流变学和热学特性。该粗物能不仅能提高虾肉的弹性模量G’值,增加肌肉弹性,而且能提高虾肉的热变性温度,提升肌肉的热稳定性。因此,大豆胰蛋白酶抑制剂粗提物可以抑制凡纳滨对虾冷藏期间肌肉的软化,从而延长其货架期,在凡纳滨对虾保鲜方面具有应用前景。
[1]SRIKETC,BENJAKULS,VISESSANGUANW,etal.Collagenolyticserineproteaseinfreshwaterprawn(Macrobrachium rosenbergii):Characteristicsanditsimpactonmuscleduringicedstorage[J].FoodChemistry, 2010, 124(1):29-35.
[2]苏辉,谢晶. 生物保鲜剂在水产品保鲜中的应用研究进展 [J]. 食品与机械, 2013, 29(5):265-268.
[3]蓝蔚青,谢晶. 生物保鲜剂对水产品保鲜效果影响的研究进展 [J]. 山西 农业科学,2009, 37(6):75-78.
[4]赵海鹏,谢晶. 生物保鲜剂在水产品保鲜中的应用 [J]. 吉林农业科学, 2009, 34(4):60-64.
[5]CONNORSBJ,LAUNNP,MAYNARDCA,etal.MolecularcharacterizationofageneencodingacystatinexpressedinthestemsofAmericanchestnut(Castanea dentata) [J].Planta, 2002, 215(3):510-514.
[6]SRIKETC,BENJAKULS,VISESSANGUANW,etal.Effectoflegumeseedextractsontheinhibitionofproteolyticactivityandmuscledegradationoffreshwaterprawn(Macrobrachium rosenbergii) [J].FoodChem, 2011, 129(3):1 093-1 099.
[7]BENJAKULSV,W.IsolationandcharacterizationoftrypsininhibitorsfromsomeThailegumeseeds[J].JoumalofFoodBiochemistry, 2000, 24(2):107-127.
[8]LIUQ,BAOH,XIC,etal.Rheologicalcharacterizationoftunamyofibrillarproteininlinearandnonlinearviscoelasticregions[J].JournalofFoodEngineering, 2014, 121:58-63.
[9]RIEBROYS,BENJAKULS,VISESSANGUANW,etal.Acid-inducedgelationofnaturalactomyosinfromAtlanticcod(Gadus morhua)andburbot(Lota lota) [J].FoodHydrocolloids, 2009, 23(1):26-39.
[10]WESTPHALENAD,BRIGGSJL,LONERGANSM.Influenceofmuscletypeonrheologicalpropertiesofporcinemyofibrillarproteinduringheat-inducedgelation[J].MeatScience, 2006, 72(4):697-703.
[11]EGELANDSDALB.Heat-inducedgellinginsolutionsofovalbumin[J].JournalofFoodScience, 1980, 45(3):570-574.
[12]CHOIYM,KIMBC.Musclefibercharacteristics,myofibrillarproteinisoforms,andmeatquality[J].LivestockScience, 2009, 122(2/3):105-118.
[13]BRENNERT,JOHANNSSONR,NICOLAIT.Characterisationandthermo-reversiblegelationofcodmuscleproteinisolates[J].FoodChemistry, 2009, 115(1):26-31.
[14]LI-CHANE,NAKAIS,WOODDF.Muscleproteinstructurefunctionrelationshipsanddiscriminationoffunctionalitybymultivariate[J].JournalofFoodScience, 1987, 52(1):31-41.
[15]刘琴. 金枪鱼肌原纤维蛋白冻藏过程中生化及流变特性研究 [D].上海:上海海洋大学,2013.
[16]李艳青.蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D].哈尔滨:东北农业大学,2013.
[17]姜国庆,刘英丽. 肌原纤维蛋白热诱导凝胶特性研究进展 [J]. 肉类研究, 2013, 27(12):19-22.
[18]李蕾蕾,王素英. 南美白对虾在低温贮藏过程中的品质及菌相变化分析 [J]. 食品科学, 2014, 35(18):246-250.
[19]BERTOLANC,BEVILACQUAAE,ZARITZKYNE.Heattreatmenteffectontexturechangesandthermaldenaturationofproteinsinbeefmuscle[J].JournalofFoodProcessingandPreservation, 1994, 18(1):31-46.
[20]MARTENSESH.Thermaldenaturationofproteinsinpostrigormuscletissueasstudiedbydifferentialscanningcalorimetry[J].JournaloftheScienceofFoodandAgriculture, 1980, 31(10):1 034-1 042.
[21]FRYSTEINESKFT.Myosindenaturationinpalesoftandexudative(PSE)porcinemuscletissueasstudiedbydifferentialscanningcalorimetry[J].JournaloftheScienceofFoodandAgriculture, 1984, 35(2):240-244.
[22]WRIGHTD.Differentialscanningcalorimetry-Itsapplicationtothestudyofmeatproteins[J].JournaloftheScienceofFoodandAgriculture, 1978, 29(12):42-45.
[23]孙京新,刘功明. 差示扫描量热法测定鸡肉、鱼肉食品加热终点温度 [J]. 食品科技, 2015, 40(1):157.
[24]WRIGHTD.Differentialscanningcalorimetrycandeterminekineticsofthermaldenaturationofbeefmuscleproteins[J].JournaloftheScienceofFoodandAgriculture, 1978, 29(12):1088.
[25]WILDINGDJWP.Differentialscanningcalorimetricstudyofmuscleanditsproteins:Myosinanditssubfragments[J].JournaloftheScienceofFoodandAgriculture, 1984, 35(3):357-372.
EffectofcrudeextractsoftrypsininhibitorfromsoybeanontherheologicalandthermalpropertiesofLitopeneaus vannameimuscleduringcoldstorage
ZHENGYang-yang1,JIWei1,JIHong-wu1,2,3,4*,SUWei-ming1,2,3,LIUShu-cheng1,2,3,4
1 (CollegeofFoodScienceandTechnology,GuangdongOceanUniversity,Zhanjiang524088,China)2(GuangdongProvincialKeyLaboratoryofAquaticProductsProcessingandSafety,Zhanjiang524088,China)3 (GuangdongEngineeringResearchCenterofSeafood,Zhanjiang524088,China)4(KeyLaboratoryofAdvancedProcessingofAquaticProductsofGuangdongHigherEducationInstitution,Zhanjiang524088,China)
InordertoevaluatetheeffectofcrudeextractsoftrypsininhibitorfromsoybeanonthemusclepropertiesofLitopeneaus vannameiduringstorage(0 ℃) ,thedynamicrheometeranddifferentialscanningcalorimeterwereusedtoinvestigatethedifferencebetweentheexperimentalgroupinjectedwithcrudeextractsandtheblank.Dynamicrheologyresearchshowedthattwogroupsofshrimpcouldbeabletoformthermalgel.Theformationofthegelbeganatabout47 ℃andbetternetworkoccurredathightemperature(about78 ℃).Thegelwasfurtherreinforcedthroughcooling.Elasticmodulus(G’)ofinjectinggroupwashigherthanthatoftheblankonDay2, 4, 6duringstorage.Thegelelasticityofinjectinggroupwasbetter.DSCresultsrevealedthatonday0andday2ofstorage,twogroupsofshrimphad3endothermicpeaksandthedenaturationtemperaturewereabout48 ℃, 68 ℃,79 ℃,respectively.Anewendothermicpeakatabout53 ℃appearedwiththetimeextension.However,thedenaturationtemperatureof4endothermicpeaksofinjectinggroupwashigherthanthatoftheblankgroupasawhole.ThecrudeextractsoftrypsininhibitorhadremarkableeffectonthedenaturationtemperatureonDay2andDay4ofstorage(P<0.05).Therefore,thecrudeextractsoftrypsininhibitorfromsoybeancouldimprovetheelasticityofthethermalgelandproteinstabilityduringtheearlystageofthestorage(< 6days),thusresultindelayofsofteninganddegenerationofLitopeneaus vannamei.
crudeextractoftrypsininhibitorfromsoybean; Litopeneaus vannamei;dynamicrheology;elasticmodulus;differentialscanningcalorimeter;denaturationtemperature
10.13995/j.cnki.11-1802/ts.201608038
硕士研究生(吉宏武教授为通讯作者,E-mail:jihw62318@163.com)。
中国现代农业产业技术体系(CARS-47);广东省产学研合作项目(2013B090600155);广东海洋大学创新强校项目(GDOU2014050203,GDOU2013050314)
2015-11-05,改回日期:2015-12-16
