细胞自噬与人卵巢癌细胞对顺铂耐药的关系
2016-10-21朱星枚成碧萍西安医学院第一附属医院中心实验室陕西西安70077陕西中医药大学中药化学教研室陕西西咸新区7046第四军医大学生物化学与分子生物学教研室陕西西安700
朱星枚 吴 琳 张 媛 姚 杨 成碧萍 张 丹.西安医学院第一附属医院中心实验室,陕西西安70077;.陕西中医药大学中药化学教研室,陕西西咸新区7046;.第四军医大学生物化学与分子生物学教研室,陕西西安700
细胞自噬与人卵巢癌细胞对顺铂耐药的关系
朱星枚1,2吴琳3张媛3姚杨1成碧萍1张丹2
1.西安医学院第一附属医院中心实验室,陕西西安710077;2.陕西中医药大学中药化学教研室,陕西西咸新区712046;3.第四军医大学生物化学与分子生物学教研室,陕西西安710032
目的探讨细胞自噬与人卵巢癌细胞对顺铂耐药的关系。方法以不同浓度的顺铂(0、1、2、4、8、16 μg/mL)分别作用人卵巢癌细胞A2780及其顺铂耐药株A2780/DDP 48 h,采用MTT法检测卵巢癌细胞的增殖率,透射电镜检测顺铂诱导细胞自噬体的形成,Western blot法测定自噬和凋亡相关蛋白。结果与A2780对照比较,A2780/DDP增殖率明显升高(P<0.01);顺铂可以诱导A2780及A2780/DDP中自噬体的形成,且A2780和A2780/DDP中LC3-Ⅱ水平均升高,这种作用可以被自噬抑制剂3-甲基腺嘌呤(3-MA)阻断;顺铂可以诱导A2780中凋亡相关蛋白Cleaved-PARP水平升高,但作用A2780/DDP时影响不大,当3-MA与顺铂同时作用人卵巢癌细胞时,A2780/DDP中的Cleaved-PARP表达水平显著升高(P<0.01)。结论卵巢癌细胞的耐药可能与顺铂诱导卵巢癌细胞自噬有关,自噬抑制剂3-MA可以抑制顺铂诱导的细胞自噬,同时促进顺铂诱导人卵巢癌细胞凋亡,且增加顺铂耐药株对顺铂的敏感性。
顺铂;耐药;卵巢癌;增殖;细胞自噬;凋亡
[Abstract]Objective To study the relationship between cell autophagy and Cisplatin resistance in the ovarian cancer cells.Methods Cell proliferation was determined by an MTT assay after A2780 and A2780/DDP cells were treated by Cisplatin at different concentrations(0,1,2,4,8,16 μg/mL)for 48 h,the formation of autophagosomes were detected by transmission electron microscopy,both autophagy and apoptosis related protein expression were determined by Western blot.Results Compared with the control of A2780,A2780/DDP proliferation rate was significantly increased(P<0.01);Autophagy,characterized by an increase in the number of autophagosomes and LC3-II protein level,was observed in Cisplatin-treated A2780 and Cisplatin-treated A2780/DDP cells,which could be blocked by autophagy inhibitor 3-methyl adenine(3-MA);Cleaved-PARP protein level was increased in Cisplatin-treated A2780 cells while almost no effect in Cisplatin-treated A2780/DDP cells,however,Cleaved-PARP protein level was significantly increased in Cisplatin and 3-MA-treated A2780/DDP cells(P<0.01).Conclusion Resistance of ovarian cancer cells may be associated with autophagy induced by Cisplatin,autophagy inhibitor 3-MA can inhibite autophagy,but promote apoptosis induced by Cisplatin in ovarian cancer cells,and increase the Cisplatin sensitivity to Cisplatin resistant strains.
[Key words]Cisplatin;Resistance;Ovarian Cancer;Proliferation;Autophagy;Apoptosis
卵巢癌是一种常见的妇科恶性肿瘤,严重威胁着妇女生命[1]。临床上常用顺铂治疗卵巢癌,反应率可达70%~80%[2-3]。然而,大多数开始对顺铂敏感的卵巢癌患者服药不久后便出现了复发、耐药[4],严重限制了顺铂的应用。研究表明[5-6],自噬与癌症的发生、发展密切相关,调节自噬可以克服包括顺铂耐药的肿瘤的化疗耐药。最近研究表明[7],顺铂激活细胞自噬通路,这种作用可以抵消顺铂诱导的肿瘤细胞死亡。自噬激活导致肺癌对顺铂耐药已经得到证实[8-9],然而自噬在肿瘤治疗中的准确作用与组织类型和化疗药物类型有关[10-11],自噬与顺铂治疗卵巢癌及其对顺铂耐药的关系尚不明确,因此有必要针对卵巢癌寻找特殊的自噬调控方法。本实验拟考察顺铂对人卵巢癌细胞A2780及其顺铂耐药株A2780/DDP的自噬和凋亡作用,并借助自噬抑制剂研究细胞自噬与卵巢癌细胞对顺铂耐药的关系,为自噬作为克服顺铂耐药性的新靶点添加新的依据。
1 材料与方法
1.1试剂与仪器
实验所用人卵巢癌细胞顺铂敏感株A2780及顺铂耐药株A2780/DDP购于中科院上海细胞库。顺铂(10 mg,齐鲁制药厂);噻唑蓝(MTT)、二甲基亚砜(DMSO)、巴弗洛霉素A1(Baf A1)、3-甲基腺嘌呤(3-MA)均购自Sigma公司;RPMI1640培养基购自Gibco公司;胎牛血清购自北京四季青生物科技有限责任公司。单克隆抗体(PARP、LC3)购自美国Cell Signaling公司;单克隆抗体β-actin、羊抗兔IgG-HRP标记二抗购自武汉博士德生物工程有限公司。CO2培养箱(3110水套系列,美国,Thermo Scientific公司),多功能酶标仪(Infinite®F500,瑞士,Tecan公司),垂直电泳系统(Powerpac通用,美国,Bio-Rad公司),电转膜系统(170-4070,美国,Bio-Rad公司),透射电子显微镜(JEM-1230,日本,日本电子株式会社),Odyssey红外成像系统(Odyssey®CLx,美国,LICOR公司)。
1.2方法
1.2.1细胞培养与分组人卵巢癌A2780细胞株和A2780/DDP细胞株均用含10%胎牛血清的RPMI1640培养基在37℃、5%CO2恒温细胞培养箱中培养。为维持A2780/DDP细胞株的耐药性,细胞传代时采用含顺铂的培养基[顺铂浓度1 μg/mL)培养。光学显微镜下观察细胞生长状况,每2~3天换液1次,待细胞贴壁70%~80%时,进行传代。设空白对照组(0 μg/mL)和药物组[顺铂(5 μg/mL),3-MA(1 mmol/L),3-MA(1 mmol/L)&顺铂(5 μg/mL),Baf A1(2 nmol/L),Baf A1(2 nmol/L)&顺铂(5 μg/mL)]。
1.2.2 MTT法检测顺铂作用下卵巢癌细胞的增殖率取对数生长期细胞A2780和A2780/DDP分别接种于96孔板中(8×103/孔),次日待贴壁后加入不同浓度的顺铂培养液(0、1、2、4、8、16 μg/mL)。作用48 h后,弃去上清液,每孔加入20 μL MTT(5 mg/mL),37℃、5%CO2恒温细胞培养箱中继续培养4 h后弃上清液。每孔加入150 μL DMSO,振摇10 min后将96孔板置于Infinite®F500多功能酶标仪中于490 nm处测定各孔光密度值,并根据公式计算顺铂作用下的细胞相对增殖率:细胞相对增殖率=(OD加药组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.3透射电镜检测顺铂诱导的细胞自噬JEM-1230透射电镜观测自噬小体形成是细胞发生自噬的金标准。取对数生长期的细胞A2780和A2780/DDP,常规消化离心,传代(细胞密度为1×107/瓶)。细胞贴壁后,弃去培养液,然后换为含5 μg/mL顺铂的培养液,于37℃、5%CO2孵箱中培养,培养24 h后,常规消化,1500 r/min离心15 min,收集细胞沉淀,弃上清,加入2%戊二醛固定,0~4℃下固定过夜。送样检测。
1.2.4 Western blot法检测顺铂诱导的自噬蛋白与凋亡蛋白的表达收集各组细胞,离心弃去上清液,加入含蛋白酶抑制剂的细胞裂解液100 μL,冰上裂解后于4℃,12 000 r/min离心20 min。配制不同浓度的BSA标准液绘制蛋白标准曲线,并对蛋白样品进行定量。采用12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白分离,通过湿法转膜将蛋白转移至NC膜上,5%去脂奶粉室温封闭1 h,加入TBST润洗3次,加入一抗(LC3,PARP)4℃过夜后,TBST润洗3次后加入二抗(1︰20 000),室温下振摇孵育1 h,TBST润洗3次后,Odyssey®CLx扫膜仪扫膜。以β-actin为内参,计算各蛋白的相对含量。
1.3统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1顺铂对人卵巢癌细胞A2780及其耐药株A2780/ DDP增殖的作用
顺铂抑制人卵巢癌细胞A2780及其耐药株A2780/DDP增殖,且这种抑制作用具有浓度依赖性。根据GraphPadPrism5软件计算不同浓度顺铂(0~16μg/mL)作用人卵巢癌细胞(A2780和A2780/DDP)48 h的半数抑制浓度(IC50)。顺铂敏感细胞株A2780的IC50A2780=2.52 μg/mL,顺铂耐药细胞株A2780/DDP的IC50A2780/DDP=13.61 μg/mL,故顺铂耐药细胞相对敏感细胞的耐药系数RI=IC50A2780/DDP/IC50A2780=5.4,提示A2780/ DDP较A2780对顺铂不敏感。见图1。

图1 不同浓度顺铂对A2780和A2780/DDP细胞增殖的影响
2.2顺铂诱导人卵巢癌细胞A2780及其耐药株A2780/DDP自噬
5 μg/mL顺铂作用人卵巢癌细胞A2780及其耐药株A2780/DDP 24 h后,通过透射电镜观察分析,人卵巢癌细胞A2780及其耐药株A2780/DDP中均出现自噬小体,但是在耐药株A2780/DDP中的自噬小体数目明显多于敏感株A2780,且在空白对照中发现,顺铂耐药株A2780/DDP中的自噬小体数目远多于A2780空白对照中的自噬小体数目(图2A)。Western blot实验结果显示,顺铂作用细胞后,敏感株A2780和耐药株A2780/DDP中LC3-Ⅱ水平均升高,且相对敏感株A2780,耐药株A2780/DDP中LC3-Ⅱ呈现高表达(图2B)。进一步提示卵巢癌细胞的耐药可能与细胞自噬有关。

图2 顺铂诱导细胞自噬
2.3自噬抑制剂对顺铂诱导自噬蛋白LC3-Ⅱ表达的影响
为明确顺铂对耐药株A2780/DDP中自噬的诱导作用,应用溶酶体抑制剂Baf A1,阻断自噬体和溶酶体的结合,通过Western blot法检测LC3-Ⅱ的水平,分析A2780/DDP中的自噬流。Western blot结果显示,Baf A1处理A2780/DDP后,经顺铂处理的较未经顺铂处理的A2780/DDP中LC3-Ⅱ表达明显增加(P<0.01)(图3A),提示顺铂可以诱导A2780/DDP中自噬体的形成。为进一步验证顺铂诱导的自噬是否可以被自噬抑制剂3-MA阻断,实验尝试顺铂(5 μg/mL)作用人卵巢癌顺铂敏感细胞A2780 24 h,比较同时加入3-MA(1 mmol/L)或不加3-MA,细胞中LC3-Ⅱ水平的变化。Western blot结果显示,顺铂与3-MA同时作用卵巢癌细胞株后,细胞中LC3-Ⅱ水平大大降低(P<0.01)(图3B),提示3-MA可以抑制顺铂诱导的卵巢癌细胞中的自噬。

图3 Western blot检测自噬抑制剂对顺铂诱导自噬蛋白LC3-Ⅱ表达的影响
2.4自噬抑制剂对顺铂诱导A2780和A2780/DDP中凋亡蛋白Cleaved-PARP表达的影响及3-MA和顺铂对A2780/DDP增殖的影响
顺铂诱导人卵巢癌细胞敏感株A2780凋亡,3-MA同时作用时,其对耐药株A2780/DDP的凋亡诱导能力明显增加,同时使A2780/DDP对顺铂敏感性增加。Western blot检测结果显示,顺铂可以诱导人卵巢癌顺铂敏感株A2780中Cleaved-PARP水平升高,但对其耐药株A2780/DDP作用时影响不大(图4A)。然而,当3-MA与顺铂同时作用人卵巢癌细胞时(图4B),耐药株A2780/DDP中的Cleaved-PARP表达水平显著升高(P<0.01),同时耐药株细胞增殖力受到顺铂明显抑制(图5)。提示自噬抑制剂3-MA可以促进顺铂诱导人卵巢癌细胞凋亡,且增加顺铂耐药株对顺铂的敏感性。
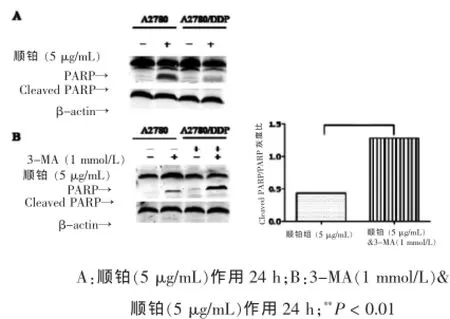
图4 Western blot检测自噬抑制剂对顺铂诱导A2780和A2780/DDP中凋亡蛋白Cleaved-PARP表达的影响

图53 -MA和顺铂对A2780/DDP增殖的影响
3 讨论
顺铂及其铂类抗肿瘤药物是治疗卵巢癌的一线化疗药物,但是大多数卵巢癌患者最终都会出现顺铂耐药而导致肿瘤复发,因此解决顺铂的耐药问题是临床治疗卵巢癌的关键点。最近几十年的研究中,自噬在卵巢癌中的作用引起越来越多的关注[12-13]。自噬不仅在肿瘤的发生、发展中起着关键作用,在肿瘤的药物治疗中也发挥着关键作用[14-15]。Liu等[16]研究表明自噬激活剂(雷帕霉素联合三氧化二砷)可以抑制卵巢癌细胞增殖;有研究发现,抑制自噬可以增加卵巢癌细胞的敏感性[17-18]。
本研究结果显示,顺铂作用卵巢癌细胞后,顺铂敏感株及耐药株中自噬体增加,自噬相关蛋白LC3-Ⅱ水平升高,为进一步证实LC3-Ⅱ升高的同时伴随顺铂诱导人卵巢癌细胞A2780,A2780/DDP发生自噬的过程,实验分别使用溶酶体抑制剂Baf A1和自噬抑制剂3-MA抑制顺铂耐药株A2780/DDP中自噬体和溶酶体融合形成自噬溶酶体或抑制自噬体的形成。结果显示Baf A1与顺铂同时作用时,卵巢癌细胞株中自噬体的堆积程度加大,即顺铂可以诱导卵巢癌细胞A2780及其耐药株A2780/DDP发生自噬,同时这种作用可以被3-MA阻断。
大量文献表明自噬可以促进肿瘤生长[19-20],本实验中发现,A2780/DDP中自噬体明显增多,自噬相关蛋白LC3-Ⅱ表达水平较顺铂敏感株A2780显著升高。但是顺铂对其诱导凋亡能力较弱,表现为顺铂单独作用A2780/DDP时,凋亡蛋白PARP几乎不裂解,PARP是细胞凋亡核心成员半胱天冬酶(caspase)的切割底物,在细胞凋亡中发挥着重要作用。当自噬抑制剂3-MA阻断顺铂诱导自噬后,顺铂诱导A2780/ DDP凋亡的能力显著提高,且A2780/DDP对顺铂的敏感性增加。因此,顺铂作用A2780/DDP时,自噬与凋亡是两种相互拮抗的通路,同时调节着卵巢癌细胞对顺铂的敏感性。其中自噬是促进卵巢癌细胞耐药的因素,而且可以削弱顺铂对卵巢癌耐药细胞的杀伤力。
卵巢癌的顺铂耐药性是临床亟待解决的问题,体外实验结果表明抑制细胞自噬可以增加卵巢癌顺铂耐药株A2780/DDP对顺铂的敏感性。因此,以细胞自噬作为治疗卵巢癌复发与耐药的靶点可以为克服卵巢癌顺铂耐药带来新的希望。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J]. CA:a Cancer Journal for Clinicians,2015,65(1):5-29.
[2]Kim A,Ueda Y,Naka T,et al.Therapeutic strategies in epithelial ovarian cancer[J].Journal of Experimental& Clinical Cancer Research,2012,31(1):1.
[3]Tummala M,McGuire W.Recurrent ovarian cancer[J]. Clinical Advances in Hematology&Oncology:H&O,2005,3(9):723-736.
[4]AgarwalR,KayeSB.Ovariancancer:strategiesforovercoming resistancetochemotherapy[J].NatureReviews Cancer,2003,3(7):502-516.
[5]Duffy A,Le J,ausville E,et al.Autophagy modulation:a targetforcancertreatmentdevelopment[J].Cancer Chemotherapy and Pharmacology,2015,75(3):439-447.
[6]Maycotte P,Thorburn A.Autophagy and cancer therapy[J]. Cancer Biology&Therapy,2011,11(2):127-137.
[7]O'Donovan TR,O'Sullivan GC,McKenna SL.Induction of autophagy by drug-resistant esophageal cancer cellspromotes their survival and recovery following treatment with chemotherapeutics[J].Autophagy,2011,7(5):509-524.
[8]Ren JH,He WS,Nong L,et al.Acquired Cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy[J].Cancer Biotherapy and Radiopharmaceuticals,2010,25(1):75-80.
[9]Sirichanchuen B,Pengsuparp T,Chanvorachote P.Long-term Cisplatin exposure impairs autophagy and causes Cisplatin resistance in human lung cancer cells[J].Molecular and Cellular Biochemistry,2012,364(1-2):11-18.
[10]Le XF,Mao W,Lu Z,et al.Dasatinib induces autophagic cell death in human ovarian cancer[J].Cancer,2010,116(21):4980-4990.
[11]Bast R.Molecular approaches to personalizing management ofovariancancer[J].AnnalsofOncology,2011,22(Suppl8):viii5-viii15.
[12]宋丽萍,李翠兰,王子介,等.自噬与卵巢癌研究进展[J].中华临床医师杂志,2015,9(3):464-467.
[13]沈晓燕,王建六.卵巢癌中的自噬[J].中国妇产科临床杂志,2015,16(5):466-468.
[14]Mathew R,Kongara S,Beaudoin B,et al.Autophagy suppr esses tumor progression by limiting chromosomal instab ility[J].Genes&Development,2007,21(11):1367-1381.
[15]Jin S,White E.Role of autophagy in cancer:management of metabolic stress[J].Autophagy,2007,3(1):28-31.
[16]Liu N,Tai S,Ding B,et al.Arsenic trioxide synergizes with everolimus(Rad001)to induce cytotoxicity of ovarian cancer cells through increased autophagy and apoptosis[J].Endocrine-related Cancer,2012,19(5):711-723.
[17]Zhang N,Qi Y,Wadham C,et al.FTY720 induces necrotic cell death and autophagy in ovarian cancer cells:a protectiveroleofautophagy[J].Autophagy,2010,6(8):1157-1167.
[18]Wang J,Wu GS.Role of autophagy in Cisplatin resistance in ovarian cancer cells[J].Journal of Biological Chemistry,2014,289(24):17163-17173.
[19]Scarlatti F,Maffei R,Beau I,et al.Role of non-canonical Beclin 1-independent autophagy in cell death induced by resveratrol in human breast cancer cells[J].Cell Death& Differentiation,2008,15(8):1318-1329.
[20]Denton D,Nicolson S,Kumar S.Cell death by autophagy:factsandapparentartefacts[J].CellDeath&Differentiation,2012,19(1):87-95.
Cell autophagy promotes ovarian cancer cells resistance to Cisplatin
ZHU Xingmei1,2WU Lin3ZHANG Yuan3YAO Yang1CHENG Biping1ZHANG Dan2
1.Department of the Key Laboratory,the First Affiliated Hospital,Xi'an Medical College,Shaanxi Province,Xi'an 710077,China;2.Department of Chinese Medicine Chemistry,Shaanxi University of Chinese Medicine,Shaanxi Province,Xixian New Area712046,China;3.Department of Biochemistry and Molecular Biology,the Fourth Military Medical University,Shaanxi Province,Xi'an710032,China
R965
A
1674-4721(2016)09(a)-0012-05
2016-06-03本文编辑:任念)
陕西省教育厅专项科研计划项目(14JK1633);陕西省自然科学基础研究计划项目(2013JC2-21);陕西中医药大学校级基金项目(2015QN18)。
朱星枚(1981.6-),女,博士;研究方向:肿瘤药理学。
