嫁接对葫芦砧木及西瓜接穗甲基化水平的影响
2016-10-17邢乃林张蕾琛应泉盛黄芸萍王毓洪
邢乃林,张蕾琛,应泉盛,黄芸萍,王毓洪
(浙江省宁波市农业科学院,浙江 宁波 315040)
嫁接对葫芦砧木及西瓜接穗甲基化水平的影响
邢乃林,张蕾琛,应泉盛,黄芸萍,王毓洪*
(浙江省宁波市农业科学院,浙江 宁波 315040)
以葫芦砧木甬砧1号及西瓜接穗早佳8424为材料,利用甲基化敏感扩增多态性(MSAP)技术对嫁接及非嫁接的苗期及开花期叶片的甲基化水平进行了研究。结果表明:西瓜和葫芦幼苗期叶片的甲基化水平分别为12.7%和11.0%,它们在开花期的甲基化水平分别较幼苗期提高了1.5和0.5个百分点;嫁接总体上提高了幼苗期和开花期的全甲基化水平,但明显降低了半甲基化水平;嫁接对西瓜接穗甲基化水平的影响大于对砧木的影响;嫁接对开花期DNA甲基化状态改变的影响最大,嫁接导致的甲基化状态改变方式主要为未甲基化与全甲基化状态之间的改变。
嫁接;甲基化;砧木;接穗;西瓜; MSAP
0 引言
DNA甲基化在高等动植物中普遍存在,是表观遗传修饰的重要类型之一,且不同物种不同发育时期不同器官的甲基化水平不同[1]。甲基化与表观遗传中的转座子的转移失活、miRNA表达、基因印记等存在密切关系,同时还与生物及非生物胁迫抗性等有关[2-3]。植物中的DNA甲基化主要为5′-CG-3′中的胞嘧啶在甲基转移酶催化下发生甲基化。甲基化检测方法有亚硫酸氢盐法、甲基化检测芯片技术、DNA甲基化敏感扩增多态性(MSAP)分析和甲基化测序等技术,其中MSAP法因操作简单、重复性好、费用低等优点被广泛应用,是植物DNA甲基化水平检测的重要技术[4-5]。
葫芦科瓜菜作物包括葫芦、西瓜等蔬菜和瓜果,具有十分重要的经济价值。而嫁接是解除西瓜等作物连作障碍的一种有效手段。大量研究表明,葫芦砧木不仅可以影响西瓜接穗的产量和品质性状,还可以显著增强西瓜接穗的生物及非生物胁迫抗性[6-7]。近年来的多项研究表明,嫁接过程可以引起葫芦科、茄科及模式植物拟南芥等物种中miRNA及24碱基sRNA等分子在接穗及砧木之间交流与传递[8-9]。这些物质可导致生物体表观遗传模式及基因表达水平发生改变,进而产生产量、品质及抗性的改变[10-11]。其中DNA胞嘧啶甲基化是一种重要的表观遗传修饰模式,广泛存在于动植物基因组中,在调节基因表达等方面具有重要作用。
目前国内外尚无针对嫁接引起西瓜接穗及葫芦砧木DNA甲基化水平变异的研究。因此笔者通过MSAP方法检测了嫁接对葫芦砧木及西瓜接穗DNA甲基化水平的影响,以期为从DNA水平上研究嫁接机理及嫁接对西瓜品质等性状的影响奠定一定的理论基础。
1 材料与方法
1.1实验材料
以葫芦类型砧木甬砧1号(由宁波市农业科学研究院提供)为砧木,以浙江广泛种植的西瓜品种早佳8424(商品种)为接穗进行嫁接。嫁接方法采用插接法,育苗及管理采用常规嫁接育苗及田间栽培方法,在宁波市农业科学研究院温室进行。取存活30 d的嫁接幼苗及其开花期的叶片进行分析,同时以未嫁接的甬砧1号和早佳8424的叶片为对照。
1.2基因组DNA提取及MSAP分析
对幼苗期及开花期的嫁接及未嫁接材料DNA的提取选用CTAB法进行;提取后利用0.8%琼脂糖凝胶电泳及Mini Drop超微量分光光度计(上海依科赛生物制品有限公司)进行DNA质量检测。MSAP分析方法参照Xiong等[12]的方法。将提取的DNA稀释至50 ng/μL,分别用EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ内切酶(New England Biolabs)组合对每个DNA样品进行双酶切。酶切体系为DNA 500 ng、10× Buffer 10 μL、EcoRⅠ 10 U、MspⅠ (HpaⅡ) 10(20)U,加双蒸水补至50 μL;在37 ℃下温育5 h,在 65 ℃下水浴1 h终止酶切。酶切结束后向酶切产物中加入EcoR接头[接头及扩增引物序列见表1,由生工生物工程(上海)股份有限公司合成]10 μmol、MspⅠ(HpaⅡ)接头100 μmol、T4 DNA连接酶(北京全式金生物技术有限公司)5 U、10× T4 DNA Ligase Buffer 10 μL,加双蒸水补至100 μL;在4 ℃下保持12 h。预扩增体系为:连接产物0.5 μL、10× Buffer 2.5 μL、MgCl250 μmol、dNTP 4 μmol、Taq DNA聚合酶(北京全式金生物技术有限公司)2 U、E-A 50 μmol、M-T 1 μmol,加双蒸水补至25 μL。预扩增反应程序:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火1 min,72 ℃延伸1 min,19个循环;72 ℃延伸10 min。将预扩增产物稀释20倍,用于选择性扩增。扩增体系为:模板3 μL、10× Buffer 1.5 μL、MgCl230 μmol、dNTP 3 μmol、Taq DNA聚合酶2U、E-A+2 50 μmol、M-T+2 0.5 μmol,加双蒸水补至15 μL。选择性扩增反应程序:94 ℃预变性1 min;94 ℃变性30 s,65 ℃ 30 s,每个循环降低0.7 ℃,72 ℃延伸1 min,12个循环;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,25个循环;72 ℃延伸5 min。扩增产物经0.6%变性聚丙烯酰胺凝胶电泳分离,用常规硝酸银染色法进行检测。

表1 MSAP分析所用的接头和引物序列
1.3数据分析
将每条扩增带纹作为1个酶切识别位点,有扩增条带记为1,无扩增条带记为0。全甲基化及半甲基化类型统计方法参照徐志军等[3]的方法。采用Excel进行数据分析。
2 结果与分析
2.1不同发育时期甲基化水平
利用35对选择性扩增引物组合,对幼苗期和开花期的嫁接和非嫁接材料叶片的甲基化水平进行分析,共扩增出1218条清晰可读的条带(表2)。其中甬砧1号的多态性条带有299条,占甬砧1号总条带数的38.09%;早佳8424的多态性条带有434条,占早佳8424总条带数的52.54%。表明早佳8424的甲基化多态性高于甬砧1号。
在幼苗期,甬砧1号的全甲基化水平为8.6%(表3),高出开花期0.1个百分点;而半甲基化水平则以开花期为高,高出0.6个百分点。对于早佳8424,相对于幼苗期,开花期的全甲基化水平升高1.8个百分点,半甲基化水平则降低0.3个百分点。对于嫁接材料,相对于幼苗期,除早佳8424的半甲基化水平有所降低外,甬砧1号和早佳8424的全甲基化水平分别升高0.6和1.3个百分点,甬砧1号的半甲基化水平升高0.3个百分点。总体上,开花期的甲基化水平高于幼苗期。

表2 甬砧1号及早佳8424的
2.2嫁接对甲基化水平的影响
MSAP分析结果(表3)显示:嫁接材料砧木甬砧1号及接穗早佳8424在幼苗期的全甲基化水平分别为8.2%和7.7%,半甲基化水平分别为1.9%和4.1%,相对于未嫁接材料,它们的全甲基化水平分别改变了-0.4、0.6个百分点,半甲基化水平分别下降了0.5、1.5个百分点;在开花期,嫁接材料砧木甬砧1号及接穗早佳8424的全甲基化水平分别为8.8%和9.0%,半甲基化水平为2.2%和3.0%,相对于未嫁接材料,分别改变了0.3、0.1和-0.8、-2.3个百分点。说明嫁接总体上提高了全甲基化水平,但明显降低了半甲基化水平,其中对西瓜接穗的影响较大。

表3 嫁接对甲基化水平的影响
注:G表示嫁接苗。
2.3嫁接对甲基化状态改变的影响
从表4可以看出:甬砧1号砧木幼苗期和开花期发生甲基化状态改变的条带数分别为42和83条,早佳8424接穗幼苗期和开花期发生改变的条带数分别为128和140条。表明嫁接对开花期DNA甲基化状态改变的影响最大。从甲基化状态改变条带占多态性条带之比来看,甬砧1号砧木在幼苗期和开花期分别为0.14、0.28,早佳8424接穗在幼苗期和开花期分别为0.29和0.32,以开花期甲基化状态改变程度最大,而且早佳8424接穗的改变程度大于甬砧1号砧木的。在各个甲基化状态改变类型中,未甲基化与全甲基化之间改变的条带最多,其中2个发育时期早佳8424接穗的改变条带数高于甬砧1号砧木的。
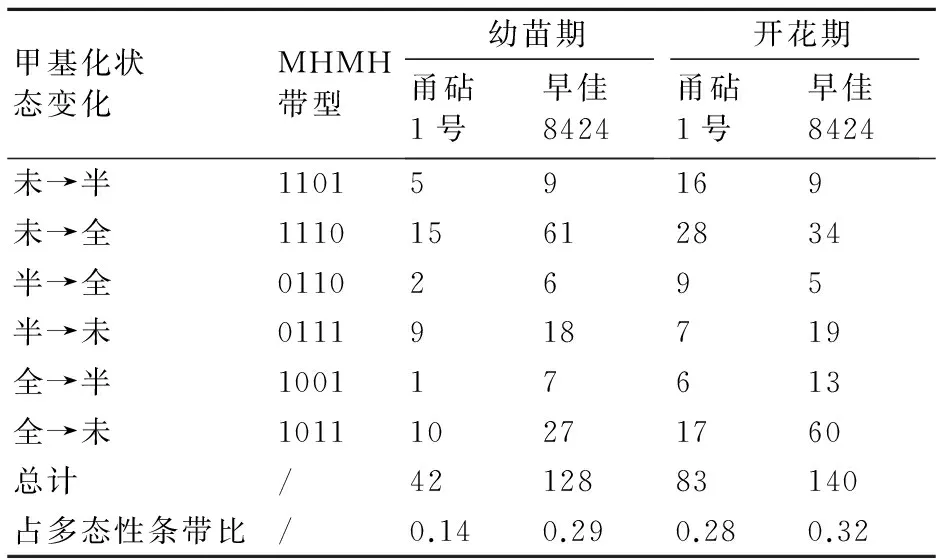
表4 嫁接引起的DNA甲基化状态改变的条带数
注:“未”表示未甲基化;“半”表示半甲基化;“全”表示全甲基化。
3 讨论
DNA甲基化是表观遗传调控的一种重要方式,在营养生长和生殖生长过程中均有重要的作用。主要通过基因的甲基化和去甲基化来调控基因的表达。在所有动物和植物中均广泛存在,且在不同物种间DNA甲基化水平存在一定的差异,且同一物种同一器官在不同发育时期甲基化水平也不同[1,13]。甲基化类型有3种,分别为半甲基化、全甲基化及超甲基化。本研究所用的MSAP方法仅能检测半甲基化和全甲基化2种。结果显示:西瓜幼苗期叶片的甲基化水平为12.7%,葫芦幼苗期叶片的甲基化水平为11.0%,且成熟期甲基化水平较幼苗期均有一定程度的升高,分别提高1.5和0.5个百分点;嫁接对葫芦砧木及西瓜接穗的甲基化水平均有影响,且对西瓜接穗的影响更大。这与Xing等[1]的研究结果一致。
嫁接是果树与瓜菜生产中广泛采用的重要技术,砧木品种的选择对嫁接瓜菜等的生产至关重要。尽管嫁接已经被广泛使用,但是相关嫁接机理仍不清楚。Liu等[14]通过对嫁接西瓜的测序发现,以葫芦和南瓜为砧木均发现有miRNA在砧木和接穗间交换。2015年, Liu等[15]又发现嫁接导致激素信号、初级和次级代谢、转录因子、转座子及对刺激物反应相关的mRNA转录水平的改变。Avramidou等[16]发现有mRNA从砧木到接穗的转移。本研究发现嫁接可以同时改变砧木及接穗的甲基化水平。Avramidou等[5]也发现嫁接可以引起接穗甲基化水平的改变,使接穗甲基化水平上升。因此,嫁接的原理之一可能是由于砧木及接穗间miRNA的转移,然后与甲基化相互调控,最终影响相关基因的表达,导致嫁接对砧木及接穗的影响。但是嫁接材料砧木和接穗间甲基化和miRNA转移的调控机制仍需要验证。Lewsey等[17]在拟南芥中发现有相关结果,但其与嫁接后接穗产量等性状的变化的关系还不清楚。
[1] Xing M Q, Zhang Y J, Zhou S R, et al. Global analysis reveals the crucial roles of DNA methylation during rice seed development [J]. Plant Physiology, 2015, DOI: 10.1104/pp.15.00414.
[2] 李慧,彭立新,于玮玮,等.盐胁迫下红花基因组DNA甲基化的MSAP分析[J].西北农业学报,2011,20(12):116-120.
[3] 徐志军,黄莉,姜慧芳.青枯菌诱导下花生基因组DNA表观遗传变化的MSAP分析[J].华北农学报,2015,30(2):93-99.
[4] Zhao X X, Chai Y, Liu B. Epigenetic inheritance and variation of DNA, methylation level and pattern in maize intra-specific hybrids[J]. Plant Sci, 2007, 172(5): 930-938.
[5] Avramidou E, Kapazoglou A, Aravanopoulos F A, et al. Global DNA methylation changes in Cucurbitaceae inter-species grafting [J]. Crop Breeding and Applied Biotechnology, 2015, 15: 112-116.
[6] Karaca F, Yetisir H, Solmaz I, et al. Rootstock potential of TurkishLagenariasicerariagermplasm for watermelon: plant growth, yield and quality [J]. Turk J Agric For, 2012, 36: 167-177.
[7] Yetisir H, Qzdemir A E, Aras V, et al. Rootstocks effect on plant nutrition concentration in different organ of grafted watermelon [J]. Agricultural Sciences, 2013, 4 (5): 230-237.
[8] Wu R, Wang X R, Lin Y, et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants [J]. PloS One, 2013, DOI: 10.1371/journal.pone. 0061995.
[9] Kim B O, Han J S, Park K I, et al. Absence of AVP1 transcripts in wild type watermelon scions grafted onto transgenic bottle gourd rootstocks [J]. Journal of Plant Biotechnology, 2015, 42 (1): 13-18.
[10] Karan R, Deleon T, Biradar H, et al. Salt stress induced variation in DNA methylation pattern and its influence on gene expression in contrasting rice genotypes [J]. PloS One, 2012, DOI: 10.1371/journal.pone. 0040203.
[11] Folsom J J, Begcy K, Hao X J, et al. Rice fertilization-independent endosperm regulates seed size under heat stress by controlling early endosperm development [J]. Plant Physiology, 2014, 165 (1): 238-248.
[12] Xiong L Z, Xu C G, Maroof M A S, et al. Patterns of cytosine methylation in an elite rice hybrid and its parental lines detected by a methylation sensitive amplification polymorphism technique [J]. Mol Gen Genet, 1999, 261(3): 439-446.
[13] Numata S, Ye T Z, Hyde T M, et al. DNA methylation signatures in development and aging of the human prefrontal cortex [J]. American Journal of Human Genetics, 2012, 90(2): 260-272.
[14] Liu N, Yang J H, Guo S G, et al. Genome-wide identification and comparative analysis of conserved and novel microRNAs in grafted watermelon by high-throughput sequencing [J]. PloS One, 2013, DOI: 10.1371/journal.pone. 0057359.
[15] Liu N, Yang J H, Fu X X, et al. Genome-wide identification and comparative analysis of grafting-responsive mRNA in watermelon grafted onto bottle gourd and squash rootstocks by high-throughput sequencing [J]. Molecular Genetics and Genomics, 2015, DOI: 10.1007/s00438-015-1132-5.
[16] Avramidou L, Vincent C, Jang S, et al. FT protein movement contributes to long-distance signaling in floral induction ofArabidopsis[J]. Science, 2007, 316 (5827): 1030-1033.
[17] Lewsey M G, Hardcastle T J, Melnyk C W, et al. Mobile small RNAs regulate genome-wide DNA methylation [J]. Proceedings of the National Academy of Sciences, 2016, doi: 10.1073/pnas. 1515072113.
(责任编辑:黄荣华)
Effect of Grafting on DNA Methylation Level of Calabash Rootstock and Watermelon Scion
XING Nai-lin, ZHANG Lei-chen, YING Quan-sheng, HUANG Yun-ping, WANG Yu-hong*
(Ningbo Municipal Academy of Agricultural Sciences in Zhejiang Province, Ningbo 315040, China)
Using calabash rootstock (Yongzhen No. 1) and watermelon scion (Zaojia 8424) as experimental materials, the author used Methyl Sensitive Amplification Polymorphism (MSAP) technique to evaluate the DNA methylation level of grafted and non-grafted calabash and watermelon leaves at seedling stage and flowering stage. The results showed that the DNA methylation levels of non-grafted watermelon and calabash leaves at seedling stage were 12.7% and 11.0%, respectively, which were separately 1.5 and 0.5 percent lower than those at flowering stage. Grafting generally increased the full-methylation levels of watermelon and calabash leaves at seedling stage and flowering stage, but obviously reduced their semi-methylation levels. Grafting had a greater influence on the methylation level of watermelon scion than calabash rootstock. Grafting had the greatest influence on the variation in DNA methylation status at flowering stage, and the variation mode of DNA methylation status caused by grafting was mainly the transformation from non-methylation status to fulll-methylation status.
Grafting; Methylation; Rootstock; Scion; Watermelon; MSAP
2016-03-28
瓜类砧木育种创新团队(2014B81002);国家西甜瓜产业技术体系(CARS-26);宁波市瓜菜育种重点实验室(2014A22007)。
邢乃林(1985─),男,河南封丘人,助理研究员,博士,主要从事瓜类砧木分子育种研究。*通讯作者:王毓洪。
S616
A
1001-8581(2016)09-0027-04
