浮游植物叶绿素a的微波法研究及其与反复冻融法的比较*
2016-10-12林罗敏唐鹊辉韦桂峰林叔忠李湘姣杨浩文
林罗敏,唐鹊辉,彭 亮,韦桂峰,林叔忠,李湘姣,杨浩文
(1:暨南大学生态学系,热带亚热带水生态工程教育部工程研究中心,广州 510632) (2:广东省水文局,广州 510150)
浮游植物叶绿素a的微波法研究及其与反复冻融法的比较*
林罗敏1,唐鹊辉1,彭亮1,韦桂峰1**,林叔忠2,李湘姣2,杨浩文2
(1:暨南大学生态学系,热带亚热带水生态工程教育部工程研究中心,广州 510632) (2:广东省水文局,广州 510150)
为缩短样品处理时间和提高测定准确度,本文设计和优化了微波处理辅助提取浮游植物叶绿素a的方法,并比较了反复冻融法和微波法对浮游植物叶绿素a的提取效率. 结果表明:(1)微波法提取叶绿素a的最优处理条件为:高火(额定输出功率800W)处理60s左右. 过滤水量为:贫营养型水体为1000ml以上,中、富营养水体为100~500ml. (2)反复冻融法在测定贫营养型水体时更稳定,而微波法对中、富营养水样提取率显著高于冻融法,可提高7%~12%,对具胶被及硅质外壳的藻类提取效率极显著高于冻融法,测定结果的相对偏差更小,且提取时间较冻融法缩短一半以上,适用于富营养化水体的应急监测.
微波法;反复冻融法;提取;浮游植物;叶绿素a
叶绿素a是表征藻类现存量的一个重要指标[1],可在一定程度上反映水体初级生产力和浮游植物生物量[2],是水体富营养化评价的重要指标和水华预警的重要依据[3]. 因此,叶绿素a浓度的准确测定是水体富营养化研究和水质评价的重要基础[1]. 在叶绿素a的测定过程中,较高的提取率是保证测定结果准确性和稳定性的前提. 目前常用的提取方法是利用反复冻融细胞破碎藻类细胞,再用丙酮或乙醇等有机溶剂浸提细胞溶出物中的叶绿素[4-7],该方法冻融操作简单,与有毒溶剂接触时间短[7-8],但耗时相对较长,且可能对具胶被或硅质壳藻细胞的破碎能力较弱.
自1986年开始利用微波技术从羽扇豆中提取鹰爪豆生物碱以来[9],微波辅助技术(microwave-assistedextraction,MAE)在色素的提取工艺中被广泛应用[10-12]. 微波法通过升温汽化胞内液体,使细胞膨胀破裂,内容物自由流出,因此萃取率较高[13]. 但此方法对浮游植物细胞尤其是具胶被或硅质壳藻细胞是否具有较强的破碎能力和较高的叶绿素提取效果还有待验证. 为缩短样品处理时间和提高测定的准确度,本文设计并优化了微波法提取浮游植物叶绿素a的处理条件,比较了优化后的微波法和反复冻融法(Freezing-thawing,FT)对叶绿素a的提取率及两种方法的稳定性,提出适合不同营养水平水体叶绿素a的测定方法.
1 材料与方法
1.1 实验材料
纯藻液样品:实验室培养的铜绿微囊藻(Microcystis aeruginosa)、蛋白核小球藻(Chlorella pyrenoidosa)和颗粒直链藻(Melosira granulata).
野外样品:湖泊(暨南大学南湖S1 、明湖S2)、河流(流溪河石海桥S3、珠江猎德大桥S4)、水库(流溪河水库S5、南屏水库S6),其中S1、S3、S5叶绿素浓度较低,S2、S4、S6叶绿素浓度较高.
1.2 实验方法
实验内容包括微波处理条件优化及其与反复冻融法提取叶绿素效果比较两部分,具体实验设计见表1. 1.2.1 微波法操作步骤及实验条件优化用醋酸纤维滤膜(0.45μm)过滤一定量的水样,再将滤膜折叠为1/4后,置于对折的定性滤纸中遮光并吸去滤膜背面水分. 将滤膜连同定性滤纸和装有小半杯水的烧杯(防止微波炉空烧)放入微波炉(型号:P80D23N2L-A9(R0),额定输出功率800W)中,在高火(额定输出功率100%输出,即800W功率输出[14])条件下进行微波破壁处理.
破壁处理后将滤膜取出放入盛有10ml90%丙酮溶液的离心管中,用快速混匀器/手摇震荡1min后放于4℃冰箱浸提8h以上,再经过7000转/min离心15min后,用HitachiU-3900紫外分光光度计于630、645、663和750nm波长测量吸光值后计算得出叶绿素a浓度[15].
根据叶绿素a的测定结果,确定微波法中最优的微波处理时长和过滤水量. 1.2.2 比较微波法和反复冻融法提取效果分别用微波法和反复冻融法(-20℃冷冻20min,取出室温融解5~10min,反复冻融5次,90%丙酮4℃浸提20h)[8]提取纯藻液(铜绿微囊藻、蛋白核小球藻和颗粒直链藻)以及野外水样(S1、S2、S3、S4、S5和S6)的叶绿素a浓度. 微波法和反复冻融法样品统一批次、浓度及过滤水量等条件,保证结果的可比性;所有实验设置5组平行,保证重复性.

表1 实验设计*Tab.1 Experimental design
*Mic.:铜绿微囊藻;Chl.:蛋白核小球藻;Mel.:颗粒直链藻.
1.3 数据分析与绘图
利用SPSS20.0进行单因素方差分析;用Origin8.0软件完成绘图.
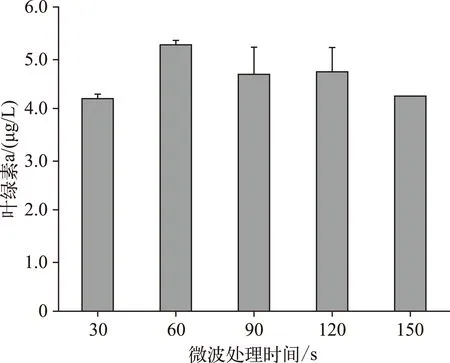
图1 不同微波处理时间对野外水样(S1) 叶绿素a浓度测定结果的影响Fig.1 Effect of microwave treatment time on determination of chlorophyll-a concentration from field water samples
2 结果与讨论
2.1微波法的处理条件筛选
2.1.1 微波处理时间对叶绿素提取效果的影响微波法主要通过微波破壁产生裂缝和空隙[11-12],有助于有机溶剂丙酮有效地溶出叶绿素. 微波处理时长直接影响提取效果. 对于野外水体(S1),微波处理60s后的叶绿素a浓度的测定结果显著高于处理30s后的测定结果(P<0.05),且相对标准偏差较小(图1). 但随着处理时间的增加,叶绿素a浓度的测定结果并未显著升高,当处理时间达150s时,微波可能破坏了藻细胞体内的叶绿素a结构[15],导致测定的叶绿素a浓度显著下降(P<0.05). 对于室内培养的不同浓度的微囊藻藻液和小球藻藻液,微波处理时间超过60s时,叶绿素a浓度的测定结果无显著差异(P>0.05)(图2). 因此,最适的微波破壁处理时长为60s左右.
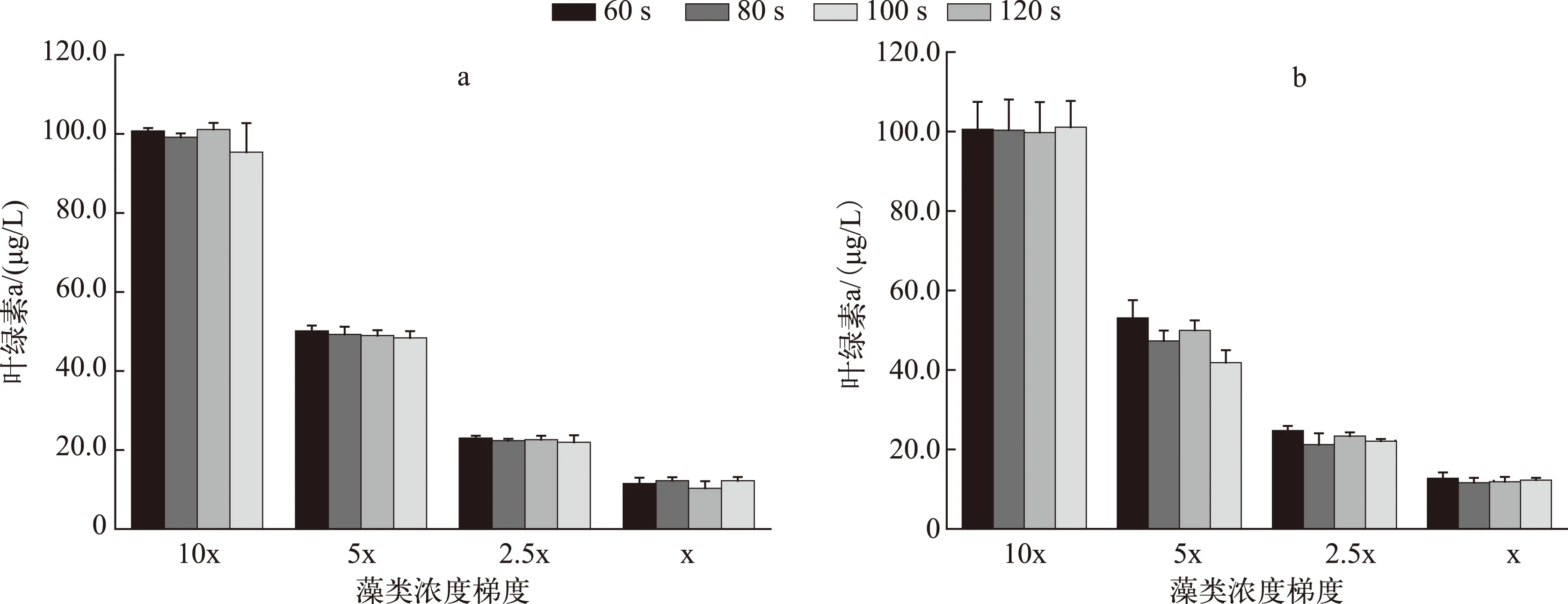
图2 不同微波处理时间对室内培养藻液叶绿素a浓度的影响(a:铜绿微囊藻; b:蛋白核小球藻)Fig.2 Effect of microwave irradiation time on determination of chlorophyll-a concentration from cultured samples (a: Microcystis aeruginosa; b: Chlorella pyrenoidosa)
2.1.2 过滤水量对微波法提取效果的影响过滤水量为50ml时,S2水样的叶绿素a提取效果较差,可能是由于此时滤膜上叶绿素过少,浓度低于检测限,导致测量值偏低(图3). 当过滤水量增加到100、500ml时,提取效果显著提高(P<0.05),但当过滤水量为1000ml时,叶绿素a浓度测定值略降低(图3),这可能与过滤时间较长,叶绿素部分分解有关[16],也可能与泥沙等杂质增多,干扰测定结果的准确性有关. 因此,以叶绿素a浓度为15μg/L左右的富营养水样为例,微波法提取叶绿素a的最适过滤水量为100~500ml. 随着叶绿素a浓度的升高或降低,应相应调整过滤水量:贫营养型水体为1000ml;中、富营养水体为100~500ml.

图3 微波法对不同体积野外水样(S2) 叶绿素a浓度的测定结果Fig.3 The determination of chlorophyll-a concentration in field samples with different volumes by MAE
2.2 微波法和反复冻融法对叶绿素a提取效果的比较
对于室内培养的微囊藻藻液,微波法和反复冻融法对叶绿素a的提取效果无显著差异(图4a),这可能与微囊藻细胞体积小、细胞壁薄[8]有关;对于室内培养的小球藻和直链藻藻液,微波法提取效果显著高于反复冻融法(P<0.05),这可能是因为微波辐射均匀,选择性强[13],对具细胞个体胶被的小球藻和具硅质外壳的直链藻细胞壁的破碎效果较好. 而反复冻融法通过冷冻使细胞内形成冰粒和细胞液浓度增高引起溶胀[17],依赖多次反复冷冻及室温解冻,受环境因素影响较大,破壁效果较差.
用微波法和反复冻融法分别测定以蓝、绿藻占优势的湖泊和水库水样以及以硅藻占优势的河流水样中的叶绿素a浓度. 当叶绿素a浓度较低时(S1、S3和S5),两种方法的测定结果无显著差异;当叶绿素浓度较高(S2、S4和S6)时,微波法的测定结果显著高于反复冻融法(P<0.05),且相对标准偏差较小,此时微波法的提取效果更好(图4b).
3 结论
1)微波法提取叶绿素a的最优处理条件为:高火(额定输出功率800W)60s左右. 最佳过滤水量为:贫营养型水体为1000ml;中、富营养水体为100~500ml.
2)微波法提取对具有胶被和硅质外壳的藻类提取效率优于冻融法,且误差更小.

图4 微波法和反复冻融法对室内培养藻液(a)和野外水样(b)叶绿素a浓度测定结果的比较Fig.4 Comparison of determination of chlorophyll-a concentration in cultured samples(a) and in field samples(b) by MAE and FT
3)两种方法在操作上均较简单易行. 反复冻融法在测定贫营养水体叶绿素a浓度上具有一定的优势(采用反复冻融法建议贫营养水体过滤水量为500~1000ml[8]),但当叶绿素a浓度较高时,微波法提取率显著高于反复冻融法,测定结果的相对偏差较小,且提取时间较冻融法缩短一半以上,适用于富营养化水体的应急监测.
[1]SEPA"AquaticOrganismsMonitoringHandbook"editorialed.Aquaticorganismsmonitoringhandbook.Nanjing:SoutheastUniversityPress, 1993: 177-180(inChinese).[国家环境保护局《水生生物监测手册》编委会. 水生生物监测手册. 南京: 东南大学出版社, 1993: 177-180.]
[2]KimSangchan,TuQingyingeds.Eutrophicationsurveyspecifications(2ndedition).Beijing:ChinaStandardPress, 1990: 268-270(inChinese).[金相灿, 屠清瑛. 湖泊富营养化调查规范(第2版). 北京: 中国标准出版社, 1990: 268-270.]
[3]HuangYingbo.Animprovedmethodforextractionofchlorophyllainphytoplankton:freezing-thawingmethod. China Science and Technology Information, 2012, (10): 157(inChinesewithEnglishabstract). [黄莹波. 浮游植物叶绿素a提取方法的改进: 反复冻融—浸提法. 中国科技信息, 2012, (10): 157.]
[4]RosenBH,LoweRL.PhysiologicalandultrastructuralresponsesofCyclotella meneghiniana (Bacillariophyta)tolightintensityandnutrientlimitation. Journal of Phycology, 1984, 20(2): 173-183.
[5]LevassseurM,ThompsonPA,HarrisonPJ.Physiologicalacclimationofmarinephytoplanktontodifferentnitrogensources. Journal of Phycology, 1993, 29(5): 587-595.
[6]PápistaÉ,csÉ,BöddiB.Chlorophyll-adeterminationwithethanol—acriticaltest. Hydrobiologia, 2002, 485: 191-198.
[7]FengJing,LiYanbo,ZhuQinget al.Comparisonofmethodsforphytoplanktonchlophyll-aconcentrationmeasurement. Ecology and Environment, 2008, 17(2): 524-527(inChinesewithEnglishabstract). [冯菁,李艳波,朱擎等. 浮游植物叶绿素a测定方法比较. 生态环境, 2008, 17(2): 524-527.]
[8]LinShaojun,HeLijing,HuangPeishenget al.Comparisonandimprovementontheextractionmethodforchlorophyllainphytoplankton. Ecology and Environment, 2005, 24(1): 9-11(inChinesewithEnglishabstract). [林少君,贺立静,黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11.]
[9]GanzlerK,SalgóA,ValkóK.MicrowaveextractionAnovelsamplepreparationmethodforchromatography. Journal of Chromatography A, 1986, 371: 299-306.
[10]XieMingyong,ChenYi.Theresearchprogressofmicrowaveassistedextractingtechnology. Journal of Food Science and Biotechnology, 2006, 25(1): 105-114(inChinesewithEnglishabstract). [谢明勇, 陈奕. 微波辅助萃取技术研究进展. 食品与生物技术学报, 2006, 25(1): 105-114.]
[11]EskilssonCS,BjörklundE.Analytical-scalemicrowave-assistedextraction. Journal of Chromatography A, 2000, 902(1): 227-250.
[12]RenQingguo.Thestudyofmicrowaveassistantextractiononchlorophyllfromsilkwarmandchlorophyll-copper-sodiumpreparation[Dissertation].Dalian:DalianUniversityofTechnology, 2005(inChinesewithEnglishabstract).[任清国. 微波辅助萃取蚕沙中叶绿素及叶绿酸铜钠的研究[学位论文]. 大连: 大连理工大学, 2005.]
[13]PasquetV,ChérouvrierJR,FarhatFet al.Studyonthemicroalgalpigmentsextractionprocess:performanceofmicrowaveassistedextraction. Process Biochemistry, 2011, 46(1): 59-67.
[14]JiangXiuxined.Microwaverepairatlas.Harbin:HarbinEngineeringUniversityPress, 2006: 31(inChinese).[蒋秀欣. 微波炉维修图集. 哈尔滨: 哈尔滨工程大学出版社, 2006: 31.]
[15]LiZhenguo,LuJun,WangGuoxianget al.Comparisonofmeasurementofphytoplanktonchlorophyll-aconcentrationbyspectrophotometry. Environmental Monitoring in China, 2006, 22(2): 21-23(inChinesewithEnglishabstract). [李振国, 卢军, 王国祥等. 分光光度法测定浮游植物叶绿素a的比较研究. 中国环境监测, 2006, 22(2): 21-23.]
[16]ZhangWuchang,WangRong.Effectoflightandtemperatureonthedegradationofchlorophyllaandphaeophorbidea. Marine Science, 2000, 24(4): 50-52(inChinesewithEnglishabstract). [张武昌, 王荣. 光和温度对叶绿素a和脱镁叶绿素a降解的影响. 海洋科学, 2000, 24(4): 50-52.]
[17]SunLiqin,WangChanghai,JiangTao.ResearchonthemethodsofPorphyridium cruentumcellsfragmentation. Marine Science Bulletin, 2004, 23(4): 71-74(inChinesewithEnglishabstract). [孙利芹, 王长海, 江涛. 紫球藻细胞破碎方法研究. 海洋通报, 2004, 23(4): 71-74.]
Microwave-assisted method for extracting chlorophyll-a in phytoplankton and its comparison with freezing-thawing extraction method
LIN Luomin1, TANG Quehui1, PENG Liang1, WEI Guifeng1**, LIN Shuzhong2, LI Xiangjiao2& YANG Haowen2
(1: Engineering Research Center of Tropical and Subtropical Aquatic Ecological Engineering Ministry of Education, Department of Ecology, Jinan University, Guangzhou 510632, P.R.China) (2: Hydrological Bureau of Guangdong Province, Guangzhou 510150, P.R.China)
Inordertosavetimeofsampleprocessingandtoimprovethedeterminingaccuracy,amicrowave-assistedextractionmethodwasdesignedandoptimizedtoextractchlorophyll-ainphytoplankton,andwascomparedtothefreezing-thawingmethodforextractionefficiencyofchlorophyll-a.Theresultsshowedthatmicrowave-assistedextractionmethodwasoptimalin60streatmentwithoutputpowerof800W,andtheappropriatewatervolumeforfiltrationwasabout100-500mlforsamplescollectedinmeso-eutrophicwaterbodiesand1000mlforthosefromoligotrophicwaterbodies.Thechlorophyllextractionrateofmicrowave-assistedextractionmethodwassignificantlyhigherthanthatoffreezing-thawingmethodinmeso-eutrophicwaterbodies,whichcanincreasedby7%-12%,whilefreezing-thawingmethodwasmorestableinmeasuringchlorophyll-aofoligotrophicwaterbodies.Forthosealgaewithaglueshellorsiliceousshell,microwave-assistedextractionmethodhadahigherefficiencyforchlorophyll-aextractionandalowerrelativestandarddeviationthanthefreeze-thawmethod.Themicrowave-assistedextractionmethodneedsonlyonehalfoperationtimeofthefreezing-thawingextractionmethod,sothatitismoresuitableforemergencymonitoringofeutrophicwaterbodies,whilethefreezing-thawingextractionmethodismoresuitableformonitoringoligotrophicwaterbodies.
Microwave-assistedextractionmethod;freezing-thawingmethod;extraction;phytoplankton;chlorophyll-a
*广东省水利科技创新项目“广东省河流水生态健康评价指标体系及评价方法研究”(2014-01)资助.2015-10-23收稿;2015-12-16收修改稿. 林罗敏(1990~),女,硕士研究生;E-mail:linluomin@126.com.
**通信作者;E-mail:tweigf@jnu.edu.cn.
