138例唑来膦酸不良反应分析
2016-09-27王乔羽颜晓燕
王乔羽,王 萍,张 林,陈 岷,颜晓燕△
1.成都医学院 药学院(成都 610500); 2.温州医科大学 药学院(温州 325035);3.绍兴市人民医院、浙江大学绍兴医院 临床药学科(绍兴 312000); 4.四川省人民医院 药学部(成都 610500)
138例唑来膦酸不良反应分析
王乔羽1,王萍2,张林3,陈岷4△,颜晓燕1△
1.成都医学院 药学院(成都610500); 2.温州医科大学 药学院(温州325035);3.绍兴市人民医院、浙江大学绍兴医院 临床药学科(绍兴312000); 4.四川省人民医院 药学部(成都610500)
目的认识和探索唑来膦酸发生不良反应的特点与规律,为临床合理使用唑来膦酸提供参考。方法 以浙江省2012至2014年报告的138例唑来膦酸不良反应监测数据为研究对象,按患者性别、年龄、原患疾病、不良反应累及器官或系统、临床表现、因果关系及转归等因素统计并深入分析。结果138例唑来膦酸不良反应个案报告,患者23~97岁,>60岁占67.4%,男∶女为1∶1.9;原患疾病中,实体瘤转移病例占50.7%、骨质疏松症占46.4%;静脉滴注给药引发的不良反应达94.2%;唑来膦酸不良反应发热病例占65.9%,其他涉及骨骼肌肉、皮肤及其附件、消化等器官或系统不同程度的损害。结论静脉滴注唑来膦酸发生不良反应的事件较为常见。老年尤其是老年女性患者不良反应发生率明显高于男性;实体瘤转移及骨质疏松症患者使用唑来膦酸,发生不良反应的比率较高;不良反应以发热为主,多为一过性。不良反应性质轻微,一般对症处理即可转归,临床偶见低钙血症、下颌骨坏死,肾、肝功能损害等病例报告,应引起重视,加强用药监测,减少或避免不良反应发生。
唑来膦酸;不良反应;监测数据;统计分析
双膦酸盐药物用于治疗绝经后骨质疏松症、预防骨折和再骨折的发生[1],近年发现其具有抗乳腺癌、前列腺癌和肺癌等肿瘤的作用[2]。双膦酸盐是焦磷酸盐的稳定类似物,活性基本结构为P-C-P,两个磷酸根在分子中起“骨链” 作用。侧键R1多为羟基,与两个膦酸基共同作用使双膦酸盐与钙鳌合,由二位点鳌合变成三位点鳌合,促进双膦酸盐高效结合于骨表面;R2为可变脂肪侧链,其改变可直接影响双膦酸盐的抗骨吸收活性,R2 是不同双膦酸盐差异的关键(图1)。第三代双膦酸盐结构中,具有杂环结构的含氮侧链,如利塞膦酸、替鲁膦酸和唑来膦酸(zoledronic acid, 图2)[3],其中唑来膦酸为药理活性最强的双膦酸盐类药物,能抑制骨吸收而减少骨基质生长因子的释放,抑制癌细胞黏附于骨基质,降低癌症患者的骨转移发生率。多用于辅助治疗发生骨转移的癌症患者,以减少高钙血症、骨痛和骨折的危险;也见用于预防恶性肿瘤引起的骨骼相关疾病,延缓骨转移的发生[2,4-6]。
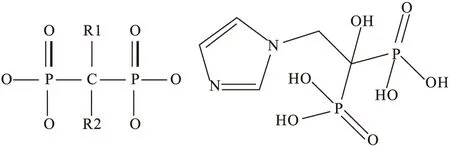
图1双膦酸盐共同分子结构图2唑来膦酸分子结构
中国唑来膦酸上市10年来,个案报道的不良反应主要为流感样症状,如发热、关节痛、肌痛、一过性骨痛,以及胃肠道反应、血细胞减少、呼吸困难、水肿、心动过缓、味觉倒错、口渴等[7],也有严重低钙血症[8]、相关性颌骨坏死等[9]等少见不良反应。唑来膦酸主要以原型经肾排泄,长期使用可有肾功损害,甚者可致中毒性急性肾小管坏死[10-11]。为从监测数据中了解唑来膦酸临床不良反应情况,本研究对国内同一区域3年内报告的唑来膦酸所致不良反应病例进行归类和分析,以期为临床合理使用唑来膦酸提供参考。
1 资料与方法
1.1临床资料
回顾性总结2012至2014年浙江省不良反应监测中心监测获取的全部唑来膦酸不良反应138例临床资料。
1.2统计学方法
手工筛选并借助Excel表格,按患者性别、年龄、原患疾病,唑来膦酸不良反应累及器官或系统、临床表现、因果关系及转归等因素,进行统计和分析。
2 结果
2.1患者性别与年龄分布
138例唑来膦酸不良反应病例中,男47例(34.1%),女91例(65.9%),男女之比1∶1.9,年龄23~97岁,>60岁患者32例(67.4%)(表1)。
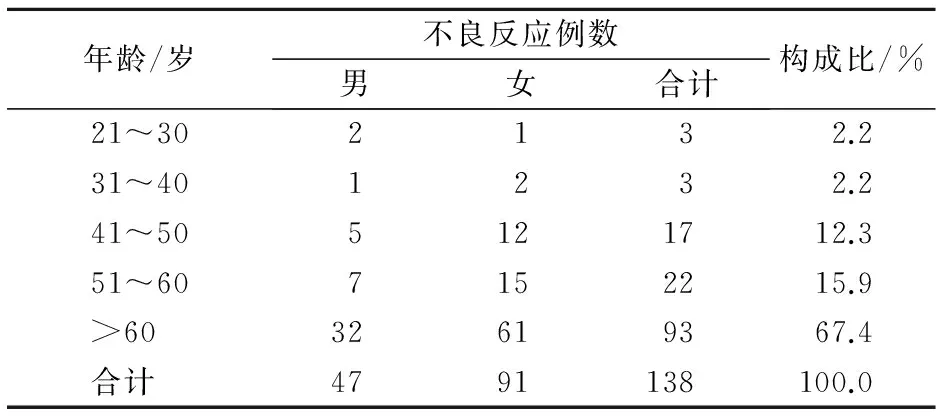
表1 唑来膦酸发生不良反应的患者性别与年龄分布
2.2出现不良反应患者的原患疾病
138例唑来膦酸不良反应报告病例中,实体瘤溶骨性转移70例(50.7%),骨质疏松症64例(46.4%),免疫系统疾病3例(2.2%),多发性骨髓瘤1例(0.7%)(表2)。
2.3引发不良反应的给药途径
138例不良反应病例给药途径为唑来膦酸注射液静脉滴注。未统计到静脉滴注给药途径的其他相关干扰因素。
2.4不良反应累及器官或系统的临床表现
138例唑来膦酸不良反应病例报告中,全身性症状106例(76.8%),以发热反应为主(91例,65.9%),其次是骨骼肌肉系统的不良反应18例(13.0%),皮肤及其附件、神经系统、循环系统、胃肠系统等6~8例(4.3%~5.8%)(表3)。

表2 出现唑来膦酸不良反应患者的原患疾病

表3 唑来膦酸不良反应累及器官或系统的临床表现
注:*部分不良反应病例涉及几个器官或系统,统计的总例数>138例
2.5唑来膦酸不良反应干预措施及转归
138例唑来膦酸不良反应病例报告中,给予不良反应对症干预115例,未经特殊干预23例。本组唑来膦酸不良反应的发热病例91例,80%以上的患者予以解热镇痛药物或和物理降温。不良反应转归情况:治愈50例(36.2%),好转86例(62.4%),有后遗症1例(0.7%),不详1例(0.7%)。
3 讨论
3.1唑来膦酸不良反应与年龄、性别的关系
老年患者,尤其是绝经后患骨质疏松症的妇女使用唑来膦酸,不良反应发生率较高。分析本组病例,唑来膦酸不良反应可见任何年龄段,但>60岁的老年患者不良反应发生率明显偏高(67.4%)。主要原因是老年人组织器官衰老,生理机能减退,对药物的吸收、分布、代谢和排泄发生改变,容易导致药品在体内蓄积。老年患者免疫力低,往往同期多疾病共存(共病,comorbidity)、用药品种多、个体差异大,增加了不良反应发生率[12]。伴随我国社会人口老龄化的加剧,开展对老年患者不良反应的监测,将成为不良反应研究的重点领域[13]。老年患者临床用药要充分考虑老年人的生理机能特点,以及药代动力学特性等因素,严格谨慎用药,从而降低不良反应发生率。
本组病例中女性发生不良反应率显著高于男性(1.9∶1),与文献[14]报道相符。本研究中, 唑来膦酸主要用于骨质疏松症,而骨质疏松症多见于绝经后妇女和老年人,所以女性的不良反应发生率较高。
3.2唑来膦酸不良反应与给药途径的关系
本组138例出现唑来膦酸不良反应的患者均为静脉滴注给药,排除患者自身特殊体质因素,不良反应可能与唑来膦酸注射液的赋形剂,以及内毒素、微粒、pH值和渗透压等因素相关。静脉滴注速度的随意性和输液的不规范也可能是诱发原因。由于静脉滴注没有“首过效应”,药物对患者疾病症状影响快速,一旦发生不良反应,很难将药物从体内立即去除,对患者影响严重[15]。建议严格控制静脉滴注的剂量和时间,并规范输液性操作,以降低唑来膦酸不良反应发生率。
3.3唑来膦酸不良反应的临床表现分析
唑来膦酸静脉给药的安全性问题受到广泛关注,其静脉滴注的不良反应通常发生在给药后3 d内,以发热、骨痛和肌痛最常见。本研究收集的138例不良反应主要临床表现为流感样症状(发热、寒战、关节痛、肌痛和一过性骨痛)、头晕、心悸、胃肠道反应、血细胞减少、乏力衰弱和味觉倒错等,与文献[16-18]报道类似。
3.3.1出现发热反应本组研究中各年龄段患者均出现发热反应,且发热反应的发生率较高(91例,65.9%),均为急性期反应,多在3 d内好转。唑来膦酸所致发热的原因,Dicuonzo等[19]认为,急性期的发热反应可能是由于唑来膦酸抑制法尼基焦磷酸合成酶,致其上游香叶基焦磷酸(IPP)和二甲基丙烯焦磷酸酯(DMPP)堆积,IPP及DMPP刺激T细胞活化、增殖,释放肿瘤坏死因子(TNF-α)及白细胞介素(IL-6)所致。
Evdokiou 等[20]报道,唑来膦酸引起的急性期发热反应发生率为37.8%,唐跃琼等[21]报道的发生率为34.3%,Sheedy等[22]报道唑来膦酸感冒样症状发生率为29.0%,以上研究数据与本文统计结果差异较大,其原因在于本文收集的数据是已发生不良反应的病例,并没有收集使用唑来膦酸而无不良反应的病例,因此使本文的研究样本量变小,致发热的发生率变大,还有可能与解热镇痛药物的使用等有关。
3.3.2发生低钙血症本研究中,发生低钙血症5例,国内外也有相关报道[8,23]。引发低钙血症原因很多,如术后或特发的甲状旁腺功能减退症、维生素D缺乏、肾小管疾病、肾脏衰竭、摄入不足导致镁缺乏、急性胰腺炎、低蛋白血症、严重骨病、败血症休克、高磷血症、药物和某些疾病分泌降钙素[23]。本组5例低钙血症病例中,4例为患者术后使用唑来膦酸,1例为类风湿性关节炎患者应用唑来膦酸。建议唑来膦酸临床给药前,常规检测患者血清钙离子浓度;给药治疗期间,密切监测患者血清钙离子浓度,如出现血清钙含量过低时,应给予补充钙和维生素D,以减少低钙血症的发生。
3.3.3偶见下颌骨坏死本组病例报告中,发生下颌骨坏死1例。病历资料:54岁女性患者,患乳腺恶性肿瘤入院,因左乳腺癌胸椎转移,2011年6月26日给予唑来膦酸(具体用药不详)。2011年12月口腔检查全景片显示,右下颌后牙槽骨阴影明显,2012年5月阴影增大,2012年6月起下颌骨下缘颊侧骨膨隆,次月CT显示,右下颌骨可见骨质破坏,死骨形成,诊断为右下颌双膦酸盐相关坏死。临床全身麻醉下行右下颌骨部分切除术+颌骨病灶清除术。
文献[24]报道,由于上下颌骨的血运状况以及局部状况不同,上下颌骨坏死比例约为1∶2,其发病机制,破骨细胞功能障碍学说认为,长期承受咀嚼压力的颌骨易发生微损伤和微骨折,正常骨具有吸收重建功能,可消除这种微创伤。双膦酸盐类药物,一方面干扰破骨细胞胞内通道,抑制破骨细胞介导的骨改建过程并诱导其凋亡,改变破骨细胞-成骨细胞轴平衡,导致骨坏死发生;另一方面抑制成骨细胞介导的破骨性吸收,骨循环被严重抑制,生理性再塑功能下降,对日常生活中发生的微骨折失去修复能力,导致发生颌骨坏死[25]。伴有口腔疾病、口腔放疗后、长期使用糖皮质激素、贫血和凝血功能异常的患者,应用双膦酸盐类药物易发生颌骨坏死,可能与高活性双膦酸盐与骨高效结合且难以解离相关。美国FDA建议在使用该类药物前,行口腔检查,用药期间避免创性牙科检查和治疗。唑来膦酸临床给药过程中,应重视颌骨的影像变化,如有影像学改变,建议停止使用唑来膦酸。
3.3.4急性肾功能衰竭138例报告病例中,发生急性肾功能衰竭1例。病历资料:66岁女性患者,2012年7月2日因“多关节肿痛10余年,口眼干4年”收治入院。初步诊断:1)干燥综合症,自身免疫性相关性肝病,肝硬化,肺间质病变;2)类风湿性关节炎;3)骨质疏松症;4)颈椎间盘突出症;5)胆囊结石;6)双肾囊肿。因骨质疏松症,给予唑来磷酸5 mg静脉滴注,3 d后患者出现小便减少(尿量1 000 mL/d)、腹胀、双下肢水肿。给予呋塞米40 mg静脉注射,并行腹腔引流后,患者尿量增加,无明显腹胀,肾功能恢复正常。病人为老年共病患者,且有双肾囊肿,因其骨质疏松使用唑来膦酸,出现肾功能恶化直至衰竭。究其原因是临床对唑来膦酸的不良反应和禁忌证认识不足,导致患者肾功能衰竭。
2011年美国FDA发布公告[26],唑来膦酸存在导致肾衰竭风险,并对唑来膦酸说明书进行了更新,增加了肾毒性警告和注意事项,提醒肾功能不全的患者需减少剂量。建议临床使用唑来膦酸前,应评估病人是否属于肾衰竭高危因素患者;确定使用唑来膦酸的患者,每次给药前采用 Cockcroft Gault计算患者肌酐清除率,高危因素患者每次给药后应监测患者的肌酐清除率。选择适宜接受唑来膦酸治疗的患者并在给药过程中进行严密监护,可减少类似不良事件的发生,从而保证用药安全[11]。
3.3.5肝功能损害本组唑来膦酸不良反应报告病例中,出现肝功能损害3例,给予保肝药物治疗后肝功能恢复正常。除Polyzos等[27]曾报道唑来膦酸引起短暂的肝损害外,本研究并未查到唑来膦酸诱导肝毒性更多的文献。唑来膦酸诱导肝毒性的机制尚不清楚。尽管如此,本研究收集的3例(1.2%)也足以说明唑来膦酸有潜在肝功能损害的风险,提示临床使用唑来膦酸注射液时应考虑肝功能损害的可能性。用药前详问患者肝病既往病史、过敏史及家族变态反应史等,用药中观察肝功能变化,出现不良变化应及时采取有效措施,避免出现严重并发症,确保用药安全。
综上所述,静脉滴注唑来膦酸发生不良反应的事件较常见。老年尤其是老年女性患者,不良反应发生率高于男性。骨质疏松症、实体瘤转移患者使用唑来膦酸,发生不良反应的比率较高。虽然本组唑来膦酸不良反应以发热反应为主,并未监测到严重不良反应[28],但也有低钙血症、下颌骨坏死、急性肾功能衰竭和肝功能损害等病例报告,提示临床应用唑来膦酸应在严格适应证和禁忌证的基础上,重视给药前肝肾功能、血钙检测及口腔检查,选择合适的给药途径,密切观测给药后患者的临床表现,及时处理不良反应,防止发生严重不良反应发生。
[1]Zekri J, Mansour M, Karim SM.The anti-tumour effects of zoledronic acid[J].Journal of Bone Oncology, 2014, 3(1): 25-35.
[2]Hsieh PC.Effectiveness and safety of zoledronic acid in the treatment of osteoporosis[J].Orthopedics, 2016, 39(2): 263-270.
[3]Russell RG, Watts NB, Ebetino FH,etal.Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy[J].Osteoporos Int, 2008, 19(6): 733-759.
[4]Alegre A, Gironella M, Bailen A,etal.Zoledronic acid in the management of bone disease as a consequence of multiple myeloma: a review[J].European Journal of Haematology, 2014, 92(3): 181-188.
[5]Reid IR, Gamble GD, Mesenbrink P,etal.Characterization of and risk factors for the acute-phase response after zoledronic acid[J]. J Clin Endocrinol Metab, 2010, 95(9): 4380-4387.
[6]车建华, 杨保庆, 杨玲玲,等.希罗达联合唑来膦酸治疗乳腺癌多发骨转移疗效观察[J].实用医学杂志, 2012,28(6): 979-981.
[7]Berenson JR.Recommendations for zoledronic acid treatment of patients with bone metastases[J]. Oncologist, 2005, 10(1): 52-62.
[8]Aldave APN, Jaiswal S.Severe resistant hypocalcemia in multiple myeloma after zoledronic acid administration: a case report[J]. J Med Case Rep, 2014, 8: 353.
[9]Katz J, Ordoveza PA.Bisphosphonate-related osteonecrosis of the jaw (BRONJ) associated with a once-yearly IV infusion of zoledronic acid (Reclast) 5 mg: two cases and review of the literature [J]. Quintessence Int, 2014, 45(8): 685-690.
[10] Iranikhah M, Wilborn TW, Wensel TM,etal.Denosumab for the prevention of skeletal-related events in patients with bone metastasis from solid tumor[J]. Pharmacotherapy, 2012, 32(3): 274-284.
[11] Cha YJ, Lee YJ.Risk factors for renal impairment in patients with solid tumors or multiple myeloma treated with zoledronic acid[J]. Int Journal of Clinical Pharmacology and Therapeutics, 2013, 51(4): 274-282.
[12] 朱琳琳, 张维华, 于风华.沂水县1585例药品不良反应回顾性分析[J].中国新药杂志, 2012(20): 2454-2460.
[13] 寿张轩, 金雪, 马晓蝶.我院521例药品不良反应分析[J].药物流行病学杂志, 2013(09): 486-489.
[14] 韩一萱. 14例唑来膦酸不良反应文献分析[J].中国执业药师, 2014(08): 3-6.
[15] 曹迪, 王兆斌.药品不良反应568例报告分析[J].淮海医药, 2015(01): 83-85.
[16] 赵淑慧. 静脉应用唑来膦酸注射液的临床安全性[J].实用药物与临床, 2014,17(12): 1601-1603.
[17] 李铮. 唑来膦酸注射液致流感样不良反应1例[J].中国新药杂志, 2011(09): 849-850.
[18] Hamdy R.Zoledronic acid: clinical utility and patient considerations in osteoporosis and low bone mass[J].Drug Design Development and Therapy, 2010, 4(22): 321-335.
[19] Dicuonzo G, Vincenzi B, Santini D,etal.Fever after zoledronic acid administration is due to increase in TNF-alpha and IL-6[J].J Interferon Cytokine Res, 2003, 23(11): 649-654.
[20] Evdokiou A, Labrinidis A, Bouralexis S,etal.Induction of cell death of human osteogenic sarcoma cells by zoledronic acid resembles anoikis[J].Bone, 2003, 33(2): 216-228.
[21] 唐跃琼, 高洁, 赵东宝,等.静脉注射唑来膦酸的安全性观察和临床护理体会[J].解放军护理杂志, 2013(24): 48-49.
[22] Sheedy K, Camara M, Camacho P.Comparison of the Efficacy, Adverse Effects, and Cost of Zoledronic Acid and Denosumab in the Treatment of Osteoporosis[J].Endocr Pract, 2015, 21(3): 275-279.
[23] 王颖轶, 管梅, 白春梅,等.唑来膦酸钠静脉注射导致低钙血症一例[J].中国肿瘤临床与康复, 2013(12): 1429-1430.
[25] 陈菊仙, 郭雪华, 阮宏,等.唑来膦酸并发的上颌骨坏死2例报告[J].口腔颌面外科杂志, 2012,22(05): 378-380.
[26] 历远. 唑来膦酸说明书中增加肾损害禁忌证[J].药物不良反应杂志, 2011,13(05): 337.
[27] Polyzos SA, Kountouras J, Anastasilakis AD,etal.Zoledronic acid-induced transient hepatotoxicity in a patient effectively treated for Paget′s disease of bone[J].Osteoporos Int, 2011, 22(1): 363-367.
[28] Kotian P, Boloor A, Sreenivasan S.Study of adverse effect profile of parenteral zoledronic acid in female patients with osteoporosis[J].J Clin Diagn Res, 2016, 10(1): 4-6.
The Characteristic Analysis of Adverse Reactions of Zoledronic Acid in 138 Cases
WangQiaoyu1,WangPing2,ZhangLin3,ChenMin4△,YanXiaoyan1△.
1.SchoolofPharmacy,ChengduMedicalCollege,Chengdu610500,China; 2.CollegeofPharmacy,WenzhouMedicalUniversity,Wenzhou325035,China; 3.DepartmentofClinicalPharmacyofShaoxingPeople′sHospital,ShaoxingHospitalofZhejiangUniversity,Shaoxing312000,China; 4.SchoolofPharmacy,SichuanProvincialPeople′sHospital,Chengdu610500,China
ObjectiveTo explore the characteristics of adverse reactions (ADR) of zoledronic acid and provide a reference for rational use of zoledronic acid. Methods138 ADR cases of zoledronic acid which were reported between 2012 and 2014 were collected from ADR Monitoring Center of Zhejiang Province. The statistical analysis was performed on the basis of genders, ages, original diseases, ADR involved organs or systems of ADR, clinical manifestations, causation and prognosis factors, etc. ResultsThe ages of those patients ranged from 23 to 97, and the patients over 60 accounted for 67.4%. The male-female ratio is 1∶1.9. As to the original diseases, the cases of solid tumor metastasis accounted for 50.7%, while the cases of osteoporosis took up 46.4%. The ADR cases caused by intravenous drip accounted for 94.2%, and the cases with fever accounted for 65.9% (91 cases). In addition, there were different degrees of damage in the involved organs or systems such as bones, muscle, skin and its appendages, and digestive system. ConclusionMost ADR cases of zoledronic acid were caused by the intravenous drip. Among the elderly patients, the female had higher incidence than the male. The high rate of adverse reactions was also common in patients with osteoporosis and solid tumor metastasis. The symptom of the adverse reaction was fever, which is often transient. The side effects were minor and the symptomatic treatment was effective, but there were also occasional reports of hypocalcemia, necrosis of mandible, function damage of kidney and liver. Therefore, the occurrences of adverse reactions should be reduced or avoided by paying more attention and enhancing the monitor of clinical drug use.
Zoledronic acid; Side effect; Monitoring data; Statistical analysis
10.3969/j.issn.1674-2257.2016.04.020
陈岷,E-mail: bear_min@163.com;颜晓燕,E-mail:171756035@qq.com
R95
A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160906.1547.002.html
