胰岛素和高糖对大鼠肝星状细胞增殖及NF-κB p65蛋白表达的影响*
2016-09-27邓存良
李 芹,王 刚,邓存良
西南医科大学附属医院 感染科(泸州 646000)
胰岛素和高糖对大鼠肝星状细胞增殖及NF-κB p65蛋白表达的影响*
李芹,王刚,邓存良△
西南医科大学附属医院 感染科(泸州646000)
目的探讨胰岛素和高糖对肝纤维化的影响。方法体外培养大鼠肝星状细胞(hepatic stellate cell,HSC),分为正常对照组、高渗透压对照组、高糖组、(低、中、高)胰岛素组、高糖+(低、中、高)胰岛素组。细胞培养24 h和48 h,用细胞计数试剂盒-8(CCK-8法)检测HSC的增殖情况,并计算细胞增殖率;细胞培养48 h,用免疫印迹法检测HSC NF-κB p65蛋白表达。结果培养24 h,各组HSC增殖率与正常对照组相比,差异无统计学意义(P>0.05);培养48 h,高、中胰岛素组HSC增殖率明显高于正常对照组和高渗透压对照组(P<0.05);高糖组、(低、中、高)胰岛素组、高糖+(低、中、高)胰岛素组HSC p65蛋白表达量均明显高于正常对照组及高渗透压对照组(P<0.05)。结论胰岛素能诱导体外培养的大鼠HSC增殖,其机制可能与p65蛋白表达增加有关。
胰岛素;高糖;肝纤维化;肝星状细胞;p65
糖尿病(diabetes mellitus,DM)是常见的以葡萄糖和脂肪代谢紊乱、血浆葡萄糖水平增高为特征的代谢性疾病,临床以2型糖尿病居多。糖尿病患者的生活质量与糖尿病的各种并发症密切相关。高血糖作为糖尿病的重要表现,被认为是引起糖尿病并发症的主要原因,其与肝纤维化的关系已成研究热点[1]。研究[2]表明,机体血糖含量与肝纤维化程度呈正相关,高血糖是非酒精性肝病的主要危险因素。因此,探索糖尿病性肝纤维化的发生途径具有重要临床意义。研究[3]发现,肝星状细胞(hepatic stellate cell,HSC)是导致肝纤维化的主要细胞,其激活、增殖被认为是肝纤维化发生、发展的关键环节。高血糖及高胰岛素血症是2型糖尿病的重要特点,为进一步研究高糖及高胰岛素与肝纤维化的关系,本实验以不同浓度胰岛素加高糖及单纯不同浓度胰岛素作用于HSC,检测NF-κB信号通路中的p65蛋白表达量变化,以探讨糖尿病性肝纤维化的发生机制。
1 材料与方法
1.1细胞株及实验试剂
大鼠HSC(泸州医学院附属医院中心实验室);细胞计数试剂盒-8(CCK-8)试剂盒(上海碧云天生物技术公司);DMEM培养基(美国GIBCO公司);小鼠抗大鼠β-actin单克隆抗体(美国CST 公司);兔抗大鼠NF-κB p65 单克隆抗体(美国Epitomics公司)。
1.2实验仪器
Model 680酶标仪、紫外凝胶成像仪、湿转仪和Mini-P3垂直电泳仪均为美国Bio-rad公司生产。
1.3实验分组
共9组,分别为:25 mmol/L甘露醇组作为高渗透压对照组;5.6 mmol/L葡萄糖组作为正常对照组;高糖组(25 mmol/L);(低、中、高)浓度胰岛素组:5.6 mmol/L葡萄糖+胰岛素(10-9、10-8、 10-6mol/L); 高糖(25 mmol/L)+(低、中、高)胰岛素组(10-9、10-8、 10-6mol/L)。
1.4细胞培养
复苏成功的大鼠HSC,正常糖DMEM培养基培养至70%融合,胰酶消化,培养基终止消化,接种于96孔平底培养板,培养 12 h,细胞同步于 G0期。弃上清,按组加干预物(7复孔/组)各100 μl,分别作用24、48 h。
1.5HSC吸光度值的测定
培养24、48 h后,去培养基,每孔加CCK-8液10 μL,以加培养液的空白孔调零,继续培养2.5 h。酶标仪测波长为450 nm的吸光度值(OD值),实验重复3次。绘制生长曲线图。计算各组细胞的增殖率。细胞增殖率=(1-实验组OD值/对照组OD值)×100%。
1.6HSC NF-κB p65蛋白量测定
分组培养48 h后,用冷PBS液冲洗培养瓶2次, 用细胞刮使细胞脱落,形成细胞悬液,计数细胞,6 500转/min离心15 min,离心半径5 cm,弃上清,留细胞沉淀,应用免疫印迹法测蛋白量,按细胞核蛋白与细胞浆蛋白抽提试剂盒说明书操作,提取细胞总蛋白,-70 ℃保存。按BCA蛋白浓度测定试剂盒说明书操作,配制成6.12 mL BCA工作液,将样品加入96孔板,加标准品稀释液到20 μL。各孔加200 μL BCA工作液,37 ℃静置30 min。选562 nm波长测OD值。据标准曲线(r>0.99)计算蛋白浓度。按SDS-PAGE试剂盒配制凝胶两块,蛋白电泳后,1块用于考马斯亮蓝染色,另1块用于转膜(湿转法)。将转印后的PVDF膜漂洗4次,封闭1 h。然后一抗孵育过夜,再二抗孵育1 h,再洗膜4次, 镊子夹膜的一角,下缘用吸水滤纸吸出膜上的TBST溶液,将PVDF膜置于滴有发光试剂的保鲜膜上,孵育5 min,将PVDF膜置于紫外凝胶成像仪,系统自动显影曝光,扫描,软件分析。
1.7统计学方法
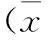
2 结果
2.1细胞增殖率
经两因素重复方差分析发现,细胞培养24 h(F=0.261,P=0.982)和48 h(F=0.192,P=0.695),高糖和胰岛素之间均无交互作用。培养24 h,各组HSC增殖率与正常对照组相比,差异无统计学意义(P>0.05);培养48 h,高、中胰岛素组HSC增殖率明显高于正常对照组和高渗透压对照组(P<0.05)(图1)。
2.2NF-κB p65蛋白表达量
培养48 h,经两因素重复方差分析发现,高糖和胰岛素之间无交互作用(F=2.044,P=0.937),高糖组、(低、中、高)胰岛素组、高糖+(低、中、高)胰岛素组HSC p65蛋白表达量均明显高于正常对照组及高渗透压对照组(P<0.05)(图2和图3)。
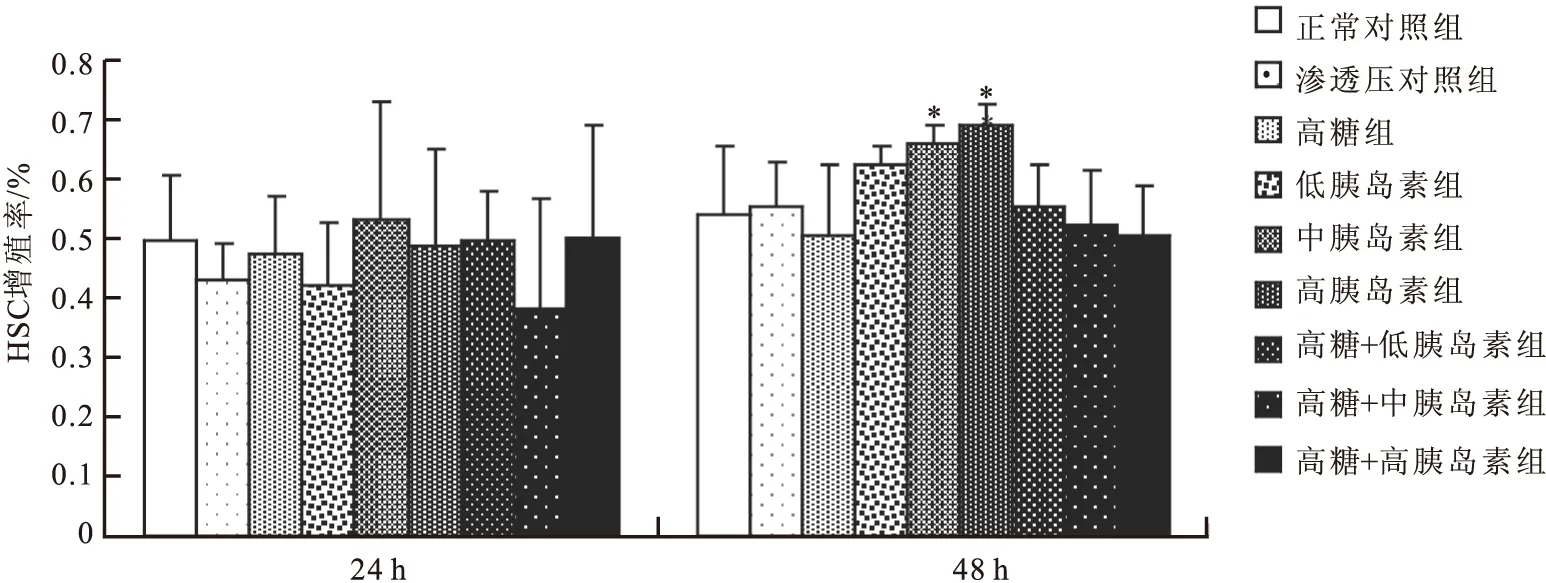
图1胰岛素和高糖对HSC增殖的影响
注:*与正常对照组和高渗透压组比较,P<0.05
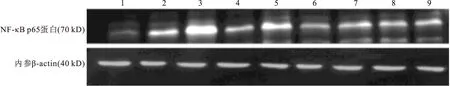
图2培养48 h HSC p65蛋白表达电泳图
注:1:正常对照组;2:高糖组;3:高胰岛素组;4:高糖+高胰岛素组;5:中胰岛素组;6:高糖+中胰岛素组;7:低胰岛素组;8:高糖+低胰岛素组;9:高渗透压对照组
图3培养48 h HSC p65蛋白表达相对量
注:*与正常对照组和高渗透压组比较,P<0.05
3 讨论
我国糖尿病患病率呈逐年递增趋势,目前患病人数已跃居世界第一[4]。与糖尿病相关的各种并发症的患病人数也相应增加,特别是糖尿病性肝病逐渐引起临床重视。糖尿病以2型糖尿病居多,多数患者存在胰岛素抵抗,高糖及高胰岛素血症在糖尿病并发症的发生发展中具重要作用。研究[5-6]表明,高血糖能促进肝纤维化发生,加重肝纤维化程度,且患者血糖含量与肝纤维化程度呈正相关,高糖是非酒精性肝病的重要危险因素。但本研究发现,高糖对HSC增殖无明显影响,而胰岛素可促进HSC增殖。
有关糖尿病致肝纤维化的机制,目前尚不清楚,相关研究主要围绕HSC活化和增殖进行。研究[7-8]表明,HSC在肝纤维化的发生发展中起关键作用。 NF-κB具有多向性调节作用,可阻止HSC凋亡和促进HSC增殖,从而加速炎症反应,促进肝纤维化发展。 NF-κB有多种形式,但发挥主要作用的是由p50和p65组成的异源二聚体,故本研究选择p65蛋白进行观察。在2型糖尿病和肝源性糖尿病中大多存在胰岛素抵抗,高血糖和高胰岛素血症成为糖尿病性肝病的重要特点[9]。胰岛素对HSC生长的影响已有少量报道,常远鸿等[10]研究发现,胰岛素能促进HSC增殖,故本研究做了高糖加高胰岛素作用于HSC的研究。本研究发现,培养48 h,高糖组、(低、中、高)胰岛素组、高糖+(低、中、高)胰岛素组HSC p65蛋白表达量均明显高于正常对照组及高渗透压对照组(P<0.05),表明高糖与胰岛素均
能刺激HSC p65蛋白表达增加,HSC的增殖可能与p65蛋白表达增加有关。本研究还表明,胰岛素能激活HSC,且这种激活呈浓度依赖性。
综上所述,本研究发现,高糖对HSC增殖无明显影响,而胰岛素可促进HSC增殖,高糖与胰岛素均能促进HSC p65蛋白表达,HSC的增殖可能与p65蛋白表达增加有关。
[1]Li Y, Xie H, Musha H,etal. The Risk Factor Analysis for Type 2 Diabetes Mellitus Patients with Nonalcoholic Fatty Liver Disease and Positive Correlation with Serum Uric Acid[J]. Cell Biochem Biophys, 2015, 72(3):643-647.
[2]Yang JH, Kim SC, Kim KM,etal. Isorhamnetin attenuates liver fibrosis by inhibiting TGF-β/Smad signaling and relieving oxidative stress[J]. Eur J Pharmacol, 2016,783:92-102.
[3]马志刚, 陈兰,詹灵凌, 等. Wnt信号通路调控肝星状细胞活化及增殖在肝纤维化治疗中的研究进展[J].世界华人消化杂志,2014, 22(21):3048-3055.
[4]廖涌. 中国糖尿病的流行病学现状及展望[J]. 重庆医科大学学报,2015, 40(7):1042-1044.
[5]刘银利, 吴涛,毛美绒, 等. 高血糖对大鼠肝纤维化及肝星状细胞活化的影响[J]. 胃肠病学和肝病学杂志,2013, 22(1):6-9.
[6]Tang LX,He RH,Yang G,etal. Asiatic acid inhibits liver fibrosis by blocking TGF-beta / Smad signaling in vivo and in vitro[J]. PLoS One,2012,7(2) : e31350.
[7]张琴, 黄涛,卓强, 等. 肝纤维化中MAPK信号转导通路对肝星状细胞活性的影响[J].成都医学院学报,2014, 9(4):493-496.
[8]Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver[J]. Physiological reviews, 2008, 88(1): 125-172.
[9]García-Compeán D, González-González JA, Lavalle-González FJ,etal. Current Concepts in Diabetes Mellitus and Chronic Liver Disease: Clinical Outcomes, Hepatitis C Virus Association, and Therapy[J]. Dig Dis Sci, 2016, 61(2):371-380.
[10] 常远鸿, 苌新明,任莉.高胰岛素对肝星状细胞HSC-T6增殖及MMP-2、TIMP-1、TIMP-2 mRNA转录的影响[J].陕西医学杂志,2012, 41(5): 531-534.
The Effect of Insulin and High Glucose on Proliferation of Hepatic Stellate Cell in Rats and Expression of Protein p65
LiQin,WangGang,DengCunLiang△.
DepartmentofInfectiousDiseases,TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China
ObjectiveTo investigate the effect of insulin and high glucose on hepatic fibrosis. Methods Hepatic stellate cells (HSC) of rats were cultured in vitro and divided into five groups including the normal control group, the hyperosmosis control group, the high glucose group, the insulin groups of low, intermediate, and high doses respectively, and the mixed groups of high glucose and insulin of low, intermediate, and high doses respectively. Cell counting kit CCK-8 was applied to measure the proliferation of HSC after the cells were cultured for 24 and 48 hours respectively and count their proliferation rate. Western blotting was used to detect the HSC protein p65 in each group after the cells were cultured for 48 hours. ResultsThe proliferation rate of HSC in the normal control group after 24 hours was not significantly different from that in the other groups respectively (P>0.05). The proliferation rates in the insulin groups of high and intermediate doses were significantly higher after 48 hours than in the normal control group and the hyperosmosis control group (P<0.05). The expression levels of HSC p65 protein in the high glucose group, the insulin groups of low, intermediate, and high doses respectively, and the mixed groups of high glucose and insulin of low, intermediate, and high doses respectively were significantly higher than those in the normal control group and the hyperosmosis control group (P<0.05). ConclusionInsulin can induce the HSC proliferation in rats in vitro, which may be correlated with the expression increase of Protein p65.
Insulin; High glucose; Hepatic fibrosis; Hepatic stellate cell; p65
10.3969/j.issn.1674-2257.2016.04.003
四川省科技厅资助项目(No:2014TSX-0036)
邓存良, E-mail:dengcunl64@vip.sina.com
R587.1
A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.r.20160825.0835.028.html
