响应面法优化合浦珠母贝糖胺聚糖提取工艺
2016-09-26周小双王锦旭杨贤庆林婉玲魏涯
周小双,王锦旭,杨贤庆*,林婉玲,魏涯
1(中国水产科学研究院 南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州,510300) 2(上海海洋大学食品学院,上海,201306)
响应面法优化合浦珠母贝糖胺聚糖提取工艺
周小双1, 2,王锦旭1,杨贤庆1*,林婉玲1,魏涯1
1(中国水产科学研究院 南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州,510300) 2(上海海洋大学食品学院,上海,201306)
以合浦珠母贝全脏器为原材料,经解冻匀浆和热水浸提后,采用枯草杆菌中性蛋白酶和胰蛋白酶双酶酶解,sevage法除蛋白2次,清液醇沉得糖胺聚糖粗制品(GAG),粗制品经DEAE-52离子交换柱纯化后得精制品。在单因素试验基础上,以粗制品得率与糖胺聚糖含量的乘积Y/(×10-4)为响应值,加酶量、液料比、酶解时间为影响因子,利用响应面试验分析法优化GAG的粗提工艺,得最佳提取工艺:加酶量为1.14%(枯草杆菌中性蛋白酶与胰酶质量的比为7∶8);液料比为3∶1(mL∶g)酶解时间为4.1 h。在此条件下,糖胺聚糖粗制品得率为0.518%,糖胺聚糖含量为10.9%,经DEAE-52柱纯化后的糖胺聚糖含量为89%。
合浦珠母贝;糖胺聚糖;响应面法
合浦珠母贝(Pinctadamartensii),又称马氏珠母贝,双壳纲,珍珠贝科。1965年我国成功开展其人工育苗,自此海水珍珠养殖业迅猛发展[1],在我国南方沿海海域均有分布。近几年对于合浦珠母贝的研究主要是遗传育种、珍珠层结构、插核育珠等[2],而针对软体部贝肉的研究不多。目前,合浦珠母贝贝肉年产量达2 000 t以上,大多用作食材或饲料,利用率不高,亟待高值化开发利用,具有良好的应用前景。
糖胺聚糖(glycosaminoglycans,GAGs),又名氨基多糖、酸性黏多糖,是蛋白聚糖整体分子结构中的“含糖片段”,其二糖单位为氨基己糖和己糖醛酸。现今确定的糖胺聚糖结构共7种,即硫酸软骨素C (CSC)、硫酸软骨素A (CSA)、透明质酸(HA)、硫酸皮肤素(DS)、硫酸角质素(KS)、肝素(HP)及硫酸乙酰肝素(HS)。研究表明,海洋贝类肉中糖胺聚糖具有多种生物活性,如增强免疫[3]、保湿作用[4]、抗肿瘤[5]、降血脂[6]、抗氧化[7]等活性,已有学者对翡翠贻贝[3]、近江牡蛎[6]、波纹巴非蛤[8]、四角蛤蜊[9]等多种贝类糖胺聚糖的分离纯化和理化性质进行了探讨。
响应面法是一种确定最佳提取条件的简单有效方法,计算机能够生成非线性二次式模型[10-11],包括中心复合设计和一个二阶多项式方程,来确定不同变量对响应值影响的显著性[12]。本文在前期研究的基础上[13],利用响应面法优化合浦珠母贝肉中糖胺聚糖提取的工艺条件。
1 材料与方法
1.1原材料与试剂
合浦珠母贝贝肉全脏器,购自广东省徐闻县,贝肉取出后-18 ℃冷冻备用。
枯草杆菌中性蛋白酶(酶活力100 U/mg)、胰蛋白酶(酶活力250 U/mg)、木瓜蛋白酶(酶活力800 U/mg),购自广州齐云生物技术有限公司;肝素钠(效价150 U/mg)、1,9-二甲基亚甲基蓝,购自Sigma;硫酸软骨素钠,购自中国食品药品检定研究院;甘氨酸、NaCl、NaAc、三氯甲烷、正丁醇、无水乙醇均为分析纯。
1.2仪器设备
高速组织捣碎机;小型切向流超滤系统,美国MILLIPORE;pH计,梅特勒-托利多仪器(上海)公司;Milli-Q超纯水机,美国MILLIPORE;J26XP高速离心机,美国贝克曼库特;紫外可见分光光度计,日本SHIMADZU;Alpha1-4冷冻干燥机,德国Christ;隔膜真空泵(GM- 0.33B);TLJ-2型定时增力电动搅拌器,姜堰市天力医疗器械有限公司;HWS24电热恒温水浴锅,上海一恒科学仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;CBS-B程控多功能全自动部份收集器和BT-100SD定时电脑泵,上海青浦沪西仪器厂。
1.3实验方法
1.3.1粗提工艺
合浦珠母贝全脏器→解冻→加水匀浆→热水浸提→酶解→煮沸灭酶→10 000 r/min离心10 min,sevage法除蛋白→清液调pH值至7.0,体积分数65%乙醇4 ℃醇沉24 h→离心分离沉淀→无水乙醇和丙酮洗涤→冷冻干燥得GAG粗制品
1.3.2含量测定
糖胺聚糖的含量测定采用1,9-二甲基亚甲基蓝法[14]。
1.3.3酶量比例选择
以合浦珠母贝全脏器为原料,经解冻匀浆、热水浸提后分别按质量分数0.1%、0.3%、0.5%、0.7%、0.9%枯草杆菌中性蛋白酶和0.2%、0.4%、0.6%、0.8%、1.0%胰蛋白酶的比例,在50 ℃、pH 7.5~7.7的条件下分别进行4 h单酶水解和双酶酶解,酶解液经sevage法除蛋白两次后醇沉的GAG粗制品,以粗制品得率与糖胺聚糖含量的乘积Y/(×10-4)作为指标,选择出最佳酶量比例。
1.3.4合浦珠母贝肉中糖胺聚糖提取工艺的单因素试验
选取对粗制品得率与糖胺聚糖含量有影响的3个因素,即加酶量、液料比、酶解时间,按照1.3.1提取合浦珠母贝肉中糖胺聚糖,以粗制品得率与糖胺聚糖含量的乘积Y/(×10-4)作为指标进行考察。
1.3.5响应面法优化合浦珠母贝肉中糖胺聚糖提取工艺
综合单因素试验结果,根据Box-Benhken的中心组合试验设计原理,本实验选取加酶量A、液料比B、酶解时间C作为3因素进行编码,糖胺聚糖粗制品得率与糖胺聚糖含量的乘积Y/(×10-4)为响应值,实验因子和水平设计如表1。

表1 响应面分析因子及水平表
1.3.6精制工艺
取1.0 g GAG粗制品溶解于250 mL NaAc缓冲溶液(pH 6.0)后,上样至DEAE-52离子交换色谱柱,采用0.5 mol/L NaAc缓冲液(pH 6.0)和1.5 mol/L NaCl各100 mL分别进行洗脱分离,以5 mL/管收集洗脱液后,以1,9-二甲基亚甲基蓝法测定各管样品中糖胺聚糖的含量,合并相同组分,将不同峰段组分分别进行超滤除盐、冻干后储存备用。
2 结果与分析
2.1酶量比例选择
如图1和图2所示,经单酶水解的结果表明,糖胺聚糖粗制品得率与含量的乘积Y随加酶量的增加提高显著,但当加酶量高于0.7%枯草杆菌蛋白酶和0.8%胰蛋白酶时有下降趋势,故枯草杆菌蛋白酶和胰蛋白酶的最适加酶量分别为0.7%和0.8%。

图1 枯草杆菌中性蛋白酶水解结果Fig.1 Effect of enzyme dosage on the enzymatic hydrolysis by neutral protease of Bacillus subtilis

图2 胰蛋白酶酶解结果Fig.2 Effect of enzyme dosage on the enzymatic hydrolysis by pancreatin
随后进一步确定枯草杆菌中性蛋白酶与胰蛋白酶的双酶最佳比例,结果见表2。经综合考虑粗制品得率、GAG含量及其乘积Y/(×10-4)3项指标,确定最佳酶量比例为7∶8(g∶g)。
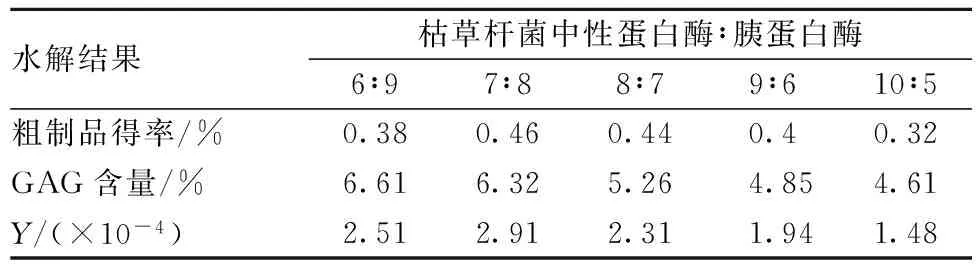
表2 枯草杆菌中性蛋白酶与胰蛋白酶不同酶比例水解结果比较
注:酶解条件为总加酶量1.5%、pH 7.5~7.7、50 ℃酶解4 h。
2.2单因素试验及其分析
2.2.1酶解时间对糖胺聚糖粗制品得率与含量的影响
取50 g合浦珠母贝全脏器匀浆后,加入150 mL蒸馏水55 ℃热水浸提5 h后,加入质量分数1.5%的双酶(枯草杆菌中性蛋白酶与胰酶的质量比为7∶8),调节pH值至7.5~7.7,在50 ℃下分别酶解1、2、3、4、5 h。酶解后煮沸灭酶,离心去除杂质,sevage法除蛋白2次,调节pH值至7.0后加入无水乙醇至乙醇体积分数65%醇沉12 h,离心得沉淀,冷冻干燥后得糖胺聚糖粗制品,以Y/(×10-4)为指标。结果如图3所示,可知Y值随酶解时间的增加呈先增后减的趋势,在4 h处达最大值,故最适酶解时间为4 h。

图3 酶解时间对糖胺聚糖提取的影响Fig.3 Effect of hydrolysis time on the extraction yield of glycosaminoglycans
2.2.2液料比对糖胺聚糖粗制品得率与含量的影响
取50 g合浦珠母贝全脏器匀浆后,分别按1∶1、2∶1、3∶1、4∶1、5∶1(mL∶g)的液料比加入蒸馏水55 ℃热水浸提5 h后,加入质量分数1.5%的双酶(枯草杆菌中性蛋白酶与胰酶的质量比为7∶8),调节pH值至7.5~7.7,在50 ℃下分别酶解4 h。酶解后煮沸灭酶,离心去除杂质,sevage法除蛋白两次,调节pH值至7.0后加入无水乙醇至乙醇体积分数65%醇沉12 h,离心得沉淀,冷冻干燥后得糖胺聚糖粗制品,以Y/(×10-4)为指标。结果如图4所示,随着液料比的增大,Y值快速升高,当液料比为3∶1时Y值达最大值,而后随着液料比的增大缓慢减小。故选取液料比为3∶1。

图4 液料比对糖胺聚糖提取的影响Fig.4 Effect of liquid-solid ratio on the extraction yield of glycosaminoglycans
2.2.3加酶量对糖胺聚糖粗制品得率与含量的影响
取50 g合浦珠母贝全脏器匀浆后,分别按3∶1的液料比加入150 mL蒸馏水55 ℃热水浸提5 h后,分别加入质量分数0.9%、1.2%、1.5%、1.8%、2.1%的双酶(枯草杆菌中性蛋白酶与胰酶的质量比为7∶8),调节pH值至7.5~7.7,在50 ℃下分别酶解4 h。酶解后煮沸灭酶,离心去除杂质,sevage法除蛋白2次,调节pH值至7.0后加入无水乙醇至乙醇体积分数65%醇沉12 h,离心得沉淀,冷冻干燥后得糖胺聚糖粗制品,以Y/(×10-4)为指标。结果如图5所示,可知当加酶量为1.2%时Y值达最大值,而后随着加酶量的增大Y值减小。

图5 加酶量对糖胺聚糖提取的影响Fig.5 Effect of enzyme dosage on the extraction yield of glycosaminoglycans
2.3响应面试验结果与分析
在单因素试验的基础上,根据Box-Benhken的中心组合试验设计原理,选取加酶量A、液料比B、酶解时间C作为三因素,并以糖胺聚糖粗制品得率与糖胺聚糖含量的乘积Y/(×10-4)为响应值,试验方案及结果见表3。
运用SPSS软件对上述结果进行整理和数据分析,回归分析结果见表4。可以看出加酶量对合浦珠母贝肉中糖胺聚糖的提取具有极显著的影响,液料比和酶解时间对其也有显著影响。试验数据经回归拟合得回归方程:
Y=5.65-0.34A-0.12×B+0.11C+0.47AB-0.23×AC-0.060BC-0.93A2-2.07B2-0.94C2
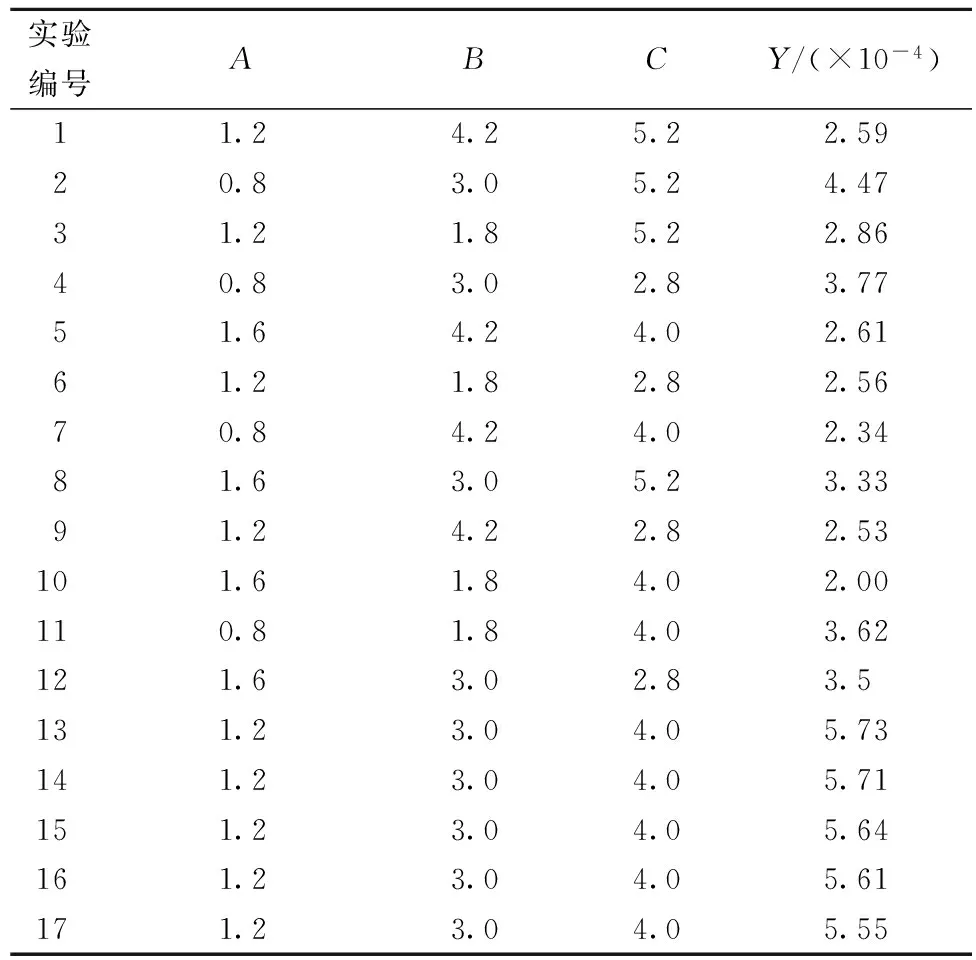
表3 实验方案与结果

表4 方差分析
响应面模型的好坏要根据系数R2和方差分析来判断[15]。方差分析结果中,模型的P值小于0.000 1,具有极显著影响,表示该模型有效。失拟项是描述合适模型附近数据的变动情况,失拟项的值不显著(P=0.420 8),说明拟合的模型方程效果比较好,这种实验方案是可行的[16]。该试验R2=0.998 6表示水平较好,说明该模型拟合较好。同时根据F值可以判断出3个因素对合浦珠母贝糖胺聚糖提取影响的排序为:加酶量>液料比>酶解时间。
根据回归分析和回归方程拟合可绘制出相应等高线和响应面分析图,响应面三维图形是响应值对试验因子所构成的三维空间的曲面图,从图6~图8中能够直观的看出各因素相互作用对响应值的影响。由于响应面图是三维图形,所以只能固定其中一个因素,表达其中2个因素的函数。响应面3D图形的坡度及等高线的形状可以反应2因子之间交互作用强弱,3D图形的坡度越陡,等高线形状为椭圆形则表示两因素交互作用显著。
图6表示酶解时间与加酶量交互作用对糖胺聚糖提取的影响,随着酶解时间和加酶量的增加,Y值缓慢增加后逐渐减小。图7表示液料比与加酶量交互作用对糖胺聚糖提取的影响作用,Y值随着液料比和加酶量的增加呈先增后减的趋势。图8表示液料比与酶解时间交互作用对糖胺聚糖提取的影响,随着液料比和酶解时间的增加,Y值同样呈先增后减的趋势。经对比,从图中可以看出加酶量与液料比的交互作用最为显著。

图6 酶解时间与加酶量交互作用对糖胺聚糖提取影响的等高线和响应面图Fig.6 Response surface and contour plots for the effect of enzyme dosage and hydrolysis time on the extraction yield of glycosaminoglycans

图7 液料比与加酶量交互作用对糖胺聚糖提取影响的等高线和响应面图Fig.7 Response surface and contour plots for the effect of liquid-solid ratio and enzyme dosage on the extraction yield of glycosaminoglycans

图8 液料比与酶解时间交互作用对糖胺聚糖提取影响的等高线和响应面图Fig.8 Response surface and contour plots for the effect of liquid-solid ratio and hydrolysis time on the extraction yield of glycosaminoglycans
以Y值极大值为指标,经Design-Expert 8.0软件分析可得最佳工艺条件为:加酶量1.12%(枯草杆菌中性蛋白酶与胰蛋白酶的质量比为7∶8)、液料比2.93∶1、酶解时间4.1 h,相应的响应面二次模型预测Y最大值为5.69×10-4。为了验证本实验响应面法的可行性,采用最佳提取工艺进行验证实验。考虑到实际操作问题,选取最佳提取工艺为:加酶量1.14%(枯草杆菌中性蛋白酶与胰酶的质量比为7∶8)、液料比3∶1、酶解时间4.1 h。重复3次实验得糖胺聚糖粗制品得率平均值为0.518%,糖胺聚糖平均含量为10.9%,故3次平行实验得平均Y值为5.23×10-4,与理论值相差不大,说明由响应面法得出的糖胺聚糖最佳提取工艺是可行的。
2.4粗制品精制结果与分析
糖胺聚糖粗制品经DEAE-52离子交换柱纯化的洗脱曲线如图9所示,以5 mL/管收集洗脱液。1~20管收集0.5 mol/L NaAc缓冲液(pH 6.0)洗脱液,经1,9-二甲基亚甲基蓝法测定无糖胺聚糖反应,可淋洗除去未吸附于离子交换填料上的杂质;21~100管收集1.5 mol/L NaCl溶液洗脱液,绘制洗脱曲线可见呈单峰,经合并相同组分测定后可得糖胺聚糖含量为89%,达到精制糖胺聚糖粗品的目的。

图9 糖胺聚糖粗制品经DEAE-52离子交换柱纯化的洗脱曲线Fig.9 Elution curve of GAG by DEAE-52 ion exchange column chromatography
3 结论
(1)本实验通过响应面法建立3个影响因素(加酶量、液料比、酶解时间)与响应值Y/(×10-4)(糖胺聚糖粗制品得率与糖胺聚糖含量的乘积)相互作用的模型,该模型有效反映出糖胺聚糖提取的最佳工艺为:加酶量1.14%(枯草杆菌中性蛋白酶与胰酶的质量比为7∶8)、液料比3∶1(mL∶g)、酶解时间4.1 h。在此条件下进行重复试验,合浦珠母贝全脏器中糖胺聚糖的粗制品得率为0.518%,糖胺聚糖含量为10.9%。
(2)经实验对比等电点与sevage法2种除蛋白方法,后者的效果更好,可能因为在等电点除蛋白时的pH变化大而导致糖胺聚糖的结构破坏从而降低了糖胺聚糖的提取率。
(3)经实验摸索,醇沉的最佳pH值为7.0,溶液呈酸性或碱性均不利于糖胺聚糖的析出。
(4)使用DEAE-52离子交换柱纯化糖胺聚糖,可以有效去除残留蛋白、色素等杂质,提高糖胺聚糖的纯度,经DEAE-52柱纯化后糖胺聚糖含量为89%。
[1]汤健, 刘文广, 林坚士, 等. 9个合浦珠母贝家系的中期生长性状评估[J]. 南方水产科学, 2011, 7(5): 30-36.
[2]秦培文, 纪丽丽, 范润珍,等.黑壳病合浦珠母贝贝肉微量元素及挥发性成分分析[J]. 南方水产科学, 2010, 6(2): 35-40.
[3]刘倩. 近江牡蛎糖胺聚糖免疫调节作用及体外抗肿瘤活性的研究[D]. 湛江: 广东海洋大学, 2012.
[4]卢传亮, 郑上华, 童银洪. 合浦珠母贝多糖提取及其保湿性研究[J]. 现代农业科技, 2013(21): 254-256.
[5]WU Hong-mian, FAN Xiu-ping,HU Xue-qiong, et al. Antitumor activity of glycosaminoglycan fromCrassostrearivularis[J]. Modern Food Science and Technology, 2014, 30(6): 18-23.
[6]李孟婕. 翡翠贻贝糖胺聚糖降血脂作用的研究[D]. 湛江: 广东海洋大学, 2011.
[7]李孟婕, 范秀萍, 吴红棉, 等. 翡翠贻贝糖胺聚糖的体外抗氧化活性研究[J]. 现代食品科技, 2011,27(7):759-762.
[8]董晓静. 波纹巴非蛤糖胺聚糖抗氧化与降血脂活性研究[D]. 湛江: 广东海洋大学, 2010.
[9]孙晓朋. 四角蛤蜊糖胺聚糖的提取、纯化及生理活性研究[D]. 天津: 天津科技大学, 2011.
[10]NATARAJAN U, PERIYANAN P, YANG S H. Multiple-response optimization for micro-endmilling process using response surface methodology [J]. International Journal of Advanced Manufacturing Technology, 2011, 56(1-4):177-185.
[11]MUSTAFA G, BABOOTA S, ALI J, et al. Design expert-supported development and validation of high-performance thin-layer chromatographic stability-indicating (HPTLC) method: an application in quantitative analysis of ropinirole in the bulk drug and in marketed dosage forms [J]. Journal of Pharmaceutical Innovation, 2012, 7(2):47-55.
[12]SINGH J, SHARMA A. Application of response surface methodology to the modeling of cellulase purification by solvent extraction [J]. Advances in Bioscience and Biotechnology, 2012, 3(4): 408-416.
[13]孙晓朋, 袁春营, 崔青曼, 等. 4种天津近海产贝类牛磺酸和糖胺聚糖的粗提及含量比 较[J]. 水生态学杂志, 2010, 3(2): 80-83.
[14]刘义. 梅花参糖胺聚糖的提取、分离纯化及结构研究[D]. 无锡: 江南大学, 2005.
[15]WANG Ling, LIU Yun. Optimization of solvent extraction conditions for total carotenoids in rapeseed using response surface methodology [J]. Natural Science, 2009, 1(1): 23-29.
[16]ZAINAL S, NADZIRAH K Z, NORIHAM A, et al. Optimisation of beef tenderisation treated with bromelain using response surface methodology (RSM) [J]. Agricultural Sciences, 2013, 4(5B): 65-72.
Optimization of extraction process for glycosaminoglycans fromPinctadamartensiiby response surface methodology
ZHOU Xiao-shuang1, 2, WANG Jin-xu1, YANG Xian-qing1*,LIN Wan-ling1, WEI Ya1
1(South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, National R&D Center for Aquatic Product Processing, Guangzhou 510300, China) 2(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Glycosaminoglycans were extracted from the whole viscera ofPinctadamartensiivia enzymatic hydrolysis by pancreatin and neutral protease ofBacillussubtilis. Enzymatic hydrolysate was deproteinized twice by sevage and subsequent ethanol precipitation. The pure product of glycosaminoglycans was separated through DEAE-52 column. The product as Y/(×10-4) of the yield and the content of glycosaminoglycans was the response value. Liquid-solid ratio, enzyme dosage and enzymolysis time were impact factors. The optimum extraction conditions for glycosaminoglycans were selected by response surface. The optimal enzyme dosage were of 1.14% (the ratio of neutral protease and pancreatin at 7∶8), liquid-solid ratio 3∶1 and enzymolysis time 4.1 h. Under these conditions, the yield and content of glycosaminoglycans were of 0.518%, 10.9%, with further purification at the content of 89% through DEAE-52 column. It is feasible to optimize extraction of glycosaminoglycans fromPinctadamartensiiby response surface method, which will be great help to the research in the future.
Pinctadamartensii; glycosaminoglycans; response surface methodology
10.13995/j.cnki.11-1802/ts.201601043
硕士研究生(杨贤庆研究员为通讯作者,E-mail:yxqgd@163.com)。
广东省公益研究与能力建设专项(2014A020217009);广东省海洋渔业科技与产业发展专项科技攻关与研发项目(A201501C08);中央级公益性科研院所基本科研业务费专项资金项目(2014TS25);农业部水产品加工重点实验室开放基金项目(NYBJG201408)资助
2015-05-29,改回日期:2015-08-27
