不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响
2016-09-26孙丹黄士淇蔡圣宝
孙丹,黄士淇,蔡圣宝
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响
孙丹,黄士淇,蔡圣宝*
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
已有研究表明,加工方法会影响食品中的营养及功能成分。苦荞被认为是一种具有健康促进作用的全谷物,含有多种功能成分,尤其富含酚类物质。然而,目前关于加工方式对苦荞酚类物质和抗氧化性的影响却鲜有报道。因此,文中研究了不同处理方式对苦荞中总酚总黄酮含量以及抗氧化性的影响,同时利用HPLC分析了苦荞中最主要黄酮芦丁的变化。结果表明:苦荞经过浸泡后可以显著提高总酚、总黄酮、芦丁含量以及抗氧化性(P<0.05),而经高温或者高压处理不仅会显著降低苦荞的总酚、总黄酮和芦丁含量(P<0.05),同时其抗氧化性也显著降低(P<0.05)。另外,通过对不同处理苦荞抗氧化性与总酚总黄酮含量相关性分析发现,苦荞提取物的总酚总黄酮是其主要的抗氧化性物质。
苦荞;抗氧化性;芦丁;相关性
流行病学研究表明,全谷物膳食可以降低多种慢性疾病的发病率,如糖尿病、肥胖和心血管疾病[1]。因此,食品科学家及营养学家建议人们日常饮食要摄入足够的全谷物以便预防这些慢性疾病,例如,在美国、丹麦和瑞典,全谷物的推荐剂量分别为48, 63~75和70~90 g/d[2]。根据美国国际谷物化学家学会对全谷物的定义,小麦、大米以及玉米是人类饮食中主要的全谷物,另外,在世界的一些地方,燕麦、大麦、黑麦以及荞麦也被用来作为全谷物食用[3]。
大量研究表明全谷物中多种植物化学物质具有改善健康的作用,例如,酚类物质、VE、植物甾醇和膳食纤维[3]。在这些植物化学物质中,具有多种生物活性的酚类物质(一类含有苯环,并且苯环上具有一个或者多个羟基基团的化合物)越来越受到人们的关注[4-5]。之前大量研究表明,食用富含酚类物质的植物性食物与降低慢性退行性疾病之间存在着密切的关系[6-7]。但是,研究发现蔬菜和豆类中的酚类物质在蒸煮和加工过程中不稳定,容易降解[7-8]。因此,在评价食品中这些酚类物质的健康益处时,需要考虑不同加工方法对食物中酚类物质的影响。全谷物或者全谷物产品也都是需要经过加工后才能被食用,如最常见的蒸煮。但是目前关于不同加工方式对全谷物酚类物质影响方面的研究却很少。
荞麦是一种富含酚类物质的假谷物,具有多种生理功能。尽管荞麦有很多品种,但是只有2种荞麦品种被用作食物,即苦荞麦(FagopyrumtataricumGaertn.)和普通荞麦(FagopyrumesculentumMoench)。据报道,苦荞麦中总黄酮特别是芦丁比普通荞麦高出很多[9-11]。虽然荞麦对健康的潜在益处已经被广泛研究,并且其高黄酮含量被认为是荞麦具有多种生物活性的物质基础,但是不同加工方法对荞麦的酚类物质含量及生物活性的影响却未见研究报道。因此,本文研究了不同处理对苦荞中总酚含量、总黄酮含量及抗氧化性的影响。
1 材料与方法
1.1材料
苦荞 (F.tataricumGaertn.), 购自昆明市当地食品市场;DPPH、TPTZ、ABTS、 芦丁、没食子酸,购自Sigma-Aldrich公司;色谱乙腈和Folin-Ciocalteu,购自Merck公司;其他试剂,均为能获得的最高纯度。
1.2苦荞的处理
苦荞的不同处理方式:(1)普通蒸煮组:将100 g苦荞洗净,加入500 mL纯净水后煮沸15 min。(2)浸泡组:苦荞在室温条件浸泡8 h。(3)蒸煮加高压处理组:经过普通蒸煮后的苦荞再经过100 kPa、121 ℃处理15 min。(4)浸泡加高压处理组:经过浸泡后的苦荞再经过100 kPa、121 ℃处理15 min。(5)对照组,该组苦荞未作任何处理。所有处理苦荞和未处理苦荞都经过冻干后用于后续实验。
1.3提取物的制备
所有冻干的原料(处理和未处理的苦荞)粉碎后用正己烷脱脂。经过脱脂后的原料用体积分数80%甲醇在40 ℃条件下超声提取30 min。经过滤后的残渣用同样的条件再提取1次。合并滤液后,在40 ℃下减压旋蒸,最后冻干得到各提取物。
1.4总酚含量测定
采用稍加修改的Folin-Ciocalteu法测定每个样品的总酚(total phenolics content, TPC)含量[12]。取1 mL经过适当稀释的样品加入到Folin-Ciocalteu试剂中并摇匀。然后,再分别加入1.5 mL的质量分数20% Na2CO3水溶液和7.5 mL 蒸馏水。混合溶液在70 ℃水浴条件下孵育10 min,等冷却到室温后在765 nm下测定其吸光值。以没食子酸做标准曲线,每个样品中TPC的含量表示为mmoL没食子酸等价物(GAE) / kg干样品。
1.5总黄酮含量测定
样品中总黄酮测定采用文献报道的方法并稍加修改[13-14]。取1 mL稀释样品和0.3 mL质量分数5% NaNO2分别加入到4 mL的蒸馏水中,然后再分别加入0.3 mL质量分数10% AlCl3和2 mL NaOH (1 mol/L),最后用蒸馏水补足到10 mL,反应液在室温条件下静置30 min。反应结束后,在510 nm下测定反应液的吸光值。以芦丁作为标准曲线,所有样品中的总黄酮含量表示为mmoL芦丁/ kg干样品。
1.6样品中酚类物质的HPLC分析
采用配有UV检测器的安捷伦1260型HPLC来对不同处理苦荞中酚类物质的含量及稳定性进行分析。样品酚类物质在配有保护柱的Sepax-C18分析柱(250 mm×4.6 mm, 5 μm) 上进行,柱温为30 ℃。采用0.1%甲酸(A)和乙腈(B)作为流动相,流速为1 mL/min,梯度为: 0~5 min,10% B;5~45 min,10~60% B;45~46 min,10% B;以及46~60 min,10% B。样品经过0.45 μm 滤膜过滤后进样,进样量为20 μL,检测波长为280 nm。根据标准品的保留时间和浓度对样品中的相应酚类物质进行初步的定性和定量分析。
1.7抗氧化性的测定
采用DPPH自由基清除法、ABTS自由基清除法以及FRAP法分别评价各样品的抗氧化性,并进行比较分析。
1.7.1DPPH自由基清除能力
DPPH自由基清除法参照之前报道[15-16]。具体为:将0.5 mL 样品和2.0 mL的0.1 mmol/L DPPH试剂混合均匀。然后,混合反应液在室温条件下避光放置30 min,在517 nm下测定其吸光值AS。将0.5 mL 甲醇和2.0 mL DPPH 试剂的混合溶液吸光值AC作为空白对照组。采用以下公式计算样品的DPPH自由基清除能力:
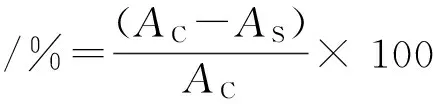
1.7.2ABTS自由基清除能力
每个样品的ABTS自由基清除能力测定方法参照之前报道[17]。首先,配制ABTS 自由基母液,将7 mmol/L 的ABTS溶液和2.45 mmol/L 的过硫酸钾等体积混合后,室温条件下于避光放置12 h以便生成ABTS 自由基。在试验之前,将ABTS 自由基母液用甲醇进行适当稀释从而配制ABTS 自由基工作液。然后,将0.3 mL 的样品和2.7 mL的ABTS 自由基工作液混合均匀于30 ℃下孵育6 min,孵育结束后于30 ℃、745 nm条件下测定其吸光值As。以在相同条件下,0.3 mL甲醇和2.7 mL的ABTS+·自由基工作液的混合溶液的吸光值AC为对照。每个样品对ABTS 自由基的清除能力用以下公式进行计算:

1.7.3铁离子还原能力(ferric reducing antioxidant power, FRAP)
采用吡啶三吖嗪法测定每个样品的铁离子还原能力,操作参照文献[18],并稍加修改。用0.25 mol/L、pH 3.6的乙酸缓冲液溶解TPTZ(10mmol/L)和FeCl3(20mmol/L)配成FRAP工作液。取0.5 mL经过适当稀释后不同浓度的样品,加入到3 mL FRAP工作液中,在37 ℃下孵育10 min后,于593 nm处测其吸光值。以FeSO4作为标准曲线。
1.8数据统计分析
所有试验均重复测定3次,数据表示为平均值(n=3)± 标准偏差(SD),并通过单因素方差分析(one-way ANOVA)对所有数据进行显著性分析,P<0.05认为具有显著性差异,所有数据均采用Origin 8.5软件进行统计学分析并作图。
2 结果与讨论
2.1总酚含量(TPC)
经过不同处理后的苦荞中总酚含量如图1所示。从图1中可以看出,与未处理的苦荞相比, 不同处理方法对苦荞中总酚含量均有显著的影响(P<0.05)。苦荞经过浸泡后,其总酚含量升高超过25%。但是,浸泡后的苦荞再经过高压处理后,其总酚含量会显著下降。 与浸泡苦荞相比,进一步的高压处理会降低约11%,说明高压会破坏苦荞中的酚类物质。另外,蒸煮也会对苦荞中酚类物质造成破坏。经过蒸煮后,与未处理苦荞相比,总酚含量下降超过8%。而且,经过蒸煮后的苦荞再经过高压处理,其总酚含量会进一步下降,与未处理苦荞相比,其总酚含量减少超过15%。

图1 经不同处理的苦荞中总酚含量Fig.1 The totalphenolic content of tartary buckwheat with different processing methods注:柱状图中不同字母表示具有显著差异(P<0.05)。
一般认为,谷物中的大部分酚类物质都是与蛋白、多糖、脂质等大分子以共价键形成聚合物,不容易被提取出来[19]。而经过浸泡后,苦荞总酚含量上升可能是因为浸泡过程中激活了苦荞中的多种酶,在这些酶的作用下,将苦荞中的一些处于结合状态的酚类物质给水解成游离态,从而可以增加可提取总酚的含量。已有研究也表明,燕麦在浸泡发芽过程中,其可提取总酚含量会有非常显著的提高[20-21]。植物中的酚类物质是一类含有苯环,并且苯环上具有一个或者多个羟基基团的化合物,而多种因素会影响这类化合物的稳定性,如光、热、氧气以及pH。IM等通过对一些蔬菜中酚类物质的热稳定性进行研究发现,这些蔬菜中的酚类物质在经过开水中蒸煮1 h后,含量下降均达到约60%[8]。说明蔬菜中的酚类物质对热不稳定,这与本文的结果相一致。
2.2总黄酮含量
苦荞经过不同处理后的总黄酮含量如图2所示。从图2中可以看出,苦荞中总黄酮含量变化趋势与总酚变化规律一致,不同处理方式对其总黄酮含量也均有显著的影响(P<0.05)。浸泡8 h后苦荞中的总黄酮上升超过32%,但是,浸泡后苦荞再经过高压处理,其总黄酮含量会有所下降(下降约7%),说明高压处理也会对黄酮有轻微的破坏。同时,蒸煮后的苦荞总黄酮下降约5%,进一步的高压处理,总黄酮含量会进一步下降,与未处理苦荞相比,下降超过22%。
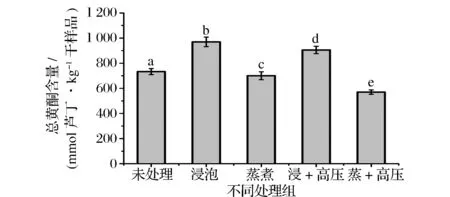
图2 经不同处理的苦荞中总黄酮含量Fig.2 The totalflavonoid content of tartary buckwheat with different processing methods注:柱状图中不同字母表示具有显著差异(P<0.05)。
植物中的黄酮类化合物是一种以2-苯基色原酮为母核具有C6-C3-C6骨架的一系列植物次级代谢产物,并且,其母核上常含有1个到多个羟基、甲基、甲氧基等取代基团。研究发现黄酮类化合物具有多种生物活性,可以对多种人类疾病起到预防和辅助治疗的作用[22]。黄酮类化合物同样对多种因素不稳定,如光照、pH和温度等[23]。本文结果也显示,苦荞中的黄酮物质对温度较为敏感,特别是经过蒸煮后的苦荞再经过高压高温处理,其约四分之一的黄酮会被破坏。与浸泡会提高总酚含量一样,浸泡同样可以极显著提高黄酮含量,这与王静波等人的研究结果相一致,其研究表明,苦荞在发芽过程中,黄酮含量会逐步显著提高[24],原因可能就是因为在苦荞种子浸泡萌发过程中,大量结合态的黄酮被酶水解释放出来,从而提高了可提取黄酮的含量。
2.3HPLC分析
研究表明,苦荞中的黄酮类物质主要为芦丁,约占其总黄酮的85%[25]。因此,本文利用HPLC对不同处理苦荞中芦丁含量进行定性和定量分析,结果如图3和表1所示。从图3中也可以看出,苦荞中的黄酮类物质主要是芦丁。根据图2和表1结果,计算出芦丁约占苦荞总黄酮的80%。同样,不同处理方式对其芦丁含量也均有显著的影响(P<0.05),浸泡可以显著提高芦丁含量(P<0.05),而高温高压处理后,其芦丁含量均会显著下降(P<0.05),说明芦丁对高温高压是不稳定的。

图3 苦荞(未处理组)在280nm下的液相色谱图Fig.3 HPLC chromatograms oftartary buckwheat (untreated group) at 280 nm

样品芦丁含量/(mmol·kg-1干样品)变化率/%未处理组浸泡组蒸煮组浸泡加高压组蒸煮加高压组578.8±15.6-847.1±23.246.4±4.0494.4±6.4-14.6±1.1701.7±11.221.2±1.9448.3±7.3-22.5±1.3
2.4抗氧化性分析
2.4.1DPPH自由基清除能力
经过不同处理苦荞的DPPH自由基清除活性结果如图4所示。
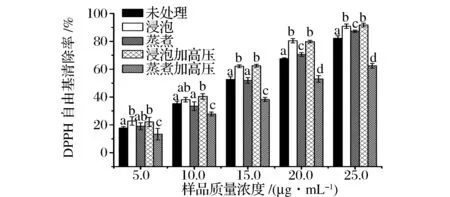
图4 经不同处理的苦荞在各浓度下对DPPH自由基的清除能力Fig.4 The DPPH radical scavenging activities of tartary buckwheat withdifferent processing methods at various concentrations注:柱状图中同一浓度条件下不同字母表示具有显著差异(P<0.05)。
从图4中可以看出,未处理苦荞及不同处理苦荞对DPPH自由基均具有很好的清除活性,并且呈现量效关系。另外,浸泡后的苦荞表现出最强的DPPH自由基清除活性,而蒸煮后再经高压处理的苦荞清除DPPH自由基能力最弱,这些结果表明,加热处理会降低苦荞的DPPH自由基清除能力,可能是因为加热破坏苦荞中酚类物质所致。
不同处理苦荞清除DPPH自由基能力的趋势与其总酚和总黄酮变化趋势相似。因此,本文进一步分析了不同处理苦荞对DPPH自由基的清除能力与总酚以及总黄酮之间的相关性,结果如图5所示。由图5可知,不同处理苦荞的DPPH自由基清除能力与其总酚(r=0.988,P<0.01)和总黄酮(r=0.987,P<0.01)含量呈现非常显著的相关性。说明苦荞中的总酚和总黄酮是其主要的抗氧化性物质,这与前人的研究结果相一致[21, 24]。

图5 不同处理苦荞中(a)总酚、(b)总黄酮与DPPH自由基清除率之间关系Fig.5 Correlation between the DPPH radical scavenging ratios (%) and (a) the totalphenolic content, (b) the totalflavonoid content of tartary buckwheat with different processing methods
2.4.2ABTS自由基清除能力
各样品在不同浓度下对ABTS 自由基的清除能力如图6所示。从图6中也可以看出,各样品均具有很好的ABTS 自由基清除能力,且浸泡苦荞清除能力最强,蒸煮加高压处理苦荞清除能力最弱,未处理、浸泡、蒸煮、浸泡加高压以及蒸煮加高压处理苦荞的IC50值分别为(16.4±1.3)、(13.1±0.5)、(20.2±1.6)、(13.8±0.7)和(21.8±1.6) μg/mL。与DPPH自由基清除能力变化规律相似,经过高温高压处理均会显著降低苦荞的ABTS自由基的清除能力。

图6 经不同处理的苦荞在各浓度下对ABTS自由基的清除能力Fig.6 The ABTS radical scavenging activities of tartary buckwheat withdifferent processing methods at various concentrations注:柱状图中同一浓度条件下不同字母表示具有显著差异(P<0.05)。
各样品ABTS自由基的清除能力与其总酚和总黄酮相关性分析如图7所示。

图7 不同处理苦荞中(a)总酚、(b)总黄酮与ABTS自由基清除率之间关系Fig.7 Correlation between the ABTS radical scavenging ratios (%) and (a) the totalphenolic content,(b) the totalflavonoid content of tartary buckwheat with different processing methods (μmoL/L)
从图7中同样可以看出,苦荞的ABTS自由基的清除能力与其总酚(r=0.962,P<0.01)和总黄酮(r=0.970,P<0.01)均具有极显著的相关性,说明苦荞中的总酚和总黄酮是其清除ABTS 自由基的主要活性物质。前人大量研究也均表明,植物中的酚类物质具有很好的抗氧化性,能有效地清除多种自由基,从而发挥预防和辅助治疗人类多种疾病的功能[20-21]。
2.4.3铁离子还原能力
各样品在不同浓度条件的铁离子还原能力如图8所示。与DPPH自由基清除能力以及ABTS自由基清除能力的趋势类似。各样品均有良好的铁离子还原能力,并且浸泡处理的苦荞具有最强的铁离子还原能力,而蒸煮加高压处理的苦荞铁离子还原能力最弱。但是,在低浓度条件下(5 μg/mL),各处理组以及与未处理苦荞的铁离子还原能力没有显著差别,这可能是因为在低浓度条件下,样品中酚类物质以外的还原性化合物对结果产生了一定影响。

图8 经不同处理的苦荞在各浓度下对铁离子的还原能力Fig.8 The ferric reducing capacities of tartary buckwheat with different processing methods at various concentrations注:柱状图中同一浓度条件下不同字母表示具有显著差异(P<0.05)。
各样品铁离子还原能力与其总酚和总黄酮相关性分析如图9所示。

图9 不同处理苦荞中(a)总酚、(b)总黄酮与铁离子还原能力之间关系Fig.9 Correlation between the ferric reducing capacities and (a) the totalphenolic content, (b) the totalflavonoid content of tartary buckwheat with different processing methods
从图9中同样可以看出苦荞的铁离子还原能力与其总酚(r=0.992,P<0.01)和总黄酮(r=0.982,P<0.01)均具有极显著的相关性,这一结果再一次证明苦荞中的总酚和总黄酮是其发挥抗氧化性的主要活性物质。还原反应是机体终止某些对人体有害的自由基反应的重要方式,通过降低体内有害的自由基[26],从而可以预防多种疾病的发生,因此可以看出苦荞提取物具有较好的健康促进活性。
3 结论
本文主要研究了不同处理方式对苦荞的总酚含量、总黄酮含量以及抗氧化性的影响,同时利用HPLC分析了苦荞中最主要黄酮芦丁的变化。结果表明,苦荞经过浸泡后可以显著提高其总酚、总黄酮含量以及抗氧化性,而经高温或者高压处理会显著降低苦荞的总酚和总黄酮含量,同时其抗氧化性也显著降低。另外,通过对不同处理苦荞抗氧化性与总酚总黄酮含量相关性分析发现,苦荞提取物的总酚总黄酮是其主要的抗氧化性物质。
[2]MCKEOWN N M, JACQUES P F, SEAL C J, et al. Whole grains and health: from theory to practice—highlights of the Grains for Health Foundation's Whole Grains Summit 2012 [J]. The Journal of Nutrition, 2013, 143(5), 744S-758S.
[3]LIU R H. Whole grain phytochemicals and health [J]. Journal of Cereal Science, 2007,46(3):207-219.
[4]DYKES L, ROONEY L. Phenolic compounds in cereal grains and their health benefits [J]. Cereal Foods World, 2007, 52(3): 105-111.
[5]PAN M H, LAI C S, HO CT,et al. Anti-inflammatory activity of natural dietary flavonoids [J]. Food & Function, 2010, 1(1), 15-31.
[6]ALOTHMAN M, BHAT R, KARIM A. Effects of radiation processing on phytochemicals and antioxidants in plant produce [J]. Trends in Food Science & Technology, 2009, 20(5): 201-212.
[7]NIVEDITHA V R, SRIDHAR K R. Antioxidant activity of raw, cooked andRhizopusoligosporusfermented beans of Canavalia of coastal sand dunes of Southwest India [J]. Journal of Food Science and Technology, 2014, 51(11): 3 253-3 260.
[8]IM M H, PARK Y S, LEONTOWICZ H, et al. The thermostability, bioactive compounds and antioxidant activity of some vegetables subjected to different durations of boiling: Investigationinvitro[J]. LWT-Food Science and Technology, 2011, 44(1): 92-99.
[9]LI S Q, ZHANG Q H. Advances in the development of functional foods from buckwheat [J]. Critical Reviews in Food Science and Nutrition, 2001, 41(6): 451-464.
[10]FABJAN N, RODE J, KOIR I J, et al.Tartary buckwheat (FagopyrumtataricumGaertn.) as a source of dietary rutin and quercitrin [J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6 452-6 455.
[11]JIANG P, Burczynski F, Campbell C, et al. Rutin and flavonoid contents in three buckwheat speciesFagopyrumesculentum,F.tataricum, andF.homotropicumand their protective effects against lipid peroxidation [J]. Food Research International, 2007, 40(3): 356-364.
[12]SINGLETON V L,ROSSI J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents [J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158.
[13]DEWANTO V, WU X, ADOM K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2002, 50(10): 3 010-3 014.
[14]CAI S,WANG O,WU W, et al. Comparative study of the effects of solid-state fermentation with three filamentous fungi on the total phenolics content (TPC), flavonoids, and antioxidant activities of subfractions from oats (AvenasativaL.) [J]. Journal of Agricultural and Food Chemistry, 2011, 60(1): 507-513.
[15]CORREA-BETANZO J, ALLEN-VERCOE E, MCDONALD J, et al. Stability and biological activity of wild blueberry (Vacciniumangustifolium) polyphenols during simulatedinvitrogastrointestinal digestion [J]. Food Chemistry, 2014, 165(15): 522-531.
[17]RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay [J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1 231-1 237.
[18]ALMAJANO M P, DELGADO M E, GORDON M H, et al. Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate [J]. Food Chemistry, 2007, 101(1): 126-130.
[19]DANIELS D, MARTIN H. Antioxidants in oats: glyceryl esters of caffeic and ferulic acids [J]. Journal of the Science of Food and Agriculture, 1968, 19(12): 710-712.
[20]付晓燕,胡崇琳,田斌强, 等. 燕麦发芽过程中酚类物质的变化 [J]. 食品科学,2011, 32(5):137-142.
[21]徐建国. 燕麦发芽过程中多酚含量及其抗氧化活性的变化 [J]. 中国食品学报, 2013,13(1): 201-205.
[22]朱沛沛, 李宁宁, 梁晶, 等. 黄酮类化合物的组分及生物活性研究进展 [J]. 饮料工业, 2012, 15(3): 13-15.
[23]曹婉鑫, 陈洋, 唐瑶. 苦荞中黄酮类化合物的生物活性研究进展 [J]. 饮料工业 2015, 18(3): 19.
[24]王静波, 赵江林, 彭镰心,等. 苦荞芽中黄酮类化合物含量及其抗氧化性的研究 [J]. 现代食品科技, 2013, 29(5): 965-968.
[25]张强, 李艳琴. 苦荞菜中总黄酮的测定 [J]. 食品与药品, 2007, 9(4A): 24-25.
[26]DARGEL R. Lipid peroxidation—a common pathogenetic mechanism [J]. Experimental and Toxicologic Pathology, 1992, 44(4): 169-181.
The effects of different processing methods on the total phenolics content (TPC),flavonoids, and antioxidant activities of tartary buckwheat
SUN Dan, HUANG Shi-qi, CAI Sheng-bao*
(Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, China)
Studies reported that processing methods had profound effects on the nutritional and functional ingredients of the final products. Tartary buckwheat, which has been recognized as a kind of health-promoting cereal, is rich in many functional compounds, especially phenols. However, the influence of processing methods on the antioxidant activity and phenols compounds of whole tartary buckwheat hasn’t got much attention. Therefore, the purpose of the present work was to investigate the effect of different processing methods (soak, boiling or steam) on total phenolics content (TPC), flavonoids, and antioxidant activities of tartary buckwheat, and to delineate changes of rutin content from different treated tartary buckwheat by HPLC. The results indicated that TPC, flavonoids, rutin and antioxidant activity of soaked tartary buckwheat increased dramatically (P<0.05). However, boiling or steam not only significantly decreased TPC, flavonoids and rutin of tartary buckwheat (P<0.05), but also remarkably reduced the antioxidant activity (P<0.05). Moreover, according to the analysis results of the correlation between antioxidant activity and TPC (flavonoids), the TPC and flavonoids were the main antioxidant compounds in tartary buckwheat.
tartary buckwheat; antioxidant activity; rutin; correlationship
10.13995/j.cnki.11-1802/ts.201601026
硕士研究生(蔡圣宝副教授为通讯作者,E-mail: caikmust2013@163.com)。
国家自然科学基金(31401503);云南省应用基础研究面上项目(2014FB120);昆明理工大学省级人才培养项目(14118781)
2015-08-28,改回日期:2015-10-19
