巴氏醋酸杆菌沪酿1.01对液体保藏中醋酸胁迫的生理应答
2016-09-26马新凤陈义伦周波李超男吴慧黄颖倩张玉环郭莎莎
马新凤,陈义伦*,周波,李超男,吴慧,黄颖倩,张玉环,郭莎莎
1(山东农业大学 食品科学与工程学院,山东 泰安,271018) 2(山东农业大学 生命科学学院,山东 泰安,271018)
巴氏醋酸杆菌沪酿1.01对液体保藏中醋酸胁迫的生理应答
马新凤1,陈义伦1*,周波2,李超男1,吴慧1,黄颖倩1,张玉环1,郭莎莎1
1(山东农业大学 食品科学与工程学院,山东 泰安,271018) 2(山东农业大学 生命科学学院,山东 泰安,271018)
以AcetobacterpasteurianusHuniang 1.01为试验菌株,采用不同醋酸酸度保藏液保藏醋酸菌,每周检测活菌数、酸度、乙醇脱氢酶(Alcohol dehydrogenase,ADH)、乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH)活性及细胞多糖含量随保藏时间的变化,通过显微镜观察醋酸菌细胞形态,采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析细胞膜脂肪酸成分的变化。结果表明,活菌数先缓慢后快速地减少,脱氢酶系活性呈现波动变化状态,酸度变化幅度很小,呈平缓上升趋势;随着酸度的过度上升,活菌数、ADH、ALDH活性降低,醋酸菌的生长和产酸代谢活动受到抑制,细胞形态由规则的椭圆形变为不规则的长棒杆状,细胞多糖含量增加,细胞膜不饱和脂肪酸的相对含量显著提高。初步断定AcetobacterpasteurianusHuniang 1.01主要依靠改变乙醇呼吸链酶活力、细胞形态、细胞膜脂肪酸组分,增加细胞荚膜多糖的分泌和细胞膜的流动性等机制的协同作用来适应液体保藏过程中醋酸胁迫产生的不良环境。
巴氏醋酸杆菌沪酿1.01;液体保藏;酸度;生长;细胞形态;细胞膜脂肪酸
醋酸菌(Acetobacter)属于变形菌纲,醋杆菌科,严格好氧[1],被广泛用于食醋酿造工业[2]。醋酸菌是重要的微生物资源,选育的醋酸菌必须保持其优良性状才不至于降低生产性能,能长期在生产中使用。目前,食醋工业生产中醋酸菌大多采用固体斜面保藏法,食醋生产厂家主要依靠频繁传代的培养方法来保证醋酸菌活性[3],此法保藏的醋酸菌菌种退化快,易变异。依据德国制醋“种醋不分,醋种同源”[4]的理论,发酵醋液、醋醅是良好的醋酸菌种来源,也是有利于醋酸菌保藏的一种方法,采用液体方式保藏醋酸菌简易实用,但保藏的醋酸菌不可避免的暴露于醋酸的压力下,低浓度醋酸无法抑制菌体的生长和代谢活动,高浓度醋酸容易经过细胞膜渗透到细胞质中,对菌体生长及代谢产生不利影响。
目前研究表明,醋酸菌的耐醋酸机制包括:(1)ABC转运子机制:aatA是一个与细菌耐酸性有关的ABC转运子,广泛存在于多种醋酸菌中,Nakano等[5]证实,aatA的功能可能是作为醋酸的外排泵。(2)醋酸过氧化机制:主要是在乙酰辅酶A转移酶AarC的作用下氧化醋酸并使其进入乙醛酸循环途径来实现的[6]。(3)醋酸耐受相关蛋白的表达:醋酸能够诱导包括分子伴侣GrpE、GroES和GroEL等的表达[7],ATP依赖的转运蛋白ClpB[8]等也与醋酸耐受性相关。(4)基因与酶调控机制:当胞内醋酸浓度需要降低时,aarA、aarB、aarC三个aar基因协同形成一个不同于传统TCA的完整循环[9]。以上探究的耐酸机制都是相对独立的,醋酸菌耐酸机理应该是一个有机协调的整体。因此,酸度对醋酸菌生理的整体影响需深入研究阐明。本文研究了液体保藏巴氏醋酸杆菌对醋酸形成的胁迫环境在脱氢酶系、细胞形态、菌体生长和生理调节方面的影响,探讨了巴氏醋酸杆菌在液体保藏过程中的耐酸机制,以期为提高食醋及醋酸饮料液态保藏菌种性能和标准化生产提供理论基础。
1 材料与方法
1.1实验材料
1.1.1菌种
AcetobacterpasteurianusHuniang 1.01(ApH.1.01),为本实验室研究用菌株,由山东大学微生物系提供。
1.1.2培养基
醋酸菌增殖培养基:葡萄糖1 g,酵母粉1 g,KH2PO40.05 g,MgSO40.05 g,蒸馏水100 mL,pH 5.5,无水乙醇3.5 mL,在培养基灭菌后冷却至60 ℃以下后加入。
醋酸菌液体保藏培养基:葡萄糖1 g,酵母粉1 g,蒸馏水100 mL,pH 5.5,无水乙醇3.5 mL,在培养基灭菌后冷却至60 ℃以下后加入。
醋酸菌平板培养基:葡萄糖1 g,酵母粉1 g,CaCO32 g,琼脂1.8 g,蒸馏水100 mL,pH自然,无水乙醇3.5 mL,在培养基灭菌后冷却至60 ℃以下后加入。
1.2仪器与设备
T6紫外-可见分光光度计,北京普析通用仪器有限责任公司;QLYMPUS奥林巴斯CX21生物显微镜,上海茸研仪器有限公司;TGL-20bR高速冷冻离心机,上海安亭科学仪器厂;GCMS-TQ8030三重四极杆气质联用仪,日本岛津公司。
1.3试验方法
1.3.1菌种活化
向已灭菌冷却的100 mL醋酸菌增殖培养基中加入3.5 mL无水乙醇,从斜面试管保藏的ApH 1.01醋酸菌刮下2环接入其中,30 ℃,150 r/min摇床培养20 h,活化2次,使其中的菌体浓度达到108CFU/mL以上。
1.3.2生长曲线的绘制
取26个装有液体保藏培养基容量为250 mL的三角瓶,每瓶含液量100 mL,分别加入5 mL二次活化菌液,30 ℃,150 r/min 振荡培养,从0~72 h每隔6 h取出2个,测定OD600值,取平均值,绘制生长曲线,确定收种时间,同时测定此时间的具体活菌数。
1.3.3酸度对菌体生长和生理代谢的影响
选10个1 000 mL的锥形瓶,装入液体保藏培养基400 mL,灭菌冷却后加入14 mL无水乙醇,移接二次活化液10%的体积分数至其中,30 ℃,150 r/min摇床培养至收种时间后进行活菌计数,测定酸度、乙醇浓度、细胞多糖含量、ADH、ALDH活性,根据测定结果分别调整酸度为0、1、2、3、4、5、6、7、8、9 g/L,乙醇的体积分数全部调整为3%,为减少空气含量转移250 mL至250 mL已灭菌锥形瓶,换上灭菌橡皮塞,包裹封口,置4 ℃冰箱保藏。每周取出,测定其活菌数、酸度、ADH活性、ALDH活性、细胞多糖含量,计算醋酸菌存活率,连续测定4周,第4周时用显微镜观察不同酸度下的细胞形态,采用气质联用测定细胞膜脂肪酸的成分。
1.4分析方法
1.4.1活菌数
稀释涂布平板计数法。
1.4.2总酸
GB/T 12456—2008 食品中总酸的测定。
1.4.3乙醇浓度的测定
GB/T 15038—2006葡萄酒、果酒通用分析方法。
1.4.4ADH、ALDH活性的测定
参照Wood氏法[10]。取Mellvaine缓冲液0.5 mL(pH4.0),体积分数为10%的TritonX-100溶液0.1 mL,1 mol/L乙醇(乙醛)溶液0.1 mL,发酵液0.2 mL,0.1 mol/L铁氰化钾溶液0.1 mL于25 mL的比色管中,25 ℃保温5 min,加入硫酸铁-Dupanol溶液0.5 mL,蒸馏水3.5 mL混合后,25 ℃条件下放置20 min(同时作空白对照)后,紫外分光光度计测定OD660值。在上述条件下,每分钟催化氧化1 μmol乙醇(乙醛)为1个酶活力单位。

1.4.5显微镜分析
湿墨汁法[11-12]。取3 mL菌液于离心管中,6 000 r/min离心8 min,去掉上清液,得到湿菌泥,加1滴过滤之后的墨汁于洁净载玻片上,挑少量菌泥与之充分混合,将一洁净盖玻片盖于混合液上,然后在盖玻片上放一滤纸,向下轻压以吸去多余的混合液,镜检。
1.4.6细胞多糖含量[13]
苯酚-硫酸法。取3 mL菌液于离心管中,11 500 r/min离心12 min,收集沉淀,沉淀中加入3 mL 质量分数为3%的EDTA溶液,混匀,11 500 r/min离心12 min,上清液用孔径为0.45 μm微孔滤膜过滤,滤液为待测的多糖样品,取1 mL滤液,加质量分数为5%的苯酚1 mL,摇匀,加浓硫酸5.0 mL,摇匀,放置20 min,490 nm测其OD值。
1.4.7气质联用测定细胞膜脂肪酸成分
(1)细胞膜脂肪酸的提取及甲酯化。将样品于4 ℃ 6 000 r/min离心15 min,得湿菌体,并用无菌生理盐水反复洗涤2次并离心。在上述洗涤后的菌泥中加入1 mL浓度为1 mol/L的甲醇钠溶液,剧烈振荡1 min,加入1 mL正己烷溶液,振荡20 s[14],6 000 r/min离心15 min后,取上清液,有机系滤头过滤,待测。
(2)GC-MS操作条件。色谱条件:Rtx-5MS 30 m×0.25 mm×0.25 μm,进样口温度250 ℃,起始柱温100 ℃,保持1 min,以10 ℃/min升至150 ℃保持3 min,以5 ℃/min升至225 ℃,保持5 min;载气:高纯氦气;载气流速:1.0 mL/min;进样方式:不分流;进样量:1 μL;接口温度:230 ℃。
质谱条件:电离方式EI,电子能量70 eV,离子源温度230 ℃,扫描模式:Scan,扫描质量范围50~600 m/z,溶剂延迟2 min。
(4)脂肪酸质量分数计算[15]。醋酸菌菌株细胞膜脂肪酸的峰面积总和认为是100%,根据每种脂肪酸峰面积占总峰面积的比例计算细胞膜脂肪酸的相对质量分数,即:某种脂肪酸的质量分数=某脂肪酸峰面积/脂肪酸峰面积总和×100%。
1.4.8数据处理
实验数据采用Excel、Origin8.5软件进行处理和分析。
2 结果与分析
2.1醋酸菌生长曲线与醇/酸转化规律
由图1可知,醋酸菌依次经历生长延滞期(0~6 h)、对数生长期(6~18 h)、稳定期(18~48 h)、衰亡期(48~72 h)4个阶段,该菌最大比生长速率为0.1 h-1。由图2可知,醋酸菌产醋酸过程大致分3个阶段,即高速积累期(0~48 h),平缓增长期(48~60 h),同化消耗期(60 h~)。发酵至18 h,即对数生长期后期,菌体生长旺盛且菌体量未达到最大,适于收种。此时酸度约6.41 g/L,乙醇的体积分数约1.97%,活菌数约1.79×108CFU/mL。
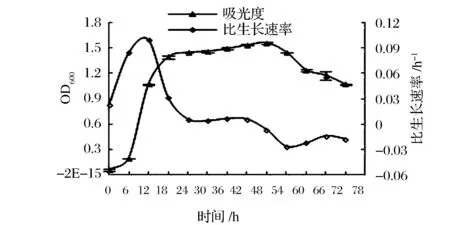
图1 ApH 1.01的生长曲线Fig.1 The growth curve of ApH 1.01
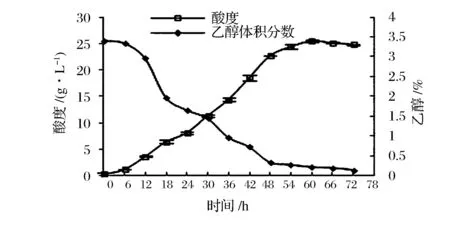
图2 ApH 1.01的醇/酸转化曲线Fig.2 Alcohol and acidity metabolism curves of ApH 1.01
2.2酸度对醋酸菌生长与生理代谢的影响
2.2.1保藏过程中活菌数的变化
当酸度超过6 g/L时,保藏第3周活菌数已小于106CFU/mL,选取前7个梯度作图。如图3所示,在保藏第1周内活菌数均下降缓慢,之后呈现快速下降趋势。对比得知,在保藏期间,酸度太低太高都不利于醋酸菌存活,尤其是高酸度下后期保藏过程中活菌数急剧减少,酸度2 g/L时活菌数高于其他,较适于醋酸菌保藏。
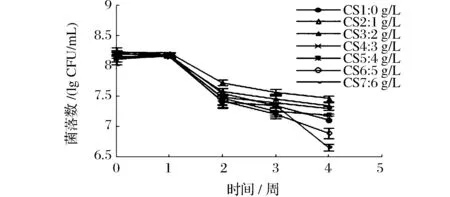
图3 保藏过程中活菌数变化曲线Fig.3 Curves of the living bacterium change during the preservation
2.2.2保藏过程中酸度的变化
由图4可以看出,整个保藏过程酸度为0、1 g/L时增速较大,其他酸度下呈平缓上升趋势,变化幅度很小。表明,在保藏过程中低酸度无法抑制醋酸菌产酸代谢活动。
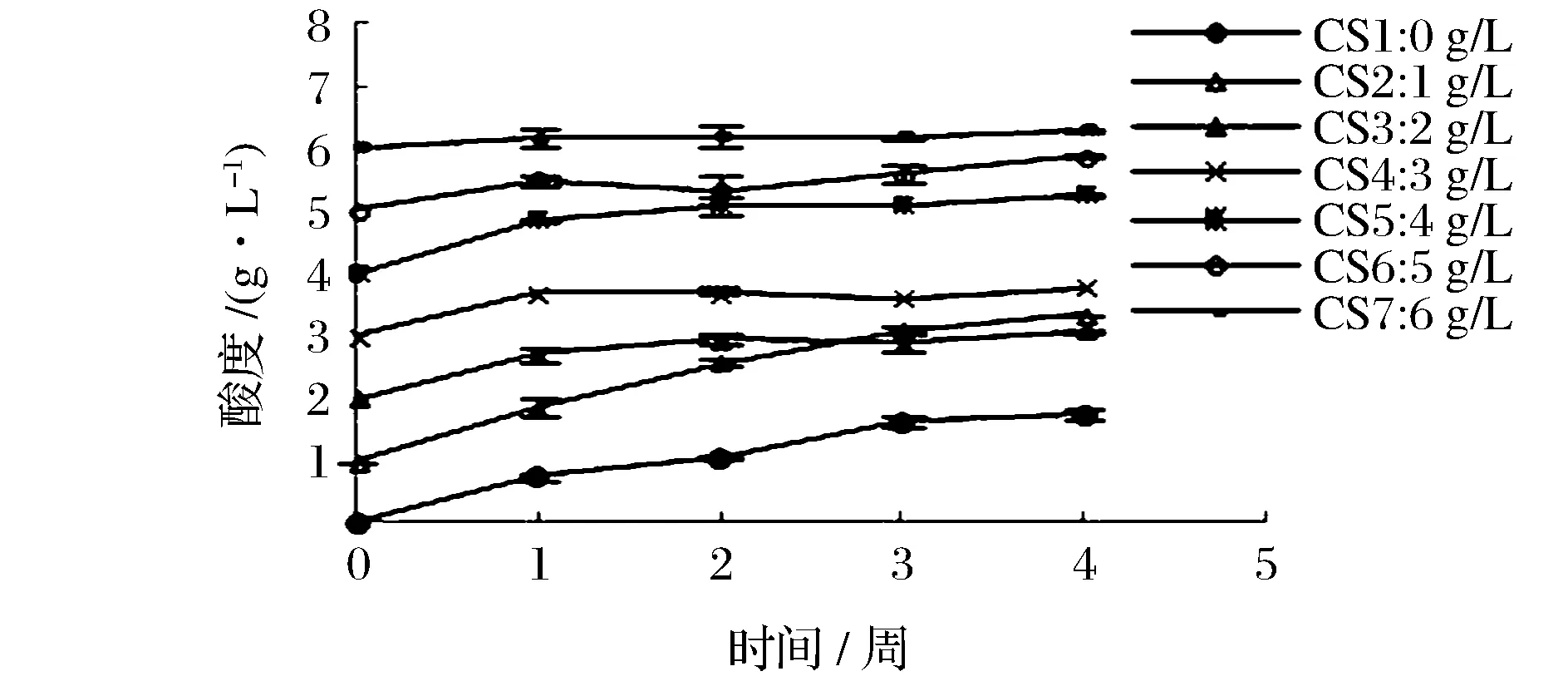
图4 保藏过程中酸度变化曲线Fig.4 Curves of acidity change during the preservation
2.2.3保藏过程中ADH、ALDH活性的变化
由图5可知,1周内ADH、ALDH活性迅速下降,而后呈波动上升的变化趋势。酸度越低,ADH、ALDH活性越高,醋酸菌代谢活动越旺盛。酸度2 g/L的醋酸菌保藏液ADH、ALDH活性处于中间,变化平稳,进一步验证2 g/L的酸度能够在保藏期间起到抑制醋酸菌代谢活动的作用。目前,对于乙醇氧化体系在醋酸菌耐酸中的作用机制还没彻底探明,但有研究发现产高酸菌的ADH对高浓度的醋酸耐受能力更好[16]。乙醇呼吸链的活跃运行有利于形成膜内外质子梯度和生成ATP,细胞的能量水平可能决定了巴氏醋酸杆菌耐醋酸能力的高低。
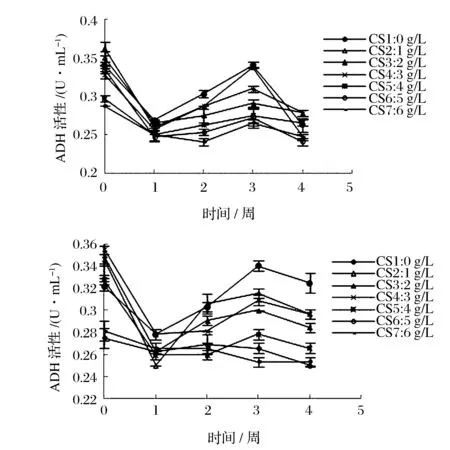
图5 保藏过程中ADH、ALDH活性变化曲线Fig.5 Curves of activity change of ADH and ALDH during the preservation
2.2.4保藏过程中菌体形态的变化
如图6所示,低酸度下细胞形态为规则的椭圆形,随着酸度的升高,开始出现棒杆状的细胞,无论酸度高低,胞外都有明显的荚膜产生。酸度升至9 g/L时,因受醋酸毒害作用细胞长度进一步增加,呈现不规则的长棒杆状。
2.2.5保藏过程中细胞多糖含量的变化
荚膜在多元醇生产菌中较为常见,主要成分是多糖,由图7可知,整个保藏过程细胞多糖含量呈上升趋势,酸度越高,菌体细胞越长,细胞表面积越大,产生的胞外荚膜多糖越多,有利于阻止外界环境中的醋酸穿过周质空间进入细胞内,减少对细胞的毒害,这既表明了荚膜是该菌在保藏过程中抵御醋酸不良环境的必要屏障,又与显微镜下细胞形态的相应变化相吻合。ANDRÉS-BARRAO等[17]研究发现,发酵过程中荚膜多糖的分泌量是减少的,与本试验研究保藏过程中的变化不同,可能是菌株为适应发酵与保藏不同过程、不同环境而做出的自我调节不同导致的。
2.2.6细胞膜脂肪酸组分的变化
除了调节荚膜多糖的合成,一些极端微生物通过改变细胞膜不饱和脂肪酸的比例增加膜的流动性来

图6 保藏过程中菌体细胞形态的变化Fig.6 Morphologic changes of cells during the preservation
抵抗不利的生存环境[18]。由图8和表1可知, 该菌膜脂肪酸主要成分是癸酸(C10∶0)、月桂酸(C12∶0)、肉豆蔻酸(C14∶0)、棕榈油酸(C16∶1)、棕榈酸(C16∶0)、油酸(C18∶1)、硬脂酸(C18∶0)、十九碳烯酸(C19∶1)。不同酸度下细胞膜脂肪酸的种类一样,相对含量存在差异。由图9可知,不同酸度下,油酸(C18∶1)占总脂肪酸的比例最大,其次是棕榈酸(C16∶0)。随着酸度的升高,总不饱和脂肪酸(C16∶1、C18∶1和C19∶1)的相对含量变大,增加了膜的流动性,长链脂肪酸(C14∶0、C16∶0和C18∶0)的相对含量明显降低,中链脂肪酸(C10∶0、C12∶0)的含量轻微降低。总之,随着酸度的升高,ApH 1.01细胞膜的单不饱和脂肪酸的含量上升,而饱和脂肪酸的含量下降。亓正良等[2]报道了相似的现象,发现发酵过程中随醋酸积累,膜不饱和脂肪酸比例上升。
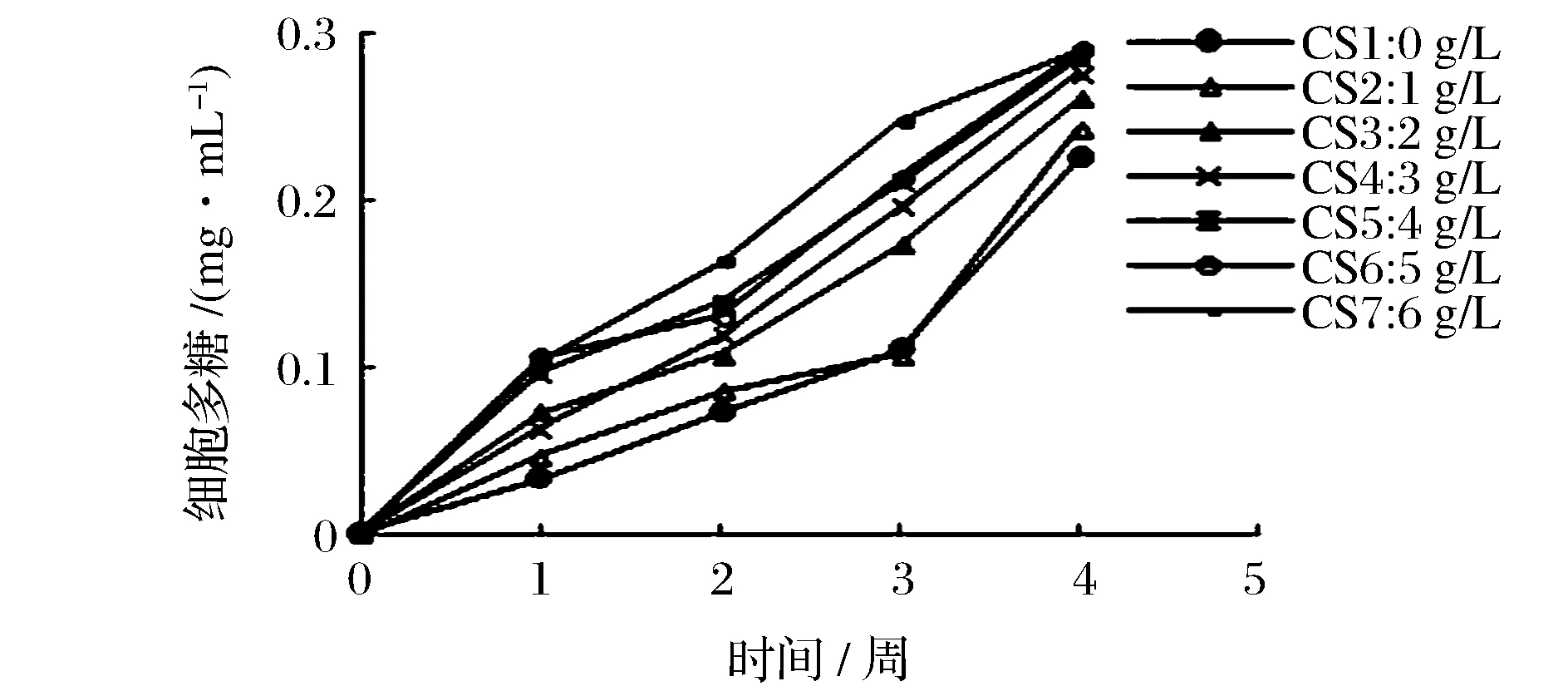
图7 保藏过程中细胞多糖含量变化曲线Fig.7 Curves of cellular polysaccharides change during the preservation

1-癸酸(7.325);2-月桂酸(11.527);3-肉豆蔻酸(16.473);4-棕榈油酸(20.547);5-棕榈酸(21.028);6-油酸(24.778);7-硬脂酸(25.11);8-十九碳烯酸(26.939)图8 ApH 1.01细胞膜脂肪酸GC-MS总离子流图(TIC)Fig.8 Total ion chromatogram(TIC)of fatty acids in cell membrane of ApH 1.01

出峰顺序脂肪酸特征离子保留时间/min1癸酸74871431867.3252月桂酸748717121411.5273肉豆蔻酸748719924216.4734棕榈油酸558319423620.5475棕榈酸748714322721.0286油酸558318026424.7787硬脂酸748725529825.118十九碳烯酸558319427826.939
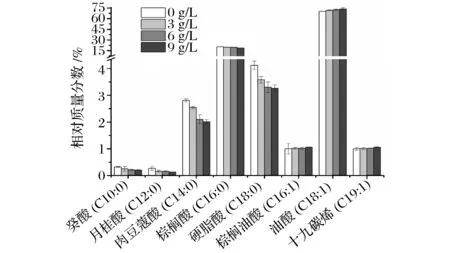
图9 ApH 1.01细胞膜脂肪酸的相对含量Fig.9 Membrane fatty acids change of ApH 1.01
3 小结
试验结果表明,随着保藏时间的延长,ApH 1.01活菌数先缓慢减少,后快速下降,脱氢酶系活性呈现波动变化状态,酸度变化幅度很小,呈平缓上升趋势,细胞多糖含量增加。随着酸度的过度升高,醋酸菌的存活性、产酸代谢活动和乙醇呼吸链酶活性受到了抑制;细胞形态由规则的椭圆形变为不规则的长棒杆状;荚膜多糖的含量增多,表明荚膜是巴氏醋酸杆菌抵御醋酸不良环境的必要屏障;膜不饱和脂肪酸的质量百分比变大,有利于增加细胞膜的流动性,适应外界不良环境。酸度2 g/L较利于液体保藏的醋酸菌存活。据此推测AcetobacterpasteurianusHuniang 1.01主要依靠改变乙醇呼吸链酶活力、细胞形态、细胞膜脂肪酸组分,增加细胞荚膜多糖的分泌和细胞膜的流动性等机制的协同作用来适应液体保藏过程中醋酸胁迫产生的不良环境。
食醋企业应先探索生产用的各菌株在不同酸度、酒精度下的活性等生理状态,以及最适保藏温度等,针对不同的菌株采取不同的保藏措施,而不是所有的醋酸菌都采用同一种保藏方法,从而提高液态保藏菌种的性能,延长保藏期限,减小菌种变异几率,提高生产效率和产品质量。
[1]SENGUN I Y,KARABIYIKLI S.Importance of acetic acid bacteria in food industry[J].Food Control,2011,22(5): 647-656.
[2]亓正良,杨海麟,夏小乐,等.巴氏醋酸杆菌对发酵中醋酸胁迫的生理应答[J].微生物学报,2014(3):299-308.
[3]邵伟,乐超银,唐明,等.醋酸菌菌种保藏条件改进[J].中国酿造,2002(4):12-14.
[4]SOKOLLEK S J,HERTEL C,HAMMES W P.Cultivation and preservation of vinegar bacteria[J].Journal of Biotechnology,1998,60(3):195-206.
[5]NAKANO S,FUKAYA M,HORINOUCHI S,et al.Putative ABC transporter responsible for acetic acid resistance inAcetobacteraceti[J]. Applied and Environmental Microbiology,2006,72(1):497-505.
[6]FUKAYA M,TAKEMURA H,TAYAMA K,et al.TheaarC gene responsible for acetic acid assimilation confers acetic acid resistance on acetobacter aceti[J].Journal of Fermentation and Bioengineering,1993, 76(4):270-275.
[7]ISHIKAWA M,OKAMOTO K A,JOCHI T,et al.Cloning and characterization ofgrpE inAcetobacterpasteurianusNBRC 3283[J].Journal of Bioscience and Bioengineering,2010,109(1):25-31.
[8]LIU Y P,TONG H Z,LIN Z L,et al.Mechanisms of acid tolerance in bacteria and prospects in biotechnology and bioremediation[J].Biotechnology Advances,2015. doi:10.10 16 /j.biotechadv.2015.06.001
[9]MULLINS E A, FRANCOIS J A, KAPPOCK T J. A specialized citric acid cycle requiring succinyl-coenzyme A (CoA): acetate CoA-transferase (AarC) confers acetic acid resistance on the acidophileAcetobacteraceti[J]. Journal of Bacteriology, 2008, 190(14):4 933-4 940.
[10]WILLIS A WOOD.Methods in Enzymology[M].San Diego,CA (United States):Academic Press Inc,1989:491.
[11]MALANG S K,MAINA N H,SCHWAB C,et al.Characterization of exopolysaccharide and ropy capsular polysaccharide formation by Weissella[J].Food Microbiology,2015,46:418-427.
[12]KINZLER K, GEHRKE T, TELEGDI J. Bioleaching-a result of interfacial processes caused by extracellular polymeric substances (EPS) [J]. Hydrometallurgy, 2003, 71(1-2):83-88.
[13]FUJIKAWA S.Morphology Evidence of membrane damage caused by intracellular ice crystals[J]. Cryobiology,1978,15:707.
[14]KUMARI P,KUMAR M,GUPTA V,et al.Tropical marine macroal-gae as potential sources of nutritionally important PUFAs[J].Food Chemistry,2010,120(3):749-757.
[15]XU X Q,CHENG G,DUAN L L,et al.Effect of training systems on fatty acids and their derived volatiles in Cabernet Sauvignon grapes and wines of the north foot of Mt. Tianshan[J].Food Chemistry,2015, 181:198-206.
[16]YAKUSHI T,MATSUSHITA K.Alcohol dehydrogenase of acetic acid bacteria: structure, mode of action, and applications in biotechnology[J]. Applied Microbiology and Biotechnology, 2010, 86: 1 257-1 265.
[17]ANDRÉS-BARRAO C,SAAD M M,CHAPPUIS M L,et al.Proteome analysis ofAcetobacterpasteurianusduring acetic acid fermentation[J].Journal of Proteomics,2012,75(6):1 701-1 717.
[18]CYBULSKI L E,MARTN,Mariana M,et al.Membrane thickness cue for cold sensing in a bacterium[J]. Current Biology,2010,20(17):1 539-1 544.
Physiological response to acetic acid stress of theAcetobacterpasteuranusHN 1.01 during liquid-preservation
MA Xin-feng1, CHEN Yi-lun1*, ZHOU Bo2, LI Chao-nan1, WU Hui1,HUANG Ying-qian1, ZHANG Yu-huan1, GUO Sha-sha1
1(College of Food Science and Engineering, Shandong Agricultural University, Taian 271018, China) 2(College of Life Sciences, Shandong Agricultural University, Taian 271018, China)
The preservation liquid with different acidity was used to preserveAcetobacterpasteurianusHuniang 1.01, a tested acetic acid bacteria. The changes of survival, dehydrogenase activity, acidity, content of cell polysaccharide with the preservation time prolonged were detected. Cell morphological changes were observed with light microscope and alteration of fatty acid components of cell membrane would be also analyzed by Gas chromatography-mass spectrometry (GC-MS). On the whole, as the extension of preservation time, the living bacteria number slowly declined at first and then decreased rapidly, while the dehydrogenase activity fluctuated. Acidity changed slightly and rose smoothly. With the excessive increasing of acidity, the growth and metabolic activity of acetic acid bacteria were restrained through the decreased survival rate and dehydrogenase activity. Cell morphology changed from regular oval-shape to irregular long rod-shape. The content of capsular polysaccharide increased. Ratio of unsaturated fatty acids to saturated fatty acids was increased obviously. On the basis of the results obtained from the experiment, it could deduced thatAcetobacterpasteurianusHuniang 1.01 mainly relied on the cooperation of changes of activity of alcohol respiratory chain, cell morphology, membrane fatty acids, extracellular capsular polysaccharide and membrane fluidity to tolerate acetic acid environment.
AcetobacterpasteuranusHuniang 1.01; liquid-preservation; acidity; growth; cell morphology; membrane fatty acids
10.13995/j.cnki.11-1802/ts.201601008
硕士研究生(陈义伦教授为通讯作者,E-mail: cylun@ sdau. edu. cn)。
山东省自主创新成果专项(2014ZZCX07301)资助
2015-09-01,改回日期:2015-10-14
