碱胁迫条件下草本植物根系力学强度试验研究*
2016-09-26李光莹付江涛余冬梅胡夏嵩栗岳洲虎啸天
李光莹 付江涛 余冬梅 胡夏嵩③ 栗岳洲 虎啸天
(①中国科学院青海盐湖研究所 西宁 810008)
(②中国科学院大学 北京 100049)
(③青海大学 西宁 810016)
碱胁迫条件下草本植物根系力学强度试验研究*
李光莹①②付江涛①②余冬梅①胡夏嵩①③栗岳洲①②虎啸天①②
(①中国科学院青海盐湖研究所西宁810008)
(②中国科学院大学北京100049)
(③青海大学西宁810016)
本项研究选取适宜于黄河源区寒旱环境生长的两种草本植物垂穗披碱草(Elymus nutans Griseb)和老芒麦(Elymus sibiricus Linn)作为供试种,通过室内培育种植方法,采用浓度分别为25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1的NaHCO3溶液对垂穗披碱草和老芒麦两种植物进行了碱胁迫处理,同时采用浓度为0mmol·L-1的溶液作为未进行碱胁迫处理对照组。在碱胁迫处理后第15d和第30d,分别测定了两种植物单根抗拉力、单根抗拉强度,以及脯氨酸含量、丙二醛含量、叶绿素含量、相对电导率值等4个抗盐碱性生理指标。试验结果表明:碱胁迫对两种植物单根抗拉力影响程度随浓度增加而增大,亦随生长时间增加而增大,其中当碱胁迫浓度为25mmol·L-1时,两种植物单根抗拉力值均大于未进行碱胁迫处理呈正常生长的对照组植物,而当浓度大于25mmol·L-1时,两种植物单根抗拉力值均小于对照组的两种植物;碱胁迫条件下两种植物单根抗拉强度较对照组两种植物均呈增大趋势,增幅为3%~16%,且相同浓度条件下,两种植物单根抗拉强度随生长时间增加而呈降低趋势,降幅为1%~18%;相同浓度和相同生长时间条件下,老芒麦单根抗拉力值较垂穗披碱草大0.13~0.53N,且老芒麦单根抗拉强度值较垂穗披碱草大20~65MPa;由灰色关联分析结果可知,在碱胁迫条件下,脯氨酸含量、丙二醛含量、叶绿素含量、相对电导率值等4种生理指标中,相对电导率值与两种植物单根抗拉力及单根抗拉强度关联度相对最大即为0.888~0.996,反映出两种植物单根抗拉力及单根抗拉强度受相对电导率值影响相对较为显著。本项研究对于进一步探讨盐碱胁迫条件下,植物根系力学强度特征和影响机理等方面具有重要理论研究价值,同时利用植物有效防治黄河源土地盐碱化地区水土流失、浅层滑坡、沙化等灾害具有现实意义。
寒旱环境草本植物碱胁迫单根抗拉力株高相对存活率生理指标
0 引 言
土地盐碱化是影响生态环境的一个全球性科学问题(Flowers et al., 1977),即使在黄河源地区,由于受气候等因素影响出现了一定程度的草地退化现象,造成一定规模的裸地和裸露边坡的产生,导致表层土壤的pH值增大、碱性增强(马世震等,2004;周华坤等,2012),并随之出现了一定程度的土地盐碱化、植被退化和沙化等现象。张森琦等(2004c)关于黄河源区生态环境地质问题分类时指出,作为以荒漠化为主的土地资源退化与生态环境恶化类型的土壤盐渍化亚类,其所带来的主要危害表现在使得源区不耐盐植物衰亡,地面植被稀落,土壤裸露,蒸发增大;土地含盐量增大,也造成水环境变异,加剧了植被退化和相对脆弱生态环境的不断恶化(张森琦等,2004a,2004b,2004c)。封建明等(2004)通过对2000aTM影像解译,解译结果显示,黄河源区土地退化面积达31464.8km2,占源区总面积的34.4%,其中土地沙漠化面积为13434.8km2,植被退化面积为7636.5km2,水蚀面积为7101.7km2,冻融侵蚀面积为3084.5km2,盐渍化面积为389.3km2,分别占退化面积的42.45%,24.13%,22.44%,9.75%,1.23%。因此在黄河源区开展植被恢复,以有效防治水土流失、土地沙化、盐碱化等灾害,保护区域生态环境意义重大。研究表明,植物通过其茎叶和根系的涵水固土作用,可起到防治水土流失、浅层滑坡等灾害,同时适宜于盐碱化区生长植物,还具有控制土地盐碱化、起到改良土壤作用。
盐碱胁迫条件下对植物生长量和生理指标均会产生一定程度影响(Shi et al., 2005;Song et al., 2009)。Galvan-Ampudia et al.(2011)通过对Arabidopsis属植物在盐碱胁迫下根系生长发育特征研究认为,适量浓度盐碱溶液会促进和增加植物根系生物量,而较高浓度盐溶液亦会抑制植物根系生长、发育,甚至造成植物枯萎或死亡。Vos et al.(2013)通过对Diplotaxis tenuifolia、Cochlearia officinalis等两种植物施加浓度为0mmol·L-1、50mmol·L-1、100mmol·L-1、200mmol·L-1、300mmol·L-1的NaCl胁迫溶液,结果表明当溶液浓度为50mmol·L-1时,D.tenuifolia的鲜重、相对生长率显著高于对照组;当浓度高于50mmol·L-1时,植物鲜重、相对生长率则显著低于对照组,且浓度愈高,植物鲜重、相对生长率相对愈低,而对于植物C.officinalis其鲜重、相对生长率随溶液浓度增加而逐渐减小。王素平等(2006)通过室内水培试验研究了黄瓜(Cucumis satwus)在浓度为0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mol·L-1的NaCl溶液胁迫下根系的生长反应,结果表明当NaCl溶液低于25mmol·L-1时,促进植物根系生长即高出对照组平均根长约3cm左右;当高于该浓度时,植物根系生长受到一定程度抑制,根系生长长度低于对照组平均根长约10cm左右。宁建凤等(2010)利用温室盆栽试验,研究不同浓度NaCl胁迫对罗布麻(Apocynum venetum)生长及生理特性影响,结果表明采用浓度为100~400mmol·L-1NaCl胁迫30d后即可明显抑制罗布麻生长,随着盐浓度增加,丙二醛含量显著增加;当NaCl浓度小于等于200mmol·L-1时,罗布麻叶片脯氨酸含量随着盐浓度的增加而增加,而当盐浓度进一步增加时,其脯氨酸含量则呈下降趋势。杨月娟等(2014)通过采用0mmol·L-1,50mmol·L-1,150mmol·L-1,250mmol·L-1等不同浓度NaCl溶液处理垂穗披碱草幼苗,通过检测垂穗披碱草在盐胁迫逆境下生理生化变化,并与老芒麦进行比较,结果表明垂穗披碱草对盐害具有一定调控能力,能在一定盐浓度下生长,抗盐性高于老芒麦;随着胁迫浓度的提高,垂穗披碱草和老芒麦的脯胺酸质量分数的增加较为显著,且垂穗披碱草始终高于老芒麦。
盐碱土地区植物固土护坡机理主要表现在根系力学效应和茎叶水文效应两方面,针对植物根系力学效应,需进一步探讨生长在盐碱土地区植物,不同盐碱化程度土壤对根系强度影响等相关内容。国内外已有研究成果中,开展植物根系抗拉力学强度方面的试验研究相对较多(Gray et al., 1995;朱海丽等,2009;胡夏嵩等,2011;张兴玲等,2012;Hu et al.,2013)。Mattia et al.(2005)、Baets et al.(2008)对生长于干旱和盐碱环境Atriplex halimus、Salsola genistoides等25种植物开展了根系强度力学试验,认为单根抗拉力、单根抗拉强度与根径间分别存在指数函数和幂函数关系,即植物单根抗拉力随根径增加而增大,而单根抗拉强度随根径增大而减小;Genet et al.(2006)研究了不同生长阶段的日本柳杉(Cryptomeria japonica(L.f.)D.Don)根系对边坡土体加固作用,结果表明植物生长期愈长则根径愈大,其抗拉强度相应愈小,即根径与抗拉强度呈幂函数关系,且根系对土体加固效果随植物生长时间增加而提高。苑淑娟等(2009)研究了不同生长期柠条锦鸡儿根系在不同径级条件下抗拉强度与根径关系,结果表明当根系径级分别划分为0.5~0.6mm,0.9~1.0mm,1.3~1.4mm等7种根径范围时,由生长初期至生长旺盛期,柠条锦鸡儿单根抗拉力分别由32.95MPa,50.68MPa,50.60MPa等减小至42.28MPa,47.40MPa,48.84MPa等,即其平均抗拉力由45.31MPa减小至49.70MPa。相比较而言,已有研究成果中反映盐碱胁迫条件下,对植物根系力学强度影响等相关成果相对较少,尤其是涉及黄河源区,对于生长在不同盐碱化土壤条件下的植物,探讨植物生长区土壤盐碱化及其对根系力学强度的影响,尚需开展大量的基础性研究工作。
本项研究选择位于黄河源区玛多星星海地区为例,选取了适宜于黄河源区生态恢复的两种草本植物,即垂穗披碱草和老芒麦作为供试种,通过两种植物的室内培育种植;采用碳酸氢钠(NaHCO3)溶液作为碱胁迫溶液,开展5种不同浓度条件下碱胁迫对两种植物株高、相对存活率等生长量指标影响,脯氨酸、丙二醛等4种生理指标随浓度变化的规律;在此基础上,进一步探讨不同碱胁迫浓度条件下两种植物单根抗拉力、单根抗拉强度及其变化规律,以及根系力学强度与4种生理指标之间的关系。该研究成果将有助于进一步开展黄河源区,不同程度土壤盐碱化对植物根系力学强度影响机理,同时对源区植被恢复和利用植物有效防治土地盐碱化、水土流失和沙化、浅层滑坡等灾害,对于该区域实现基础设施建设与生态环境保护之间的协调发展具有理论研究价值和实际意义。
1 试验材料与植物培养方法


图1 垂穗披碱草和老芒麦两种供试种的种植过程及其生长情况Fig.1 Planting process and growing situation of Elymus nutans Griseb and Elymus sibiricus Linna.试验盆中种植两种草本植物;b.株高及相对存活率定期统计;c.碱胁迫30d后不同浓度下两种草本植物生长情况;d.两种草本植物单根力学试验及生理指标试验取样
试验采用盆口直径为30cm、高为19cm的无底孔塑料试验盆,装入珍珠岩,播种前每盆浇灌蒸馏水300mL。将种子用酒精消毒后,均匀撒播在试验盆中,垂穗披碱草和老芒麦的播种量分别为120粒/盆和170粒/盆。两种植物种植后每3d用霍格兰氏(Hoagland)营养液浇灌一次,浇灌量为用称重法确定的失水量60g/盆,每次在固定时间进行浇灌,即于当日16:00~20:00时之间进行浇灌。待两种植物出苗20d后对其进行碱胁迫处理。此外,室内试验环境的温度为19~26℃,相对湿度为59%~68%。
2 碱胁迫试验原则与方法
2.1碱胁迫方法及其相关指标测定方法
试验设置NaHCO3溶液为5个浓度梯度,即分别为0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1,其中0mmol·L-1浓度为未进行碱胁迫处理的对照组,其溶液仅为蒸馏水,其他4种浓度梯度的NaHCO3溶液均用蒸馏水配置,碱胁迫处理时每盆植物浇灌300mL NaHCO3溶液,分3次浇灌,即每5d浇灌一次,每次用量为100ml。室内两种植物种植过程及生长情况(图1)。
按照试验方案,两种植物碱胁迫后的第15d进行了第一次单根拉伸试验和生理指标测定试验,第30d进行了第二次单根拉伸试验和生理指标测定试验。试验取样时对5种浓度下的植物分别取样,每种浓度下对植物取样方法均相同,即首先剪取质量约为6g的植物地上茎叶部分用于测定脯氨酸、丙二醛、叶绿素和相对电导率等4种生理指标,同时将试验盆中余下的根系部分取出,清除根系上附着的珍珠岩,然后选取单根长为5cm以上的根段进行单根拉伸试验。为确保试验结果准确性,脯氨酸等4种生理指标测定试验及单根拉伸试验均在样品制取后立刻进行。每次试验时所测定的根系力学强度指标包括单根抗拉力、单根抗拉强度,生理指标包括脯胺酸含量、丙二醛含量、叶绿素含量、相对电导率值;此外,在两种植物种植培养过程中定期统计植物株高及植物相对存活率等生长量指标,即在幼苗生长初期每3d统计一次,碱胁迫处理后则按每5d统计一次,碱胁迫处理30d后按每10d统计一次进行。为进一步研究两种供试种植物耐盐碱能力,本项试验选取脯氨酸含量、丙二醛含量、叶绿素含量以及相对电导率值等4项耐盐碱性生理指标进行了测定,该4项生理指标在碱胁迫条件下均表现出不同程度的变化,是反映植物生长受碱胁迫影响的基础指标(张志良等,2003;王宇超等,2012)。本项研究中脯氨酸含量采用酸性茚三酮法测定(Thakur et al.,2005),丙二醛含量采用硫代巴比妥酸(TBA)比色法测定(张志良等,2003;Thakur et al.,2005),叶绿素含量采用丙酮提取法测定(张志良等,2003;王宇超等,2012),相对电导率采用电导法测定(Shi et al.,2005)。脯氨酸等4种生理指标均由两种植物的地上茎叶部分测得。
2.2根系拉伸试验原理与强度计算方法
本项研究对碱胁迫后的两种植物根系进行了单根拉伸试验,试验采用课题组自行设计加工的室内拉伸与剪切试验仪,该试验仪依据电子万能试验机的工作原理和基本结构制成,即仪器主要由数据采集系统和工作系统2部分组成,其工作原理(图2)(Zhu et al.,2009)。试验通过数据采集系统记录整个单根拉伸过程中,获得了单根破坏时的最大抗拉力,并根据单根最大抗拉力等试验数据,由公式(1)计算出单根抗拉强度。
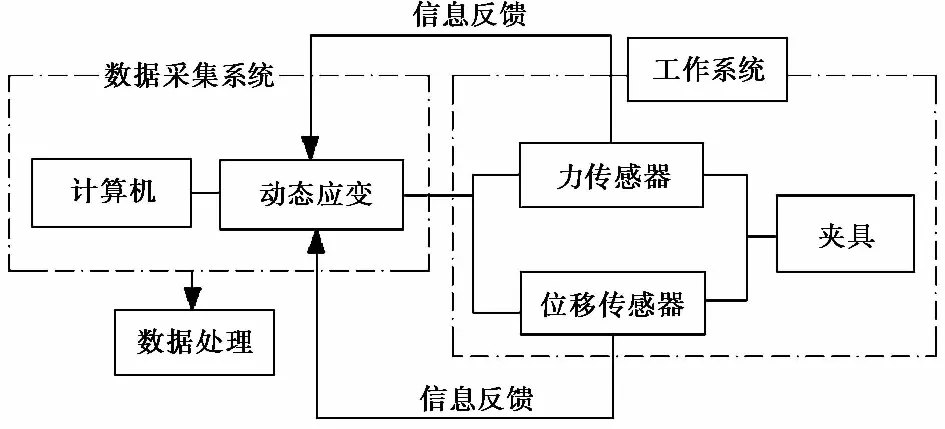
图2 单根拉伸与剪切试验仪工作原理图(冯利波等,2005)Fig.2 Operating principle diagram of single root tensile and shear test apparatus(Feng et al., 2005)
(1)
式中,P为单根抗拉强度(MPa);F为单根最大抗拉力(N);D为根系的直径(mm)。5种浓度条件下两种植物的单根拉伸试验的结果(表1)。
表1 5种浓度条件下两种植物的单根拉伸试验结果
Table 1 Results of single root tensile tests of two herbs under the condition of five concentrations of alkali treatment
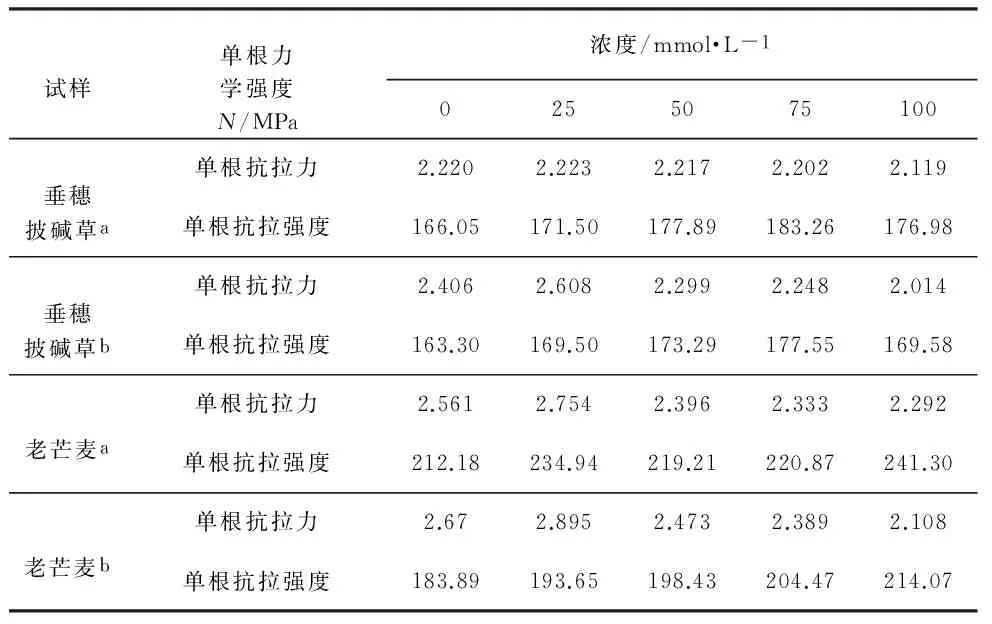
试样单根力学强度N/MPa浓度/mmol·L-10255075100垂穗披碱草a单根抗拉力2.2202.2232.2172.2022.119单根抗拉强度166.05171.50177.89183.26176.98垂穗披碱草b单根抗拉力2.4062.6082.2992.2482.014单根抗拉强度163.30169.50173.29177.55169.58老芒麦a单根抗拉力2.5612.7542.3962.3332.292单根抗拉强度212.18234.94219.21220.87241.30老芒麦b单根抗拉力2.672.8952.4732.3892.108单根抗拉强度183.89193.65198.43204.47214.07
①表中单根力学强度单位中,“N”用于表示草本单根抗拉力单位,“MPa”用于表示草本单根抗拉强度单位;②表中垂穗披碱草a和垂穗披碱草b分别表示垂穗披碱草在碱胁迫处理后第15d和第30d的试样,老芒麦a和老芒麦b则分别表示老芒麦在碱胁迫处理后第15d和第30d的试样;③表中0mmol·L-1浓度表示未进行碱胁迫的对照组试样。
3 结果与分析
3.1碱胁迫对植物根系力学强度影响
碱胁迫条件下对两种草本根系力学强度变化特征分析,主要是通过在相同生长期、相同浓度等条件下,分别探讨了碱胁迫对植物根系力学强度影响。试验所得到的5种浓度条件下两种植物的单根拉伸试验结果(表1)。
3.1.1相同生长期碱胁迫对植物根系力学强度影响
如表1所示,相同生长期内,对比同一种植物在不同浓度下的单根抗拉力可知,在浓度为25mmol·L-1时,两种植物的单根抗拉力均相对最大,其次为对照组0mmol·L-1时的单根抗拉力;当浓度大于25mmol·L-1时,两种植物的单根抗拉力均随浓度增大而呈降低趋势。这表明在相同生长期内,在25mmol·L-1浓度下有利于两种植物单根抗拉力的增大,而在浓度大于25mmol·L-1条件下两种植物单根抗拉力呈降低趋势。
相同生长期内,分别对比25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的植物单根抗拉力与对照组植物单根抗拉力的相对变化率可知,垂穗披碱草在碱胁迫处理15d后,分别在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的单根抗拉力相对变化率依次为0.14%、-0.14%、-0.81%、-4.55%,在碱胁迫处理30d后的单根抗拉力相对变化率依次为8.40%、-4.45%、-6.57%、-16.29%;由此可见,在碱胁迫处理后15d和30d两个生长期内,碱溶液浓度愈大,垂穗披碱草单根抗拉力的相对变化率愈大,即受碱胁迫的影响愈显著。老芒麦在碱胁迫处理15d后,分别在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的单根抗拉力相对对照组的单根抗拉力相对变化率依次为7.54%、-6.44%、-8.90%、-10.50%,在碱胁迫处理30d后的单根抗拉力相对对照组的单根抗拉力相对变化率依次为8.43%、-7.38%、-10.52%、-21.05%,即在碱胁迫处理后15d和30d两个生长期内,老芒麦的单根抗拉力亦均表现出随浓度的增大,受碱胁迫影响愈显著的特征,且老芒麦在碱胁迫15d后的单根抗拉力相对变化率显著大于相同生长期内的垂穗披碱草;而在碱胁迫30d后老芒麦单根抗拉力相对变化率与相同生长期内的垂穗披碱草基本一致。由以上分析表明,碱溶液浓度愈大,碱胁迫对单根抗拉力的影响也相应愈大,且在碱胁迫处理后15d内,老芒麦单根抗拉力受碱胁迫的影响相对较大,而在碱胁迫30d后,碱胁迫对两种植物单根抗拉力的影响程度基本一致。
在相同生长期内,对比两种植物碱胁迫处理后的单根抗拉强度可知,相对于未进行碱胁迫处理的对照组,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的单根抗拉强度均有所增大。即垂穗披碱草在碱胁迫处理15d后,相对于对照组,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的单根抗拉强度相对增幅依次为3.28%、7.13%、10.36%、6.58%,碱胁迫处理30d后4种浓度下的单根抗拉强度相对增幅依次为3.80%、6.12%、8.73%、3.85%,由上述单根抗拉强度相对增幅的规律表明,相同生长期内垂穗披碱草在浓度为0~75mmol·L-1范围内的单根抗拉强度随浓度增加而增大,超过75mmol·L-1浓度后单根抗拉强度即开始下降。老芒麦在碱胁迫处理15d后,4种浓度相对于对照组的单根抗拉强度的增幅依次为10.73%、3.32%、4.10%、13.72%,碱胁迫处理30d后4种浓度相对于对照组的单根抗拉强度增幅依次为5.31%、7.91%、11.19%、16.42%;由此可知,老芒麦在碱胁迫处理15d后,其单根抗拉强度随浓度变化的规律相对不显著,而在碱胁迫处理30d后,其单根抗拉强度表现出随浓度增加而增大的特征。
3.1.2相同浓度下碱胁迫对植物根系力学特性影响
如表1所示,对比相同浓度下两种植物的单根抗拉力可知,碱胁迫对单根抗拉力的影响因植物生长期不同而表现出不同的变化特征。在碱胁迫处理后15d至30d内,在0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等5种浓度下,随生长期增加垂穗披碱草的单根抗拉力的变化率依次为8.38%、17.32%、3.70%、2.09%、-4.96%,老芒麦的单根抗拉力变化率依次为4.26%、5.12%、3.21%、2.40%、-8.03%,故两种植物的单根抗拉力在浓度分别为0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1条件下均随生长期增加而增大,且25mmol·L-1浓度下两种植物单根抗拉力的增大幅度相对最大,浓度大于25mmol·L-1时,单根抗拉力的增大幅度均低于对照组,且浓度愈高时,两种植物单根抗拉力增大幅度相对愈小,直至在高浓度即100mmol·L-1的条件下,两种植物单根抗拉力随生长期增加而表现出降低的趋势。
对比两种植物分别在碱胁迫处理后15d和30d两个生长期内,25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的单根抗拉力相对对照组单根抗拉力的相对变化率可知,在相同浓度条件下,垂穗披碱草和老芒麦在碱胁迫处理后30d的单根抗拉力相对变化率均显著大于碱胁迫处理后15d,即反映出随着生长期的增加,两种植物的单根抗拉力受浓度的影响愈显著的变化趋势。
对比相同浓度下两种植物的单根抗拉强度可知,其单根抗拉强度均表现出随生长期的增加而降低的特征。在0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等5种浓度下,垂穗披碱草在碱胁迫处理后15d至30d内的单根抗拉强度的降幅依次为1.7%、1.2%、2.6%、3.1%、4.2%,与对照组相比,在25mmol·L-1浓度条件下单根抗拉强度的降幅相对较小,而在大于25mmol·L-1浓度条件下,单根抗拉强度的降幅均相对较大,且随浓度增加呈增大趋势。在0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等5种浓度下,老芒麦在碱胁迫处理后15d至30d的单根抗拉强度的降幅依次为13.3%、17.6%、9.5%、7.4%、11.3%,老芒麦单根抗拉强度降幅的大小规律与垂穗披碱草单根抗拉强度的降幅大小规律有所不同,即与对照组相比,老芒麦在25mmol·L-1浓度条件下的单根抗拉强度的降幅相对较大,而大于25mmol·L-1浓度条件下植物单根抗拉强度的降幅均小于对照组。
此外,相同浓度和相同生长期条件下,老芒麦的单根抗拉力、单根抗拉强度均表现出相对垂穗披碱草略大的特征,其中老芒麦的单根抗拉力值较垂穗披碱草的单根抗拉力值大0.13~0.53N,单根抗拉强度值较垂穗披碱草大20~65MPa,这在一定程度上说明在碱胁迫条件下,老芒麦的根系具有相对较强的力学强度,即相对于垂穗披碱草,老芒麦则具有更显著的增强土体强度作用。
3.2碱胁迫对植物生长量的影响
植物株高及植物相对存活率是反映植物耐盐碱性的相对直观的2个生长量指标(苏慧等,2005),故本项研究在两种植物培养过程中对植物株高及其相对存活率进行了定期统计,其结果(图3,图4)。其中,相对存活率(苏慧等,2005)指的是碱胁迫处理条件下植物存活株数与未进行碱胁迫处理的对照组植物存活株数的百分比,即相对存活率(苏慧等,2005)=(碱胁迫处理的植物的存活株数/对照组植物的存活株数)×100%。

图3 5种浓度条件下两种植物的株高增长与生长时间关系Fig.3 The relationship between plant height and growth time of two herbs under the condition of five different concentrations of alkali treatmenta.垂穗披碱草;b.老芒麦

图4 4种浓度碱胁迫条件下的两种植物相对存活率与生长时间关系Fig.4 The relationship between relative survival rate and growth time of two herbs under the condition of four different concentrations of alkali treatmenta.垂穗披碱草;b.老芒麦
由图3、图4可知,当两种植物出苗生长20d后仍处于幼苗期时即进行碱胁迫处理,碱胁迫处理后两种植物在5种浓度下的生长特征开始出现显著差异,即在25mmol·L-1浓度条件下,两种植物的相对存活率均保持在90%以上,且两种植物在25mmol·L-1和未进行碱胁迫处理的对照组0mmol·L-1浓度条件下的株高增长规律基本一致,即该两种浓度下的垂穗披碱草均在碱胁迫处理后25d时,株高增长开始逐渐变得缓慢,平均株高为20±1.1cm,该两种浓度下的老芒麦均在碱胁迫处理后40d时株高增长逐渐变得缓慢,平均株高为20±0.8cm。
在50mmol·L-1浓度条件下,两种植物的株高及相对存活率均表现出相对较低的特征。垂穗披碱草和老芒麦分别在碱胁迫处理20d和30d后株高增长逐渐变得缓慢,即平均株高分别为18±1.2cm和16±1.1cm,垂穗披碱草在碱胁迫处理30d后的相对存活率达到58.8%,老芒麦为62.8%;在75mmol·L-1浓度条件下的两种植物的株高亦分别在碱胁迫处理20d和30d后增长缓慢,但相对存活率略低于50mmol·L-1浓度下的两种植物的相对存活率。
在100mmol·L-1浓度下,两种植物的株高及相对存活率均显著低于0~75mmol·L-1浓度下的株高及相对存活率。垂穗披碱草和老芒麦的株高均在碱胁迫处理15d后增长逐渐变得缓慢,平均株高分别为16±1.5cm和14±1.1cm左右,垂穗披碱草在碱胁迫处理30d后的相对存活率仅为8.8%,老芒麦为16.7%,这表明两种植物在100mmol·L-1浓度下均生长受到一定程度抑制。
由上述分析可知,与未进行碱胁迫处理的对照组相比,两种供试种植物均可在相对较低浓度25mmol·L-1条件下正常生长存活,在相对中等浓度50~75mmol·L-1条件下亦可生长存活,但植物株高和存活率相对对照组较低,而在相对高浓度100mmol·L-1条件下,两种植物均生长受到抑制,植物株高和相对存活率均显著低于对照组。相同生长期内,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下的老芒麦的相对存活率较垂穗披碱草高3%~8%,即在一定程度上反映出老芒麦耐盐碱性相对更为显著。
3.3碱胁迫下植物生理特性的响应
为进一步研究两种供试种植物的耐盐碱能力,本项试验选取脯氨酸含量、丙二醛含量、叶绿素含量以及相对电导率值等4项耐盐碱性生理指标进行了测定,该4项生理指标在碱胁迫条件下均表现出不同程度的变化,是反映植物生长受碱胁迫影响的基础指标(Shi et al., 2005;Thakur et al.,2005)。本项研究中脯氨酸等4种生理指标的测定结果(表2,表3)。
表2 5种浓度条件下垂穗披碱草的生理指标测定结果
Table 2 Results of physiological indexes tests of Elymus nutans Griseb under the condition of five different concentrations
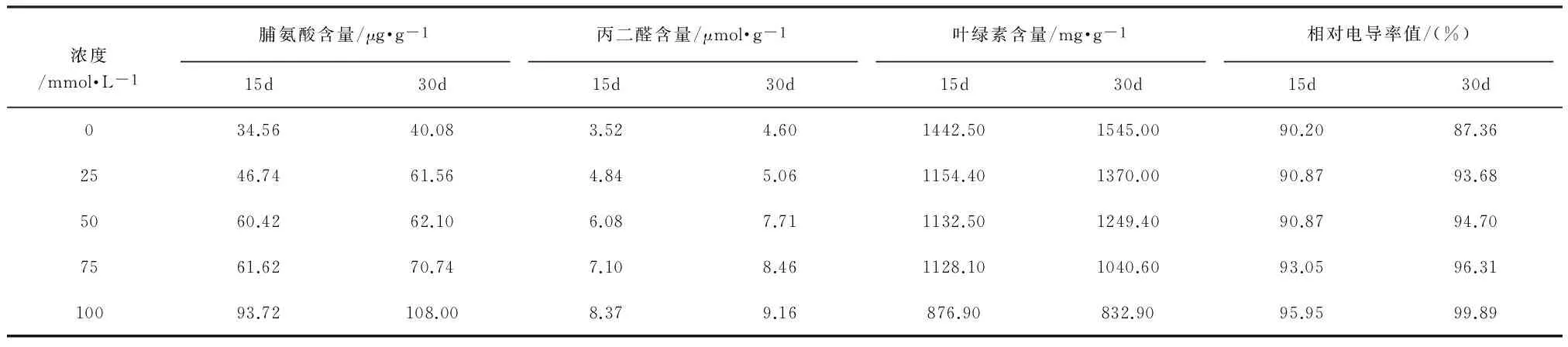
浓度/mmol·L-1脯氨酸含量/μg·g-1丙二醛含量/μmol·g-1叶绿素含量/mg·g-1相对电导率值/(%)15d30d15d30d15d30d15d30d034.5640.083.524.601442.501545.0090.2087.362546.7461.564.845.061154.401370.0090.8793.685060.4262.106.087.711132.501249.4090.8794.707561.6270.747.108.461128.101040.6093.0596.3110093.72108.008.379.16876.90832.9095.9599.89
表中浓度0mmol·L-1表示未进行碱胁迫处理的对照组,其溶液中不含NaHCO3,仅为蒸馏水脯氨酸是植物体内有效的渗透调节物质,脯氨酸含量可作为衡量植株耐盐碱性的指标(Thakur et al., 2005;Neelam et al., 2005;贾亚雄等,2008)。如表2、表3所示,本项研究中两种植物的脯氨酸含量均随浓度增加呈增大趋势,且与未进行碱胁迫处理的对照组相比,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度条件下,垂穗披碱草的脯氨酸含量在碱胁迫处理15d后的增幅依次为35%、75%、78%、171%,在碱胁迫处理30d后的增幅依次为53%、55%、76%、169%;老芒麦的脯氨酸含量在碱胁迫处理15d后的增幅依次为4%、12%、28%、194%,在碱胁迫处理30d后的增幅依次为21%、35%、59%、95%。由此可知,两种植物在100mmol·L-1浓度下受碱胁迫的影响显著高于25mmol·L-1、50mmol·L-1、75mmol·L-1浓度的影响,且垂穗披碱草脯氨酸含量随浓度增加而增大的幅度显著大于老芒麦,即说明碱胁迫对垂穗披碱草的影响相对较大。
丙二醛作为膜脂过氧化作用产物,其表现与细胞膜透性是一致的,丙二醛含量的多少可代表膜损伤程度的大小,即丙二醛含量愈大,植物体内细胞受到的破坏愈严重(Thakur et al., 2005;宁建凤等,2010)。如表2、表3所示,碱胁迫使两种植物的丙二醛含量不同程度的增大,即在碱胁迫处理15d后,与对照组相比,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下,垂穗披碱草丙二醛含量的增幅依次为37%、75%、102%、137%,老芒麦丙二醛含量的增幅依次为17%、20%、29%、35%,垂穗披碱草丙二醛含量的增幅显著大于老芒麦;在碱胁迫处理30d后,与对照组相比,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下,垂穗披碱草丙二醛含量的增幅依次为10%、68%、84%、99%,老芒麦丙二醛含量的增幅依次为64%、93%、183%、302%,老芒麦丙二醛含量的增幅显著大于垂穗披碱草。由此可知,在碱胁迫处理15d后,垂穗披碱草受碱胁迫的影响显著大于老芒麦,而在碱胁迫处理30d后,碱胁迫对老芒麦的影响相对较大。
表3 5种浓度条件下老芒麦的生理指标测定结果
Table 3 Results of physiological indexes tests of Elymus sibiricus Linn under the condition of five different concentrations

浓度/mmol·L-1脯氨酸含量/μg·g-1丙二醛含量/μmol·g-1叶绿素含量/mg·g-1相对电导率值/%15d30d15d30d15d30d15d30d031.3943.873.253.401645.002368.8052.8550.202532.7153.023.805.591442.882169.9053.3062.205035.2759.153.916.551216.941658.8054.1075.307540.1669.544.199.631187.061626.0060.1084.6010092.4885.434.3910.25903.431557.5064.5092.00
表中浓度0mmol·L-1表示未进行碱胁迫处理的对照组,其溶液中不含NaHCO3,仅为蒸馏水盐碱胁迫使叶绿素的合成受阻,叶绿素含量下降,植物叶片叶绿素含量是衡量植物耐盐碱性的重要生理指标之一(王宇超等,2012)。由表2、表3可知,两种植物的叶绿素含量均随浓度增加而降低,在碱胁迫处理15d后,与对照组相比,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下,垂穗披碱草叶绿素含量的降幅依次为20%、21%、22%、39%,老芒麦叶绿素含量的降幅依次为12%、16%、18%、55%,在碱胁迫处理30d后,在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下,垂穗披碱草叶绿素含量的降幅依次为11%、20%、33%、47%,老芒麦叶绿素含量的降幅依次为8%、30%、32%、35%。由此可知,在相同生长期内,垂穗披碱草的叶绿素的降低幅度相对老芒麦较大,即一定程度上反映了老芒麦的耐碱性相对更为显著。
植物组织受到逆境伤害时,通过相对电导率值可得知植物组织受伤害程度,从而反映植物的抗逆性强弱(Shi et al., 2005;宁建凤等,2010)(表2,表3),在25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1等4种浓度下,垂穗披碱草的相对电导率值均大于90%,而老芒麦的相对电导率值主要集中在50%~90%之间,即垂穗披碱草的相对电导率值显著大于老芒麦,说明碱胁迫对垂穗披碱草生长的影响相对较大。
由上述分析可知,垂穗披碱草的脯氨酸含量、叶绿素含量随浓度变化而增大或降低的幅度相对较大,垂穗披碱草的丙二醛含量在碱胁迫处理15d后随浓度的变化幅度亦较老芒麦大,垂穗披碱草的相对电导率值显著大于老芒麦,故从脯氨酸等4种生理指标随浓度变化特征可知,老芒麦的耐碱性相对更为显著。此外,两种植物的单根抗拉力在25mmol·L-1浓度条件下相对最大,脯氨酸等4种生理指标均未表现出在25mmol·L-1浓度时具有显著变化特征;当浓度大于25mmol·L-1时,两种植物的单根抗拉力均随浓度增加而降低,4种生理指标中的叶绿素含量亦随浓度增加而降低,两者之间存在正相关关系,而脯氨酸含量、丙二醛含量及相对电导率值均随浓度增加而增大,说明这3种生理指标与单根抗拉力之间存在负相关关系。此外,脯氨酸含量等4种生理指标与植物单根力学强度之间的相关性程度,可通过下述的灰色关联分析来定量描述。
3.4植物生理指标与根系力学强度之间的关系
为进一步探讨植物生理指标对单根抗拉力及单根抗拉强度影响,采用灰色关联分析法,通过分别计算两种植物单根抗拉力、单根抗拉强度与4种生理指标之间的关联度,分析植物生理指标与根系力学强度之间的关系。灰色关联分析(Shi et al., 2005;王宇超等,2012)是灰色系统理论的一个组成部分,它可对灰色系统中主参考因子与相关比较因子的关系密切程度进行定量描述和比较,关联度愈大,表明比较因子与参考因子的相关性愈强。本项研究所采用的关联度计算方法如下:
(1)设参考数据列和比较数据列。将主要参考因子和相关比较因子的原始数据用矩阵表示。
设参考数据列为:X0={x0(1),x0(2),…,x0(n)}。
设比较数据列为:X1={x1(1),x1(2),…,x1(n)},
X2={x2(1),x2(2),…,x2(n)},
……,
Xm={xm(1),xm(2),…,xm(n)}。
(1)
式中,n为每个数据列包括的数据个数;m为比较数据列的个数。
本项研究中,参考数据列X0为表1中所示单根抗拉力或单根抗拉强度数据列;比较数据列共有4个,即X1,X2,X3,X4分别表示脯氨酸含量、丙二醛含量、叶绿素含量和相对电导率值数据列,xi(1)、xi(2)、xi(3)、xi(4)、xi(5)分别表示Xi数据列所包含的原始数据值(i=0,1,2,3,4),即Xi数据列所对应的单根抗拉力、脯氨酸含量等指标分别在0mmol·L-1、25mmol·L-1、50mmol·L-1、75mmol·L-1、100mmol·L-1浓度下的值(表2、表3)。
(2)数据列的无量纲化。上述m+1个数据列的量纲或数量级不同,需要进行无量纲化处理,使得评价结果具有可比性。采用初值化方法,对每个数据列的每个指标数据进行无量纲化,计算公式为(Shi et al., 2005;王宇超等,2012):
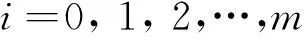
(2)
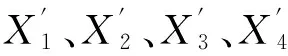
(3)计算关联系数。关联系数表示比较数据列与参考数据列每个对应数据之间的关联程度,其计算公式为(Shi et al.,2005;王宇超等,2012):

(3)
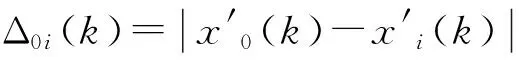
本项研究中,根据公式(3)计算了无量纲化后的单根抗拉力等参考数据列与脯氨酸含量等比较数据列各对应数据值之间的关联系数,其中,ρ取值为0.5。ξ01(k)、ξ02(k)、ξ03(k)、ξ04(k)分别表示单根抗拉力或单根抗拉强度与脯氨酸含量、丙二醛含量、叶绿素含量、相对电导率值各对应数据值之间的关联系数(k=1,2,3,4,5)。
(4)计算关联度。关联度为参考数据列与比较数据列之间所有对应数据的关联系数的平均值,由于关联系数的个数较多,不便于比较,故采用关联度来表示比较数据列与参考数据列之间的相关性,计算公式为(Shi et al., 2005;王宇超等,2012):
(4)
式中,γ0i为比较数据列Xi对参考数据列X0的关联度。
本项研究中,根据关联系数和公式(4)计算了关联度,γ01、γ02、γ03、γ04分别表示单根抗拉力或单根抗拉强度与脯氨酸含量、丙二醛含量、叶绿素含量、相对电导率值4种生理指标之间的关联度,结果如表4所示。
表4 两种植物单根抗拉力和单根抗拉强度与4种生理指标的关联度计算结果
Table 4 Calculating results of the correlation between single root tensile resistance,single root tensile strength and four physiological indexes of the two herbs
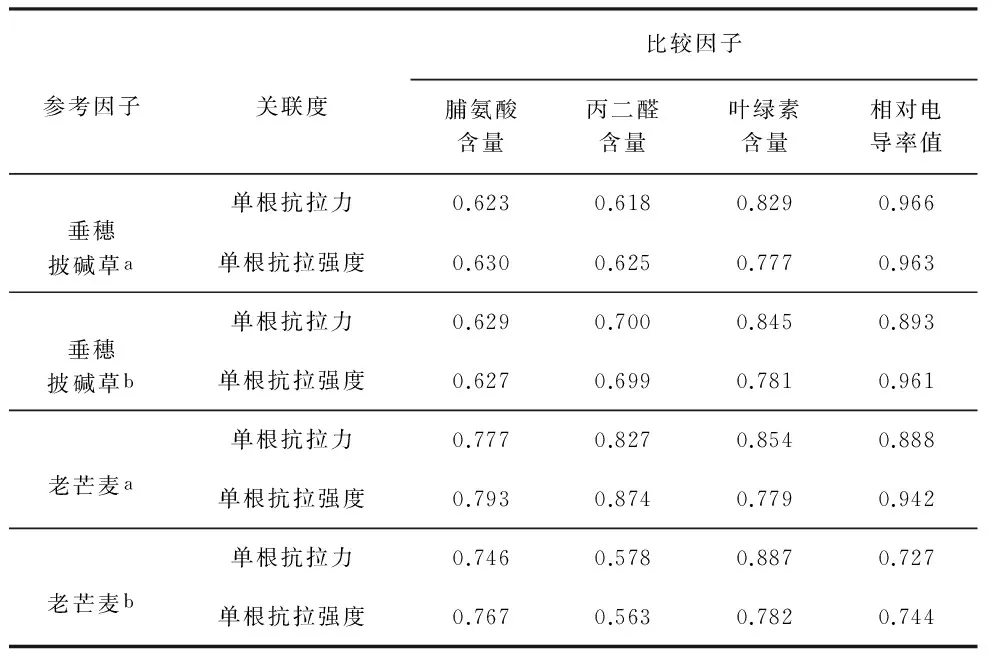
参考因子关联度比较因子脯氨酸含量丙二醛含量叶绿素含量相对电导率值垂穗披碱草a单根抗拉力0.6230.6180.8290.966单根抗拉强度0.6300.6250.7770.963垂穗披碱草b单根抗拉力0.6290.7000.8450.893单根抗拉强度0.6270.6990.7810.961老芒麦a单根抗拉力0.7770.8270.8540.888单根抗拉强度0.7930.8740.7790.942老芒麦b单根抗拉力0.7460.5780.8870.727单根抗拉强度0.7670.5630.7820.744
表中垂穗披碱草a和垂穗披碱草b分别表示垂穗披碱草在碱胁迫处理后第15d和第30d的试样;老芒麦a和老芒麦b则分别表示老芒麦在碱胁迫处理后第15d和第30d的试样
由表4可知,本项研究中所测得的4种生理指标与垂穗披碱草的单根抗拉力的关联度相对最大的为相对电导率值,其关联度在碱胁迫处理后15d和30d分别为0.966和0.893,其次为叶绿素含量与单根抗拉力的关联度,该关联度在碱胁迫处理后15d和30d分别为0.829和0.845,而脯氨酸含量、丙二醛含量与单根抗拉力的关联度相对较小,均不超过0.7。上述垂穗披碱草单根抗拉力与4种生理指标的关联度大小关系表明,在碱胁迫条件下,相对电导率值与垂穗披碱草单根抗拉力随浓度变化的规律相对较为一致,碱胁迫可通过影响植物的相对电导率值而影响植物的单根抗拉力,叶绿素含量对植物单根抗拉力的影响略低于相对电导率值,而脯氨酸含量和丙二醛含量影响植物单根抗拉力的程度相对较小。老芒麦的单根抗拉力与所测得的4种生理指标的关联度随生长期不同而不同,表现为在碱胁迫处理15d后,与老芒麦单根抗拉力关联度相对最大的生理指标亦为相对电导率值,两者的关联度为0.888,其次为叶绿素含量,两者的关联度为0.854,脯氨酸和丙二醛的关联度则相对较小,分别为0.777和0.827;而在碱胁迫处理30d后,与老芒麦单根抗拉力关联度相对最大的为叶绿素含量为0.887,其次是脯氨酸含量为0.746,再次是相对电导率值为0.727,而丙二醛含量相对最小为0.578,这说明了在碱胁迫处理后15d内,老芒麦的相对电导率值对其单根抗拉力影响相对较大,而在碱胁迫处理30d后,对老芒麦单根抗拉力影响相对较大的为脯氨酸含量。
脯氨酸等4种生理指标对单根抗拉强度的关联度的大小规律,与4种生理指标对单根抗拉力的关联度的大小规律基本保持一致,即垂穗披碱草在碱胁迫处理15d后和30d后的与单根抗拉强度的关联度大小关系依次为相对电导率值>叶绿素含量>脯氨酸含量>丙二醛含量,其中相对电导率值的关联度在碱胁迫处理15d后和30d后分别为0.963和0.961,叶绿素的关联度分别为0.777和0.781,脯氨酸的关联度分别为0.630和0.627,丙二醛的关联度分别为0.625和0.699。老芒麦在碱胁迫处理15d后其单根抗拉强度与相对电导率值、丙二醛含量、脯氨酸含量、叶绿素含量等4种生理指标的关联度由大至小依次为0.942、0.874、0.793、0.779,但在碱胁迫处理30d后,叶绿素含量与其单根抗拉强度的关联度相对最大为0.782。总之,两种植物的相对电导率值与单根抗拉强度的关联度相对最大,即相对电导率值对两种植物的单根抗拉强度的影响相对较显著。此外,老芒麦在碱胁迫处理30d后,叶绿素含量对其单根抗拉强度的影响相对较为显著。
4 结 论
(1)相同生长期内,碱胁迫对两种植物单根抗拉力的影响随浓度增加而增大,垂穗披碱草和老芒麦在浓度为25mmol·L-1时的单根抗拉力,均大于未进行碱胁迫处理的对照组的单根抗拉力;浓度大于25mmol·L-1时,两种植物单根抗拉力均低于对照组的单根抗拉力,且浓度愈大,单根抗拉力愈小;碱胁迫处理后两种植物的单根抗拉强度均大于对照组的单根抗拉强度,且随浓度增大,垂穗披碱草的单根抗拉强度呈先增大后减小的趋势,75mmol·L-1时两种植物的单根抗拉强度相对最大,而老芒麦在碱胁迫30d后,其单根抗拉强度随浓度增大而增大。
(2)在相同浓度下,碱胁迫对两种植物单根力学强度的影响随着生长期的增加而增大,其中在相对低浓度0~75mmol·L-1条件下,单根抗拉力随生长期增加而增大,而在相对高浓度100mmol·L-1条件下单根抗拉力随生长期增加而降低;两种植物的单根抗拉强度在相同浓度下,均随生长期增加而呈降低趋势;相同碱胁迫浓度和相同生长期条件下,老芒麦的单根抗拉力和单根抗拉强度分别较垂穗披碱草大0.13~0.53N和20~65MPa,这在一定程度上反映出在盐碱化地区生长的老芒麦相对更能显著增强土体强度。
(3)垂穗披碱草和老芒麦均可在未进行碱胁迫的对照组和相对低浓度25mmol·L-1碱胁迫下正常生长,在相对中等浓度即50~75mmol·L-1碱胁迫下亦可生长,但平均株高及相对存活率相对于对照组均较低,而在相对高浓度为100mmol·L-1碱胁迫下平均株高和相对存活率均较低;受碱胁迫影响,垂穗披碱草和老芒麦的脯氨酸含量、丙二醛含量、相对电导率值随浓度增加而增大,叶绿素含量随浓度增加而降低;其中老芒麦的叶绿素含量、脯氨酸含量及丙二醛含量随浓度的变化幅度较垂穗披碱草小,且老芒麦相对电导率值显著小于垂穗披碱草;从株高、相对存活率等生长量指标及脯氨酸含量等4种生理指标等方面均表现出老芒麦相对更具有良好耐盐碱性。
(4)由两种植物的单根力学强度与4种生理指标之间的灰色关联分析可知,在0~100mmol·L-1浓度碱胁迫影响下,垂穗披碱草和老芒麦的单根抗拉力、单根抗拉强度均与相对电导率值的关联度相对较大,即关联度均在0.90以上,其次为叶绿素含量,两者的关联度为0.77~0.90,丙二醛含量和脯氨酸含量的影响相对较小,关联度为0.60~0.80,这说明碱胁迫条件下,相对电导率值对两种植物的单根力学强度的影响相对较为显著。
(5)本项研究成果为黄河源区开展植被恢复,实现科学有效防治土地盐碱化、水土流失、浅层滑坡、土地沙化等地质灾害的发生,提供重要实验依据并起到理论指导的实际意义。
Baets S D,Poesen J,Reubens B,et al.2008.Root tensile strength and root distribution of typical Mediterranean plant species and their contribution to soil shear strength[J].Plant and Soil,305(1):207~226.
Feng J M,Wang T,Xie C W,et al.2004.A case study on the eco-environmental degradation in the source region of the Yellow River,Northeast Qinghai-Xizang Plateau[J].Progress in Geography,23(6):56~62.
Feng L B, Jiang W J, Kang X P, et al.2005.Review on research of plant salt tolerance and its mechanism and genetic engineering [J].Transaction of the Chinese Society of Agriculture Engineering, 21(S2):5~9.
Flowers T J,Troke P F,Yeo A R.1977.The mechanism of salt tolerance in halophytes[J].Annual Review of Plant Physiology,28(1):89~121.
Galvan-Ampudia C S, Testerink C.2011.Salt stress signals shape the plant root[J].Plant Biology,14(3):296~302.
Genet M, Stokes A, Fonrcaud T, et al.2006.Soil fixation by tress roots:change in root reinforcement parameters with age in Cryptomeria japonica D.Don.Plantations[M].Disaster Mitigation of Debris Flows,Slope protection and Landslides,535~542.
Gray D H,Sotir R B.1995.Biotechnical stabilization of steepened slopes[J].Transportation Research Record,1474,23~29.
Hu X S,Gary B,Zhu H L,et al.2013.An exploratory analysis of vegetation strategies to reduce shallow landslide activity on loess hillslopes,Northeast Qinghai-Tibet Plateau,China[J].Journal of Mountain Science,10(4):668~686.
Hu X S,Mao X Q,Zhu H L,et al.2011.The vegetation slope protection of the Qinghai-Tibet Plateau[M].Beijing:Geological Publishing House.
Jia Y X,Li X L,Yuan Q H,et al.2008.Evaluation of Salt-tolerance and the related physiological characteristics of wild Elymus spp.[J].Scientia Agricultura Sinica,41(10):2999~3007.
Ma S Z,Peng M,Chen G C,et al.2004.Feature analysis of vegetation degradation on Alpine Grassland in Yellow River source region[J].Pratacultural Science,21(10):19~23.
Mattia C,Bischetti G B,Gentile F.2005.Biotechnical characteristics of root systems of typical Mediterranean species[J].Plant and Soil,278(1-2):23~32.
Misra N, Gupta A K.2005.Effect of salt stress on proline metabolism in two high yielding genotypes of green gram[J].Plant Science,169(2):331~339.
Ning J F,Zheng Q S,Zou X Z,et al.2010.Physiological responses of Apocyum venetum to different levels of salt stress[J].Chinese Bulletion of Botany,45(6):689~697.
Shi D,Wang D.2005.Effects of various salt-alkaline mixed stresses on Aneurolepidium chinense(Trin.)Kitag.[J].Plant and Soil,271(1):15~26.
Song J,Chen M,F G,Jia Y, et al.2009.Effect of salinity on growth,ion accumulation and the roles of ions in osmotic adjustment of two populations of Suaeda salsa[J].Plant and Soil,314(2):133~141.
Su H,Liu Y P,Zhang J X,et al.2005.The Influence of Na2CO3Stress on forage growth at seedling stage[J].Grassland of China,27(1):22~25.
Thakur M,Sharma A D.2005.Salt stress induced proline accumulation in germinating embryos:Evidence suggesting a role of proline in seed germination[J].Journal of Arid Environments,62(3):517~523.
Vos A C D,Broekman R, Guerra C C D A, et al.2013.Developing and testing new halophyte crops:A case study of salt tolerance of two species of the Brassicaceae,Diplotaxis tenuifolia and Cochlearia officinlis[J].Environmental and Experimental Botany,92:154~164.
Wang S P,Guo S R,Li J,et al.2006.Effects of salt stress on the root growth and leaf water use efficiency of cucumber seedlings[J].Chinese Journal of Applied Ecology,17(10):1883~1888.
Wang Y C,Wang D X.2012.Effects of salt stress on chlorophyll content and net photosynthetic rate of woody saltbush[J].Transactions of the Chinese Society of Agricultural Engineering,28(10):151~158.
Yang Y J,Zhou H K,Wang W Y,et al.2014.Effect of salt stress on the physiological characteristic of Elymus nutans[J].Journal of Lanzhou University(Natural Sciences),50(1):101~106.
Yuan S J,Niu G Q,Liu J,et al.2009.Instantaneous anti-tension and tensile strength of single root of four plant species in two growth periods[J].Bulletin of Soil and Water Conservation,29(5):21~25.
Zhang S Q,Li C H,Xin Y H,et al.2004a.The ecological geology environment management and protection countermeasures research in Yellow River source region[J].The Environment and Disaster,2:25~30.
Zhang S Q,Shi W D,Zhu H.2004b.The reason for degeneration of the eco-environment advance trend in the headwater area of the Yellow River[J].Northwestern Geology,37(1):101~106.
Zhang S Q,Wang Y G,Zhao Y Z, et al.2004c.Permafrost degradation and its environmental sequent in the source regions of the Yellow River[J].Journal of Glaciology and Geocryology,26(1):1~6.
Zhang X L,Hu X S,Li G R,et al.2012.Time effect of young shrub roots on slope protection of loess area in Northeast Qinghai-Tibetan plateau[J].Transactions of the CSAE,28(4):136~141.
Zhang Z L,Qu W J.2003.The experiment instruction of Plant physiology(the third edition)[M].Beijing:Higher Education Press.
Zhou H K,Zhao X Q,Wen J,et al.2012.The characteristics of soil and vegetation of degenerated alpine steppe in the Yellow River source region[J].Acta Prataculturae Sinica,21(5):1~11.
Zhu H L,Hu X S,Mao X Q,et al.2009.Relationship between mechanical characteristics and anatomical structures of slope protection plant root[J].Transaction of the CSAE,25(5):40~46.
封建明,王涛,谢昌卫,等.2004.黄河源区生态环境退化研究[J].地理科学进展,23(6):56~62.
冯利波,蒋卫杰,亢秀萍,等.2005.植物耐盐性机理及基因控制技术研究进展[J].农业工程学报,21(增2):5~9.
胡夏嵩,毛小青,朱海丽,等.2011.青藏高原植被护坡[M].北京:地质出版社.
贾亚雄,李向林,袁庆华,等.2008.披碱草属野生种质资源苗期耐盐性评价及相关生理机制研究[J].中国农业科学,41(10):2999~3007.
马世震,彭敏,陈桂琛,等.2004.黄河源头高寒草原植被退化特征分析[J].草业科学,21(10):19~23.
宁建凤,郑青松,邹献中,等.2010.罗布麻对不同浓度盐胁迫的生理响应[J].植物学报,45(6):689~697.
苏慧,刘玉平,张继星,等.2005.Na2CO3胁迫对牧草苗期生长的影响[J].中国草地,27(1):22~25.
王素平,郭世荣,李璟,等.2006.盐胁迫对黄瓜幼苗根系生长和水分利用的影响[J].应用生态学报,17(10):1883~1888.
王宇超,王得祥.2012.盐胁迫对木本滨藜叶绿素合成及净光合速率的影响[J].农业工程学报,28(10):151~158.
杨月娟,周华坤,王文颖,等.2014.盐胁迫对垂穗披碱草幼苗生理指标的影响[J].兰州大学学报(自然科学版),50(1):101~106.
苑淑娟,牛国权,刘静,等.2009.瞬时拉力下两个生长期4种植物单根抗拉力与抗拉强度的研究[J].水土保持通报,29(5):21~25.
张森琦,李长辉,辛元红,等.2004a.黄河源区生态地质环境治理及保护对策研究[J].环境与灾害,2:25~30.
张森琦,石维栋,朱桦,等.2004b.黄河源区生态环境恶化的地质原因及发展演化趋势[J].西北地质,37(1):101~106.
张森琦,王永贵,赵永真,等.2004c.黄河源区多年冻土退化及其环境反映[J].冰川冻土,26(1):1~6.
张兴玲,胡夏嵩,李国荣,等.2012.青藏高原东北部黄土区灌木幼林根系护坡的时间效应[J].农业工程学报,28(4):136~141.
张志良,瞿伟菁.2003.植物生理学实验指导(第三版)[M].北京:高等教育出版社.
周华坤,赵新全,温军,等.2012.黄河源区高寒草原的植被退化与土壤退化特征[J].草业学报,21(5):1~11.
朱海丽,胡夏嵩,毛小青,等.2009.护坡植物根系力学特性与其解剖结构关系[J].农业工程学报,25(5):40~46.
MECHANICAL STRENGTH CHARACTERISTICS OF HERBACEOUS PLANT ROOTS UNDER ALKALI STRESSING
LI Guangying①②FU Jiangtao①②YU Dongmei①HU Xiasong①③LI Yuezhou①②HU Xiaotian①②
(①Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining810008)
(②University of Chinese Academy of Sciences,Beijing100049)
(③Qinghai University,Xining810016)
The experiment explores the impact of alkali stress on the growth and single root mechanical effects of herbs.Elymus nutans Griseb and Elymus sibiricus Linn are suitable to survive in cold and semi-arid environment in the Yellow River source region.They are selected as testing species.Through indoor cultivation,the two species are treated with different NaHCO3concentrations of 25mmol·L-1,50mmol·L-1,75mmol·L-1or 100mmol·L-1.Meanwhile,NaHCO3concentration at 0mmol·L-1is taken as the control group.The plant height and relative survival rate of the two herbs are recorded.After being given alkali treatment,on the 15thand 30thday,their single root mechanical effect indexes and physiological indexes are determined respectively.Single root mechanical effect indexes include single root tensile resistance and single root tensile strength.The physiological indexes include proline content,malondialdehyde content,chlorophyll content,and relative conductivity.The test results are as follows:The impact of alkali stress on the single root mechanical effects of the herbs increases as concentration or growth time increases.When the concentration of alkali stress is 25mmol·L-1,the single root tensile resistances of two herbs are greater than that of the herbs in the control group.When concentration of alkali stress is bigger than 25mmol·L-1,the single root tensile resistances of two herbs are smaller than that in the control group.After being given alkali treatment,the single root tensile strength of the two herbs is greater than that in control group,with the amplification of 3%~16%.And with the same concentration,the single root tensile strength decreases 1%~18%with increase in growth time.In the case of the same growth time and concentration,the single root tensile resistance of Elymus sibiricus Linn is 0.13 N~0.53 N greater than that of Elymus nutans Griseb,and the single root tensile strength of Elymus sibiricus Linn is 20~65MPa greater than that of Elymus nutans Griseb.Based on gray correlation analysis,under the condition of alkali stress,among the determined four physiological indexes,chlorophyll content has the greatest correlation with the single root tensile resistance or the single root tensile strength of the two herbs.The correlation analysis 0.888~0.996 reflects that the single root tensile resistance and single root tensile strength of the two herbs are influenced obviously by relative conductivity.The study has theoretical value in further exploring the changing features and mechanism of root mechanical properties of herbs under the condition of alkali stress and in effectively preventing water and soil loss,shallow landslide and desertification which happen in salinized soil areas of the Yellow River source region.
Cold and semi-arid environment,Herbaceous plant,Alkali stress,Single root tensile resistance,Plant height,Relative survival rate,Physiological indexes
10.13544/j.cnki.jeg.2016.04.013
2015-04-27;
2015-10-03.
国家自然科学基金项目(41162010),中国科学院“百人计划”项目(Y110091025),青海省自然科学基金项目(2014-ZJ-906),中国科学院青海盐湖所“青年基金”项目(Y360441058)资助.
李光莹(1989-),男,硕士生,主要从事地质工程等方面的研究工作.Email: liguangying11@mails.ucas.cn
简介:胡夏嵩(1965-),男,博士,教授,主要从事地质工程与地质灾害防治等教学科研工作.Email: huxiasong@tsinghua.org.cn
P69
A
