云南4处酸性热泉中的变形菌门细菌多样性
2016-09-26宋兆齐刘秀花
宋兆齐,王 莉,刘秀花,梁 峰
(商丘师范学院生命科学学院,河南省高校生物质降解与气化工程技术研究中心,河南 商丘 476000)
云南4处酸性热泉中的变形菌门细菌多样性
宋兆齐,王 莉,刘秀花,梁 峰
(商丘师范学院生命科学学院,河南省高校生物质降解与气化工程技术研究中心,河南 商丘 476000)
选择云南腾冲和龙陵地区的4处酸性热泉(pH:2.3~6.0,温度:47~96 ℃),通过Barcoded pyrosequencing技术及统计学分析,详细阐述了这些样点中变形菌门的物种和遗传多样性。本研究共获得了2 489条变形菌门16S rRNA基因序列,可划分为234个可操作分类单元(OTUs)。分类结果显示,热泉内涵盖了大量已知的目、科和属。而41%的OTUs可能代表了变形菌门的未知物种。系统发育分析显示,样点中存在着若干全新遗传类群,这些样点和美国黄石地区的热泉各自呈现不同的变形菌门遗传多样性。此外,本次调查的热泉彼此间存在着变形菌门群落结构的显著差异。
变形菌门;多样性;系统发育分析;酸性热泉;云南
变形菌门(Proteobacteria)因其内部细菌形态极为多样而得名,该门成员均为革兰氏阴性菌[1],该门包括了 “Alpha”、“Beta”、“Delta”、“Gamma”、“Epsilon”以及近年刚确立的“Zeta”[2]共6个纲。变形菌门广泛分布于各种自然或人工环境下,代表了整个细菌域中最为庞大的一个类群[3],其物种和遗传多样性极为丰富,这决定了该类群涵盖了极为广泛的生理代谢类型。比如,该门中既有好氧菌也存在厌氧菌,既有自养型也有异养型,既存在光能型也存在化能型。因此,变形菌门内的物种在农业、工业、医药、卫生、环保等领域具有重要应用价值,广泛用于氮肥促进利用[4]、植物病虫害防治[5]、工农业废水处理[6]、土壤修复[7]和复杂污染物降解[8]等。目前有关变形杆菌门的多样性的研究,更多是围绕某一特定的种属或功能类群展开,或者在描述整个细菌域物种多样性的同时,提及变形菌门的群落构成[9],而专门针对变形菌门多样性的研究还很少。陆地热泉在全球分布广泛,多集中于板块间的碰撞处。这一生态系统具有迥异于普通环境的高温,同时容纳了来自地球内部大量的无机矿物质。不同热泉间的物化背景存在较大差异,因此热泉系统蕴含了丰富而独特的微生物种质和遗传资源。 基于上述情况,本研究通过Barcoded pyrosequencing技术,选择国内最具代表性的云南地区温泉,详细阐述了4处酸性样点中变形菌门的物种和遗传多样性,期望能为今后这一环境下微生物资源的开发和利用提供借鉴。
1 材料与方法
1.1样品采集
云贵高原处在板块碰撞处,地热活动频繁。本研究以云南龙陵和腾冲地区4处代表性的酸性温泉为研究对象。温度和pH 值的测量通过美国哈希公司的pH探头HachRpH-meter equipped 进行。利用事先灭菌的采样勺取出热泉沉积物样品,立即置于50 mL无菌的离心管中,冰浴黑暗保存,回实验室后-80 ℃保存。
1.2主要试剂与仪器
便携式pH计(哈希,美国);环境DNA提取试剂盒 (Omega Bio-Tek Inc.,美国); Taq酶(宝生物,大连),DNA胶回收试剂盒 (Omega Bio-Tek Inc.,美国); 温度探头 (PT-10,SARTORIUS,德国); PCR仪 (ABI,美国)。
1.3环境基因组提取
称取1.0~1.5 g的沉积物样品,利用环境DNA提取试剂盒,按说明书进行环境基因组的提取。为了避免单次操作的误差,每个样点重复提取4次后将提取物混合,供后续试验。
1.4细菌16SrRNA基因的Barcodedpyrosequencing
以细菌16S rRNA基因第4可变区的通用引物Bacteria V4F:AYTGGGYDTAAAGNG 和Bacteria V4R:TACNVGGGTATCTAATCC[10]作为本研究的PCR引物。在正向引物“Bacteria V4F:”一端连接不同的8碱基序列标签即“tag”,每一个标签单一对应特定样点。随后进行PCR反应,具体条件是: 95 ℃ 4 min; 94 ℃ 30 s,56 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10min。反应体系为25 μL,获得的PCR产物经胶回收试剂盒纯化后,送生物公司进行焦磷酸测序。
1.5序列分析
采用特定的python语言脚本,参考文献[11]的标准,去除不符合要求的低质序列。随后根据“tag”的序列信息分选出对应样点的序列。利用RDP(ribosomal database project)提供的软件 RDP-Classifer-2.0分析所得序列的类群归属。选出属于变形菌门的序列,然后对其进行可操作分类单元(OTU)的划分,并得到每一个OTU在样点中的丰度。利用BLAST程序,将每条变形菌门序列与NCBI 中GenBank数据库内的序列进行相似性比对。采用maximum composite likelihood 模型计算进化距离,通过邻接法,运用MEGA5.0[12]软件构建系统发育树。
1.6多样性分析
基于OTU 的丰度,运用SPADE(species prediction and diversity estimation; A.Chao and T.-J.Shen http:∥chao.stat.nthu.edu.tw)软件计算各文库的丰富度(species richness ),覆盖率(coverage),香农指数(Shannon index),辛普森指数(Simpson's index )。通过在线的Fast UniFrac[13](http:∥ bmf2. colorado. edu / fastunifrac) 计算样点间群落结构的差异。
2 结果与分析
2.1热泉环境参数
本研究的热泉为珍珠泉、地热体验区4号泉、地热体验区14号泉和上硝1号泉,前3处位于云南腾冲县热海国家地质公园,后1处位于龙陵县境内。两地直线距离小于200 km。所有的4处热泉均为酸性,其中热海的3处pH值在3.2~4.5,属于中度酸性热泉;龙陵的上硝1号泉pH值为6.0,酸性较弱。4处热泉的温度差异明显(47~96 ℃),且存在规律性梯度变化。样点的表观特征主要为泥质或砂质沉积物,颜色为棕色和黑色,见表1。

表1 样点特征Table 1 Samples investigated in this study
2.2变形菌门物种多样性
运用RDP-Classifer-2.0软件并结合自编的pythony语言脚本,对测得的序列进行归类。4处样点共得到2 489条变形菌门的16S rRNA 基因序列,可划分为234个OTUs,其中,温度最高的珍珠泉的数量最多,达到了112个;数量最少的是酸性最弱的上硝1号泉(表2)。生物统计学分析的结果显示,样点覆盖率在0.91~0.96,这说明每个热泉的序列已基本涵盖了整个变形菌门的群落。各样点的丰富度在95~194,香农指数以及辛普森指数倒数的范围分别在3.01~3.88和12.00~19.73。这些数据表明,本次研究的4处酸性样点的变形菌门物种都较为丰富,其中珍珠泉的多样性最高。
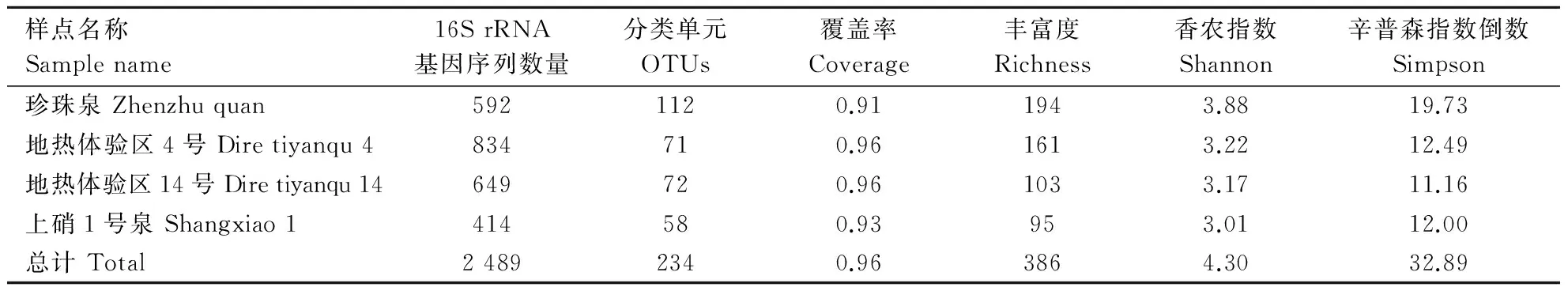
表2 各样点变形菌门的物种多样性Table 2 Ecological estimates of sequence diversity for Proteobacteia communities in investigated samples
2.3热泉的群落结构
为了获得各热泉详细的变形菌门群落组成,通过RDP-Classifer-2.0软件进一步对这2 489条16S rRNA 基因序列进行了纲、目、科、属的划分,见表3(群落比例大于1%的目、科、属)。
“Alpha”变形菌纲存于全部样点中,并且在珍珠泉、地热体验区4号和14号泉内为变形菌门优势类群,其中在体验区4号泉中的群落比例最高,达到了75%。该纲在弱酸性的上硝1号泉的比例仅为1%。红螺菌目(Rhodospirillales)下的醋杆菌科(Acetobacteraceae)内的Acidicaldu属则为“Alpha”变形菌纲的优势类群,甚至在地热体验区4号和14号泉以及上硝1号泉中为该纲的唯一类群。Acidicaldu属的菌株为中度嗜酸菌,不仅在铁、硫元素的地球化学循环过程中发挥作用[14],而且可作为新型的高温脂肪酶的重要来源[15]。
“Beta”变形菌纲在上硝1号泉的丰度最高,达到了19%,但在其他热泉中并非最主要的类群,尤其在热海体验区4号泉中,群落比例小于1%。所有样点的“Beta”变形菌均由伯克氏菌目(Burkholderiales)构成,其下主要包括了Massilia,纳西杆菌属(Naxibacter),硫单胞菌属(Thiomonas)和Thiobacter等属。不同热泉包含的属,也不尽相同。Thiomonas和Thiobacter的物种具有氧化砷和硫的功能[16- 17];Massilia属具有反硝化作用[18],又可作为聚羟基脂肪酸(PHA)的生产菌株,在污水处理及其资源化利用方面有重要价值[19]。
“Delta”变形菌纲为上硝1号泉的绝对优势类群(群落比例为73%),为地热体验区14号和4号泉的主要类群(群落比例分别为39%和19%)。上硝1号泉中的“Delta”变形菌种类丰富,包含了互营杆菌目(Syntrophobacterales),硫还原菌目(Desulfurellales)等5个目,其中Syntrophobacterales 占到了该样点群落结构的61%,主要的属为Desulfomonile和Desulfobacca。对于其他3处热泉而言,构成“Delta”纲的唯一类群均为Desulfurellales下的硫还原菌属(Desulfurella)。上述这些属的菌株往往具有较强的还原硫酸盐的功能[20]。
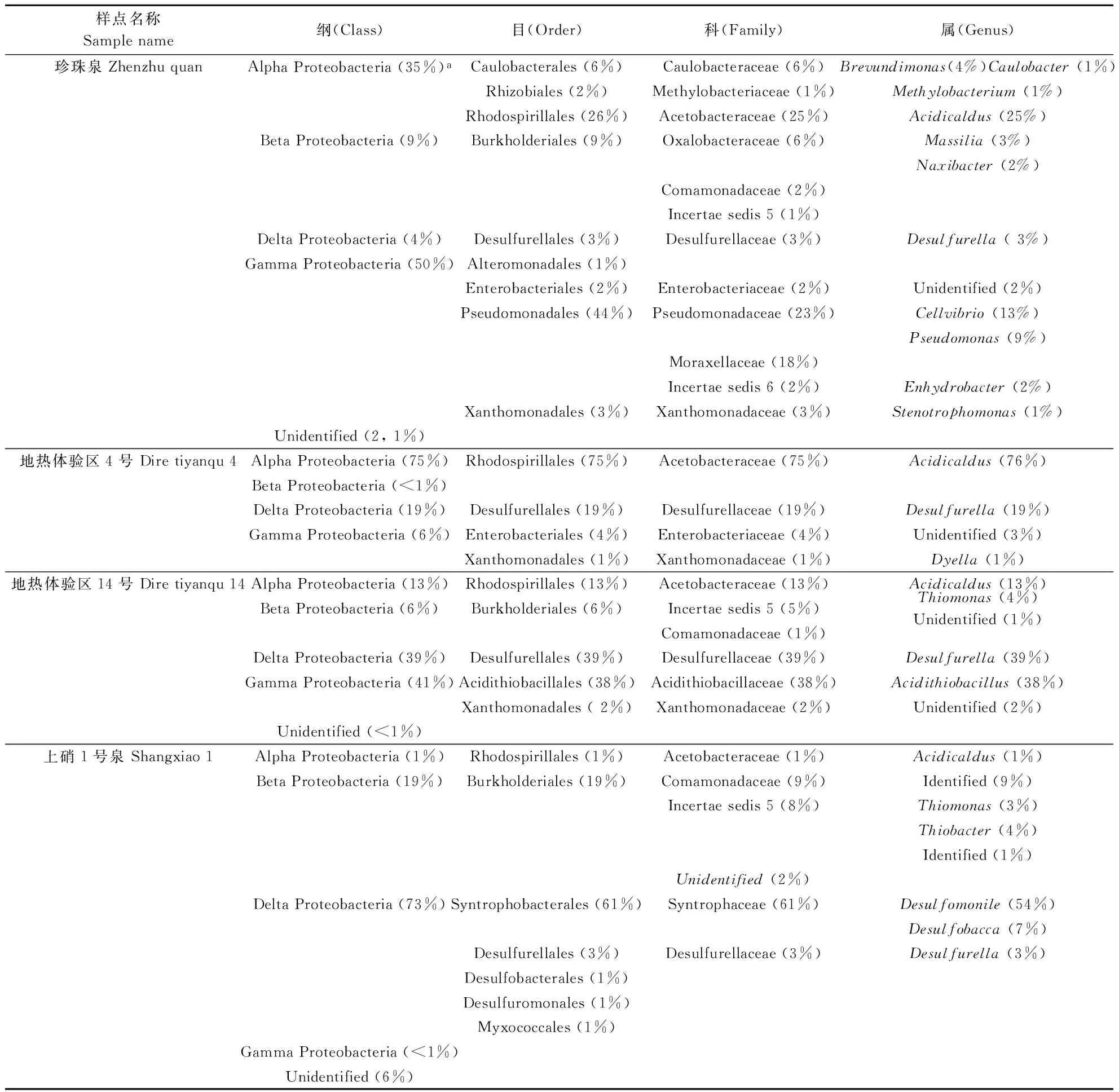
表3 研究样点的变形菌门群落组成Table 3 Community composition of Proteobacteria in investigated samples
注:括号内的数字代表了该分类单元在样点中的丰度
Note:The percentages in the parentheses indicates the abundances of taxa in the investigated hot spring
“Gamma”变形菌纲在珍珠泉和热海体验区14号泉的丰度最高,占各自样点群落结构的50%和41%,在上硝1号泉的比例小于1%。该纲在各样点中涵盖的类群种类比较丰富,且热泉间的优势类群存在差异。珍珠泉的优势类群为假单胞菌目(Pseudomonadale)下的纤维弧菌属(Cellvibrio)和假单胞菌属(Pseudomonas);热海体验区4号泉为肠杆菌目(Enterobacteriales)下的肠杆菌科(Enterobacteriaceae)以及黄色单胞菌目 (Xanthomonadales)下的Dyella属;热海体验区14号的类群为酸硫杆状菌目(Acidithiobacillales)下的酸硫杆状菌属(Acidithiobacillus)。这些类群功能广泛,在生物肥料和秸秆高效降解(纤维弧菌属)[21-22]、生物电池和芳香化合物降解(Dyella属)[23-24]、生物浸矿(酸硫杆状菌属)[25]以及环境保护(假单胞菌属)[26]等方面有很大的开发潜力。
此外,变形菌门的各纲、目、科中还存在大量不确定的类群(Unidentified),这些类群可能由一些还未被发现的变形菌门物种组成。另外,本研究并未探测到“Epsilon”和 “Zeta”2个纲的物种。
2.4变形菌门遗传多样性
从各OTUs中选出1条代表序列,通过BLAST程序在GenBanks数据库中与已知序列进行相似性比对。结果显示,96个OTUs(代表了所有OTUs的41%)与目前已知的变形菌门序列相似性在97%以下,这些OTUs在上硝1号泉的丰度最高,为71%,在热海体验区4和14号泉的丰度分别为24%和27%,在珍珠泉的丰度最低,为7%。这些数据说明,本研究中的热泉中存在大量较新颖的变形菌门物种。这也解释了为何变形菌门的各纲、目、科中还存在大量不确定的类群。

图1 形菌门16S rRNA基因片段的系统发育分析Fig.1 Phylogenetic relationships of Proteobacteria 16S rRNA gene sequences
为了确定这些类群的具体进化地位,同时与著名的地热活动区——美国黄石地质公园的热泉群进行比较,将本研究的部分代表序列与黄石热泉的代表性变形菌门序列联合进行了系统发育树的构建,结果如图1所示。图1中大部分的云南序列和黄石序列各自单独聚集,同一分支上很少存在交错分布的情况,这说明了云南和黄石的热泉中的变形菌门存在明显的遗传学差异,即存在着各自独立进化的变形菌遗传类群。此外,部分云南序列在系统发育树上形成了一些较大的独立分支(Cluster I - V)(图1),这些分支和已知的变形菌门菌株存在较大的遗传距离,有可能代表了一些还未被发现的科,甚至目一级的新分类单元。
2.5不同热泉的群落差异
本研究所得的234个OTUs中,仅有55个(代表了所有OTUs的24%和所有序列的63%)存在于2个以上的热泉中,其余的均只存在于单一热泉内。Fast UniFrac的在线分析结果表明,4处热泉的群落结构存在显著差异(P<0.05),差异程度在80%以上。Jackknife 聚类树显示,中度酸性的珍珠泉、地热体验区4号和14号3处热泉聚在一起,弱酸性的上硝1号泉处在最外围(图2)。表明本次研究样点的pH值差异越大,其变形菌门的差异越显著。

图2 Jackknife 的聚类分析Fig 2 Jackknife Sample Clusters
3 结论与讨论
(1)4处酸性热泉内涵盖了大量已知的目、科和属,这些类群具有多样且重要的功能。热泉环境又会给这些功能赋予某些特性,比如嗜高温、耐强酸和高离子浓度等,这可大大提高这些类群的应用价值。(2) BLAST分析结果表明了样点中可能蕴含有许多变形菌门的新物种,后续的系统发育分析进一步显示,样点中存在着若干全新遗传类群。这些类群的功能目前还不得而知。(3)Fast UniFrac分析表明,本次调查的热泉彼此间存在着群落结构的显著差异,而且这些样点和黄石公园的热泉各自呈现不同的遗传多样性。这表明不同环境特征,不同地理分布的热泉,其变形菌门多样性也存在明显不同。
综上所述,本次调查的温泉中蕴含了丰富和独特的变形菌门类群,存在一定的开发潜力。那么,如何通过菌株纯培养或是宏基因组技术获取这些物种和遗传资源,以及对这些资源如何开发利用,还有待进一步的探索。
[1] MADIGAN MT,MARTINKO J M.Brock biology of microorganisms[M] 11th ed.New Jersey:Prentice Hall,2006.
[2] EMERSON D,RENTZ J A,LILBURN T G et al.A novel lineage ofProteobacteriainvolved in formation of marine Fe-oxidizing microbial mat communities[J].PLoS One,2007,2(7):e667.
[3] CICCARELLI F D,DOERKS T,VON MERING C et al.Toward automatic reconstruction of a highly resolved tree of life[J].Science 2006,311 (5765):1283-1287.
[4] 李雯,阎爱华,黄秋娴,等.尾矿区不同植被恢复模式下高效固氮菌的筛选及Biolog鉴定[J].生态学报,2014,34(9):2329-2337.
[5] 王玉凤,宋艳祥,张汀,等.小麦叶锈病生防菌株的筛选[J].河北农业大学学报,2011,34(3):12-17.
[6] 王猛,李如刚,肖毅宏,等.城市生活污水处理厂活性污泥中细菌群落结构组成研究[J].化学与生物工程,2013,30(08):28-31.
[7] 张晶,林先贵,刘魏魏,等.土壤微生物群落对多环芳烃污染土壤生物修复过程的响应[J].环境科学,2012,33(08):2825-2831.
[8] 温东辉,张楠,于聪,等.环境中生物膜的菌群结构与污染物降解特性[J].微生物学通报,2014,41(07):1394-1401.
[9] 李明,郭嘉,石正国,等.春季青藏高原东北部湖泊细菌种类组成[J].应用与环境生物学报,2013,19(5):750-758.
[10] SONG Z Q,WANG F P,ZHI X Y,et al.Bacterial and archaeal diversities in Yunnan and Tibetan hot springs,China[J].Environ Microbiol,2013,15(4):1160-1175.
[11] SOGIN M L,MORRISON H G,HUBER J,et al.Microbial diversity in the deep sea and the under explored ‘rare biosphere’[J].Proc Natl Acad Sci USA,2006,103(32):12115-12120.
[12] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods [J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[13] HAMADY M,LOZUPONE C,KNIGHT R.Fast uniFrac:facilitating high-throughput phylogenetic analyses of microbial communities including analysis of pyrosequencing and phyloChip data [J].ISME Journal,2010,4(1):17-27.
[14] JOHNSON D B,STALLWOOD B,KIMURA S,et al.Isolation and characterization ofAcidicalduorganivorus,gen.nov.,sp.nov.:a novel sulfur-oxidizing,ferric iron-reducing thermo-acidophilic heterotrophic Proteobacterium[J].Arch Microbiol,2006,185(3):212-221.
[16] SLYEMI D,MOINIER D,BROCHIER-ARMANET C,et al.Characteristics of a phylogenetically ambiguous,arsenic-oxidizingThiomonassp.,Thiomonasarsenitoxydansstrain 3As(T) sp.nov[J].Arch Microbiol,2011,193(6):439-349.
[17] HIRAYAMA H,TAKAI K,INAGAKI F,et al.Thiobactersubterraneusgen.nov.,sp.nov.,an obligately chemolithoautotrophic,thermophilic,sulfur-oxidizing bacterium from a subsurface hot aquifer[J].Int J Syst Evol Microbiol,2005,55(1):467-472.
[18] RODRíGUEZ-DíAZ M,CERRONE F,SáNCHEZ-PEINADO M,et al.Massiliaumbonatasp.nov.,able to accumulate poly-β-hydroxybutyrate,isolated from a sewage sludge compost-soil microcosm[J].Int J Syst Evol Microbiol,2014,64(1):131-137..
[19] HAN X,SATOH Y,KURIKI Y,et al.Polyhydroxyalkanoate production by a novel bacteriumMassiliasp.UMI-21 isolated from seaweed,and molecular cloning of its polyhydroxyalkanoate synthase gene [J].J Biosci Bioeng,2014,118(5):514-519.
[20] GUAN Y,HIKMAWAN T,ANTUNES A,et al.Diversity of methanogens and sulfate-reducing bacteria in the interfaces of five deep-sea anoxic brines of the Red Sea [J].Res Microbiol,2015,2508(15):115-117.
[21] SUAREZ C,RATERING S,KRAMER I,et al.Cellvibriodiazotrophicussp.nov.,a nitrogen-fixing bacteria isolated from the rhizosphere of salt meadow plants and emended description of the genusCellvibrio[J].Int J Syst Evol Microbiol,2014,64(2):481-486.
[22] MCCLEARY B V,MCKIE V A,DRAGA A,et al.Hydrolysis of wheat flour arabinoxylan,acid-debranched wheat flour arabinoxylan and arabino-xylo-oligosaccharides by β-xylanase,α-L-arabinofuranosidase and β-xylosidase [J].Carbohydr Res,2015,407:79-96.
[23] NGUYEN V K,HONG S,PARK Y,et al.Autotrophic denitrification performance and bacterial community at biocathodes of bioelectrochemical systems with either abiotic or biotic anodes [J].J Biosci Bioeng,2015,119(2):180-187.
[24] MUANGCHINDA C,PANSRI R,WONGWONGSEE W,et al.Assessment of polycyclic aromatic hydrocarbon biodegradation potential in mangrove sediment from Don Hoi Lot,Samut Songkram Province,Thailand [J].J Appl Microbiol,2013,114(5):1311-1324.[25] MISHRA D,RHEE Y H.Microbial leaching of metals from solid industrial wastes [J].J Microbiol,2014,52(1):1-7.
[26] 陈丽萍,侯付景,张迪骏,等.宁波沿海陆源排污口假单胞菌属(Pseudomonas)分布特点[J].海洋与湖沼,2013,44(4):926-930.
(责任编辑:朱秀英)
ThediversitiesofProteobacteriainfouracidichotspringsinYunnan
SONG Zhaoqi,WANG Li,LIU Xiuhua,LIANG Feng
(College of Life Science,Shangqiu Normal University,Engineering Technology Research Center of Biomass Degradation and Gasification,Higher Institutions of Henan Province,Shangqiu 476000,China)
The phylumProteobacteriawere very valuable bioresources.However,little was konwn about the diversity ofProteobacteriain hot springs.In this study,the species and genetic diversities ofProteobacteiawere investigated in four acidic hot springs (pH value:2.3~6.0; temperature:47~96℃) in Yunnan province by using a barcoded 16S rRNA gene-pyrosequencing approach.A total of 2 489 16S rRNA gene sequences were divided into 234 operation taxonomic units (OTUs).Classified analysis showed the investigated hot springs harbored much of known orders,families and genus.41% of OTUs represented some candidate new species.The phylogenetic analysis showed some new big clusters existed in the investigated samples.Yunnan and Yellowstone hot springs had different genetic diversities ofProteobacteria.Community structures of the investigated hot springs were significantly different.
Proteobacteria; diversity; phylogenetic analysis; Yunnan
S 435.72
:A
2015-08-14
国家自然科学基金项目(31300430)
宋兆齐(1979-),男,河南新乡人,副教授,博士,从事微生物资源与生态的研究工作。
梁 峰(1965-),男,河南永城人,教授,硕士生导师.
1000-2340(2016)03-0376-07
