含1,3,4-噻二唑硫脲类新型化合物的合成及对植物病害抗性的分析
2016-09-26宋海龙赵钰泽王彩霞刘卫群
宋海龙,赵钰泽,王彩霞,2,周 祁,刘卫群,
(1.河南农业大学烟草学院,河南 郑州450002; 2.河南农业大学理学院,河南 郑州 450002;3.河南农业大学生命科学学院,河南 郑州 450002)
含1,3,4-噻二唑硫脲类新型化合物的合成及对植物病害抗性的分析
宋海龙1,赵钰泽3,王彩霞1,2,周 祁3,刘卫群1,3
(1.河南农业大学烟草学院,河南 郑州450002; 2.河南农业大学理学院,河南 郑州 450002;3.河南农业大学生命科学学院,河南 郑州 450002)
为了得到高性能的抗植物原害化合物,以氨基硫脲为起始原料,经环化、烷基化,得中间产物5-S-烃基-2-氨基-1,3,4-噻二唑,然后和4-三氟甲基异硫氰酸苯酯反应,合成了2种新化合物(4a,4b),其化学结构表征通过红外光谱(IR),核磁共振氢谱(1H-NMR)和核磁共振碳谱(13C-NMR )的检验符合4a,4b分子表征,采用高分辨质谱(HRMS)分析了4a,4b的相对分子质量,与计算值基本相等,表明4a,4b化合物完全与设计的分子结构一致。抗菌检验结果表明,在200 mg·L-1及100 mg·L-1质量浓度下,化合物4a,4b对新月弯孢菌、棉枯萎镰刀菌、烟草黑胫菌和禾谷镰孢菌的抑制率均高于对照药剂三唑酮;对烟草花叶病毒(TMV)抗性测试结果显示,在500 mg·L-1质量浓度下,化合物4b对TMV预防抑制率达到78.38%,比宁南霉素提高25.44%。
硫脲类化合物;烟草;合成;生物活性
在植物真菌病害、细菌病害和病毒病害中,病原真菌引起的约占病害总数的70%~80%,每年因真菌病害引起的作物产量损失很大[1]。尽管不断有新的抗菌剂研制出来,但易抗药性使得新药的研制仍是一项十分重要的任务。“病毒病害”有植物癌症之称,几乎每种农作物都受到一种或多种病毒病的危害,给农业生产带来巨大的威胁。其中,烟草花叶病毒(TMV)是一种典型的花叶病毒,可侵染38科268种植物。据估计,仅烟草花叶病毒引起的花叶病每年全世界损失达l亿美元以上[2]。目前,已经商品化的抗烟草花叶病毒药剂如病毒必克、植病灵、井冈霉索A、宁南霉素等的大田防效在30%~60%,不能有效抑制植物病毒所造成的危害,而且有的药剂(如病毒唑)还有药害。这就使得创制高效、低毒、高选择性、环境相容性好的抗植物病毒治疗剂成为当务之急。硫脲类衍生物在新农药研究、开发和商业化中显示了十分重要的作用。到目前为止,国外的一些药物公司相继成功地开发了数十个硫脲类的农药新品种,如作为杀菌剂的代菌灵、杀虫剂的螟蛉畏、杀螨剂的杀螨隆、植物生长调节剂的呋苯硫脲、杀鼠剂安妥等。在近十几年的农药或医药领域内,大量文献进一步报道了硫脲类化合物具有杀菌[3-4]、杀虫、除草[5-6]、植物生长调节[7-8]和抗癌[9-11]等广泛的生物活性。另外,硫脲类化合物还有抗病毒作用。德国SCHUSTER等于1991年首次将硫脲类化合物用于植物病毒的研究,发现烯丙基硫脲衍生物对TMV,CMV有抑制作用[12]。 1,3,4-噻二唑衍生物因同样具有广泛生物活性[13-16],在杂环农药中扮演着重要的角色,例如,杀菌剂中防治水稻白叶枯病的叶青双,作为除草剂的氟他胺都含有噻二唑环。日本的NOGUCHI等[17]最早报道了噻二唑衍生物还具有抗植物病毒活性。为了得到高活性的抗菌和抗病毒试剂,本研究利用生物等排原理和活性拼合等药物设计基本原理,将用硫醚基团修饰的1,3,4-噻二唑环和硫脲基团进行活性拼接,以氨基硫脲为起始原料,经环化、烷基化,得中间产物5-S-烃基-2-氨基-1,3,4-噻二唑,然后和4-三氟甲基异硫氰酸苯酯反应,合成2种新的化合物N-(4-三氟甲基)苯基-N′-(5-S-烃基-1,3,4-噻二唑-2-基)硫脲,并对其结构进行表征,对其抗菌及抗病毒活性进行了测定。
1 材料与方法
1.1试验材料
1.1.1 供试植物病原真菌 新月弯孢菌(Curvularialunata)、棉花枯萎病菌(Cottonfusarium)、烟草黑胫菌(Phytophthoraparasiticavar.nicotianae)、禾谷镰孢菌(Fusariumgraminearum),由河南农业大学植保学院提供。
1.1.2 供试植物与供试病毒 烟草花叶病毒(Tobacco mosaic virus,TMV)枯斑寄主为珊西烟(Nicotianatabacumcv.xanthinc),由中国农业科学院烟草研究所提供;烟草花叶病毒(TMV)由贵州大学提供。
1.1.3 仪器与试剂 X-5数字显示显微熔点仪(北京泰克仪器有限公司,温度未校正;Q-Tof MicroTM 高分辨质谱仪;TENSOR 27傅立叶红外光谱仪(德国Bruker);BRUCKER 300M核磁共振仪(德国,TMS为内标);CL-2型恒温加热磁力搅拌器(郑州长城科工贸有限公司)。
2%宁南霉素(广州穗泽环保科技有限公司);三唑酮(江苏农禾农业科技有限公司);氨基硫脲,CS2,1-氯丁烷,1-溴己烷(上海诺泰化工有限公司);N,N-二甲基甲酰胺(DMF),乙腈(上海海曲化工有限公司);所用试剂均为市售分析纯或化学纯。
1.2试验方法
目标化合物N-(4-三氟甲基)苯基-N′-[5-S-烃基-1,3,4-噻二唑-2-基]硫脲的合成路线见图1。
2-氨基-5-S-烃基-1,3,4-噻二唑衍生物参看文献[18]合成。
在50 mL圆底烧瓶中加入0.2 g(1.0 mmol)三氟甲基异硫氰酸苯酯,用1.5 mL DMF溶解后,再加入0.28 g(1.3 mmol)1,3,4-噻二唑衍生物和1.5 mL乙腈,加热回流10 h后停止反应(用TLC跟踪)。反应后,加水冷却,有固体析出,用DMF和无水乙醇混合液重结晶(图1)。
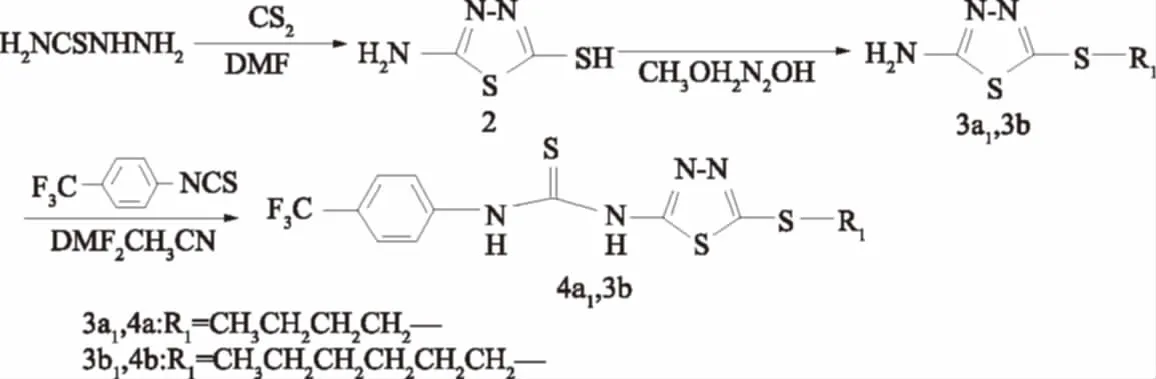
图1 目标化合物的合成路线Fig.1 Synthetic route of target compounds
新合成化合物的物理特性及结构特征如下:
N-(4-三氟甲基)苯基-N′-[5-S-正丁基-1,3,4-噻二唑-2-基]硫脲 (4a):白色固体粉末,产率 78.5%,m.p.187.5~188.8 ℃.IR cm-1:3207 (N-H),1331 (C═S),1538,1490,1400,1255,1047,850 (噻二唑环),657 (C-S-C);1H-NMR (400 MHz,DMSO-d6) δ:0.91 (t,J = 8.0 Hz,3H,CH3),1.38~1.47 (m,2H,CH2),1.65~1.72 (m,2H,CH2),3.23 (t,J = 8.0 Hz,2H,SCH2),7.67 (d,J = 8.0 Hz,2H,ArH),7.96 (d,J = 8.0 Hz,2H,ArH),10.82 (s,H,NH),14.59 (br,1H,NH);13C-NMR (100 MHz,DMSO-d6) δ:13.37 (CH3),21.11 (CH2),30.96 (CH2),32.88 (SCH2),121.61 (CF3),124.38 (CH),126.57 (CH),128.61 (C-CF3),138.96 (C-N),155.82,160.31 (噻二唑环,C2,C5),181.57 (C═S); HRMS(ESI):C14H15F3N4S3m/z [M+H]+calcd.393.0489,found 393.0485.N-(4-三氟甲基)苯基)-N′-[5-S-正己基-1,3,4-噻二唑-2-基]硫脲 (4b):黄色固体粉末,产率 72.4%,m.p.:222.5~223.7 ℃.IR cm-1:3328 (N-H),1330 (C═S),1538,1491,1398,1256,1068,843 (噻二唑环),658 (C-S-C);1H-NMR (400 MHz,DMSO-d6) δ:0.87 (t,J = 8.0 Hz,3H,CH3),1.28~1.42 (m,6H,CH2),1.66~1.73 (m,2H,CH2),3.22(t,J = 8.0 Hz,2H,SCH2),7.66 (d,J = 8.0 Hz,2H,ArH),7.96 (d,J = 8.0 Hz,2H,ArH),10.81 (s,H,NH),14.65 (br.,1H,NH) ;13C-NMR (100 MHz,DMSO-d6) δ:13.82 (CH3),21.92 (CH2),27.56 (CH2),28.84 (CH2),30.61 (CH2),32.79 (SCH2),121.73 (CF3),123.02 (CH),125.54 (CH),125.72 (C-CF3),143.15 (C-N),154.37,162.51 (噻二唑环,C2,C5),181.57 (C═S); HRMS(ESI):C16H19F3N4S3m/z [M+H]+:calcd.421.0802,found 421.0796.
1.3毒力测定
根据二倍稀释法,将供试药品设定为200,100,50,25,12.5 mg·L-15个质量浓度,药品的制备在无菌条件下进行;以新月弯孢菌(Curvularialunata)、棉花枯萎病菌(CottonfusariumWilt)、烟草黑胫菌(Phytophthoraparasiticavar.nicotianae)、禾谷镰孢菌(Fusariumgraminearum)为研究对象。按照生长速率法[19],将一定质量浓度的药品分别取3.0 mL加入到灭菌后的含27.0 mL PDA培养基的锥形瓶中,摇匀后倒入3个直径90 mm的培养皿中,即设定3个重复,待其冷却凝固;同时用不含药品的培养基做对照。在已经生长好的待测菌种上取直径6.5 mm的菌饼放到培养皿中央位置,在(28±1)℃培养箱中培养5 d,用十字交叉法测量菌落直径,计算抑制率。然后以抑制率对应的概率值为y,相对应的化合物质量浓度的对数值为x,通过SPSS 19做线性回归,建立毒力回归方程y=ax+b,并计算相关系数r和有效抑制中浓度EC50。
1.4烟草花叶病防治试验
在25 ℃防虫温室内,采取盆栽形式,以枯斑寄主半叶法[20],选取长势一致的珊西烟为对象进行药剂生物活性测定试验。
1.4.1 预防试验 移栽后,挑选长势一致,具有6~7片真叶的珊西烟,对其进行喷药处理,24 h后,用常规汁液摩擦法接种TMV病毒液,以清水处理作为对照组,每个处理设置3次重复,观察发病情况,及时记录发病枯斑数,计算枯斑抑制率。
1.4.2 治疗试验 移栽后,挑选长势一致,具有6~7片真叶的珊西烟,采用常规汁液接种法接种TMV病毒液,12 h后,对各处理喷药,以接种后喷施清水的处理作为对照组,每个处理设置3次重复,观察发病状况,及时记录发病枯斑数,计算枯斑抑制率。
2 结果与分析
2.1目标化合物合成条件的筛选
由于反应物质在不同的溶剂条件下,达到的沸点不同,且产物的得率与沸腾后的回流时间有关,因此,选用N,N-二甲基甲酰胺(DMF)、乙腈、乙醇及N,N-二甲基甲酰胺(DMF)和乙腈等比例混合溶剂进行筛选合成溶剂。结果显示,选用N,N-二甲基甲酰胺(DMF)做溶剂,沸点高,回流状态下副产物多,且产物在DMF溶解度大,不易析出;选用乙腈或乙醇,虽然沸点低,但基本没有产物生成;选用DMF和乙腈等比例混合溶剂,反应温度控制在回流状态下能获得高产率产品。采用薄板层析 [GF254硅胶板,V(乙酸乙酯)∶V(石油醚,60~90 ℃)=1∶3]跟踪反应结果显示(表1),回流10 h,反应原料已基本消失,收率达78.52%;大于10 h,产率没有明显提高。

表1 不同反应溶剂对目标化合物产率的影响Table 1 The effect of various solvent on productivity
2.2目标产物4a,4b分子结构的波谱解析
采用红外光谱(IR)检测产物 N-H的强伸缩振动出现在3 207~3 341 cm-1,C═S的强伸缩振动峰出现在1 330~1 331 cm-1,1 538~843 cm-1是1,3,4-噻二唑环的振动吸收,C-S-C的振动吸收在657~658 cm-1处(图2);碳核磁共振波谱(13C-NMR)检测C═S中的碳信号峰出现在181.57,1,3,4-噻二唑环上的C2,C5分别在154.37~155.82和160.31~162.51范围内,-CF3中的碳出现在121.61~121.73(图3),这些数据表明产物的分子表征符合设计的4a和4b分子结构特征。(由图1可知,4a和4b除了R基团C原子数目不同外,结构是一致的,因此,4b的光谱数据与4a相比,仅会有一些小的吸收峰不同,但不影响主要分子表征应产生的峰值)。高分辨质谱(HRMS(ESI) 中的m/z [M+H]+)检验相对分子质量结果显示,4a和4b的相对分子质量分别为393.0485和421.0796(图4、图5)与该物质相对分子质量的计算值基本相等。这些特征说明新合成化合物的波谱数据与分子结构完全吻合。
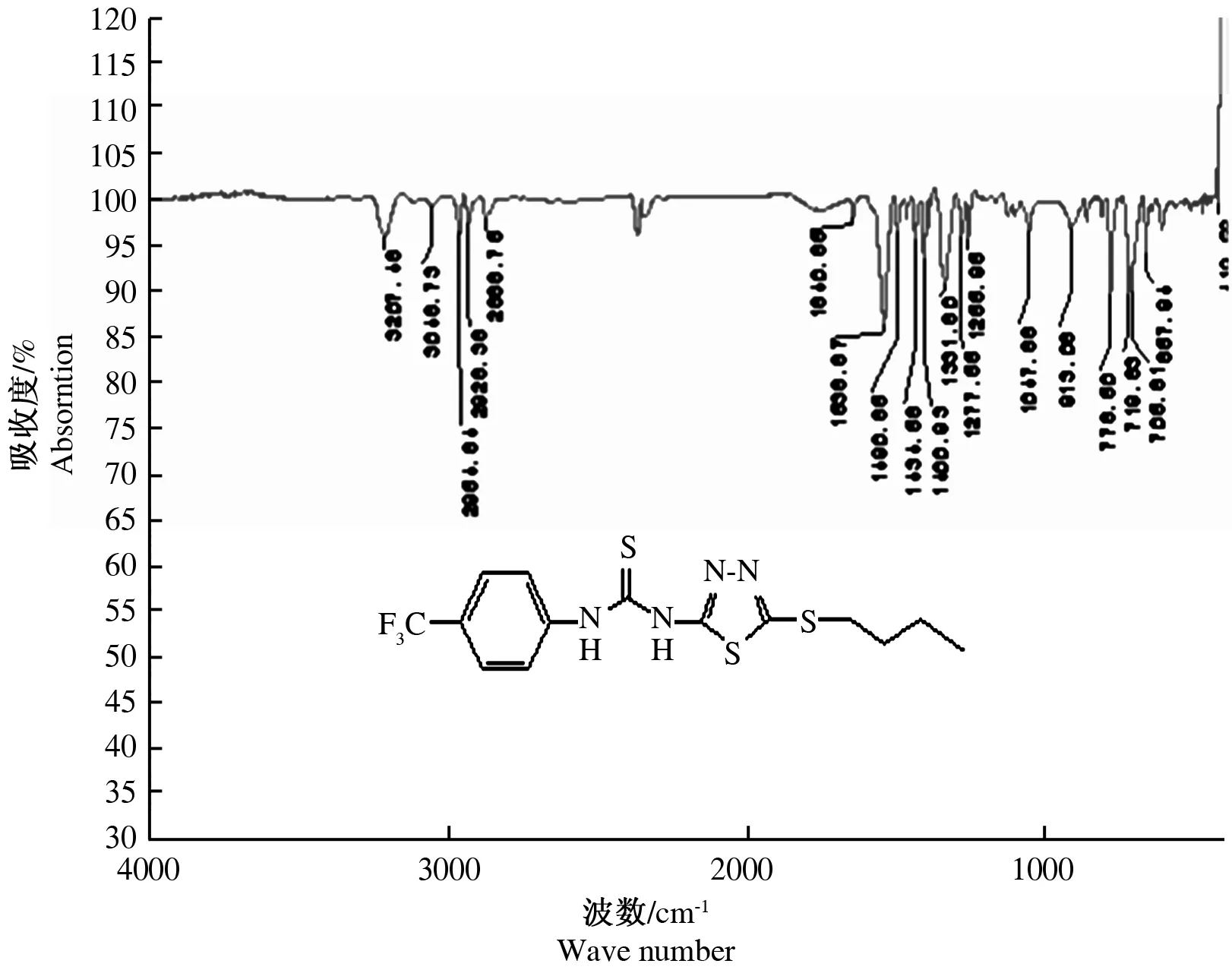
图2 目标产物4a的红外光谱图Fig.2 The infrared spectra of compound 4a
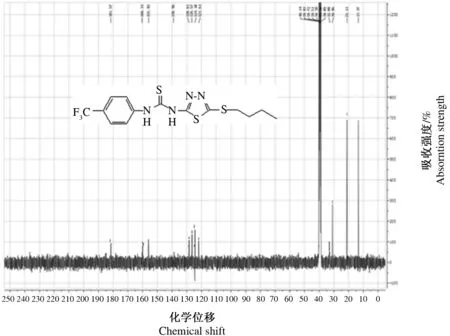
图3 目标产物4a 的碳核磁共振谱图Fig.3 The 13C-NMR spectra of compound 4a

图4 目标产物4a的高分辨质谱图Fig.4 The HRMS spectra of compound 4a
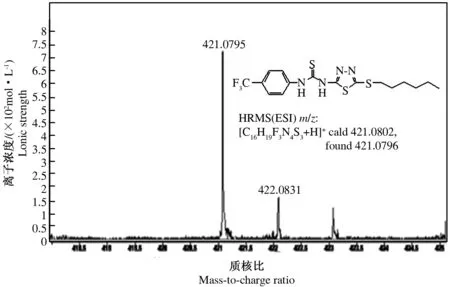
图5 目标产物4b的高分辨质谱图Fig.5 The HRMS of compound 4b
2.3目标产物4a,4b对植物病原真菌的毒力测定
目前,三唑酮是广泛应用的抗真菌的有效药物,因此,本试验以三唑酮为对照检验4a和4b的抗真菌效果,结果显示(表2),在抗新月弯孢菌方面4a和4b的效果明显强于三唑酮,尤其是4a提高9.78%;在抗棉花枯萎病菌方面,4a效果明显强于三唑酮,提高9.04%;在抗烟草黑胫菌方面,4b的效果明显强于三唑酮,提高15.52%;在抗禾谷镰孢菌方面,4b效果明显强于三唑酮,提高8.41%;从抑制率达到50%使用药物质量浓度EC50(mg·L-1)可以看出,4a和4b在抗新月弯孢菌、棉枯萎镰刀菌和烟草黑胫菌方面,具有明显优势,尤其是4b在抗新月弯孢菌和烟草黑胫菌方面,4a在抗棉枯萎镰刀菌方面都呈现药物用量明显小于三唑酮。
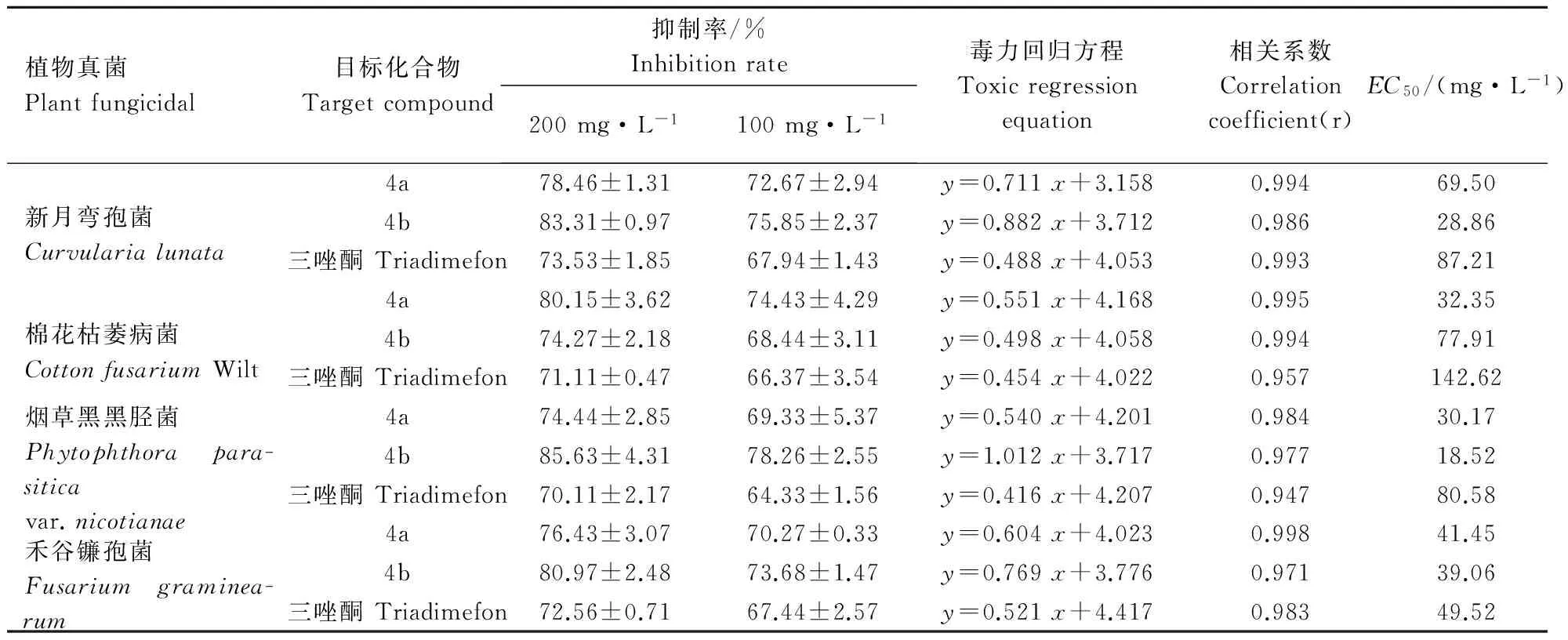
表2 目标产物4a,4b对4种植物病原菌的毒力测定Table 2 Inhibition effect of compound 4a,4b against four kinds of plant fungicidal
2.4目标产物4a,4b对烟草花叶病(TMV)的防治效果分析
以珊西烟为试验材料,采取半叶枯斑法对接种TMV前后分别喷4a和4b进行防治,结果试验显示(表3),4a,4b对烟草花叶病的治疗效果并不明显,但4b比2%宁南霉素预防效果提高25.44%。
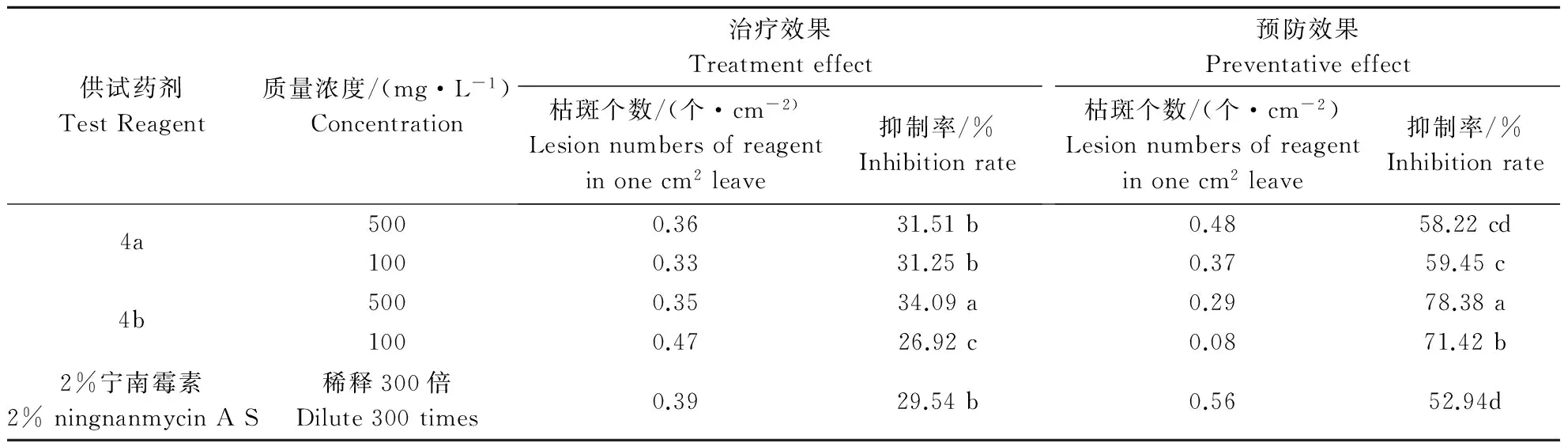
表3 目标产物4a,4b在珊西烟上对TMV的防治效果Table 3 The control effect of compound 4a,4b to TMV on Xanthi-NN
3 小结与讨论
本研究描述了由初始原料氨基硫脲通过环化,烷基化,得中间产物5-S-烃基-2-氨基-1,3,4-噻二唑,然后和4-三氟甲基异硫氰酸苯酯作用合成目标产物4a,4b的方法,并对产物的结构进行了表征。OTELEANU等[21]曾合成5个N-苯基-N′-(5-S-烃基-1,3,4-噻二唑-2-基)硫脲类化合物,但对其生物活性没有进行测定;MAHAJAN等[22]合成了N-(7-氯喹啉-4-基)-N′-(5-S-乙基-1,3,4-噻二唑-2-基)硫脲,只对其抗疟疾及抗癌活性进行了测定。这二者合成都采用N,N-二甲基甲酰胺(DMF)为溶剂,产率低,后处理麻烦。本研究对新化合物的合成方法进行改进,后处理简单,提高了产率,并对化合物的抗菌性及抗烟草花叶病毒(TMV)的活性进行了测定。初步生物活性测试结果显示,化合物4a和4b对4种真菌有不同程度的抑制作用,其中化合物4a对新月弯孢菌,棉枯萎镰刀菌的抑菌效果好于三唑酮,而4b新月弯孢菌,抗棉枯萎镰刀菌及烟草黑胫菌的抑菌效果好于三唑酮。化合物4a和4b对TMV的治疗抑制率略高于或接近宁南霉素,预防抑制率高于宁南霉素,尤其是化合物4b的预防抑制率达70%~80%,这和宋宝安等[23]合成的硫脲类物质研究结果基本相同,但是高于XU等[24]用硫醚修饰的1,3,4-噻二唑化合物对TMV的预防效果。但该类化合物的溶解性能有待进一步改进。
[1] WANG P Z,SHI L F,SU L,et al.Quantitative trait loci for resistance againstFusariumWilt based on three cotton F2populations[J].Agricultural Sciences in China,2010,9,1799-1806.
[2] 周建国,肖启明,刘双清,等.烟草花叶病毒病发生及防治研究进展[J].安徽农业科学,2013,41(1):121-122.
[3] ZHONG Z M,XING R G,LIU S,et al.Synthesis of acyl thiourea derivatives of chitosan and their antimicrobial activities in vitro[J].Carbohydrate Research,2008,343:566-570.
[4] MADABHUSIH S,POORNACHANDRA Y,MALLU K R,et al.Synthesis of novel benzimidazole functionalized chiral thioureas and evaluation of their antibacterial and anticancer activities[J].Bioorganic & Medicinal Chemistry Letters,2014,24(20):4822-4825.
[5] YONOVA P A,STOILKOVA G M.Synthesis and biological activity of urea and thiourea derivatives from 2-aminoheterocyclic compounds[J].Journal of Plant Growth Regulation,2004,23(4):280-291.
[6] XUE S J,ZOU J S,YANG H J.Synthesis and herbicidal activities of N′-(substituted pyrimidin-2-yl)-N-substituted phenoxyacetyl thiourea derivatives[J].Chinese Chemical Letters,2000,11(1):19-20.
[7] YUE P,KRISTI C,SILVERMAN R B.Conformationa-lly-restricted vigabatrin analogs as irreversible and reversible inhibitors of gamma-aminobutyric acid aminotransferase.[J].Bioorganic & Medicinal Chemistry,2004,12(21):5719-25.
[8] AMETA K L,RATHORE N S,KUMAR B,et al.Synthesis and trypanocidal evaluation of some novel 2-(substituted benzylidene)-5,7-dibromo-6-hydroxy-1-benzofuran-3(2)-Ones[J].International Journal of Organic Chemistry,2014,02(03).
[9] KANG I J,WANG L W,LEE C C,et al.Design,synthesis,and anti-HCV activity of thiourea compounds[J].Bioorganic & Medicinal Chemistry Letters,2009,19(7):1950-5.
[10] YANG,XUAN,SONG,et al.Synthesis and antiviral bioactivities of novel chiral bis-thiourea-type derivatives containing α-aminophosphonate moiety[J].Science China-Chemistry,2011,54(1):103-109.
[11] IOU-JIUN K,LI W,TENG K Y,et al.Synthesis,activity,and pharmacokinetic properties of a series of conformationally-restricted thiourea analogs as novel hepatitis C virus inhibitors.[J].Bioorganic & Medicinal Chemistry,2010,18(17):6414-21.
[12] SCHUSTER G,HUBER S.Evidence for the inhibition of potato virus × replication at two stages dependent on the concentration of ribavirin,5-azadihydrouracil as well as l,5-diacetyl-5-azadihydrouracil[J].Biochemie Und Physiologie Der Pflanzen,1991,187(6):429-438.
[13] LIESEN A P,AQUINO T M D,CARVALHO C S,et al.Synthesis and evaluation of anti-toxoplasma gondii and antimicrobial activities of thiosemicarbazides,4-thiazolidinones and 1,3,4-thiadiazoles[J].European Journal of Medicinal Chemistry,2010,45(9):3685-3691.
[14] FARSHORI N N,BANDAY M R,AHMAD A,et al.Synthesis,characterization and in vitro antimicrobial activities of 5-alkenyl/hydroxy- alkenyl-2-phenylamine-1,3,4-xoadiazoles and thiadiazoles [J].Med Chem Lett,2010,20,1933-1938.
[15] LUO Y,ZHANG S,LIU Z J,et al.Synthesis and antimicrobical evaluation of a novel class of 1,3,4-thiadiazole derivatives bearing 1,2,4-triazolo[1,5-a]pyrimidine moiety.[J].Cheminform,2013,44(43):54-61.
[16] POLKAM N,RAYAM P,ANIREDDY J S,et al.Synthesis,in vitro anticancer and antimycobacterial evaluation of new 5-(2,5-dimethoxyphenyl)-1,3,4-thiadiazole-2-amino derivatives[J].Bioorganic & Medicinal Chemistry Letters,2015,25(7):1398-1402.
[17] NOGUCHI,SHIBASAKI,ARINAMI,et al.Association of asthma and the interleukin-4 promoter gene in Japanese [J].Clinical & Experimental Allergy,1998,28(4):449-453.
[18] 周艳芬,陈宏博.1,3,4-噻二唑及其衍生物的研究进展[J].化工中间体,2009,5(6):21-25.
[19] 徐汉虹.植物化学保护学实验指导[M].北京:中国农业出版社,2012.
[20] HANSEN A,ELGOMITH STAC.Antiviral chemicals for plant disease control[J].Critical Reviews in Plant Sciences,1989,8(8):45-88.
[21] OTELEANU D,DIMITRIU M A,BADAU E.Synthesis of some new N,N′-disubstituted thiourea derivatives having pharmacodynamic effect[J].Farmacia,1981,29(1):7-12.
[22] MAHAJAN A,YEH S,NELL M,et al.Synthesis of new 7-chloroquinolinyl thioureas and their biological investigation as potential antimalarial and anticancer agents[J].Cheminform,2007,17(20):5683-5685.
[23] 宋宝安,张华金,林红,等.新型硫脲化合物的合成与生物活性研究[J].化学通报,2003(3):200-202.
[24] XU W M,LI S Z,HE M,et al.Synthesis and bioacti-vities of novel thioether/sulfone derivatives containing 1,2,3-thiadiazole and 1,3,4-oxadiazole/thiadiazole moiety[J].Bioorganic & Medicinal Chemistry Letters,2013,23(21):5821-5824.
(责任编辑:常思敏)
Synthesisandantifungalandanti-TMVactivitiesofnovelthioureascontaining1,3,4-thiadiazole
SONG Hailong1,ZHAO Yuze3,WANG Caixia1,2,ZHOU Qi3,LIU Weiqun1,3
(1.College of Tobacco Science,Henan Agricultural University,Zhengzhou 450002,China; 2.College of Science,Henan Agricultural University,Zhengzhou 450002,China; 3.College of Life Science,Henan Agricultural University,Zhengzhou 450002,China)
In order to get compounds which have high-powered anti-microbial pathogens,two new N-heterocyclic thiourea compounds were synthesized by 1,3,4-thiadiazole derivatives and trifluoromethyl phenyl isothiocyanate.The chemical structure and molecular weight was confirmed by IR,1H-NMR,13C-NMR and HRMS.The antibacterial test showed that:compound 4a and 4b exhibited better antifungal activities at the concentration of 200 mg·L-1and 100 mg·L-1against Curvularia lunata,Cotton Fusarium,Wilt,Phytophthora parasitica var nicotianae and Fusarium graminearum compared with triadimefon.In the prevention and treatment of tobatco mosaic virus (TMV),the inhibition rate of compound 4b reached 78.38% at the concentration of 500 mg·L-1,increasing by 25.44% compared with ningnanmycin,and 4b showed a good preventive effect against TMV.
thiourea derivatives; tobacco; synthesize; biological activity
S 572
:A
2015-01-05
河南省教育厅科学技术基础研究重点项目(30600808)
宋海龙(1989-),男,河南郑州人,硕士研究生,主要从事烟草生理和化学研究。
刘卫群(1956-),女,河北临城人,教授,博士生导师。
1000-2340(2016)03-0370-06
