转铁蛋白修饰长春新碱-粉防己碱脂质体中主药含量及包封率的测定Δ
2016-09-23李学涛
李学涛,唐 炜,姜 英,程 岚#
(1.辽宁中医药大学药学院,辽宁大连 116600;2.临沂市食品药品检验检测中心,山东临沂 276001)
·实验研究·
转铁蛋白修饰长春新碱-粉防己碱脂质体中主药含量及包封率的测定Δ
李学涛1*,唐炜2,姜英1,程岚1#
(1.辽宁中医药大学药学院,辽宁大连116600;2.临沂市食品药品检验检测中心,山东临沂276001)
目的:建立转铁蛋白修饰长春新碱-粉防己碱脂质体中主药含量及脂质体包封率的测定方法。方法:采用高效液相色谱法测定长春新碱含量,色谱柱为依利特C18,流动相为甲醇-15%三乙胺水溶液(70∶30),流速为1.0 ml/min,检测波长为297 nm,柱温为30℃,进样量为20µl;采用葡聚糖凝胶柱色谱法分离脂质体与游离药物,计算包封率。结果:长春新碱检测质量浓度为160~1 600 μg/ml(r=0.999 8,n=5),平均加样回收率为99.20%(RSD=0.26%,n=9),精密度RSD为0.070%(n=5)。脂质体中长春新碱的平均含量为0.790 mg/ml(RSD=0.15%,n=3),平均包封率为85.94%(RSD=2.08%,n=3)。结论:该方法准确可靠、简单快速,可用于转铁蛋白修饰长春新碱-粉防己碱脂质体中长春新碱的含量及包封率测定。
长春新碱;粉防己碱;转铁蛋白;脂质体;含量测定;包封率;高效液相色谱法
长春新碱(Vincristine,VCR)是一种由夹竹桃科长春花属植物长春花中提取的一种生物碱,是一种有丝分裂抑制剂,可使细胞停止在有丝分裂中期,同时还可与微管蛋白结合以抑制细胞的生物活性。作为一种细胞周期特异性药物,长春新碱被广泛用于临床化疗过程中,其对急性淋巴细胞性白血病、霍奇金病、淋巴肉瘤、网状细胞肉瘤和乳腺癌的治疗效果显著[1]。但长春新碱存在半衰期短、代谢快、神经系统和胃肠道毒性强等缺点[2-3]。脂质体作为抗肿瘤药物的常用载体,可改善药物理化性质、提高药物稳定性、降低药物的毒副作用[4]。转铁蛋白(TF)是血浆中主要的含铁蛋白质,负责运载由消化管吸收的铁和由红细胞降解释放的铁。肿瘤细胞表面的TF受体表达远高于正常细胞(约2~10倍),TF与某些抗肿瘤药物结合,可使药物定向转移至肿瘤部位,减少血脑屏障及避免药物快速分解等[5-6]。粉防己碱是从中药防己中提取的一种双苄基异喹啉类生物碱[7],是粉防己的主要活性成分,具有抗炎、镇痛、降压及阻断钙通道等广泛的药理作用。作为一种天然的钙离子拮抗药,粉防己碱能够逆转多种肿瘤细胞的多药耐药性,且具有高效、低毒的特点[8-9]。为了增强药物的靶向性、延长药物体内滞留时间、增强疗效、降低毒副作用,课题组以长春新碱为主药,以粉防己碱为辅药,采用脂质体将二药包裹在其中,再在其表面修饰TF,期望增加脂质体的主动靶向性能并降低肿瘤细胞的多药耐药性。笔者以高效液相色谱(HPLC)法测定该修饰脂质体中长春新碱的含量,并通过葡聚糖凝胶法分离测定脂质体中药物的包封率,报道如下。
1 材料
1.1仪器
20AT液相色谱仪,包括UV检测器、色谱工作站(日本岛津公司);LF-1脂质体挤出仪(加拿大奥维斯丁公司)。
1.2药品与试剂
硫酸长春新碱原料药、粉防己碱原料药(大连美仑生物技术有限公司,批号:M0423AS、MB6635,纯度均为:98.2%);卵磷脂(EPC,日本NOF公司,批号:120015);聚乙二醇2000-二硬脂酰磷脂酰乙醇胺(PEG2000-DSPE)、PEG2000-DSPE-N-羟基琥珀酰亚胺(PEG2000-DSPE-NHS)(日本精化株式会社,批号:B10206、B11011);胆固醇(Chol,上海普迈生物科技有限公司,批号:8280100);TF原料药(北京索莱宝科技有限公司,批号:1015567,纯度:大于90%);葡聚糖凝胶(Sephadex)G-50(上海华蓝化学科技有限公司);甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1TF修饰长春新碱-粉防己碱脂质体的制备
按照处方比例分别精密称取卵磷脂、胆固醇、PEG2000-DSPE、PEG2000-DSPE-NHS和粉防己碱,加10 ml氯仿超声使溶解,于40℃水浴中旋转蒸发(60 r/min)除去氯仿,加入250 mmol/L(NH4)2SO4溶液5 ml水化,水化后的混悬液超声10 min(超声时间为10 s,间歇时间为10 s,功率为200 W),超声后脂质体溶液依次通过孔径为400、200 nm的聚碳酯膜各2次。将过膜后的脂质体装入透析袋(截留分子质量:10 000~12 000)中,置于pH 7.6磷酸盐缓冲液(PBS)中透析24 h,每8 h更换1次透析液。透析后的脂质体加入TF 2 mg,室温磁力搅拌反应2 h,即得空白脂质体。将上述空白脂质体与适量的长春新碱混合,于40℃水浴振摇30 min,即得。
2.2色谱条件与系统适用性试验
色谱柱:依利特C18(250 mm×4.6 mm,5 μm);流动相:甲醇-三乙胺水溶液(取三乙胺15 ml加水985 ml,混匀)(70∶30),流速:1.0 ml/min;柱温:30℃,检测波长:297 nm;进样量:20μl。理论板数以长春新碱计不得低于3 000。取长春新碱空白脂质体溶液、对照品溶液、供试品溶液进样分析,记录色谱。结果,长春新碱的保留时间约为9.864 min,空白脂质体对长春新碱色谱峰测定无干扰,色谱图见图1。
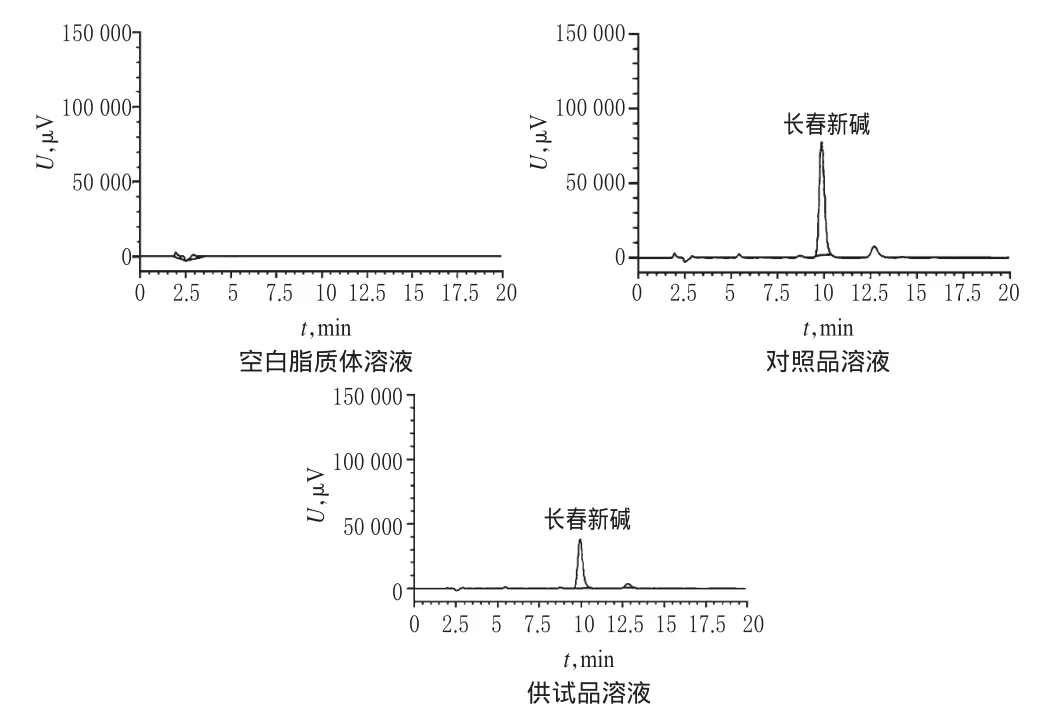
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.3溶液的制备
2.3.1供试品溶液的制备精密量取脂质体样品1 ml,置于10 ml量瓶中,加甲醇定容至刻度,超声破乳,过0.45 μm微孔滤膜,取续滤液备用。
2.3.2对照品溶液的制备精密称取长春新碱对照品16.00 mg,置于10 ml量瓶中,加流动相定容至刻度,得质量浓度为1.60 mg/ml的对照品溶液。将该对照品溶液依次稀释成质量浓度为1 600、1 200、800、400、160 μg/ml的系列对照品溶液。
2.3.3空白溶液的制备按“2.1”项下的方法制备空白脂质体,再按“2.3.1”项下方法制备空白溶液,即得。
2.4线性关系考察
取“2.3.2”项下系列对照品溶液按“2.2”项下色谱条件进样测定,以长春新碱质量浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线,得回归方程为y=1 005.9x-9 388.4(r=0.999 8,n=5)。结果表明,长春新碱检测质量浓度在160~1 600 μg/ml范围内线性关系良好,定量限为160 μg/ml。
2.5精密度试验
取质量浓度为160 μg/ml的对照品溶液,按“2.2”项下色谱条件,连续进样5次测定。结果,长春新碱峰面积的RSD= 0.070%(n=5),表明仪器的精密度良好。
2.6重复性试验
取同一供试品溶液,平行操作6份,按“2.2”项下色谱条件进样测定。结果,长春新碱峰面积的RSD=0.072%(n=6),表明方法重复性良好。
2.7稳定性试验
取同一供试品溶液,分别放置0、2、4、8、12、24 h后,按“2.2”项下色谱条件进样测定。结果,长春新碱峰面积的RSD=0.097%(n=6),表明供试品溶液在24 h内稳定。
2.8回收率试验
精密称取TF修饰长春新碱-粉防己碱脂质体样品0.5 ml,共9份,分别加入质量浓度为400 μg/ml的对照品溶液适量,按“2.3.1”项下方法制备供试品溶液,定容得高、中、低质量浓度的溶液,经0.45 μm微孔滤膜滤过后,精密吸取20 μl,按“2.2”项下色谱条件进样测定,记录长春新碱峰面积,计算加样回收率,结果见表1。
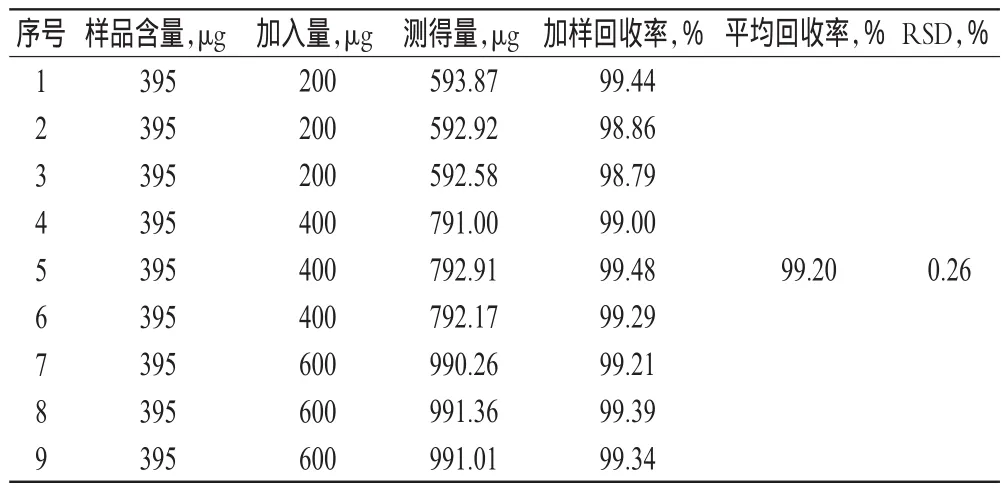
表1 回收率试验结果Tab 1 Results of recovery tests
2.9含量测定
取3批TF修饰长春新碱-粉防己碱脂质体样品,每批各3份,各精密量取1.0 ml,按“2.3.1”项下方法制备成供试品溶液,按“2.2”项下色谱条件进样测定,计算长春新碱的含量。结果,3批样品中长春新碱的平均含量分别为0.791、0.790、0.790 mg/ml,平均值为0.790 mg/ml,RSD分别为0.18%、0.09%、0.18%,平均值为0.15%(n=3)。
2.10脂质体包封率的测定
2.10.1洗脱曲线的绘制[10]称取葡聚糖凝胶G-50 2.0 g,置于pH 7.6 PBS中浸泡24 h,湿法装柱。精密吸取TF修饰长春新碱-粉防己碱脂质体0.5 ml,加入长春新碱对照品0.2 mg,混匀,加至凝胶柱(1.0 cm×12 cm)上方,以pH 7.6 PBS进行洗脱,流速为1.0 ml/min,每份1 ml,共收集20份。从20份收集液中分别吸取0.5 ml,加入0.5 ml甲醇,混匀,超声破乳,按“2.2”项下色谱条件进样,测定长春新碱的含量。以管数为横坐标、长春新碱含量为纵坐标,绘制曲线,见图2。
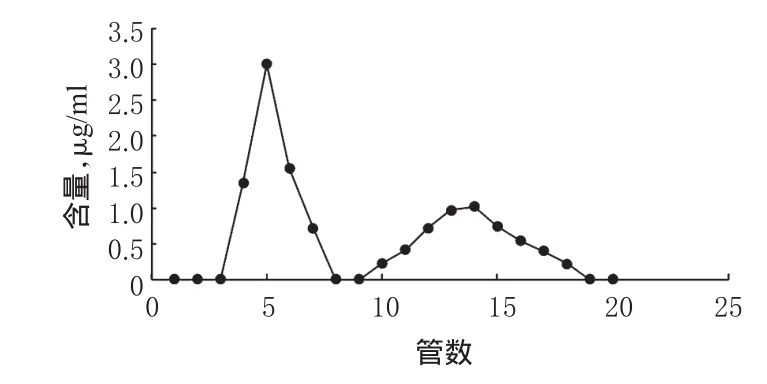
图2 长春新碱洗脱时的含量-管数曲线Fig 2 Content-tube curve of vincristine in elution
由图2可知,脂质体和游离长春新碱可以完全分离,第3~8管为含药脂质体,第9~19管为游离长春新碱。
2.10.2包封率的测定取3批TF修饰长春新碱-粉防己碱脂质体,各3份,精密吸取脂质体0.5 ml,按“2.10.1”项下方法操作,收集脂质体部分并加甲醇破乳,定容至5 ml,0.45 μm微孔滤膜过滤。取滤液20 μl测定脂质体中长春新碱的含量,计算脂质体的包封率=M总+M加入-M游离/M总×100%,式中,M总为脂质体中的长春新碱总量,M加入为洗脱时加入的长春新碱的量,M游离为游离长春新碱的量。结果,3批样品中长春新碱的包封率分别为85.63%、86.81%、85.38%,平均值为85.94%,RSD分别为2.83%、1.02%、2.39%,平均值为2.08%(n=3)。
3 讨论
近几十年来,随着对肿瘤认知水平的不断提高,临床上越来越多的药物可以应用于癌症的早期诊断和治疗。但是,这些药物并没有给患者带来满意的治疗效果。其主要原因之一就是在治疗过程中不能将这些化疗药物成功地运送至患者的病变部位,从而无法在保证疗效的前提下最大程度地降低化疗药物的毒副作用。
脂质体是由脂质双分子层构成的内部为水溶性的封闭囊泡。由于脂质体本身所具有的机体亲和性能、肿瘤组织靶向性,使脂质体制剂在癌症治疗方面受到越来越多的关注。但是传统的脂质体进入体循环系统后很容易被血浆蛋白通过网状内皮系统(Reticulo endothelial system,RES)快速清除[11]。为了能够使这些微粒逃脱RES系统的识别和清除,可以在脂质体的表面修饰一层“保护膜”,例如经过PEG亲水基修饰的脂质体不仅可以延长脂质体在体循环停留时间,更重要的是可以通过被动或主动靶向使药物在肿瘤部位蓄积,提高药物的治疗指数。本试验中,PEG2000-DSPE作为脂质体的亲水基修饰材料,可以通过阻碍脂质体与apoA-1的结合,降低RES对脂质体的亲和力,而达到延长药效、提高靶向的目的。PEG2000-DSPE-NHS是一种常用的功能化磷脂材料,在该分子中-NHS作为活泼基团可以通过酰化反应与TF中的胺基结合,形成稳定的酰胺键,从而将TF修饰在磷脂材料的一端,可以充分发挥TF的主动靶向亲和作用。
包封率是评价脂质体制剂质量的重要指标,也是脂质体能否发挥高效、低毒优势的关键[12]。影响脂质体中药物包封率的主要因素为药物的性质及浓度,脂溶性或水溶性强的药物可制备成具有较好包封率的脂质体[13]。脂质体包封率一般是将游离药物与载药脂质体分离后再进行测定[14]。常用的分离方法有凝胶柱层析法、离心法、微柱离心法、透析法、超滤离心法等[15]。其中凝胶柱色谱法具有分子筛作用,能使混合物依据分子大小不同而分离,广泛用于脂质体的分离及包封率的测定。葡聚糖凝胶色谱法分离条件较稳定,凝胶柱可重复利用[16]。在预试验中笔者使用凝胶柱色谱法分离长春新碱而绘制洗脱曲线时发现,单独用脂质体进行洗脱绘制曲线时,由于脂质体中长春新碱的包封率较高从而导致洗脱曲线中的游离药物部分不明显,无法从洗脱曲线中清楚地分析出被包封和游离的长春新碱。所以笔者在正式试验过程中往脂质体中加入了一定量的游离长春新碱,可以使得包封在脂质体中的药物与游离的药物在洗脱曲线中所围成的曲线下面积大小相似,以便更好地满足葡聚糖凝胶色谱法的操作要求。
本研究建立的HPLC法准确可靠、简单快速、重复性好,采用葡聚糖凝胶柱分离效果较好,可用于该脂质体包封率的测定。建立的测定TF修饰长春新碱-粉防己碱脂质体含量的方法操作简单、快捷,有利于提高和控制药品质量。
[1]李文静,杨志强,王杏林.硫酸长春新碱脂质体研究进展[J].中国新药杂志,2012,21(13):1 479.
[2]陈颖翀,李翔,张婧,等.硫酸长春新碱脂质体含量测定及3种包封率测定方法的比较[J].中国药房,2014,25(37):3 504.
[3]王晓,曾纪权,陈黎丽.长春新碱常规剂量化疗引起严重神经毒性反应1例临床报告[J].肿瘤防治研究,2013,40 (1):121.
[4]田伟,李银贵,修宪,等.抗肿瘤长循环热敏脂质体的研究进展[J].中国新药杂志,2014,23(17):2 061.
[5]张莉,徐维平,苏育德,等.转铁蛋白-转铁蛋白受体在肿瘤主动靶向治疗中的应用[J].中国药业,2012,21(5):1.
[6]Ulbrich K,Hekmatara T,Herbert E,et al.Transferrin-and transferrin-receptor-antibody modified nanoparticles enable drug delivery across the blood-brain barrier(BBB)[J].Eur J Pharm Biopharm,2009,71(2):251.
[7]刘越峰,高秀蓉,王凤玲,等.粉防己碱的剂型研究进展[J].中国药师,2014,17(10):1 753.
[8]刘锦裕,李永生,黄玉清.粉防己碱抗肿瘤的作用及机制研究进展[J].中国现代应用药学,2011,28(3):205.
[9]李学涛,谭静净,喻荣平,等.中药逆转抗肿瘤药物多药耐药性研究进展[J].辽宁中医药大学学报,2013,15(1):155.
[10]管庆霞,华晓丹,张喜武,等.HPLC法测定马钱子碱纳米结构脂质载体的主药含量及包封率[J].中国药房,2015,26(21):2 983.
[11]Owens DE,Peppas NA.Opsonization,biodistribution and pharmacokinetics of polymeric nanoparticles[J].Int J Pharm,2006,307(1):93.
[12]杨硕晔,王杏林,杨志强.洛莫司汀-碘海醇复方脂质体的制备及包封率测定[J].中国药房,2014,25(37):48.
[13]叶兆伟,承伟.脂质体包封率测定方法及影响因素[J].中国生物制品学杂志,2007,20(10):789.
[14]陈召红,刘皈阳,魏亚超.脂质体包封率测定方法研究进展[J].解放军药学学报,2011,27(1):79.
[15]李可欣,陈大为,商捷,等.脂质体中蛋白类药物包封率的测定[J].沈阳药科大学学报,2010,27(9):680.
[16]郭丹,熊阳,孙鹏,等.Nobiliside-A脂质体包封率测定方法的研究[J].中成药,2009,31(1):208.
(编辑:邹丽娟)
Determination of Content and Entrapment Efficiency of Transferrin Modified Vincristine-Tetrandrine Liposomes
LI Xuetao1,TANG Wei2,JIANG Ying1,CHENG Lan1
(1.School of Pharmacy,Liaoning University of TCM,Liaoning Dalian 116600,China;2.Linyi Center for Food and Drug Control,Shandong Linyi 276001,China)
OBJECTIVE:To establish the method for the determination of main components content and entrapment efficiency of transferrin modified vincristine-tetrandrine liposomes.METHODS:HPLC method was adopted to determine the content of vincristine.The determination was performed on ELITE C18column with mobile phase consisted of methanol-15%triethylamine(70∶30)at a flow rate of 1.0 ml/min.The determination wavelength was set at 297 nm and column temperature was 30℃.The sample size was 20µl.Free drug was isolated from liposomes by dextran gel column chromatography,and entrapment efficiency was determined.RESULTS:The linear range of vincristine was 160-1 600 μg/ml(r=0.999 8,n=5)with average recovery of 99.20% (RSD=0.26%,n=9).RSD of precision test was 0.070%(n=5).The average content of vincristine in liposomes was 0.790 mg/ml(RSD=0.15%,n=3),and the average entrapment efficiency was 85.94%(RSD=2.08%,n=3).CONCLUSIONS:The method is accurate,reliable,simple and rapid,and can be used for the determination of the content and entrapment efficiency of vincristine in transferrin modified vincristine-tetrandrine liposomes.
Vincristine;Tetrandrine;Transferrin;Liposomes;Content determination;Entrapment efficiency;HPLC
R979.1;R927
A
1001-0408(2016)22-3034-03
10.6039/j.issn.1001-0408.2016.22.04
国家自然科学基金资助项目(No.81541081);辽宁省科学技术计划项目(No.2014020046);辽宁省教育厅重点实验室基础研究项目(No.LZ2015053)
*副教授,博士。研究方向:药物新型给药系统。电话:0411-89850170。E-mail:lixuetao1979@163.com
教授,博士。研究方向:药物新型给药系统。电话:0411-89850145。E-mail:sychenglan@163.com
2015-11-24
2015-12-29)
