hUC-MSCs和白藜芦醇对AD小鼠学习记忆能力及脑内SIRT1信号通路的影响*
2016-09-20王欣欣马珊珊黄团结关方霞1
王欣欣,马珊珊,孟 楠,邢 衢,黄团结,程 康,杨 波,关方霞1,#
1)郑州大学第一附属医院干细胞研究室 郑州 450052 2)郑州大学生命科学院干细胞研究室 郑州450001
hUC-MSCs和白藜芦醇对AD小鼠学习记忆能力及脑内SIRT1信号通路的影响*
王欣欣1),马珊珊2),孟楠1),邢衢2),黄团结2),程康2),杨波1),关方霞1,2)#
1)郑州大学第一附属医院干细胞研究室 郑州 4500522)郑州大学生命科学院干细胞研究室 郑州450001
白藜芦醇;人脐带间充质干细胞;阿尔茨海默症;SIRT1;小鼠
目的:探讨人脐带间充质干细胞(hUC-MSCs)移植联合白藜芦醇(RES)灌胃对AD小鼠学习记忆能力的影响及对脑内SIRT1信号通路的调控作用。方法:40只AD小鼠随机分为AD组、hUC-MSCs组、RES组、hUC-MSCs联合RES组(联合组),每组10只。干预8周后,用Morris水迷宫评估小鼠学习记忆能力;取小鼠脑组织,采用免疫组化法检测Nestin的表达,TUNEL检测神经细胞凋亡,qRT-PCR检测神经营养因子BDNF、NGF和NT-3 mRNA的表达水平,Western blot法检测SIRT1、PCNA、P53、P21和P16的表达。结果:hUC-MSCs与RES均可使AD小鼠逃避潜伏期缩短,穿越平台次数增多,目的象限停留时间增加;海马区再生细胞增多,凋亡细胞减少,BDNF、NGF和NT-3 mRNA表达水平升高,SIRT1和PCNA蛋白的表达增强,P53、P21、P16蛋白的表达减弱(P<0.05)。 hUC-MSCs和RES联合对AD小鼠学习记忆能力、神经细胞再生、BDNF以及SIRT1蛋白的表达具有协同作用(P<0.05)。结论:hUC-MSCs移植和RES灌胃可能通过调控脑内SIRT1信号通路共同促进AD小鼠学习记忆能力的改善。
阿尔茨海默病(Alzheimer′s disease,AD)是一种与年龄相关的中枢神经系统退行性变,临床主要表现为认知能力下降,病理学表现为脑内淀粉样沉积和纤维样缠绕[1],目前仍无有效的干预措施。间充质干细胞(mesenchymal stem cells,MSCs)能分泌多种神经营养因子并具有神经分化的潜能,在神经损伤、神经退行性变动物模型中发挥神经保护作用[2]。作者所在的课题组前期研究[3]发现MSCs移植可改善AD鼠的学习记忆能力且无明显副作用,为治疗AD提供了新途径。白藜芦醇(resveratrol,RES)是一种存在于葡萄等植物中的多酚类化合物,能通过激活SIRT1发挥抗衰老、保护神经和延长寿命的作用[4],并能够促进脂肪间充质干细胞的生存,调控骨髓间充质干细胞的神经分化[5-6]。但是,RES是否能协同人脐带间充质干细胞(human umbilical cord derived MSCs,hUC-MSCs)移植治疗AD尚不明确。该研究采用hUC-MSCs移植联合RES灌胃干预AD小鼠,观察AD鼠行为学和组织学改善,并探讨SIRT1信号通路的介导作用。
1 材料与方法
1.1材料新生儿脐带来自郑州大学第一附属医院妇产科(产妇签署知情同意书),经分离、原代细胞培养传代得到第4代(P4) hUC-MSCs用于移植。DMEM/F12培养基购自宝信生物科技有限公司,胎牛血清购自美国Gemini公司,RES购自美国Sigma公司,DNA小提试剂盒、Trizol、逆转录试剂盒、qRT-PCR试剂盒购自TaKaRa公司,抗体购自Santa Cruz公司,引物由生工生物工程(上海)股份有限公司合成,TUNEL原位细胞凋亡检测试剂盒购自南京建成生物公司,SP二步法免疫组化二抗试剂盒、DAB染色试剂盒、苏木精购于武汉博士德生物工程有限公司。APP695V717I转基因小鼠购自中国协和医科大学动物所。
1.2APP转基因小鼠的鉴定、分组与处理APP695V717I转基因小鼠具有脑内APP过表达的特点,可模拟AD。剪取鼠尾约0.5 cm,提取DNA,进行PCR扩增,APP引物: 5’-CCCTGAACCTGAAA CATAAAAT-3’(上游引物)和5’-GCTACGAAAATC CAACCTACAA-3’ (下游引物),琼脂糖凝胶电泳鉴定。将经鉴定确认为APP+的小鼠随机分为4组,每组10只,分别为:AD组(APP+小鼠), hUC-MSCs组 (尾静脉移植 P4 hUC-MSCs 5×106mL-1,0.2 mL/只), RES组[RES灌胃200 mg/(kg·d)], RES+MSC组(hUC-MSC移植联合RES灌胃)。8周后进行以下指标的检测。
1.3Morris水迷宫检测小鼠学习记忆能力水迷宫水池直径1.2 m,平台直径10 cm,位于水池第一象限,离液面1 cm。训练阶段,小鼠首先于平台上停留10 s以熟悉环境,然后从不同象限固定位置入水,若小鼠60 s内未找到平台,将其引至平台停留10 s再进行下一象限实验。连续训练5 d,3次/d,第6天开始进行空间探索实验,撤去平台,分别从4个象限固定位置入水,用摄像采集系统捕获小鼠游泳轨迹,统计穿越平台次数、逃避潜伏期和平台所在象限停留时间等参数。
1.4免疫组化检测小鼠脑组织Nestin蛋白的表达

1.5TUNEL检测小鼠神经细胞凋亡取3只小鼠,处死取脑组织。石蜡切片经二甲苯脱蜡、梯度乙醇脱水, 0.01 mol/L枸橼酸微波修复、冷却后,用含TdT酶和FITC 标记的dUTP的反应液37 ℃孵育60 min(阴性对照组反应液中不含TdT酶),PBS清洗3次,DAPI染核10 min,PBS清洗3次,荧光显微镜下观察拍照。用Image J软件进行阳性细胞计数。
1.6qRT-PCR检测小鼠脑内神经营养因子(BDNF、NGF、NT-3)mRNA的表达Trizol裂解法提取脑组织总RNA,测RNA浓度和纯度后,逆转录合成cDNA。反应体系:SYBR Premix Ex TaqⅡ 10 μL,ROX Reference DyeⅡ 2 μL,cDNA 0.4 μL,上下游引物各0.8 μL,dH2O 6 μL。反应条件:90 ℃ 5 min,90 ℃ 30 s,60 ℃ 34 s,40个循环。采用7500 Fast PCR仪进行扩增,获得Ct值,采用2-ΔΔCt计算目的基因的表达水平。BDNF、NGF、NT-3及内参GAPDH基因引物序列及产物片段长度见表1。
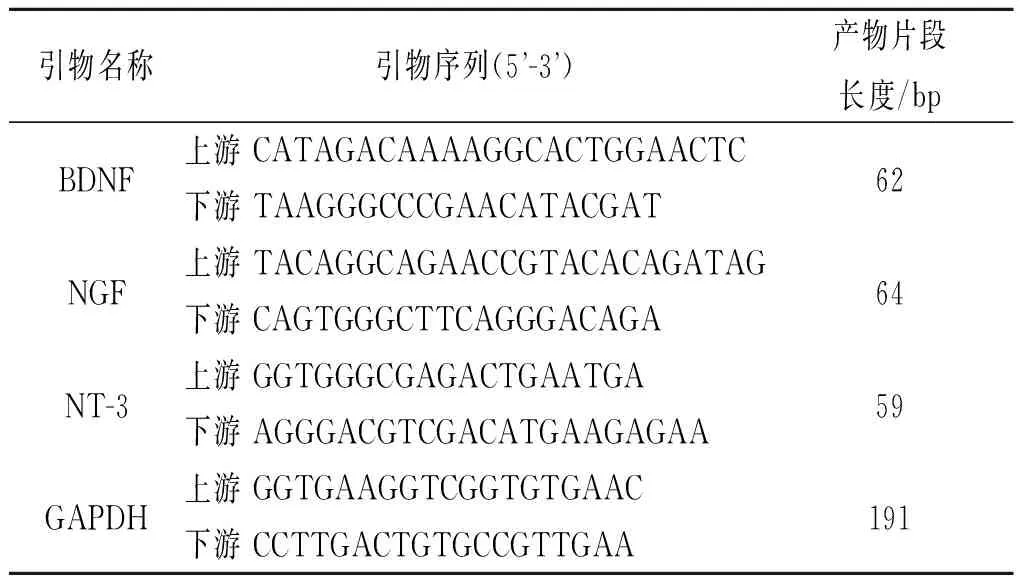
表1 实时荧光定量PCR引物序列及产物片段长度
1.8统计学处理采用SPSS 19.0处理数据。应用析因设计的方差分析探讨MSC移植和RES灌胃对水迷宫实验结果、Nestin+和TUNEL+细胞数、脑组织神经营养因子mRNA和SIRT1信号通路相关蛋白表达的影响,检验水准α=0.05。
2 结果
2.1hUC-MSCs移植和RES灌胃对AD小鼠水迷宫测试结果的影响结果见表2。
2.2hUC-MSCs移植和RES灌胃对AD小鼠海马组织Nestin+细胞数及神经细胞凋亡的影响结果见表3。
2.3hUC-MSCs移植和RES灌胃对AD小鼠脑组织神经营养因子mRNA表达的影响结果见表4。
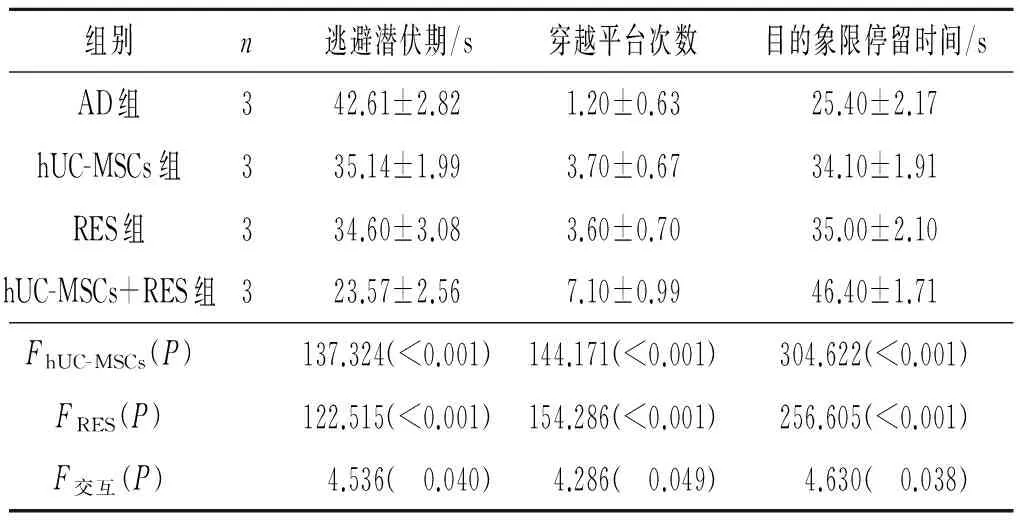
表2 4组小鼠水迷宫测试结果

表3 4组小鼠海马组织中Nestin+、凋亡神经细胞计数

表4 4组小鼠脑组织神经营养因子mRNA表达水平的比较
2.4hUC-MSCs移植和RES灌胃对AD小鼠脑内SIRT1信号通路相关蛋白表达水平的影响结果见表5。

表5 4组小鼠脑组织中SIRT1信号通路相关蛋白表达水平比较
3 讨论
该研究结果显示,hUC-MSCs移植或RES灌胃能改善AD小鼠学习记忆能力,促进AD小鼠脑组织神经营养因子BDNF、NGF、NT-3 mRNA的表达,并能促进内源性神经再生(Nestin+细胞增多),减少细胞凋亡(TUNEL+细胞减少)。此外,有研究[7]提出,移植的干细胞可整合到神经系统替代受损细胞,因此该实验中移植的hUC-MSCs在AD小鼠脑内的存活与分化状况尚需进一步研究。
分子水平上,hUC-MSCs移植与RES灌胃均能上调小鼠脑组织SIRT1信号通路相关因子如SIRT1、PCNA蛋白的表达,下调P53、P21和P16蛋白的表达。 PCNA表达增高在一定程度上反映了神经再生增强,因为PCNA是一种S期细胞增殖的标志物[8]。P53表达增高与神经元凋亡和退化相关[9],AD鼠治疗后P53蛋白表达下降,提示神经凋亡减少。p53-p21是调控衰老的重要信号[10],p16也是与衰老密切相关的基因[11],而且其表达受SIRT1基因影响[12]。该研究中RES灌胃和hUC-MSCs移植治疗后AD小鼠脑组织SIRT1增加伴随着P53、P21和P16蛋白表达减少,提示抗衰老作用增强。因此,SIRT1及相关因子PCNA、 P53、 P21和P16的改变可能是hUC-MSCs和RES治疗AD的分子机制。
另外,hUC-MSCs移植和RES灌胃联合对AD鼠学习记忆能力、神经细胞再生、BDNF以及SIRT1蛋白的表达具有协同作用。
综上所述,RES和hUC-MSCs作用于AD小鼠可协同促进神经再生,抑制神经凋亡,提高学习记忆能力。RES灌胃联合hUC-MSCs移植有望成为一种更有效的AD治疗手段。
[1]LIGGINS C,SNYDER HM,SILVERBERG N,et al.International Alzheimer′s Disease Research Portfolio(IADRP) aims to capture global Alzheimer′s disease research funding[J].Alzheimers Dement,2014,10(3):405
[2]COLPO GD, ASCOLI BM, WOLLENHAUPT-AGUIAR B, et al. Mesenchymal stem cells for the treatment of neurodegenerative and psychiatric disorders[J]. An Acad Bras Cienc, 2015, 87(2 Suppl):1435
[3]孟楠,马珊珊,王欣欣,等. 氯化锂联合 hUC-MSCs 移植对阿尔茨海默病小鼠的治疗作用[J].郑州大学学报(医学版),2015,51(2):157
[4]REHAN L,LASZKI-SZCZACHOR K,SOBIESZCZANSKA M,et al.SIRT1 and NAD as regulators of ageing[J].Life Sci,2014,105(1/2):1
[5]SIMIC P,ZAINABADI K,BELL E,et al.SIRT1 regulates differentiation of mesenchymal stem cells by deacetylating β-catenin[J].EMBO Mol Med,2013,5(3):430
[6]YUAN HF,ZHAI C,YAN XL,et al.SIRT1 is required for long-term growth of human mesenchymal stem cells[J].J Mol Med(Berl),2012,90(4):389
[7]LEE JK,JIN HK,ENDO S,et al.Intracerebral transplantation of bone marrow-derived mesenchymal stem cells reduces amyloid-beta deposition and rescues memory deficits in Alzheimer′s disease mice by modulation of immune responses[J].Stem Cells,2010,28(2):329
[8]YANG Y,MUFSON EJ,HERRUP K.Neuronal cell death is preceded by cell cycle events at all stages of Alzheimer′s disease[J].J Neurosci,2003,23(7):2557
[9]DORSZEWSKA J,OCZKOWSKA A,SUWALSKA M,et al.Mutations in the exon 7 of Trp53 gene and the level of p53 protein in double transgenic mouse model of Alzheimer′s disease[J].Folia Neuropathol,2014,52(1):30
[10]SCACCHI R,GAMBINA G,MORETTO G,et al.P21 gene variation and late-onset Alzheimer′s disease in the Italian population[J].Dement Geriatr Cogn Disord,2013,35(1/2):51
[11]OVERHOFF MG,GARBE JC,KOH J,et al.Cellular senescence mediated by p16INK4A-coupled miRNA pathways[J].Nucleic Acids Res,2014,42(3):1606
[12]SIMPSON JE,INCE PG,MATTHEWS FE,et al.A neuronal DNA damage response is detected at the earliest stages of Alzheimer′s neuropathology and correlates with cognitive impairment in the Medical Research Council′s Cognitive Function and Ageing Study ageing brain cohort[J].Neuropathol Appl Neurobiol,2015,41(4):483
(2015-10-29收稿责任编辑徐春燕)
Effects of hUC-MSCs and resveratrol on learning and memory capability and SIRT signaling pathway in brain tissue of AD mice
WANGXinxin1),MAShanshan2),MENGNan1),XINGQu2),HUANGTuanjie2),CHENGKang2),YANGBo1),GUANFangxia1,2)
1)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500522)StemCellLaboratory,SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001
resveratrol;human umbilical cord derived mesenchymal stem cell; Alzheimer′s disease;SIRT1;mouse
Aim: To investigate the effects of human umbilical cord derived mesenchymal stem cells(hUC-MSCs) transplantation and resveratrol(RES) gavage on the cognition of AD mice and SIRT1 signaling pathway in brain tissue. Methods: Forty AD mice were randomly allocated into AD group, hUC-MSCs group, RES group and hUC-MSCs combined with RES group(combined group). Eight weeks after intervention, Morris water maze was employed to evaluate the learning and memory capability; the brain tissue was prepared, immunohistochemistry was used to detect the expression of Nestin, TUNEL was used to detect cell apoptosis, qRT-PCR was used to examine the expressions of neurotropic factors BDNF, NGF and NT-3 mRNA,and Western blot was used to examine the expressions of SIRT1, PCNA, P53, P21 and P16 protein.Results: hUC-MSCs and RES could improve learning and memory capability, as evidenced by shorter latency, more crosses and time spent in the target quadrant in the Morris water maze; hUC-MSCs and RES could both enhance hippocampus neurogenesis,alleviate apoptosis,upregulate the expressions of BDNF, NGF and NT-3 mRNA as well as enhance the expressions of SIRT1 and PCNA and inhibit the expressions of P53, P21 and P16. Furthermore, hUC-MSCs and RES exerted synergistic effects on the learning and memory capability,regeneration of neuronal cells as well as upregulated the expressions of BDNF and SIRT1. Conclusion: hUC-MSCs transplantation and RES gavage could synergistically improve learning and memory capability of AD mice via regulating SIRT1 signaling pathway.
10.13705/j.issn.1671-6825.2016.05.005
*国家自然科学基金资助项目81471306,U1404313;河南省高校科技创新团队支持计划15IRTSTHN022;河南省科技创新人才计划 154200510008;河南省高等学校重点科研项目计划17A310012;高等学校博士学科点专项科研基金资助课题20114101110004
,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学, E-mail:guanfangxia@126.com
R592
