甜菜渣纤维素乙醇研究进展与展望
2016-09-19李丹苑琳李猛李冠华
李丹,苑琳,李猛,李冠华
甜菜渣纤维素乙醇研究进展与展望
李丹,苑琳,李猛,李冠华
内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021
纤维素乙醇具有清洁、安全、可再生等优点,是新能源发展的重要方向,受到各国政府、企业的广泛关注。论文首先介绍了甜菜生物学特性,随后重点阐述甜菜及其副产物甜菜渣在三代生物乙醇开发中的优越性及应用进展。在此基础上提出了甜菜渣纤维素转化乙醇及组分分离综合利用的研究思路,认为甜菜渣将会作为一种重要原料在纤维素乙醇开发中发挥作用。
生物能源,纤维素乙醇,甜菜渣,组分分离
能源分为传统化石能源和可再生能源。传统化石能源不可再生,大量使用化石能源会引起温室效应,造成环境污染,且储存量已不能满足人类经济社会发展的需求,因此可再生能源逐渐受到人类的重视。根据美国可再生燃料标准 (RFS) 要求,2022年美国可再生燃料使用量需达1.4×1011L,其中生物质燃料使用量应达到60%左右[1]。
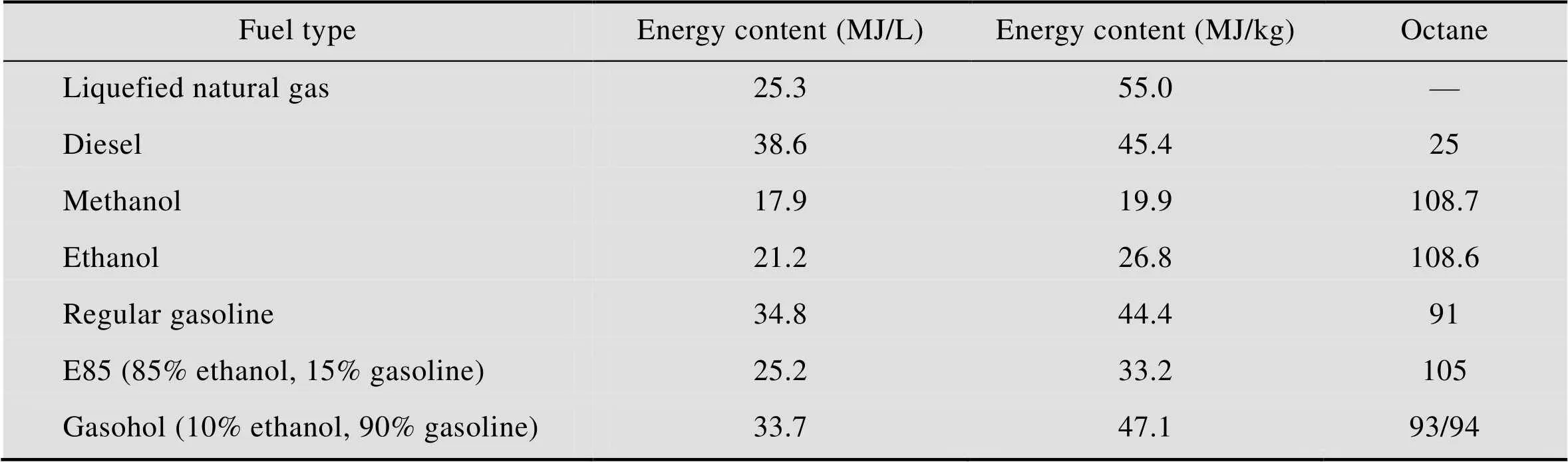
生物质燃料是指以生物质为原料转化制备得到生物乙醇、沼气、氢气、生物柴油等化工产品[2]。生物乙醇以其辛烷值高[3](表1)、安全性好,可作为含氧添加剂替代甲基叔丁基醚、乙基叔丁基醚,也可完全替代汽油作为燃料而备受关注。随着各国社会经济的快速发展及能源结构调整,生物乙醇开发成为当前科学研究的热点。
表1 几种不同燃料的能源含量对比
Table 1 Energy content of some fuels compared with ethanol
生物乙醇的研究应用拥有着悠久的历史,中国早在2 000多年前就利用固态发酵技术以谷类物质为原料制备乙醇,随后的几千年中乙醇始终作为酒品供人类饮用。直到1925年,Henry Ford首次提出乙醇可以作为未来主流能源为人类服务,同时大胆预测乙醇生产原料将会由谷类物质转变成果壳、秸秆、锯屑、苹果渣等廉价易得的生物质原料,由此开始了生物乙醇作为能源的研究。近年来美国、欧盟、巴西等国家和地区纷纷颁布相关法案,发展本国生物乙醇产业,先后发展出了以糖或淀粉为原料的“第一代生物乙醇”技术和以农林废弃物为原料的“第二代生物乙醇”技术[4]。由于“第一代生物乙醇”发展面临着“与人争粮,与粮争地”的争议,因此发展以农林废弃物等非粮作物为原料转化制备纤维素乙醇的“第二代生物乙醇”技术成为各国研究的重要方面。
甜菜属为植物界被子植物门双子叶植物纲,其栽培种有4个变种:糖用甜菜、叶用甜菜、根用甜菜和饲用甜菜[5]。甜菜适宜生长在温带地区,平均重量为0.5−1.0 kg。甜菜叶片繁茂,叶片长度能达35 cm,通过叶片进行光合作用生成糖,储存在根中。甜菜块根含有高浓度的蔗糖,是目前主要的制糖原料之一[6]。甜菜的含糖量高达16%,而甘蔗的含糖量只有12%−13%。2009年,甜菜产糖量占全球食糖总产量的20%,并呈逐年上升趋势[7]。
1 甜菜渣转化生物乙醇的优越性及不足
1.1 甜菜渣转化生物乙醇的优越性
1.1.1 甜菜渣产量大
全球甜菜种植总面积达8×106hm2,在世界农产品总产量中排名第10,约占糖料作物的48%,次于甘蔗而居第2位。2009−2013年世界甜菜主产区的产量见表2。
表2 2009–2013年甜菜产量排名前十的国家
Table 2 Top ten sugar beet producer during 2009 to 2013

Source: FAOSTAT
我国甜菜年产量高于世界平均水平,甜菜工业生产后会得到大量的甜菜渣。甜菜渣是甜菜提取蔗糖后的剩余废弃物,有许多综合利用前景。由加工副产物系数取值[8],计算可知我国2010–2014年的甜菜渣产量分别为4.65×108、5.37×108、5.87×108和4.63×108kg。
1.1.2 甜菜渣木质素含量低
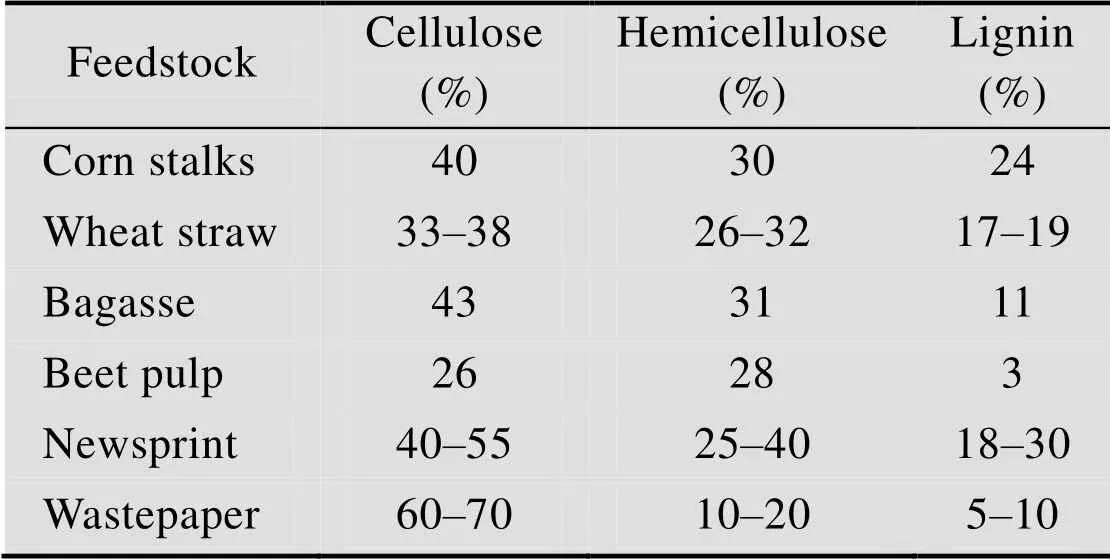
甜菜渣干物质组成为:纤维素26%、半纤维素28%、木质素3%、果胶28%、蛋白5%、灰分3%、其他27%[9]。木质素作为胞间层胶黏物质起到加固木质化植物组织的作用。高含量木质素的存在提高植物组织的生物稳定性和对各种化学试剂作用的稳定性。木质素阻碍纤维素酶对纤维素的接触,或者与纤维素不可逆结合而阻碍纤维素水解[10]。表3可知,与其他木质纤维素原料相比,甜菜渣中纤维素含量较高,而木质素含量较低,是制备纤维素乙醇的理想原料。
表3 常见木质纤维素原料及其3种组分含量[9]
Table 3 Common lignocellulosic biomass feedstock and their components[9]
1.1.3 甜菜渣集中堆放,易于收集且成本低廉
秸秆等农林废弃物分布分散,产量随季节波动大,因此原料收集和运输困难,成本较高,制约着纤维素乙醇的发展。甜菜渣是糖厂利用甜菜榨糖后的剩余副产物,大量集中堆放便于收集利用。基于此,甜菜渣的收集成本和运输成本显著降低[11]。建立甜菜制糖和甜菜渣制纤维素乙醇一体化现代制糖模式成为当前研究热点。
1.1.4 甜菜渣持续利用有利于糖业可持续发展
甜菜渣的传统利用方式中除少量用为动物饲料供给周边农户外,大部分就地堆放,处理不当会引起积压与霉烂,造成资源浪费的同时严重污染周边环境。甜菜渣含有26%的纤维素,将其转化制备为生物乙醇,能够实现资源充分利用,提高企业经济效益,减少环境污染,有利于糖业的可持续发展。
1.2 甜菜渣转化生物乙醇的不足
与其他木质纤维素原料相比,甜菜渣果胶含量高达28%,果胶的大量存在使其具有更高强度的黏性和弹性[12],相邻细胞黏接在一起,影响纤维素酶的作用效率。预处理阶段果胶分解生成半乳糖醛酸及其衍生物,上述物质的存在会对酶解与发酵产生抑制作用[13]。新鲜甜菜渣水分含量可达90%以上,处理不及时引起霉菌、酵母菌等微生物生长,导致甜菜渣腐败。烘干是脱除甜菜渣水分的常用方法,规模化应用时对设备和工艺都有较高要求。青贮也是存放甜菜渣的方法,但研究发现青贮过程中添加微生物抑制剂等会影响纤维素转化乙醇的效 率[14]。基于甜菜渣特殊性建立相关配套技术是开发甜菜渣纤维素乙醇的前提。
2 甜菜及甜菜渣在生物乙醇中的应用
2.1 甜菜在第一代生物乙醇中的应用
第一代生物乙醇的生产原料主要是淀粉类物质 (小麦、玉米、土豆和木薯) 和糖物质 (甘蔗汁和糖蜜),原料成本占乙醇生产总成本70%−80%[15]。美国和巴西已成功实现了第一代生物乙醇产业化,二者根据本国国情分别建立了以玉米和甘蔗糖为原料的生物乙醇生产线。巴西生产生物乙醇的原料,69%来自甘蔗和甜菜[16]。
甜菜富含蔗糖,在第一代生物乙醇中得到广泛应用。2005年,荷兰首先利用甜菜蔗糖转化制备乙醇[17];Dodić等提出甜菜原汁生产乙醇的动力学模型,对糖厂进行改造,建立产糖与乙醇发酵生产线[18];Juan等开发了甜菜原汁保存方法,结果表明23 ℃,蔗糖汁存放24周后,可用于发酵生产乙醇的蔗糖仍高达99%,为甜菜规模化生产乙醇打下基础[19]。以甜菜作为原料制取生物乙醇的效益日益得到大家的肯定。
2.2 甜菜渣在第二代生物乙醇中的应用
第二代生物乙醇以农林废弃物为主要原料,采用酶解-发酵相结合的模式制备生物乙醇。纤维素乙醇的生产是一个复杂的过程:纤维素 (半纤维素) 首先酶解生成葡萄糖 (木糖和阿拉伯糖),微生物转化单糖生成乙醇。据估计,全球每年大约产生51亿t (干重) 农业废弃物和501万t (干重) 林业废弃物[20]。学者以第一代生物乙醇生产技术为基础,重点研究将农林和市政废弃物转化为乙醇的第二代生物乙醇技术[21]。
加拿大的Iogen公司拥有先进的纤维素乙醇制备技术,早在1982年建立了纤维素乙醇中试装置,每天能处理1万t木质纤维素原料;2004年,建成商业销售的纤维素乙醇示范工厂,随着技术升级,实现纤维素乙醇规模化生产;2014年,Iogen公司在巴西开展一个价值30亿美元的纤维素乙醇项目,开始建立商业化纤维素乙醇工厂[22]。瑞典获得欧盟委员会5 460万欧元的拨款,建立了以造纸废弃物为原料的纤维素乙醇生产企业[23]。美国能源部国家可再生能源实验室 (NREL) 开展了多个纤维素乙醇生产项目[24]。中国山东泽生公司利用Chen等研究的秸秆纤维素固态酶解技术,建立了年产3 000 t秸秆纤维素乙醇生产示范工程[25]。国际能源机构指出,随着研究的不断深入纤维素乙醇将逐步取代传统燃料,成为人类赖以生存的新能源。
甜菜制糖和甜菜渣制纤维素乙醇的一体化现代制糖企业新模式,因甜菜渣独特的优越性,具有重要的应用前景。工艺路线包括:甜菜蔗糖提取、固液分离、糖液浓缩制糖、甜菜渣干燥贮藏、甜菜渣预处理、甜菜渣纤维素酶解、单糖发酵和乙醇蒸馏等工艺。但目前上述研究仍多处于实验室研究阶段。Foster等氨爆预处理甜菜渣,利用纤维素酶、半纤维素酶和果胶酶协同酶解,显著提高纤维素的酶解率,但处理后半纤维素酶和果胶酶用量增加,表明氨爆处理促进了纤维素的降解,对半纤维素和果胶的降解没有作用[26]。Kühnel等考察了甜菜渣经过不同预处理后酶解率差异,发现140 ℃水中热处理15 min能够溶解60% (/) 的总碳水化合物,显著除去果胶,另一方面剧烈条件会破坏溶液中的糖,生成糖降解产物糠醛、羟甲基糠醛、乙酸和甲酸[12]。Zheng等研究发现青贮不仅可以实现甜菜渣贮藏,而且青贮期间破坏甜菜渣理化结构,促进酶解[27]。甜菜渣为原料,采用基因工程菌株,同步糖化发酵乙醇。大肠埃希氏菌突变株M. KO11能有效转化阿拉伯糖和半乳糖醛酸为乙醇[28]。Rorick等对比KO11和酿酒酵母H. YSC2转化甜菜渣为乙醇的效率,分别得到乙醇产量0.144 g/g (乙醇/甜菜渣干重) 和0.092 g/g (乙醇/甜菜渣干重)[29]。Zheng等发现稀酸预处理虽然会生成发酵抑制物,但甜菜渣的乙醇产量仍会提高,甜菜渣所含蛋白质量较少,不足以支持KO11生长,所以在发酵过程中需补充酵母提取物和蛋白胨[30]。Yücel等用树干毕赤酵母P. 发酵甜菜渣的水解液生产乙醇,并利用活性炭吸附乙酸,解除发酵抑制[31]。Bellido等用拜氏梭菌D. 发酵甜菜渣酶解液生产丙酮-丁醇-乙醇,发现预处理时pH值和固液比对终产物产率影响较大[32]。
对甜菜渣进行预处理是其制备纤维素乙醇必要的步骤,包括化学处理和生物处理等[33-34]。甜菜渣富含果胶,使其与农业废弃物、木材等其他木质纤维素原料具有显著不同的组成和结构特征。基于甜菜渣建立新的预处理方法和酶解工艺是当前研究的重要方面。生物法预处理是利用微生物或微生物产生的酶破坏生物质结构的方法。具有条件温和、能耗低、抑制物少等优点。但是生物预处理时间长、效率低、不适宜工业应用。本课题组以生物预处理为核心建立了组合预处理工艺,实验发现建立的汽爆耦合真菌协同预处理是一种有效组合预处理方法。汽爆破坏玉米秸秆的刚性结构,增大表面孔径和孔隙,暴露纤维素结晶结构,提高真菌作用效率[35]。目前,我们正尝试建立一种液氨低温预浸协同硬毛粗盖孔菌预处理甜菜渣的工艺[36],预处理过程条件相对温和、发酵抑制物生成少、化学腐蚀性小、价格低,是预处理甜菜渣的理想方法。
2.3 甜菜渣在第三代生物乙醇中的应用
第三代生物乙醇有两种:一种是指以海藻油为原料生产乙醇,海藻培养和海藻油的萃取是核心步骤[37]。另一种通过现代分子生物学技术构建基因工程菌株,将生物质预处理,纤维素酶解,乙醇发酵通过同一微生物在单一的工艺步骤中实现[38-39]。第三代生物乙醇处于实验阶段,能否成功开发第三代生物乙醇,很大程度上取决于对纤维素分解菌新陈代谢的了解程度。这个生产系统包括了菌种代谢、基因重组、酶解反应以及热力学机制这些复杂过程。
研究改造乙醇生产菌株,使其可以集预处理、酶解及发酵为一体,是发展第三代生物乙醇的前提。Shahbazi等诱变里氏木霉S.,突变菌株NRCAM5能够产生外切葡聚糖酶、内切葡聚糖酶、纤维二糖脱氢酶等,这些酶共同作用,提高甜菜渣酶解糖化率[40]。Li等用紫外照射休哈塔假丝酵母B.&U.,获得突变体Cs3512。Cs3512对生物质进行预处理,还可将葡萄糖和木糖转化为乙醇[41]。Fernández-Sandoval等通过代谢工程,成功将MG1655改造为乙酸耐受菌株MS04用于生产乙醇[42]。Nakamura等重组,使其表达BGL基因,实现木糖/纤维二糖高效共发酵[43]。中粮集团构建的工程菌株424A (LNH-ST) 可以同时转化六碳糖和五碳糖生成乙醇,总糖利用率超过85.0%,成功实现500 t/y的纤维素乙醇中试规模[44]。以甜菜渣为底物生产第三代生物乙醇研究较少,但上述乙醇生产菌株的成功改造,相信可以更好地发挥甜菜渣的优越性。
3 甜菜渣组分分离及综合利用
甜菜富含蔗糖、纤维素、半纤维素和果胶等。在建立甜菜制糖和甜菜渣制备纤维素乙醇一体化的基础上,应进一步对甜菜其他组分进行分离与利用。
图1可知,甜菜渣中能够获得果胶、粗多糖、纤维、甲烷、丙二醇等多种物质[45-46]。如甜菜渣中半乳糖醛酸和阿拉伯糖进一步转化为酰胺或增塑剂等高价值化学品或材料;乳酸还原生产丙二醇;酶解甜菜渣与酒糟混合生产甲烷[47-50]。Ward等从甜菜渣水解液中分离单糖,再将其转化为更高价值的化学品和医药中间 体[51]。组分分离及综合利用提高甜菜渣资源利用率的同时可以分担乙醇生产成本,提高纤维素乙醇市场竞争力,促进产业化发展。

图1 甜菜各组分及用途
4 展望
甜菜渣产量大,纤维素含量高,易于收集且成本低廉,是制备纤维素乙醇的理想原料。甜菜渣纤维素转化制备乙醇的同时,对甜菜渣其他组分进行分级分离,各个组分的综合利用,可以实现效益的最大化。甜菜渣转化纤维素乙醇及组分综合利用涉及原料预处理技术、纤维素酶解发酵技术、组分分离及转化等。相关技术深入研究的同时,应进一步开展集成创新的工作,从工程层面实现各工艺的最优。随着新理论的提出与技术的革新,甜菜渣制备纤维素乙醇方面将会获得更快发展。
REFERENCES
[1] Energy sugar beets to biofuel: field to fuel production system and cost estimates [EB/OL]. [2015-11-15]. http://ageconsearch.umn.edu/ bitstream/196777/2/P-Energy%20Beet-SAEA%202015.pdf.
[2] Youngs H, Somerville C. Best practices for biofuels. Science, 2014, 344(6188): 1095–1096.
[3] Ziemiński K, Romanowska I, Kowalska-Wentel M, et al. Effects of hydrothermal pretreatment of sugar beet pulp for methane production. Bioresour Technol, 2014, 166: 187–193.
[4] Lennartsson PR, Erlandsson P, Taherzadeh MJ. Integration of the first and second generation bioethanol processes and the importance of by-products. Bioresour Technol, 2014, 165: 3–8.
[5] Biancardi E, Panella LW, Lewellen RT. Beta Maritima: the origin of beets. New York, NY: Oxford University Press, 2014: 4–6.
[6] McGrath JM, Townsend BJ. Sugar beet, energy beet, and industrial beet//Cruz VMV, Dierig DA, Eds. Industrial Crops. New York: Springer, 2015: 81–99.
[7] Cooke DA, Scott RK. The sugar beet crop. United Kingdom: Chapman & Hall, 1993: 3–7.
[8] Guo LL, Wang XY, Tao GC, et al. Assessment of field crop process residues production among different Provinces in China. J China Agric Univ, 2012, 17(6): 45–55 (in Chinese). 郭利磊, 王晓玉, 陶光灿, 等. 中国各省大田作物加工副产物资源量评估. 中国农业大学学报, 2012, 17(6): 45–55.
[9] Leijdekkers AGM, Bink JPM, Geutjes S, et al. Enzymatic saccharification of sugar beet pulp for the production of galacturonic acid and arabinose; a study on the impact of the formation of recalcitrant oligosaccharides. Bioresour Technol, 2013, 128: 518–525.
[10] El-Naggar NEA, Deraz S, Khalil A. Bioethanol production from lignocellulosic feedstocks based on enzymatic hydrolysis: current status and recent developments. Biotechnology, 2014, 13(1): 1–21.
[11] Henke S, Bubník Z, Hinková A, et al. Model of a sugar factory with bioethanol production in program Sugars™. J Food Eng, 2006, 77(3): 416–420.
[12] Kühnel S, Schols HA, Gruppen H. Aiming for the complete utilization of sugar-beet pulp: examination of the effects of mild acid and hydrothermal pretreatment followed by enzymatic digestion. Biotechnol Biofuels, 2011, 4: 14.
[13] Edwards MC, Doran-Peterson J. Pectin-rich biomass as feedstock for fuel ethanol production. Appl Microbiol Biotechnol, 2012, 95(3): 565–575.
[14] Doležal P, Pyrochta V, Doležal J. Effects of chemical preservative and pressing of ensiled sugar-beet pulp on the quality of fermentation process. Czech J Anim Sci, 2005, 50(12): 553–560.
[15] Taylor MP, Eley KL, Martin S, et al. Thermophilic ethanologenesis: future prospects for second-generation bioethanol production. Trends Biotechnol, 2009, 27(7): 398–405.
[16] Jurado M, Prieto A, Martínez-Alcalá Á, et al. Laccase detoxification of steam-exploded wheat straw for second generation bioethanol. Bioresour Technol, 2009, 100(24): 6378–6384.
[17] Carere CR, Sparling R, Cicek N, et al. Third generation biofuelsdirect cellulose fermentation. Int J Mol Sci, 2008, 9(7): 1342–1360.
[18] Dodić JM, Vučurović DG, Dodić SN, et al. Kinetic modelling of batch ethanol production from sugar beet raw juice. Appl Energy, 2012, 99: 192–197.
[19] Vargas-Ramirez JM, Haagenson DM, Pryor SW, et al. Determination of suitable storage conditions to preserve fermentable sugars in raw thick beet juice for ethanol production. Biomass Bioenergy, 2013, 59: 362–369.
[20] Ho DP, Ngo HH, Guo WS. A mini review on renewable sources for biofuel. Bioresour Technol, 2014, 169: 742–749.
[21] Ragauskas AJ, Williams CK, Davison BH, et al. The path forward for biofuels and biomaterials. Science, 2006, 311(5760): 484–489.
[22] IOGEN Corporation. History of Iogen [EB/OL]. [2015-11-15]. http://www.iogen.ca/about-iogen/ history. html.
[23] European Commission. State aid: Commission approves Swedish €55 million aid for «Domsjö» R&D project [EB/OL]. [2015-11-15]. http://europa.eu/rapid/press-release_IP-11-67_en.htm?locale=en.
[24] National Renewable Energy Laboratory. Innovation for Our Energy Future. [EB/OL]. [2015-11-15]. http://www.nrel.gov/biomass/pdfs/ 40742.pdf.
[25] Chen HZ, Li GH. An industrial level system with nonisothermal simultaneous solid state saccharification, fermentation and separation for ethanol production. Biochem Eng J, 2013, 74: 121–126.
[26] Foster BL, Dale BE, Doran-Peterson JB. Enzymatic hydrolysis of ammonia-treated sugar beet pulp. Appl Biochem Biotechnol, 2001, 91(1/9): 269–282.
[27] Zheng Y, Yu CW, Cheng YS, et al. Integrating sugar beet pulp storage, hydrolysis and fermentation for fuel ethanol production. Appl Energy, 2012, 93: 168–175.
[28] Doran JB, Cripe J, Sutton M, et al. Fermentations of pectin-rich biomass with recombinant bacteria to produce fuel ethanol//Finkelstein M, Davison BH, Eds. Twenty-First Symposium on Biotechnology for Fuels and Chemicals. United States: Humana Press, 2000: 141–152.
[29] Rorick R, Nahar N, Pryor S. Enzymatic hydrolysis and fermentation of sugar beet pulp. Amer Soc Agric Biol Eng, 2009, 5: 2975.
[30] Zheng Y, Lee C, Yu CW, et al. Dilute acid pretreatment and fermentation of sugar beet pulp to ethanol. Appl Energy, 2013, 105: 1–7.
[31] Yücel HG, Aksu Z. Ethanol fermentation characteristics ofyeast from sugar beet pulp hydrolysate: use of new detoxification methods. Fuel, 2015, 158: 793–799.
[32] Bellido C, Infante C, Coca M, et al. Efficient acetone-butanol-ethanol production byfrom sugar beet pulp. Bioresour Technol, 2015, 190: 332–338.
[33] Dhiman SS, Haw JR, Kalyani D, et al. Simultaneous pretreatment and saccharification: green technology for enhanced sugar yields from biomass using a fungal consortium. Bioresour Technol, 2015, 179: 50–57.
[34] Imman S, Arnthong J, Burapatana V, et al. Effects of acid and alkali promoters on compressed liquid hot water pretreatment of rice straw. Bioresour Technol, 2014, 171: 29–36.
[35] Li GH, Chen HZ. Synergistic mechanism of steam explosion combined with fungal treatment byfor the pretreatment of corn stalk. Biomass Bioenergy, 2014, 67: 1–7.
[36] Li GH, Li D, Yuan L. Enhanced enzymatic hydrolysis of lignocellulose by aqueous ammonium pretreatment combined with: CN, 201510120457.0 (in Chinese).李冠华, 李丹, 苑琳. 一种液氨低温预浸协同硬毛粗盖孔菌预处理提高木质纤维素生物质酶解率的方法. 中国, 201510120457.0.
[37] Goh CS, Lee KT. A visionary and conceptual macroalgae-based third-generation bioethanol (TGB) biorefinery in Sabah, Malaysia as an underlay for renewable and sustainable development. Renewable Sustainable Energy Rev, 2010, 14(2): 842–848.
[38] Langeveld JWA, van de Ven GWJ, De Vries SC, et al. Ethanol from sugar beet in the Netherlands: energy production and efficiency. Int J Sustain Dev, 2014, 17(1): 78–88.
[39] Kracher D, Oros D, Yao WY, et al. Fungal secretomes enhance sugar beet pulp hydrolysis. Biotechnol J, 2014, 9(4): 483–492.
[40] Shahbazi S, Askari H, Naseripour T. Enzymatic saccharification of sugar beet pulp by novel mutants ofNRCAM 5 for bioethanol production. Int J Agric Crop Sci, 2014, 7(15): 1560–1569.
[41] Li Y, Park JY, Shiroma R, et al. Improved ethanol and reduced xylitol production from glucose and xylose mixtures by the mutant strain ofATCC 22984. Appl Biochem Biotechnol, 2012, 166(7): 1781–1790.
[42] Fernández-Sandoval MT, Huerta-Beristain G, Trujillo-Martinez B, et al. Laboratory metabolic evolution improves acetate tolerance and growth on acetate of ethanologenicunder non-aerated conditions in glucose-mineral medium. Appl Microbiol Biotechnol, 2012, 96(5): 1291–1300.
[43] Nakamura N, Yamada R, Katahira S, et al. Effective xylose/cellobiose co-fermentation and ethanol production by xylose-assimilatingvia expression of β-glucosidase on its cell surface. Enzyme Microb Technol, 2008, 43(3): 233–236.
[44] Yue GJ, Wu GQ, Lin X. Insights into engineering of cellulosic ethanol. Chin J Biotech, 2014, 30(6): 816–827 (in Chinese). 岳国庆, 武国庆, 林鑫. 纤维素乙醇工程化探讨. 生物工程学报, 2014, 30(6): 816-827.
[45] Ziemiński K, Kowalska-Wentel M. Effect of enzymatic pretreatment on anaerobic co-digestion of sugar beet pulp silage and vinasse. Bioresour Technol, 2015, 180: 274–280.
[46] Berlowska J, Binczarski M, Dudkiewicz M, et al. A low-cost method for obtaining high-value bio-based propylene glycol from sugar beet pulp. RSC Adv, 2015, 5(3): 2299–2304.
[47] Li DQ, Du GM, Jing WW, et al. Combined effects of independent variables on yield and protein content of pectin extracted from sugar beet pulp by citric acid. Carbohydr Polym, 2015, 129: 108–114.
[48] Yapo BM, Robert C, Etienne I, et al. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pulp pectin extracts. Food Chem, 2007, 100(4): 1356–1364.
[49] Li M, Wang LJ, Li D, et al. Preparation and characterization of cellulose nanofibers from de-pectinated sugar beet pulp. Carbohydr Polym, 2014, 102: 136–143.
[50] Chen HM, Fu X, Luo ZG. Properties and extraction of pectin-enriched materials from sugar beet pulp by ultrasonic-assisted treatment combined with subcritical water. Food Chem, 2015, 168: 302–310.
[51] Ward DP, Cárdenas-Fernández M, Hewitson P, et al. Centrifugal partition chromatography in a biorefinery context: separation of monosaccharides from hydrolysed sugar beet pulp. J Chromatogr A, 2015, 1411: 84–91.
Progress on cellulosic ethanol produced from beet pulp
Dan Li, Lin Yuan, Meng Li, and Guanhua Li
School of Life Sciences, Inner Mongolia University, Hohhot 010021, Inner Mongolia, China
Cellulosic ethanol, with the advantages of renewable resource, cleanliness and safety, is the mainstream of new energy development and has obtained extensive attention worldwide. In this review, the biological characteristics of beets were introduced, and then the superiority and application progress of beets and its by-product sugar beet pulp in the bioethanol production were stated. At last, cellulosic ethanol production coupled with the component separation and comprehensive utilization of beet pulp was proposed.
bioenergy, cellulosic ethanol, sugar beet pulp, fractionation
September 10, 2015; Accepted: December 21, 2015
综 述
李丹, 苑琳, 李猛, 等. 甜菜渣纤维素乙醇研究进展与展望. 生物工程学报, 2016, 32(7): 880–888.
Li D, Yuan L, Li M, et al. Progress on cellulosic ethanol produced from beet pulp. Chin J Biotech, 2016, 32(7): 880–888.
Supported by: Desconstruction of Recalcitrance to Enzymatic Hydrolysis of Sugar-beet Pulp: Technology and Mechanism (No. 2015BS0201), Solid State Fermentation of Cellulase (No. 21400-5145138).
Corresponding author: Guanhua Li. Tel/Fax: +86-471-4992476; E-mail: liguanhua1984@126.com
内蒙古自治区自然科学基金项目 (No. 2015BS0201),内蒙古大学2014年博士引进科研启动经费 (No. 21400-5145138) 资助。
网络出版时间:2016-01-07 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160107.1444.002.html
(本文责编 陈宏宇)
