亲和纯化技术联合质谱分析筛选乳腺癌中p90核糖体S6蛋白激酶4相互作用蛋白
2016-09-19刘日强刘天华张钦乐刘银坤杨华伟广西医科大学附属肿瘤医院乳腺外科广西南宁5300复旦大学附属中山医院肝癌研究所上海0003复旦大学生物医学研究院上海0003
刘日强,刘天华,张钦乐,江 凯,郭 坤,张 舒,刘银坤,杨华伟.广西医科大学附属肿瘤医院乳腺外科,广西 南宁 5300;.复旦大学附属中山医院肝癌研究所,上海 0003;3.复旦大学生物医学研究院,上海 0003
亲和纯化技术联合质谱分析筛选乳腺癌中p90核糖体S6蛋白激酶4相互作用蛋白
刘日强1,刘天华2,3,张钦乐2,3,江 凯2,3,郭 坤2,张 舒2,刘银坤2,3,杨华伟1
1.广西医科大学附属肿瘤医院乳腺外科,广西 南宁 530021;2.复旦大学附属中山医院肝癌研究所,上海 200032;3.复旦大学生物医学研究院,上海 200032
背景与目的:p90核糖体S6蛋白激酶4基因(ribosomal S6 kinase 4 gene,RSK4)作为抑癌基因,能够抑制细胞增殖、迁移并诱导细胞的凋亡,但与其配合发挥相应功能的相互作用蛋白尚不明确。该研究利用Flag标签纯化技术和质谱分析筛选鉴定乳腺癌细胞株MDA-MB-231中的RSK4相互作用蛋白。方法:构建含有RSK4全长和Flag亲和标签的真核表达载体pcDNA3.1/EGFP-RSK4-Flag,将其转染至MDA-MB-231乳腺癌细胞株,72 h后收集细胞蛋白。采用实时荧光定量聚合酶链反应(real-time fuorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测RSK4表达情况。运用标签分离纯化RSK4蛋白,液相质谱/质谱分析技术(liquid chromatography mass spectrometry/mass spectrometry,LC-MS/MS)鉴定RSK4相互作用蛋白,通过生物信息学的方法(GO分析和IPA分析)归纳分析互作蛋白以及与RSK4相互作用机制。结果:通过标签纯化联合质谱分析成功鉴定出丝氨酸/苏氨酸蛋白激酶38(serine/threonine-protein kinase 38,STK38)/丝氨酸/苏氨酸蛋白激酶38类(serine/threonine-protein kinase 38-like,STK38L)、MOB激酶致活因子2(MOB kinase activator 2,MOB2)、蛋白精氨酸N甲基转移酶5(protein arginine N-methyltransferase 5,PRMT5)等24个RSK4相互作用蛋白。对所鉴定出的互作蛋白进行生物信息学分析,提示RSK4互作蛋白组参与包含细胞凋亡和细胞迁移运动等在内的多种生物信号通路。结论:利用亲和纯化技术联合质谱鉴定成功筛选出RSK4相互作用蛋白并通过生物信息学分析获得了RSK4参与乳腺癌细胞的凋亡、迁移相关生物调控网络。
亲和纯化;RSK4蛋白;真核表达;基因转染
核糖体S6蛋白激酶(ribosomal S6 kinase,RSK)属于丝氨酸/苏氨酸蛋白激酶,相对分子质量大约为90×103,最早由Erikson等于1985年在非洲爪蟾卵上发现。目前,已经发现了4种RSK亚型(RSK1、RSK2、RSK3和RSK4)。研究发现,这4种亚型的蛋白结构非常相似,但功能却明显不同[1]:前3种RSK亚型是生长因子依赖性的激酶,通过ERK信号通路可促进细胞的生长、增殖和分化[2];而RSK4作为抑癌基因,其表达产物RSK4是非生长因子依赖的激酶,却可能抑制细胞的增殖、迁移和侵袭,并参与诱导细胞的凋亡[3]。由于RSK4的作用与其前3种亚型差别巨大,针对RSK4基因和蛋白功能的研究受到了越来越广泛的重视[4-8],但关于RSK4相互作用蛋白的研究报道甚少。本研究通过构建带有Flag标签稳定转染的RSK4过表达细胞株,并利用Flag标签纯化RSK4融合蛋白的方式对RSK4蛋白及其相互作用蛋白进行蛋白质质谱分析,最终借助生物信息学的方法对获得的质谱结果进行进一步解析,旨在揭示可能与RSK4存在相互作用的蛋白,探讨RSK4作用机制。
1 材料和方法
1.1材料
1.1.1质粒和乳腺癌细胞株
质粒过表达载体购自上海吉凯基因化学技术有限公司;MDA-MB-231、MCF-7乳腺癌细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。
1.1.2主要试剂
Leibovitz L-15培养液购自吉诺生物医药技术有限公司(GNM41300),胎牛血清FBS购自美国Gbico公司(10099-141),实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)所需的酶及试剂购自瑞士罗氏公司(4913914001),一抗小鼠抗人Flag单抗购自美国Sigma公司(F1804),一抗大鼠抗人RSK4单抗购自美国R&D公司公司(MAB3916),一抗小鼠抗人PRMT5单抗购自美国Sigma公司(SC-376937),二抗羊抗小鼠多抗购自美国Santa Cruz公司(SC-2005),二抗羊抗大鼠多抗购自美国Biorbyt公司(orb16535),抗Flag标签的蛋白纯化试剂购自美国Sigma公司(A2220),免疫共沉淀试剂购自美国Thermo公司(MF160357)。
1.2方法
1.2.1载体构建
依据NCBI中RSK4基因(GenBank序列号:AAI43649.1)的表达序列设计引物(表1),PCR扩增后1%琼脂糖凝胶电泳鉴定并回收目的片段。用AgeⅠ/NheⅠ分别双酶切目的片段和pcDNA3.1-EGFP-Flag载体,回收酶切产物,于16 ℃连接过夜后转化DH5α感受态细胞,挑选阳性克隆进行验证及鉴定正确的克隆测序。
1.2.2细胞培养
MDA-MB-231乳腺癌细胞培养于含10%胎牛血清的L-15培养液,置于37 ℃、饱和湿度、CO2体积分数为5%的培养箱中进行培养,每48~72 h更换培养液并观察细胞的生长状态。
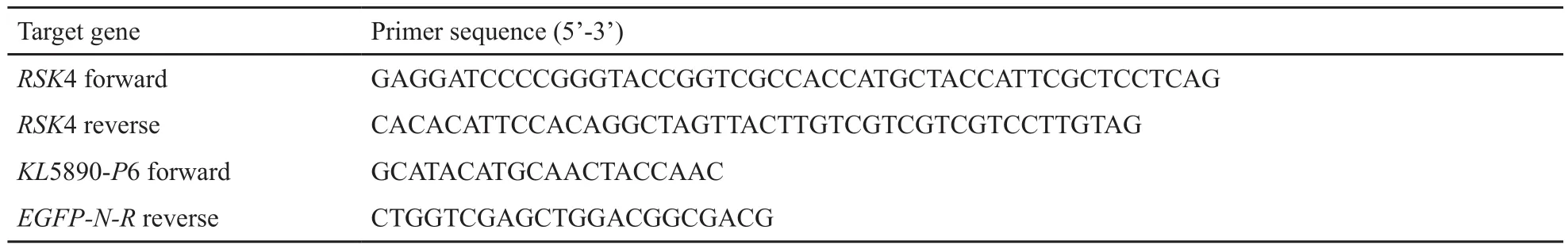
表1 相关引物序列设计Tab.1 The related primer sequences
1.2.3瞬时转染细胞
将状态良好的MDA-MB-231细胞提前传代至6孔板中,待细胞融合度达80%~90%时,按照生产厂家的转染操作说明,将构建好的融合了Flag标签的RSK4慢病毒过表达载体和作为阴性对照的空慢病毒载体分别转染至MDA-MB-231细胞,12 h后更换为正常培养液,72 h后根据载体中GFP的表达,于倒置相差显微镜下观察转染情况。
1.2.4RTFQ-PCR验证转染细胞株的转染效果
按照TRIzol法提取细胞总RNA,采用Nanodrop2000测定RNA的纯度和浓度,分别取阴性对照细胞和RSK4过表达细胞RNA 3 μg,根据cDNA第一链合成反转录试剂盒说明书进行反转录。利用Primer 5.0软件设计引物,交由生工生物工程(上海)股份有限公司合成,RSK4引物及β-actin引物序列见表2。扩增条件:95 ℃预变性30 s,95 ℃10 s,60 ℃10 s,72 ℃10 s,共40个循环;72 ℃延伸10 min。

表2 RTFQ-PCR相关引物序列Tab.2 Related primer sequences of RTFQ-PCR
1.2.5蛋白[质]印迹法(Western blot)检测转染细胞株RSK4蛋白的表达效果
将转染了的细胞接种至10 cm培养皿,培养至融合度达90%时,更换为无血清培养液,24 h后冰上裂解细胞,提取蛋白,分别用抗Flag一抗和抗RSK4一抗进行Western blot实验,检测融合蛋白的表达情况。
1.2.6融合蛋白纯化
经鉴定转染成功的细胞转移至10 cm培养皿中进行培养,细胞融合度达80%~90%时,冰上蛋白裂解液裂解细胞,收集细胞裂解液于4 ℃离心机中离心(7 500 ×g,30 min),并提取蛋白上清液与抗Flag交联珠于4 ℃冰箱内,混合仪上进行温育交联,6 h后取出,用冲洗缓冲液(wash buffer)洗3遍,然后用3×Flag多肽(4 ℃,30 min)或洗脱缓冲液(elution bufer)(室温,15 min)温育后洗脱即可得到纯化蛋白。
1.2.7蛋白质质谱鉴定及生物信息学分析
纯化蛋白,经SDS-PAGE分离后银染切取蛋白条带进行波形蛋白(vimentin)和α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)分析。将所获得的质谱结果在DAVID数据库(Database for Annotation,Visualization and Integrated Discovery)和相关功能注释工具中对参与的生物学进程进行GO分析(gene ontology,GO)。为了构建蛋白的相互作用网络,依据蛋白参与的疾病类型及其分子功能,利用IPA(ingenuity pathway analysis)分析软件对所获质谱蛋白结果进行分析并构建相应的蛋白相互作用网络。
1.2.8免疫共沉淀
提取未转染的野生型乳腺癌细胞MCF-7蛋白裂解液,采用BCA法测定蛋白浓度,分别取3 000 μg蛋白裂解液和10 μg 抗RSK4单克隆抗体,根据Thermo免疫共沉淀试剂的操作指南进行交联实验,将所得的交联洗脱液用抗PRMT5单克隆抗体进行Western blot实验验证。
2 结 果
2.1质粒构建验证
扩增出RSK4基因,AgeⅠ单酶切,酶切鉴定结果如图所示(图1)。经测序验证,所构建载体完全正确。
2.2转染细胞构建的效果检测
利用RTFQ-PCR方法检测并比较在阴性对照和过表达细胞株中RSK4的转录表达情况(图2)。结果表明,RSK4在转染的过表达细胞中稳定过表达。
Western blot检测结果证明,RSK4融合蛋白在转染的过表达细胞中的表达较阴性对照组明显升高(图3)。
2.3Flag标签纯化蛋白
利用抗Flag交联珠对过表达细胞株中的RSK4融合蛋白进行纯化,银染实验(图4)和Western blot实验(图5)检测纯化效果。结果表明,经过纯化后杂蛋白显著减少,所剩的未知蛋白条带主要为可能与RSK4存在相互作用的蛋白。
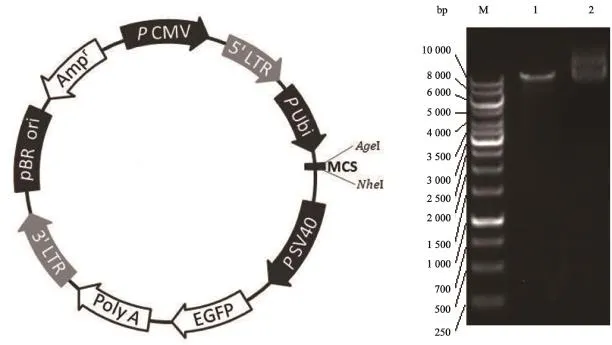
图1 重组载体pcDNA3.1-EGFP-Flag酶切鉴定Fig.1 Recombinant vector pcDNA3.1-EGFP-Flag identifed by enzyme digestion
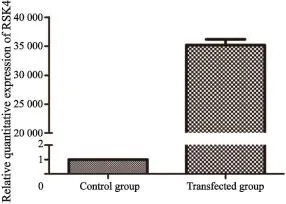
图2 RTFQ-PCR检测RSK4在MDA-MB-231乳腺癌细胞中转染后的过表达情况Fig.2 Overexpressions of RSK4 detected by RTFQ-PCR after transfection

图3 Western blot检测RSK4-Flag融合蛋白表达Fig.3 RSK4-Flag fusion proteins detected using diferent frst antibodies by Western blot

图4 Flag标签纯化的银染胶图Fig.4 Silver staining after Flag tag purification

图5 Western blot检测Flag标签纯化RSK4-Flag融合蛋白Fig.5 Purifed RSK4-Flag fusion protein detected using diferent frst antibodies by Western blot
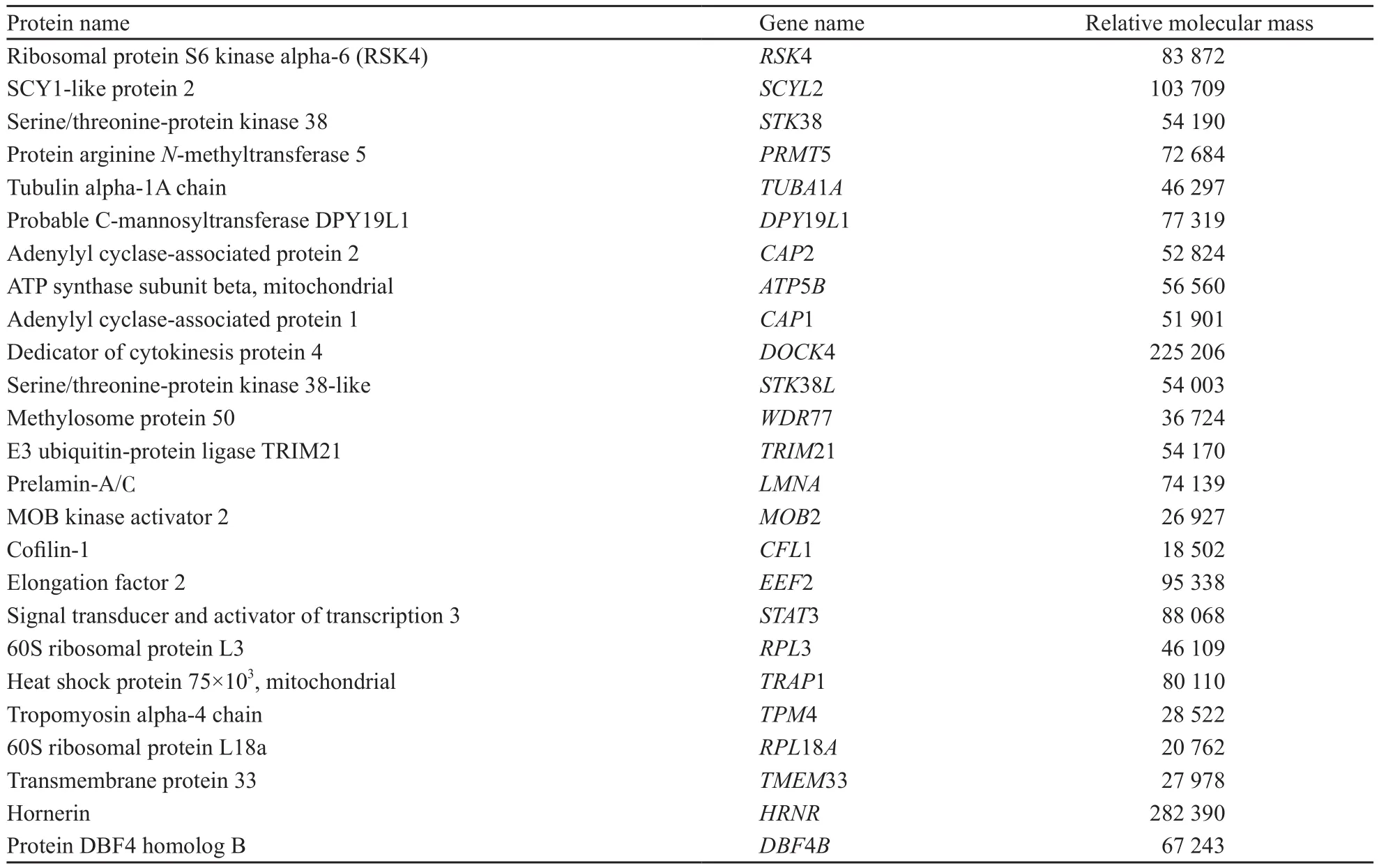
表3 质谱鉴定出的RSK4蛋白及其相互作用蛋白Tab.3 RSK4 and its interacting proteins identifed by mass spectrometry
2.4蛋白质质谱分析及生物信息学分析
利用前述两种不同洗脱液分别纯化带有Flag单标签的RSK4融合蛋白后均进行质谱检测,分别鉴定到了111个(3×Flag多肽洗脱)和136个蛋白(用洗脱缓冲液洗脱)。将IgG的质谱鉴定结果作为对照去除杂蛋白后比较两组蛋白谱,筛选获得在两次RSK4融合蛋白样品中均检测到的蛋白,包括RSK4(基因名称为RPS6KA6,图6)在内共25个(表3)。为了更全面地了解RSK4的互作蛋白,运用生物信息学的方法GO分析其生物学进程(图7),IPA分析蛋白相互作用通路的网络(图8)。
综合GO分析与IPA分析结果,丝氨酸/苏氨酸蛋白激酶38(serine/threonine-protein kinase 38,STK38)/丝氨酸/苏氨酸蛋白激酶38类(serine/ threonine-protein kinase 38-like,STK38L)、MOB激酶致活因子2(MOB kinase activator 2,MOB2)、蛋白精氨酸N甲基转移酶5(protein arginine N-methyltransferase 5,PRMT5)等24个RSK4相互作用蛋白主要参与蛋白磷酸化代谢、细胞的迁移运动与定位等生物学进程,互作网络通路主要富集在凋亡相关子网络(图8深红色区域)与迁移相关子网络(图8金黄色区域)。提示RSK4是一个多功能蛋白分子。

图6 RSK4和PRMT5蛋白的部分肽质指纹图Fig.6 Partial peptide fngerprint of RSK4 and PRMT5
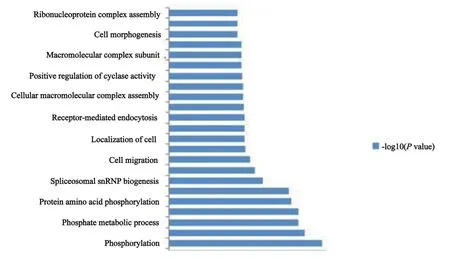
图7 GO分析RSK4互作蛋白参与的生物学进程Fig.7 Biological processes of RSK4 interacting proteins analyzed by GO
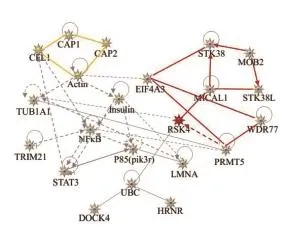
图8 RSK4相互作用蛋白的相互作用网络Fig.8 Interaction networks of RSK4 interacting proteins detected by IPA
3 讨 论
本研究的前期研究发现,RSK4基因的转录水平和蛋白水平在正常的乳腺组织、癌旁组织和癌组织样本中的表达呈递减的趋势。而在不同类型的乳腺癌细胞中,RSK4的蛋白表达水平与其转移侵袭能力呈负相关。在不同乳腺癌细胞内分别使用RSK4过表达和干扰处理后的研究结果表明,RSK4表达水平低的细胞系进行RSK4过表达处理后,其成瘤、侵袭和转移能力明显减弱;反之,对RSK4表达水平高的细胞系进行相应的干扰处理后所形成的移植瘤结果提示,抑制了RSK4基因表达后,可以促进肿瘤的形成和生长[9-11]。这些研究均提示RSK4在乳腺癌中扮演着抑癌基因的角色。与此同时,RSK4还在p53通路中通过促使p21cip1磷酸化参与细胞凋亡的调控[12-13]。
蛋白是细胞生物学功能的执行者,而绝大部分蛋白执行细胞的生物学功能时,并不是由单一的蛋白来实现,而是通过蛋白复合体的形式去完成,所以鉴定和识别某一蛋白的功能时,分析其相互作用蛋白对其作用机制及功能研究具有重要的意义。本研究利用标签纯化的方式筛选出一系列与RSK4有关的相互作用蛋白,这些蛋白参与了蛋白的磷酸化、细胞迁移运动等多种生物学过程,其参与的信号通路主要集中在凋亡相关子网络和细胞迁移运动子网络。
凋亡相关子网络中的蛋白S T K 3 8、STK38L、MOB2和MICAL1都与细胞的凋亡相关。STK38与ST38L即NDR1/NDR2,与RSK4一样,也属于丝氨酸/苏氨酸激酶超家族,参与Fas受体诱导的细胞凋亡调控—诱导细胞凋亡的发生[14]。MOB2本身能诱导细胞凋亡以及抑制细胞生长[15],与此同时,MOB2还通过与NDR1/2相互作用形成蛋白复合体,可以显著增强NDR1/2蛋白的催化活性[16]。而与MOB2一样,MICAL1也通过与NDR1/2疏水基团相互作用,抑制NDR1/2激酶的活性,负性调控NDR信号通路,从而达到抑制细胞凋亡的目的[17]。在信号通路网络图中,RSK4与MICAL1存在直接相互作用关系,MICAL1可能通过直接调控RSK4进而影响细胞的凋亡。PRMT5属于Ⅱ型蛋白精氨酸甲基转移酶,它通过不同的机制来促进细胞的生长和转化[18]。在不同类型的恶性肿瘤中,比如:卵巢癌、乳腺癌、前列腺癌,PRMT5表达水平明显升高[19]。PDCD4是肿瘤抑制基因,在乳腺癌细胞中,PRMT5对PDCD4蛋白N末端的甲基化使其功能受到抑制,从而促进肿瘤细胞的生长[20]。而RSK4与PDCD4同属抑癌基因,在网络中可以看到RSK4受到PRMT5的间接调控。PRMT5可能同样通过对RSK4蛋白进行的甲基化修饰抑制其抑瘤功能的发挥。
在迁移运动子网络中,标签纯化蛋白结果鉴定发现,CFL1、CAP1和CAP2存在于RSK4的蛋白复合体中,与RSK4相互作用。CFL1是主要的翻转激动蛋白的调控蛋白,通过与对肌动蛋白翻转作用,加强肿瘤细胞的迁移能力[21],CFL1过表达的肿瘤细胞其凋亡减少,细胞的增殖、黏附和侵袭能力增加[22]。CAP1和CAP2为腺苷酸环化酶相关蛋白,参与肌动蛋白的调控,促进细胞的迁移和侵袭。同时,CAP1可以磷酸化CFL1,抑制了CAP1的表达后,CFL1的磷酸化水平降低,细胞的迁移能力显著下降[23-24]。有文献报道[25],RSK4拥有抑制细胞迁移的能力,在RSK4过表达的细胞迁移能力降低,这表明RSK4与迁移信号通路有着密切的关系。
虽然RSK4在肿瘤的发生、发展过程中起着非常重要的作用,但是其参与调控肿瘤细胞生物学行为功能的具体机制尚不清楚。本研究通过标签纯化联合蛋白质质谱鉴定出RSK4的相互作用蛋白,有助于揭示和解决以上所述问题。
[1] LARA R,SECKL M J,PARDO O E,et al.The p90 RSK family members: common functions and isoform specificity [J].Cancer Res,2013,73(17): 5301-5308.
[2] CLARK D E,ENINGTON T M,SMITH J A,et al.The serine/ threonine protein kinase,p90 ribosomal S6 kinase,is an important regulator of prostate cancer cell proliferation [J].Cancer Res,2005,65(8): 3108-3116.
[3] LOPEZ-VICENTE L,PONS B,COCH L,et al.RSK4 inhibition results in bypass of stress-induced and oncogene induced senescence [J].Carcinogenesis,2011,32(4): 470-476.
[4] 蔡 君,张 涛.RSK4蛋白在结直肠癌中的表达及临床意义[J].肿瘤学杂志,2015,21(3): 252-254.
[5] 付国庆,范林妮,朱 瑾,等.Rsk-4蛋白在胰腺肿瘤中的表达及其与临床病理的关系[J].临床与实验病理学杂志,2010,26(6): 658-660.
[6] FAN L,LI P,YIN Z,et al.Ribosomal S6 protein kinase 4: a prognostic factor for renal cell carcinoma [J].Br J Cancer,2013,109(5):1137-1146.
[7] 孙玉朝,王忠臣.肾细胞癌患者临床病理特征与核糖体S6激酶4表达的相关性[J].中国老年学杂志,2015,35(1): 98-100.
[8] DEWDNEY S B,RIME B J,THAKER P H,et al.Aberrant methylation of the X-linked ribosomal S6 kinase RPS6KA6 (RSK4) in endometrial cancers[J].Clin Cancer Res,2011,17(8): 2120-2129.
[9] 刘剑仑,杨华伟,陈祖舜,等.核糖体S6蛋白激酶4在乳腺癌中的异常表达及临床意义[J].中华肿瘤杂志,2011,33(6): 452-456.
[10] 朱 佳,刘剑仑,韦 薇,等.RNA干扰RSK4基因表达对裸鼠移植瘤生长与转移影响观察[J].中华肿瘤防治杂志,2013,20(24): 1865-1868.
[11] THAKUR A,SUN Y,BOLLIG A,et al.Anti-invasive and antimetastatic activities of ribosomal protein S 6 kinase 4 in breast cancer cells [J].Clin Cancer Res,2008,14(14): 4427-4436.
[12] LOPEZ-VICENTE L,ARMENGOL G,PONS B,et al.Regulation of replicative and stress-induced senescence by RSK4,which is down-regulated in human tumors [J].Clin Cancer Res,2009,15(14): 4546-4553.
[13] BERNS K,HIJMANS E M,MULLENDERS J,et al.A largescale RNAi screen in human cells identifies new components of the p53 pathway [J].Nature,2004,428(6981): 431-437.
[14] VICHALKOVSKI A,GRESKO E,CORNILS H,et al.NDR kinase is activated by RASSF1A/MST1 in response to Fas receptor stimulation and promotes apoptosis [J].Curr Biol,2008,18(23): 1889-1895.
[15] LENG J J,TAN H M,CHEN K,et al.Growth-inhibitory effects of MOB2 on human hepatic carcinoma cell line SMMC-7721[J].World J Gastroenterol,2012,18(48): 7285-7289.
[16] DEVROE E,ERDJUMENT-BROMAGE H,TEMPST P,et al.Human Mob proteins regulate the NDR1 and NDR2 serinethreonine kinases[J].J Biol Chem,2004,279(23): 24444-24451.
[17] ZHOU Y,ADOLFS Y,PIJNAPPEL W W,et al.MICAL-1 is a negative regulator of MST-NDR kinase signaling and apoptosis [J].Mol Cell Biol,2011,31(17): 3603-3615.
[18] HAN X,LI R,ZHANG W,et al.Expression of PRMT5 correlates with malignant grade in gliomas and plays a pivotal role in tumor growth in vitro [J].J Neurooncol,2014,118(1): 61-72.
[19] WEI H,WANG B,MIYAGI M,et al.PRMT5 dimethylates R30 of the p65 subunit to activate NF-κB [J].Proc Natl Acad Sci U S A,2013,110(33): 13516-13521.
[20] POWERS M A,FAY M M,FACTOR R E,et al.Protein arginine methyltransferase 5 accelerates tumor growth by arginine methylation of the tumor suppressor programmed cell death 4 [J].Cancer Res,2011,71(16): 5579-5587.
[21] YAN H,YANG K,XIAO H,et al.Over-expression of cofilin-1 and phosphoglycerate kinase 1 in astrocytomas involved in pathogenesis of radioresistance [J].CNS Neurosci Ther,2012,18(9): 729-736.
[22] XU Y L,WANG D B,LIU Q F,et al.Silencing of cofilin-1 gene attenuates biological behaviours of stromal cells derived from eutopic endometria of women with endometriosis [J].Hum Reprod,2010,25(10): 2480-2488.
[23] LIU Y,CUI X,HU B,et al.Upregulated expression of CAP1 is associated with tumor migration and metastasis in hepatocellular carcinoma [J].Pathol Res Pract,2014,210(3): 169-175.
[24] ZHANG H,GHAI P,WU H,et al.Mammalian adenylyl cyclase-associated protein 1 (CAP1) regulates cofilin function,the actin cytoskeleton,and cell adhesion [J].J Biol Chem,2013,288(29): 20966-20977.
[25] 张晓丽,刘剑仑,杨华伟,等.抑癌基因RSK4的表达与乳腺癌细胞体外侵袭力的相关性研究[J].中国肿瘤临床,2011,38(6): 308-311.
Screening of proteins interacting with RSK4 in breast cancer by affinity purification and liquid chromatography/mass spectrometry
LIU Riqiang1,LIU Tianhua2,3,ZHANG Qinle2,3,JIANG Kai2,3,GUO Kun2,ZHANG Shu2,LIU Yinkun2,3,YANG Huawei1(1.Department of Breast Surgery,the Afliated Tumor Hospital of Guangxi Medical University,Nanning 530021,Guangxi Zhuang Autonomous Region,China; 2.Liver Cancer Institute of Zhongshan Hospital,Shanghai 200032,China; 3.Institute of Biomedical Sciences,Fudan University,Shanghai 200032,China)
Correspondence to: YANG HuaweiE-mail: lordyhw@163.com
Background and purpose: As a tumor suppressor gene,ribosomal S6 kinase 4 (RSK4) plays important roles in inhibiting cell proliferation,migration and inducing cell apoptosis.However,the proteins interacting with RSK4 are still unknown.This study aimed to screen proteins interacting with RSK4 in breast cancer cell line MDA-MB-231 by fag-tag afnity purifcation and LC-MS/MS (liquid chromatography/mass spectrometry).Methods:The pcDNA3.1/EGFP-RSK4-Flag eukaryotic expression vector was constructed by inserting full length RSK4 gene into vector pcDNA3.1/EGFP-Flag.And then the recombinant plasmids were transferred into MDA-MB-231 cells.Real-timefuorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot were used to detect the expression of RSK4 in MDA-MB-231 cells.Afnity purifcation and LC-MS/MS were applied to screen proteins interacting with RSK4,and the related action mechanism of RSK4 with its interacted proteins was detected based on bioinformatics gene ontology (GO) and ingenuity pathway analysis (IPA).Results: Twenty-four proteins,such as serine/threonine-protein kinase 38 (STK38)/serine/threonine-protein kinase 38-like (STK38L),MOB kinase activator 2 (MOB2) and protein arginine N-methyltransferase 5 (PRMT5),were successfully identifed by Flag-tag afnity purifcation followed by LCMS/MS analysis,which probably interacted with RSK4.Bioinformatics analysis of the identifed proteins suggested the proteins interacting with RSK4 were involved in diverse biological pathways,such as apoptosis and cell migration.Conclusion: According to bioinformatics results of proteins interacting with RSK4 identifed by afnity purifcation and LC-MS/MS,biological networks of RSK4 are involved in apoptosis and migration in breast cancer cells.
Afnity purifcation; RSK4; Eukaryotic expression; Gene transfection
10.19401/j.cnki.1007-3639.2016.07.004
R737.9
A
1007-3639(2016)07-0581-08
国家自然科学基金(81260394)。
杨华伟 E-mail:lordyhw@163.com
2015-05-13
2016-01-10)
