高浓度氧对腺肌症细胞生长及HIF-1α表达的影响
2016-09-16朱绍密
朱绍密,黄 璐,段 霜
(四川省成都市妇女儿童中心医院妇产科 610000)
高浓度氧对腺肌症细胞生长及HIF-1α表达的影响
朱绍密,黄璐,段霜
(四川省成都市妇女儿童中心医院妇产科610000)
目的探讨高浓度氧对腺肌症细胞生长及细胞内缺氧诱导因子1α(HIF-1α)表达的影响。方法将标本分为高氧组和对照组,原代培养腺肌症细胞,绘制生长曲线,检测细胞中超氧化物歧化酶(SOD)活力及培养液中丙二醛(MDA)的水平。细胞免疫组织化学检测腺肌症细胞内HIF-1α的表达。结果高浓度氧使腺肌症细胞生长速度减慢,8 h后呈抑制状态。在相同培养时间内,高氧组腺肌症细胞SOD活力低于对照组,MDA水平高于对照组(P<0.05)。随着高浓度氧持续时间的延长,HIF-1α在腺肌症细胞中表达呈下降趋势。结论高浓度氧可能对子宫腺肌症中新生血管的生成产生抑制。
缺氧诱导因子1;超氧化物歧化酶;丙二醛;子宫腺肌症
子宫腺肌症是指子宫内膜向子宫肌壁侵入生长的病理过程,多发于40岁以上经产妇,该病发病机制不明,主要临床表现为继发性痛经、经期延长、月经量过多等[1]。该病近年来发病率有上升趋势,且逐渐趋于年轻化[2]。药物及保守手术治疗效果不理想,有效治疗仍以子宫全切为主,这对渴望生育的妇女临床治疗非常棘手,因此探讨子宫腺肌症分子水平的治疗成为子宫腺肌症研究的热点课题。异位病灶在子宫肌层生长必须有新生血管供血。因此,血管形成在腺肌症发病中具有重要作用[3]。血管生成不仅受低氧环境的影响,还与促血管生成因子有密切的关系,而血管生成因子的表达受许多外部因子调控,其中缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)对其调控最为显著[4]。研究表明,低氧环境下HIF-1α能诱导微血管生成,增加组织无氧代谢,从而增强内膜细胞的侵袭能力[5]。本研究采用原代细胞培养及免疫组织化学的方法,通过检测氧化指标丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD),探讨高浓度氧(95%O2+5% CO2)对腺肌症病灶中异位内膜细胞活性及细胞内HIF-1α表达的影响。
1 资料与方法
1.1一般资料选取2014年8月 至2015年3月在成都市妇女儿童中心医院妇产科因子宫腺肌症行子宫全切术的患者30例,平均年龄(42.4±3.4)岁。所选病例术前3个月未接受激素治疗。收集的标本分为两部分,一部分送病检,由有经验的病理科医师阅片,明确病理诊断,并排除恶性病变。一部分放入DMEM培养基中,置冰上,立即转运到实验室,进行细胞消化,原代培养。
1.2方法
1.2.1主要试剂DMEM培养基,胎牛血清(FBS)为美国Gibco公司产品,胶原酶Ⅲ,四甲基偶氮唑盐(MTT)为美国Sigma公司产品,兔抗人HIF-1α单克隆抗体为美国Abcam公司产品,SOD及MDA测试盒均为南京建成生物公司产品。
1.2.2腺肌症细胞的原代培养在超净工作台内,将腺肌症组织剪成1 mm3小块,D-Hanks液反复冲洗后加入Ⅲ型胶原酶,DMEM培养基,使消化酶最终浓度为2 mg/mL;37 ℃恒温水浴箱振荡消化7 h。加入等体积10%FBS终止消化。将腺肌症细胞悬液以2×106/mL密度种植于6孔板。
1.2.3分组将原代培养的腺肌症细胞分为两组,培养于不同的气体环境中。高氧组,95%氧气+5%的CO2;对照组,95%空气+5%的CO2。MTT法分别检测两组细胞活力,并绘制生长曲线。
1.2.4细胞爬片及HIF-1α的检测将腺肌症细胞悬液以1×106/mL密度种植于细胞专用爬片,高浓度氧培养后,参考试剂盒步骤SP法检测细胞内干预前及干预后4、8 h HIF-1α蛋白的表达变化。免疫组织化学阳性判断标准:HIF-1α阳性信号为腺肌症细胞胞质中出现棕黄色颗粒,通过Imageproplus图像分析软件高倍视下选择10个视野测定每张切片中阳性细胞的平均光密度(MOD)代表蛋白表达量。
1.2.5SOD活力、MDA水平检测腺肌症细胞经高浓度氧环境培养,干预前及干预后4、8 h细胞内SOD及MDA的检测均参照试剂盒步骤。
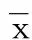
2 结 果
2.1两组腺肌症细胞生长曲线比较腺肌症细胞在高浓度氧状态下缓慢增殖,随时间的增加,差距逐渐增大,生长速度明显小于对照组(P<0.05)。8 h后,高氧组细胞呈明显生长抑制状态,见图1。

图1 两组腺肌症细胞生长曲线
2.2两组腺肌症细胞中SOD活力比较对照组腺肌症细胞在各时间点SOD活力差异无统计学意义(P>0.05)。在相同培养时间内,高氧组腺肌症细胞SOD活力明显低于对照组(P<0.05)。在高浓度氧环境下,随着时间的延长,腺肌症细胞内SOD活力呈下降趋势,见表1。
2.3两组腺肌症细胞培养液中MDA水平比较对照组内在各时间点腺肌症细胞培养液中MDA水平比较差异无统计学意义(P>0.05)。在相同培养时间内,高氧组细胞培养液中MDA水平明显高于对照组(P<0.05)。在高浓度氧环境下,随着时间的延长,细胞培养液内MDA水平呈上升趋势,见表2。
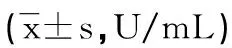
表1 两组腺肌症细胞中SOD活力对比
a:P<0.05,与对照组比较。
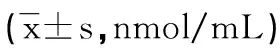
表2 两组细胞培养液中MDA水平比较
a:P<0.05,与对照组比较。
2.4高浓度氧对腺肌症细胞内HIF-1α蛋白表达的影响HIF-1α在腺肌症细胞爬片中阳性染色主要定位于细胞核,呈现棕黄色颗粒。随着高浓度氧持续时间的延长,HIF-1α在腺肌症细胞中表达总体上呈下降趋势(图2)。0、4、8 h HIF-1α蛋白分别为0.189±0.025、0.142±0.013、0.079±0.012,8 h明显低于4 h,差异有统计学意义(P<0.05)。
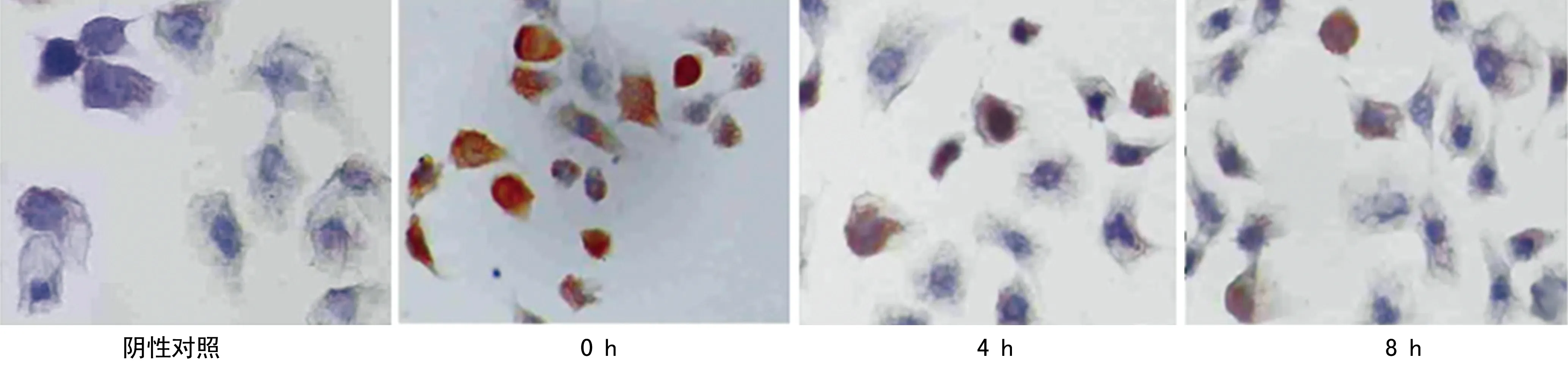
图2 HIF-1α在腺肌症细胞中的表达(×400)
3 讨 论
高浓度氧产生大量自由基攻击生物膜中的多个不饱和脂肪酸,引发脂质过氧化作用,形成脂质过氧化物,包括MDA、脂自由基 L·、烷自由基 R·等。这些产物性质稳定且寿命长,可蔓延而发生连锁反应,造成更严重的损伤[6]。生命的进化使细胞发展了有效的抗氧化防御机制。以SOD为代表的抗氧化酶是一个最重要的防御体系,以自由基为底物催化歧化反应,清除体内氧自由基及MDA等产物,保护细胞[7]。MDA生成能刺激抗氧化防御机制增高活性以对抗其伤害,但是MDA一旦生成过量细胞还是会受到损伤,过度损伤的细胞将通过凋亡机制被清除[8]。本研究中,腺肌症细胞在高浓度氧环境中的生长活力相对于对照组受到明显的抑制,随着高浓度氧培养时间的延长,细胞发生凋亡,活力明显下降,与上述理论相符。本研究的后续实验探索了这一现象的原因,结果发现,腺肌症细胞在高浓度氧环境中生长,培养液中的脂质过氧化产物MDA水平明显高于对照组,呈时间-剂量累积效应。相反,长时间的高浓度氧培养,破坏了腺肌症细胞的抗氧化防御机制,使得抗氧化酶SOD活力逐渐降低,最终失去对细胞的保护,致其生长受到抑制,甚至死亡。根据本研究结果,高浓度氧可抑制腺肌症细胞的生长,为临床医疗中,可否对子宫腺肌症病灶进行局部高浓度氧治疗的探索提供新的方向有待深入研究。
研究发现缺氧环境能够调节子宫内膜血管内皮生长因子大量分泌,促进大量新生血管的形成可能是腺肌症的发病机制之一[9]。血管生成是子宫内膜异位症发生、发展的基础,血管生成有赖于血管生长因子的调控[10]。HIF-1α是在缺氧条件下存在于哺乳动物及人体内的一种转录因子,它是低氧应答的全局性调控因子,可在上游基因水平调控血管内皮生长因子等多种血管生成相关因子的表达直接参与血管生成的调控。其功能不仅使血管内皮生长因子的mRNA稳定性增加,而且能增加血管内皮生长因子的转录活性[11]。因此,将下调HIF-1α的活性,减少其在腺肌症中的表达,进而减少新生血管,减少其转移和侵袭作为治疗的切入点,已经成为目前探索腺肌症分子治疗的热点。Zhong等[12]报道强氧化剂不利于HIF-1α在低氧细胞的表达及其DNA结合活性。本研究中发现,通过高浓度氧改变腺肌症细胞的乏氧状态,细胞中HIF-1α蛋白的表达明显下降,且随着时间的延长,HIF-1α持续下降趋势,与前述研究结果相符。HIF-1α是氧感受家族中的管家转录因子,在常氧下极不稳定,可经泛素蛋白酶解通路迅速被降解,而缺氧则抑制其降解,使 HIF-1α 表达增强,并通过激活一系列靶基因的转录,使细胞获得对组织低氧和营养物质供应减少的适应能力,维持细胞的生存与增殖[13]。本研究将腺肌症细胞持续高浓度氧刺激,一方面利用氧自由基对细胞本身的损害减少HIF-1α的表达,另一方面使持续高浓度氧状态降低HIF-1α的稳定性,使其降解。而高浓度氧降低HIF-1α表达最主要的机制,是利用持续高浓度氧提高腺肌症细胞生长环境的氧分压,使乏氧细胞转变为富氧细胞,减少低浓度氧环境对细胞的刺激,降低HIF-1α的表达,相应降低HIF-1α转录的一系列因子,减少腺肌症细胞的生长[14]。
综上所述,高浓度氧可损伤腺肌症细胞,并抑制其生长,通过减少细胞中HIF-1α的表达,可能对病灶中新生血管的生成产生抑制。通过高浓度氧来抑制腺肌症病灶的生长和侵袭,在国内外的研究中尚处于新兴阶段,但已经有一些基础实验证明了这条途径的可能性。本研究从细胞水平进一步证明了高浓度氧对腺肌症病灶的抑制,为临床研究中,探索腺肌症非手术治疗提供新的思路。尤其针对育龄期腺肌症患者保留生育力的治疗研究提供了理论基础。
[1] Taran F,Stewart E,Brucker S.Adenomyosis:epidemiology,risk factors,clinical phenotype and surgical and interventional alternatives to hysterectomy[J].Geburtshilfe Frauenheilkd,2013,73(9):924-931.
[2] 张颖,段华.子宫内膜-肌层交界区的生理功能与相关疾病[J].华妇产科杂志,2009,44(11):876-878.
[3] Zhou S,Yi T,Liu R,et al.Proteomics identification of annexin A2 as a key mediator in the metastasis and proangiogenesis of endometrial cells in human adenomyosis[J].Mol Cell Proteomics,2012,11(7):715-720.
[4] Goteri G,Lucarini G,Montik N,et al.Expression of vascular endothelial growth factor (VEGF),hypoxia inducible factor-1alpha(HIF-1alpha),and microvessel density in endometrial tissue in women with adenomyosis [J].Int J Gynecol Pathol,2009,28(2):157-163.
[5] Ahn G,Seita J,Hong B,et al.Transcriptional activation of hypoxia-inducible factor-1(HIF-1) in myeloid cells promotes angiogenesis through VEGF and S100A8[J].Proc Natl Acad Sci U S A,2014,111(7):2698-2703.
[6] Wang J,Jiang C,Alattar M,et al.Oxidative injury induced by cadmium sulfide nanoparticles in A549 cells and rat lungs[J].Inhal Toxicol,2015,25(5):1-10.
[7] Holley AK,Dhar SK,Xu Y,et al.Manganese superoxide dismutase:beyond life and death [J].Amino Acids,2012,42(1):139-158.
[8] Yasmeen H,Hasnain S.In vitro antioxidant effect of Camellia sinensis on human cell cultures[J].Pak J Pharm Sci,2015,28(5):1573-1581.
[9] Huang T,Chen Y,Chou T,et al.Oestrogen-induced angiogenesis promotes adenomyosis by activating the Slug-VEGF axis in endometrial epithelial cells[J].J Cell Mol Med,2014,18(7):1358-1371.
[10] Riddell J,Maier P,Sass S,et al.Peroxiredoxin 1 stimulates endothelial cell expression of VEGF via TLR4 dependent activation of HIF-1α [J].PLoS One,2012,7(11):e50394.
[11] Cammarata PR,Neelam S,Brooks MM.Inhibition of hypoxia inducible factor-1α downregulates the expression of epithelial to mesenchymal transition early marker proteins without undermining cell survival in hypoxic lens epithelial cells[J].Mol Vis,2015,9(1):1024-1035.
[12] Zhong H,Marzo AM,Laughner E,et al.Overexpression of hypoxia-inducible factor-1alpha in common human cancers and their metastases[J].Cancer Res,1999,59(6):5830-5835.
[13] Feast A,Martinian L,Liu J,et al.Investigation of hypoxia-inducible factor-1α in hippocampal sclerosis:A postmortem study[J].Epilepsia,2012,53(8):1349-1359.
[14] Sun L,Marti HH,Veltkamp R.Hyperbaric oxygen reduces tissue hypoxia and hypoxia-inducible factor-1 alpha expression in focal cerebral ischemia[J].Stroke,2008,39(3):1000-1006.
The effect of hyperoxia on the growth of adenomyotic cells and expression of HIF-1α
Zhu Shaomi,Huang Lu,Duan Shuang
(Department of Obstetrics and Gynecology Chengdu Women and Children Center Hospital,Chengdu,Sichuan 610000,China)
ObjectiveTo investigate the effect of hyperoxia on the growth of adenomyotic cells and expression of hypoxia inducible factor-1α(HIF-1α).MethodsAdenomyotic cells were cultured in hyperoxia group and the control group,and the cell growth curve were drawed.Superoxide dismutase(SOD) in adenomyotic cells and malondialdehyde(MDA) in the culture medium were detected.The expression of HIF-1α was detected by immunocellchemistry.ResultsThe growth rate of adenomyotic cells was slowed down by hyperoxia,which was suppressed after 8 hours.During the same time of culture,adenomyotic cells in hyperoxia group showed lower SOD and higher level of MDA when compared with that in control group(P<0.05).Hyperoxia down-regulated the expression of HIF-1α in adenomyotic cells.ConclusionHyperoxia may inhibit the formation of new blood vessels in the uterine glands.
hypoxia-inducible factor1;superoxide dismutase;malondialdehyde;adenomyosis
朱绍密(1982-),主治医师,博士,主要从事妇产科工作。
论著·临床研究10.3969/j.issn.1671-8348.2016.22.018
R711
A
1671-8348(2016)22-3075-03
2016-03-26
2016-05-14)
