VitC和锌对游泳训练大鼠皮肤光老化的协同防护作用
2016-09-16郭志丽
张 意,郭志丽,张 勇
·论著·
VitC和锌对游泳训练大鼠皮肤光老化的协同防护作用
张意1,郭志丽2,张勇2
目的探讨简便有效的防护游泳训练大鼠皮肤光老化的方法。方法行紫外线长期照射游泳训练大鼠皮肤,予以VitC+锌灌胃,病理学方法检测大鼠皮肤组织变化,检测其皮肤内羟脯氨酸(hydroxyproline,HYP)、丙二醛(malonic dialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性,酶联免疫吸附方法(enzyme-linked immuno sorbent assay, ELISA)检测皮肤内金属蛋白酶(matrix metalloproteinases,MMPs)和骨膜蛋白表达水平。结果 成功建立了游泳训练大鼠皮肤光老化的模型,VitC与锌联用可以保持大鼠皮肤组织结构完整,维持I型胶原的稳定,使皮肤内HYP含量升高,增强SOD活性,抑制MDA表达;可以有效抑制皮肤内MMPs升高,促进骨膜蛋白表达上调。结论Vit C与锌联合使用对于皮肤光老化具有良好的防护效应。
维生素C;锌;紫外线;光老化;协同效应
当前我国周边安全形势非常复杂,海洋权益受到严重威胁,对做好海上军事斗争准备的要求愈发迫切。面对新时期的挑战,我军已经针对性开展了多领域各层次的海上军事训练。海训中官兵面临的突出问题就是皮肤晒伤[1]。随着后勤保障研究的深入进行,针对急性皮肤晒伤我军已经探索建立了多种防护机制,取得了良好效果。但是由于新时期斗争的新要求,海训形势往往需要延续数月,慢性光晒伤的问题逐渐凸显出来。光老化就是慢性光晒伤的一种,具有发病隐蔽、病程迁延,不仅造成多种难治性皮损,还可以诱生恶性肿瘤[2-3]。目前有研究提示,VitC、锌制剂均具有抗过氧化的作用,有益于防护皮肤光老化[4-5]。本研究拟建立游泳训练大鼠的皮肤光老化模型,研究VitC和锌联合使用对光老化的防护作用。
1 材料与方法
1.1主要试剂与设备紫外线光疗仪:(SH-2,UVA 发射光谱340~400 nm,峰值365 nm,辐照强度: 22 W/cm2;UVB发射光谱260~350 nm,峰值311 nm,辐照强度:9.5 mW/cm2,均购自上海希格玛高技术有限公司)。超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malonic dialdehyde,MDA)试剂盒、羟脯氨酸(hydroxyproline,HYP)试剂盒购自南京建成生物有限公司,金属蛋白酶(matrix metalloproteinases,MMPs)检测试剂盒和骨膜蛋白(periostin)检测试剂盒购自RD公司。VitC、柠檬酸锌购自上海拜耳医药有限公司。健康雄性清洁级SD大鼠购自上海杰思捷实验动物有限公司,生产许可证号SCXK(沪)2013-0006。将动物置于第二军医大学实验动物中心实验动物房饲养(实验动物使用许可证号SYXK2015-0028),大鼠(200±20)g随机分为5组(空白对照组、生理盐水组、锌组、VitC组和VitC+锌组)每组8只,大鼠每4只放入一笼饲养,在相同的自然环境下(昼夜交替12h)饲养一周,常规饲养和饮食,无不良因素影响,使其适应实验室环境后开始试验。
1.2游泳训练大鼠光辐射模型的建立健康雄性大鼠用脱毛膏脱除大鼠背部5.0 cm×5.0 cm区域内毛发,置于盛水(30±2) ℃的照射盒内,进行游泳训练,使其不能在水中保持上浮,取出后尾部受刺激后呈逃避状态,难以维持平衡。照射盒上方30 cm处置光源,每次先以UVA照射3 min,休息5 min后以UVB 照射1 min,每次共照射60 min,隔日照射一次,连续照射,至12周时终止UV暴露。(每天观察大鼠背部皮肤表现,出现水泡及糜烂等反应立即停止照射,待上述症状消失后继续照射,直至建模成功)。
1.3治疗大鼠的组别与剂量设置健康雄性大鼠随机分组,每组8只:空白对照组(无UV照射);生理盐水组(UV照射,每日予以2.0 mL生理盐水灌胃);Zn组(UV照射),每日予以柠檬酸锌14.4 mg,2.0 mL溶液灌胃一次;VitC组(UV照射),每日予以VitC50 mg,2.0 mL溶液灌胃一次;VitC+锌组(UV照射),每日予以VitC25 mg+锌7.2 mg,2.0 mL溶液灌胃一次。
1.4病理学检测实验结束,断颈处死动物,迅速取背部照射处皮肤组织块(0.2~1.0 g)用于检测,固定后按常规脱水,石蜡包埋,以皮损最长径为中心行5 μm厚度连续切片,行HE组织染色,检测组织学改变;采用masson三色染色法进行I型胶原染色:以weigert铁苏木素(weigert铁苏木素A、B液等比例混和)染10 min,水洗后以1%盐酸酒精分化,丽春红酸性品红染液染5 min,磷钼酸溶液处理约5 min,用苯胺蓝人染液复染5 min,多次脱水后观察。
1.5皮肤抗氧化指标检测提取各组皮肤组织,选择南京建成生物工程研究所的检测试剂盒。采用羟胺法检测450 nm处紫外吸收峰,计算各实验组皮肤SOD活性。采用样本碱水解法检测550 nm处紫外吸收峰,计算各实验组皮肤HYP含量。采用硫代巴比妥酸法检测520 nm处紫外吸收峰,计算各实验组皮肤组织MDA含量。
1.6ELISA法检测MMPs表达水平和骨膜蛋白含量变化选择RD公司的检测试剂盒,按照说明书操作,首先加入裂解液作用裂解各实验组皮肤组织标本,依次加入一抗和二抗,加入显色液作用30 min,在570 nm 检测MMP1、MMP3和骨膜蛋白含量。

2 结 果
2.1VitC和锌联合使用可以有效防护光老化在盛水的照射盒上方放置UV照射仪,将大鼠置于盒中行游泳训练,同时予以UV照射。连续12周后建模成功,各治疗组同期予以灌胃治疗。观察各组大鼠皮肤外观,如图1所示,对照组色泽正常,弹性良好;生理盐水组大鼠背部照射区域,皮肤表现为进行性弹性丧失,粗皱纹,伴有脱屑、结痂等严重皮损情况;锌治疗组、VitC治疗组、VitC+锌联用组大鼠皮肤弹性较好,皮损等情况较生理盐水组好转,VitC+锌联用组皮损症状最轻,更接近对照组。病理切片检测各组皮肤组织,如图2所示,HE染色发现对照组皮肤表皮细胞排列整齐,表皮层和真皮层分界清楚;真皮层内可见纤维组织,其排列有序,分布均匀;模型组表皮增厚,表皮结构不完整,分层不清,真皮内纤维发生变形、破坏,排列紊乱,分布稀疏,间有大量炎性细胞浸润;锌治疗组、VitC治疗组、VitC+锌联用组皮肤病理表现介于对照组和生理盐水组之间,其中联用组表皮层和真皮层分界较清晰,真皮内纤维组织排列有序,炎性细胞浸润较少。用masson法行I型胶原染色,如图3所示,对照组皮肤内有排列整齐的纤维组织,分布均匀,疏密有致,成分及数量适当;生理盐水组I型胶原表达成分最弱,纤维发生变性,伴有结构破坏,真皮组织排列紊乱,分布不均或稀疏,有较多炎性细胞浸润;锌治疗组、VitC治疗组、VitC+锌联用组真皮内I型胶原纤维排列较规则、断裂少、排列较均匀,炎性细胞浸润少,其中联用组情况最好。皮肤外观和病理检测均表明VitC+锌联用可以有效防护紫外光长期照射,预防光老化,维持皮肤稳定。
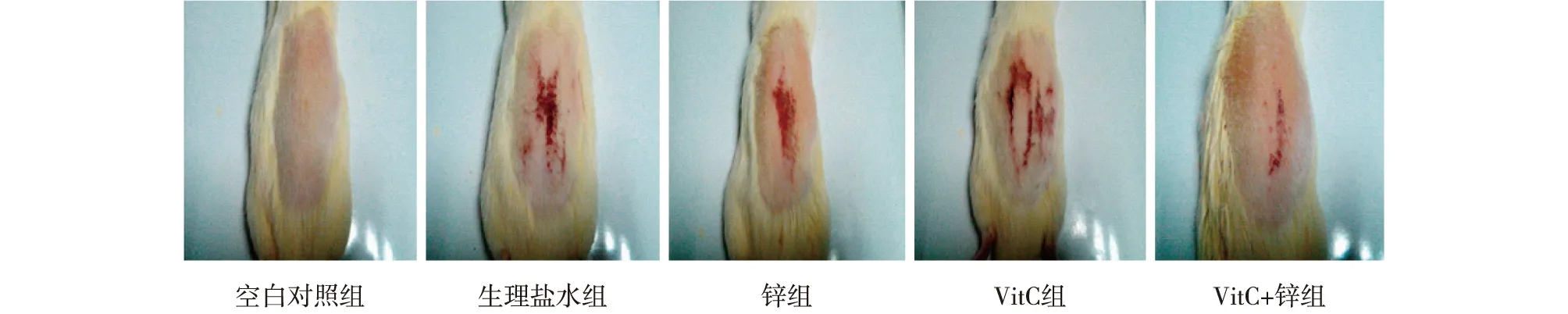
图1 各组大鼠经紫外线照射后皮肤外观图
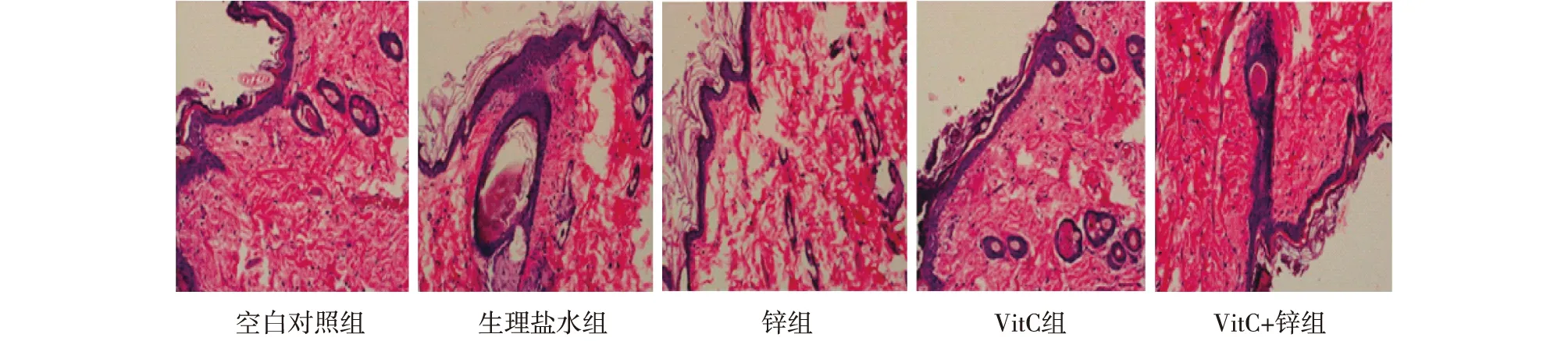
图2 各组大鼠组织病理切片图(HE ×200)
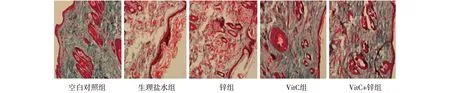
图3 各组大鼠组织切片I型胶原染色(masson法染色 ×200)
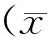
表1 各组大鼠皮肤组织生化指标比较±s)
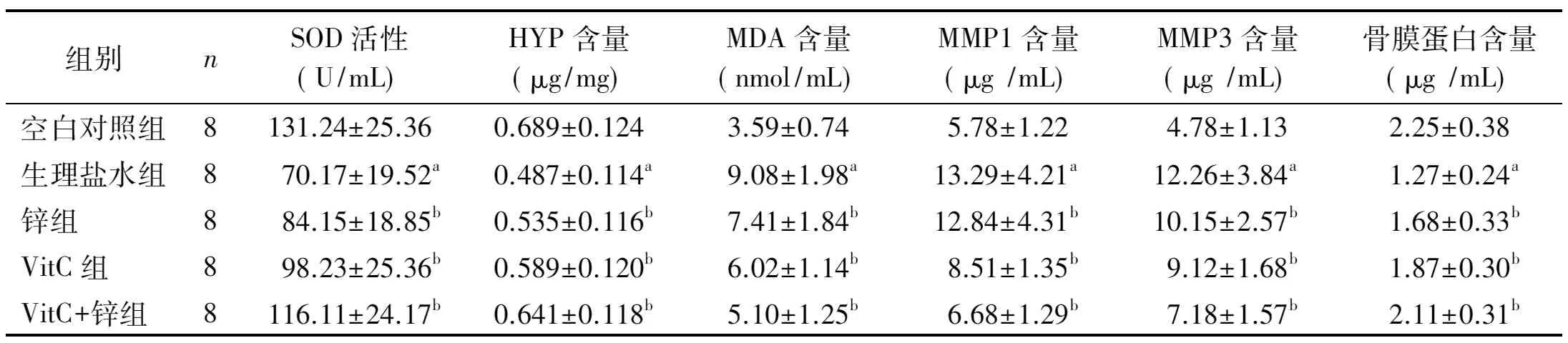
组别nSOD活性(U/mL)HYP含量(μg/mg)MDA含量(nmol/mL)MMP1含量(μg/mL)MMP3含量(μg/mL)骨膜蛋白含量(μg/mL)空白对照组8131.24±25.360.689±0.1243.59±0.745.78±1.224.78±1.132.25±0.38生理盐水组870.17±19.52a0.487±0.114a9.08±1.98a13.29±4.21a12.26±3.84a1.27±0.24a锌组884.15±18.85b0.535±0.116b7.41±1.84b12.84±4.31b10.15±2.57b1.68±0.33bVitC组898.23±25.36b0.589±0.120b6.02±1.14b8.51±1.35b9.12±1.68b1.87±0.30bVitC+锌组8116.11±24.17b0.641±0.118b5.10±1.25b6.68±1.29b7.18±1.57b2.11±0.31b注:与空白对照组比较,aP<0.05;与生理盐水组比较,bP<0.05
2.2VitC和锌联用有效改善光老化大鼠的生化指标取大鼠皮肤组织匀浆后检测各组大鼠皮肤的生化指标,见表1。采用羟胺法检测SOD活性,生理盐水组大鼠的SOD活性较对照组显著下降(P<0.05),经锌、VitC、VitC+锌联用治疗各组的SOD活性均有升高;与生理盐水组相比,联用组升高效率最佳(P<0.05)。生理盐水组大鼠皮肤的HYP含量较对照组显著下降(P<0.05),经锌、VitC、VitC+锌联用治疗各组的HYP含量均有升高;与生理盐水组相比,联用组HYP升高优于锌和VitC(P<0.05)。生理盐水组大鼠皮肤的MDA含量较对照组显著上升(P<0.05),经锌、VitC、VitC+锌联用治疗各组的MDA含量均有下降;与生理盐水组相比,联用组抑制MDA升高升高优于锌和VitC(P<0.05)。与对照组相比,光老化大鼠皮肤内MMP1和MMP3含量显著升高(P<0.05),治疗各组均可以抑制皮肤内MMPs含量上升,其中联用组效果优于锌和VitC(P<0.05)。光老化大鼠皮肤内骨膜蛋白含量较对照组显著下降(P<0.05),治疗各组均可以促进骨膜蛋白表达,联用组效果优于锌和VitC(P<0.05)。
3 讨 论
海上长周期接受中低剂量紫外线照射会导致多种不可逆的慢性光晒伤。光老化就是慢性光晒伤的一种,不仅出现皮肤变薄、弹性下降、色素不均、毛细血管扩张等皮损,还可能出现恶变[6-8]。是否可以在此发生之前进行干预,最大限度地延缓这一过程呢?本实验以此为研究目的,结合国内外研究[9]和自身实践建立游泳训练大鼠光老化的模型,在盛水的照射盒上方安置UV灯,在训练大鼠游泳的同时予以中剂量紫外照射,希望有效模拟海训时的太阳照射情况。既往研究显示,中波紫外线(UVB 290~320 nm) 照射可产生红斑、DNA损伤和皮肤癌,故认为UVB 可损伤结缔织,产生光老化。近年研究表明,长波紫外线(UVA 320~400 nm)也与皮肤光老化关系密切,UVA可扩大或协同UVB的光老化作用。另有研究显示,紫外线照射后皮肤组织氧化应激产物活性氧簇(reactive oxidative species,ROS)含量升高可导致皮肤光老化[10]。据此,我们选择UVB联合UVA照射,建立SD大鼠紫外光辐照动物皮肤老化模型。
Vit C是人体所必需的维生素之一,也是皮肤科常用药物。它为水溶性维生素,是皮肤的重要组成部分,在表皮和真皮中都有较高的表达[11-12],参与胶原蛋白和组织细胞间质的合成,参与体内多种氧化还原反应,具有抗氧自由基及对DNA 损伤有保护作用。年龄的增长、紫外线照射以及环境污染等因素均可以造成在皮肤组织中Vit C含量的减少。皮肤中的角质形成细胞在Vit C 的转运中起到重要作用[13]。口服补充Vit C可以提高其在皮肤组织中的含量[14]。已有研究显示Vit C单独或与其他药物如Vit E等联合应用中均具有抗氧化,保护DNA,改善成纤维细胞功能的作用[15]。锌是人体必需的营养物质,是300多种酶的组成成分,对生长发育、代谢、有着不可替代的重要作用。机体6%左右的锌存在于皮肤[16]。它是许多金属酶的活性辅助因子,在细胞的分化过程中起到重要作用。已有研究显示显示,锌具有促进伤口愈合的作用[17]。因此我们选择Vit C与锌联合使用,探索其对光老化的防护作用与机制。
照射后本文发现:大鼠皮肤进行性弹性丧失,皱纹变粗,伴有脱屑等现象,病理切片显示表皮增厚,表皮结构不完整,分层不清,真皮纤维发生变形、破坏,排列紊乱,分布稀疏,有较多炎性细胞浸润。I型胶原表达成分减少,纤维发生变性,伴有结构破坏,真皮组织排列紊乱,分布不均或稀疏等。这些都符合皮肤受紫外线照射后光老化的现象,说明建模成功。本文采用Vit C和锌口服制剂作为治疗剂,发现联用组大鼠皮肤外观较好,红斑、脱屑等皮损较轻,表皮结构较完整,分界清晰,真皮内纤维排列较整齐,I型胶原结构完整,炎性细胞浸润较少,显示两者联用维持皮肤结构完整、形态稳定,具有良好的抗光老化作用。
已有研究显示,紫外线照射可诱导人类皮肤成纤维细胞产生基质金属蛋白酶(MMPs),MMPs能特异性降解绝大部分细胞外基质成分,在皮肤光老化中起着重要作用[18-19]。而且MMPs能降解前胶原Ⅰ和Ⅲ,使皮肤在紫外线损伤后胶原修复能力下降。有研究表明中性粒细胞通过浸润后分泌弹性蛋白酶和基质金属蛋白酶参与了皮肤光老化的过程。骨膜蛋白是一种胞外基质分泌性蛋白,新近研究显示,骨膜蛋白在胶原蛋白生成及动态平衡的维持中发挥了重要作用。在紫外光所致的皮肤老化动物模型中骨膜蛋白表达明显减少[20]。紫外线照射会造成皮肤组织SOD活性显著下降[21],HYP含量下降[22]及MDA含量增加[23],可造成皮肤光老化。皮肤中最丰富的胶原类型是Ⅰ型、Ⅲ型胶原,羟脯氨酸是真皮内含量较高且相对稳定的氨基酸,为胶原蛋白特有的氨基酸之一,其含量可以间接反映出真皮内胶原蛋白含量的变化,而胶原含量的变化可以提示皮肤的衰老程度[24-25]。故可作为判定皮肤衰老程度的一个特殊而敏感的指标。SOD是一种生物活性蛋白,是共认最有效的抗氧化剂和自由基清除剂,具有保护细胞活性的能力[26]。丙二醛是脂质过氧化反应链终止阶段产生的小分子产物,其含量可以间接反映自由基的产生情况和机体组织细胞的过氧化程度。
本文发现,锌、 Vit C制剂和Vit C+锌治疗大鼠后,皮肤表皮、真皮组织结构完整性、维持I型胶原较未用药组更加稳定。相比于模型组,尤以Vit C+锌联合用药组可以更有效抑制皮肤内金属蛋白酶MMP1和MMP3的升高,提升组织内骨膜蛋白HYP含量,促进SOD活性,抑制MDA表达。这些都说明:Vit C+锌制剂可以有效保护皮肤,抑制紫外线引起的皮肤的光老化现象。Vit C和锌联用能够发挥良好的协同效应,且优于同剂量的Vit C和锌单独使用,Vit C和锌相互促进、协调的作用机制和其间的信号传递通路仍然值得我们深入探索。
[1]钱红,陈锦珊,胡永狮,等. 镰形棘豆防晒霜对海训官兵日晒伤防护研究[J].东南国防医药,2012,14(2):105-107.
[2]Nam JH,Nam DY,Lee DU. Valencene from the rhizomes of cyperus rotundus Inhibits skin photoaging-related ion channels and UV-Induced melanogenesis in B16F10 melanoma cells[J]. J Nat Prod,2016,79(4):1091-1096.
[3]Park G,Baek S,Kim JE,et al. Flt3 is a target of coumestrol in protecting against UVB-induced skin photoaging[J]. Biochem Pharmacol,2015,98(3):473-483.
[4]Knight J,Madduma-Liyanage K,Mobley JA,et al. Ascorbic acid intake and oxalate synthesis[J]. Urolithiasis,2016,44(4):289297.
[5]Peralta FA1,Huidobro-Toro JP. Zinc as allosteric ion channel modulator: ionotropic receptors as metalloproteins[J]. Int J Mol Sci, 2016,17(7): E1059.
[6]Kaur A,Thatai P, Sapra B. Need of UV protection and evaluation of efficacy of sunscreens[J]. Cosmet Sci, 2014,65(5):315-345.
[7]Butler PE,Gonzalez S,Randolph MA,et al. Quantitative and qualitative effects of chemical peeling on photo-aged skin: an experimental study[J].Plast Reconstr Surg,2001,107(1):222-228.
[8]Imayama S,Ueda S,Isoda M.Histologic changes in the skin of hairless mice following peeling wit h salicylic acid[J].Arch Dermatol,2000,136(11):1390-1395.
[9]杨汝斌,万屏,刘玲,等. SD大鼠皮肤光老化动物模型建立方法的探索[J].中国皮肤性病学杂志,2011,25(3):199-202.
[10]Hollins F,Sutcliffe A,Gomez E,et al. Airway smooth muscle NOX4 is upregulated and modulates ROS generation in COPD[J]. Respir Res,2016,17(1):84.
[11]Mukhopadhyay S, Sokorai K, Ukuku D,et al. Inactivation of Salmonella enterica and Listeria monocytogenes in cantaloupe puree by high hydrostatic pressure with/without added ascorbic acid[J]. Int J Food Microbiol, 2016, 235:77-84.
[12]Thiele NA, McGowan J, Sloan KB. 2-O-Acyl-3-O-(1-acyloxyalkyl) prodrugs of 5,6-isopropylidene-l-ascorbic acid and l-ascorbic acid: antioxidant activity and ability to permeate silicone membranes[J]. Pharmaceutics, 2016,8(3): E22.
[13]Steiling H, Longet K, Moodycliffe A, et al. Sodium-dependent vitamin C transporter isoforms in skin: distribution, kinetics, and effect of UVB-induced oxidative stress[J]. Free Radic Biol Med,2007, 43(5):752-762.
[14]McArdle F, Rhodes LE, Parslew R, et al. UVR-induced oxidative stress in human skin in vivo: effects of oral vitamin C supplementation[J]. Free Radic Biol Med,2002,33(10):1355-1362.
[15]Davis JL,Paris HL,Beals JW, et al. Liposomal-encapsulated ascorbic acid: influence on vitamin C bioavailability and capacity to protect against ischemia-reperfusion injury[J]. Nutr Metab Insights, 2016, 9:25-30.
[16]King JC, Shames DM, Woodhouse LR. Zinc homeostasis in humans[J]. J Nutr, 2000, 130(5S Suppl):1360S-1366S.
[17]Lansdown AB, Mirastschijski U, Stubbs N, et al. Zinc in wound healing: theoretical, experimental, and clinical aspects[J]. Wound Repair Regen,2007,15(1):2-16.

[19]Im AR, Song JH, Lee MY,et al.Magnolol reduces UVB-induced photodamage by regulating matrix metalloproteinase activity[J].Environ Toxicol Pharmacol,2015,39(1):417-423.
[20]Egbert M, Ruetze M, Sattler M, et al.The matricellular protein periostin contributes to proper collagen function and is downregulated during skinaging[J]. J Dermatol Sci, 2014,73(1):40-48.
[21]Goswami S, Haldar C. UVB irradiation severely induces systemic tissue injury by augmenting oxidative load in a tropical rodent: efficacy of melatonin as an antioxidant[J]. J Photochem Photobiol B, 2014,141(1):84-92.
[22]Pyun HB, Kim M, Park J. Effects of Collagen Tripeptide supplement on photoaging and epidermal skin barrier in UVB-exposed hairless mice[J]. Prev Nutr Food Sci, 2012,17(4):245-253.
[23]Min W, Liu X, Qian Q, et al. Effects of baicalin against UVA-induced photoaging in skin fibroblasts[J]. Am J Chin Med, 2014,42(3):709-727.
[24]Hedenbjörk-Lager A, Hamberg K, Pääkkönen V, et al. Collagen degradation and preservation of MMP-8 activity in human dentine matrix after demineralization[J]. Arch Oral Biol, 2016,68:66-72.
[25]Taga Y, Kusubata M,Ogawa-Goto K, et al. Efficient absorption of X-hydroxyproline (Hyp)-Gly after oral administration of a novel gelatin hydrolysate prepared using ginger protease[J]. J Agric Food Chem, 2016,64(14):2962-2970.
[26]蔡辉,赵凌杰,董晓蕾,等. 吡格列酮对高脂血症大鼠SOD活性和MDA活性水平的影响 [J].东南国防医药,2011,13(2):97-99.
(本文编辑:张仲书;英文编辑:王建东)
Synergistic effect of Vitamin C and Zn on anti-skin photoaging ability of swimming trainingrat
ZHANG Yi1, GUO Zhi-li2, ZHANG Yong2.
1.DepartmentofImmunology, 2.DepartmentofDermatology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
ObjectiveTo investigate the simple and effective protection method on skin photoaging of swimming training rat. MethodsSwimming training rats were irradiated by ultraviolet-radiation over long-term and treated with VitC and Zinc. The skin of rats was collected to assess the changes of skin pathology, investigate the contents of HYP and MDA, the activity of SOD, and determine the contents of MMPs and periosteum protein by ELISA assay. ResultsSwimming training rat ultraviolet-radiation-induced photoaging model was established. The intervention of VitC and Zn on rat could maintain the integrity of skin tissue, preserve the stability of type I collagen, increase the contents of skin HYP and the activity of SOD, inhibit the expression of MDA and MMPs, and promote the expression of periosteum protein. ConclusionVitC combined with Zinc could effectively protect skin from photoaging of swimming training rat.
Vitamin C; Zn; ultraviolet; skin photoaging; synergistic effect
国家自然科学基金项目(81101210)
200433上海,第二军医大学,1. 免疫学教研室,2. 长海医院皮肤科
引用格式:张意,郭志丽,张勇.VitC和锌对游泳训练大鼠皮肤光老化的协同防护作用[J].东南国防医药,2016,18(4):337-340,390.
R994.6
A
10.3969/j.issn.1672-271X.2016.04.001
2016-05-24;
2016-06-01)
