依法克生对大鼠胰岛细胞损伤的保护作用
2016-09-15黄云鸿董维平吴艺捷彭永德
黄云鸿董维平吴艺捷彭永德
依法克生对大鼠胰岛细胞损伤的保护作用
黄云鸿1董维平2吴艺捷1彭永德1
目的 探讨炎症因子对体外培养大鼠胰岛细胞的损伤情况及依法克生可能的保护作用。方法 将分离、纯化的SD大鼠胰岛细胞置于体外培养,观察炎症因子IL-1β不同浓度(0.1~10ng/ml)和不同作用时间(0~48h)下对胰岛细胞分泌功能影响。胰岛细胞分为对照组、IL-1β组和依法克生组,用单因素方差分析比较各组在低糖和高糖环境下的胰岛素分泌,观察依法克生对胰岛素分泌的影响,对胰岛功能IL-1β损伤的保护作用,并比较三组间胰岛细胞凋亡率。结果 高糖浓度下,随IL-1β浓度升高,胰岛素分泌下降(P<0.001),随作用时间延长,胰岛素分泌亦减少(P<0.001),IL-1β浓度超过5.0ng/ml、时间超过24h抑制作用较为明显。依法克生组胰岛素分泌较IL-1β组明显升高(P<0.001),与对照组无差异。胰岛细胞凋亡在IL-1β组(49.7±15.5)%高于对照组(9.7±2.5)%(P<0.01),在依法克生组(15.7±5.5)%低于IL-1β组(P<0.01),提示干预后胰岛细胞凋亡明显减少。结论 IL-1β抑制高糖环境下胰岛素的分泌,并存在剂量和时间依赖关系。依法克生加入体外培养的胰岛细胞中,可有效防止IL-1β诱导胰岛细胞损伤,逆转被抑制的胰岛分泌功能,并减少胰岛细胞凋亡。
大鼠;胰岛细胞;炎症因子;凋亡
胰岛细胞损伤和胰岛分泌不足是糖尿病的重要病理生理机制。炎症因子与糖尿病胰岛损伤和功能障碍的发生、发展有密切关系,在1型糖尿病中它参与胰岛的炎性细胞浸润,是胰岛免疫损伤的重要启动因子和效应因子[1],在2型糖尿病中炎症因子导致胰岛β细胞结构、功能障碍和胰岛素分泌不足[2]。白介素1β(IL-1β)是主要炎症因子,它可直接损伤离体胰岛细胞,且诱导的胰岛细胞基因表达变化类似活体胰岛炎时的改变,抑制IL-1β的作用可以保护胰岛细胞,延缓1型糖尿病进展[3-4],也能改善2型糖尿病患者的胰岛功能[5],因此干预IL-1β对胰岛细胞的损伤,在糖尿病防治中有重要意义。
阻断移植鼠的IL-1受体可减轻移植胰岛的炎性损伤和功能下降[6],提示干预IL-1β的毒性作用还能提高胰岛移植的成功率。依法克生与胰岛细胞表面咪唑啉受体-3结合,兴奋胰岛细胞分泌胰岛素[7],有潜在的抗糖尿病作用。目前国外关于依法克生干预IL-1β损伤胰岛细胞的研究甚少,国内尚无相关研究报道。本研究采用体外胰岛细胞培养体系观察IL-1β对胰岛细胞的损伤和依法克生对其干预作用,观察胰岛细胞凋亡的变化,以及依法克生对大鼠胰岛细胞的促分泌作用。
材料与方法
一、主要材料
在清洁级环境中饲养的封闭群健康SD成年大鼠250~300g(我院实验动物中心提供)。重组大鼠IL-1β(美国Sigma公司),依法克生(美国Sigma公司),大鼠胰岛素ELISA测定试剂盒(瑞典Mercodia公司),TUNEL试剂盒(瑞士Roche公司)。
二、方法
1.胰岛分离培养:SD大鼠胰管内逆行灌注胶原酶P消化分离胰岛,Ficoll液密度梯度离心纯化,双硫腙染色鉴定纯度并计数,吖啶橙—碘丙啶双色荧光染色鉴定活性,培养于含15%胎牛血清的RPMI1640培养液中,置CO2细胞培养箱内培养[8]。
2.胰岛分泌功能测定:观察IL-1β在不同浓度和不同作用时间下对胰岛功能的影响,观察不同浓度依法克生对胰岛分泌功能影响以及依法克生对IL-1β损伤的胰岛分泌功能的干预作用。分别行胰岛素释放试验,计算刺激指数。
3.胰岛细胞凋亡检测:胰岛细胞分为3组:对照组空白;IL-1β组加入IL-1β(5.0ng/ml);干预组加入IL-1β(5.0ng/ml)和依法克生(100μmol/L),作用48h后,用TUNEL法检测胰岛细胞凋亡数。显微镜下计数100个细胞中胞核呈棕色的阳性细胞,以百分率表示。
三、统计学分析方法
采用SPSS18.0统计软件,各组胰岛素分泌与细胞凋亡数以±s表示,多组比较用单因素方差分析,用Scheffe方法进行两两比较。以P<0.05为差异有统计学意义。
结 果
一、胰岛细胞的鉴定
对分离纯化所得细胞取样行双硫腙染色,染色阳性的红色细胞团为胰岛,胰岛>90%为合格(图1)。培养3~4d后,行胰岛素释放试验:低糖下(葡萄糖浓度1.67mmol/L)的胰岛素释放为(1.21±0.16)μg/L,高糖下(葡萄糖浓度16.7mmol/L)胰岛素释放为(3.79±0.11)μg/L,葡萄糖刺激指数为3.16±0.34,证明胰岛细胞对刺激物反应敏感、生理功能完好。
二、IL-1β对胰岛释放功能的影响
1.不同浓度IL-1β对胰岛素释放的影响:比较不同IL-1β浓度作用24h后对胰岛素释放的影响发现:低葡萄糖浓度时各组胰岛素分泌差异无统计学意义(P=0.06),IL-1β浓度的增高对低葡萄糖浓度下胰岛素的释放无明显影响。在高葡萄糖浓度时,随IL-1β浓度升高,胰岛素分泌下降(F=52.3,P<0.001),刺激指数亦下降,(F=57.1,P<0.001)(表1)。两两比较显示:各组胰岛素的释放均较对照组明显减少(P<0.05),IL-1β在较低浓度(0.1ng/ml)时,已经明显抑制高糖诱导的胰岛素释放,浓度在0.1ng/ml至1.0ng/ml之间,抑制胰岛素释放作用无明显差异(P>0.05),但浓度达5.0ng/ml后,抑制胰岛素释放作用进一步增强(P<0.01),浓度达10.0ng/ml时,抑制胰岛素释放作用较浓度为5.0ng/ml时无显著改变(P>0.05)。因此IL-1β浓度在5.0ng/ml时能较大程度抑制高葡萄糖刺激下胰岛的分泌功能。
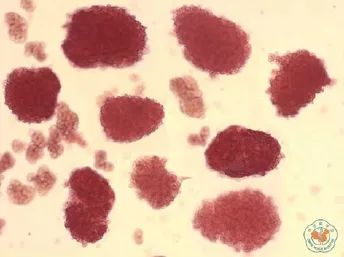
图1 倒置显微镜下观察胰岛呈红色细胞团(双硫腙染色鉴×100)
2.不同IL-1β作用时间对胰岛素释放的影响:在IL-1β浓度5.0ng/ml时,比较不同IL-1β作用时间下各组胰岛素释放情况发现:低葡萄糖浓度时各组胰岛素分泌差异无统计学意义(P=0.180),而高葡萄糖浓度时,随着IL-1β作用时间的延长,胰岛素分泌减少(F=12.9,P=0.001),葡萄糖刺激指数下降(F=32.5,P<0.001)(表2)。两两比较显示:作用6h后刺激指数已经较对照组明显减小(P=0.01),作用24h较6h进一步减小(P<0.01),但作用48h较12h和24h无显著差异(P>0.05),因此IL-1β作用24h就能较大程度抑制高糖刺激下胰岛细胞的分泌功能。
表1 不同浓度IL-1β对胰岛素释放量的影响(μg/L,±s)
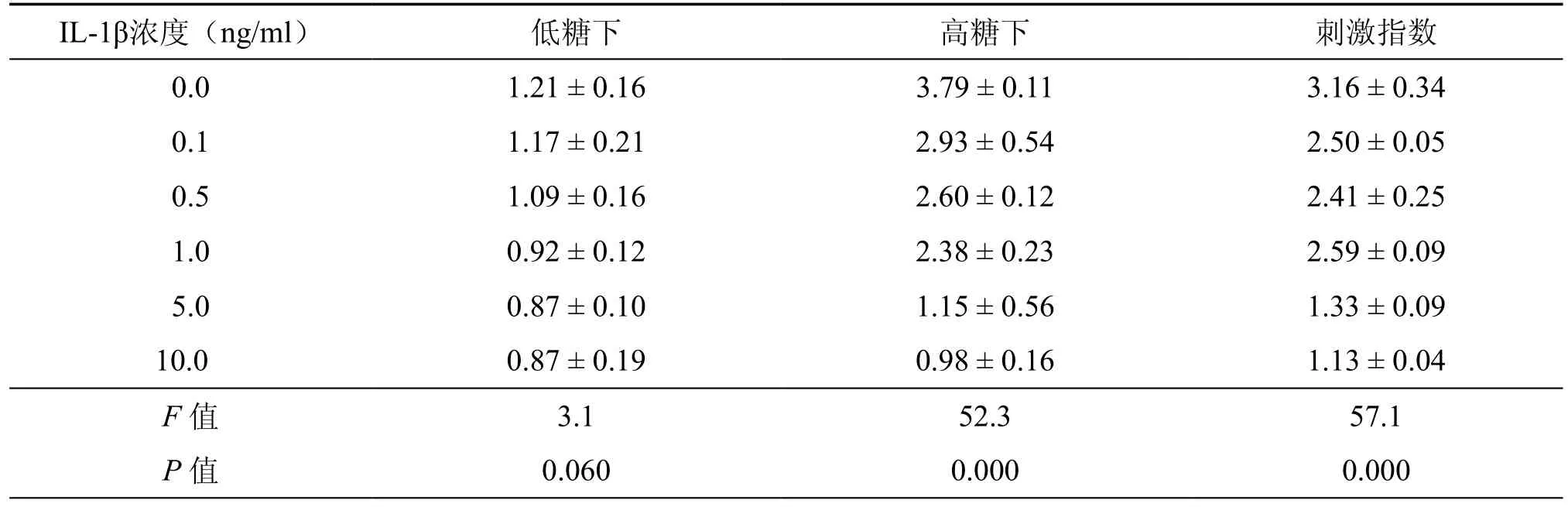
表1 不同浓度IL-1β对胰岛素释放量的影响(μg/L,±s)
IL-1β浓度(ng/ml) 低糖下 高糖下 刺激指数0.0 1.21 ± 0.16 3.79 ± 0.11 3.16 ± 0.34 0.1 1.17 ± 0.21 2.93 ± 0.54 2.50 ± 0.05 0.5 1.09 ± 0.16 2.60 ± 0.12 2.41 ± 0.25 1.0 0.92 ± 0.12 2.38 ± 0.23 2.59 ± 0.09 5.0 0.87 ± 0.10 1.15 ± 0.56 1.33 ± 0.09 10.0 0.87 ± 0.19 0.98 ± 0.16 1.13 ± 0.04 F 值 3.1 52.3 57.1 P 值 0.060 0.000 0.000
表2 不同IL-1β作用时间对胰岛素释放量的影响(μg/L,±s)

表2 不同IL-1β作用时间对胰岛素释放量的影响(μg/L,±s)
作用时间(h) 低糖下 高糖下 刺激指数0 1.28 ± 0.19 4.01 ± 1.08 3.09 ± 0.39 6 1.06 ± 0.23 2.23 ± 0.77 2.07 ± 0.32 12 0.97 ± 0.21 1.52 ± 0.28 1.58 ± 0.06 24 0.91 ± 0.24 1.18 ± 0.13 1.33 ± 0.19 48 0.81 ± 0.24 0.79 ± 0.15 0.99 ± 0.16 F 值 1.9 12.9 32.5 P 值 0.180 0.001 0.001
三、依法克生对胰岛素分泌的影响
1.不同浓度依法克生对胰岛细胞释放胰岛素的影响:依法克生增加胰岛素分泌呈葡萄糖依赖性,在低糖环境下各组胰岛素分泌差异无统计学意义(P=0.924)。而高葡萄糖浓度时各组胰岛素分泌量差异有统计学意义(P<0.001),胰岛素分泌量随着依法克生浓度的升高而增加(图2)。两两比较显示:胰岛素的释放在依法克生浓度达100μmol/L和200μmol/L时增加最为明显(P<0.01),但浓度为100μmol/L与浓度为200μmol/L之间差异无统计学意义(P>0.05)。

图2 依法克生浓度对高糖胰岛素释放影响
2.依法克生对IL-1β作用下胰岛素释放的影响:IL-1β组在胰岛细胞培养液中加入IL-1β(5ng/ml),依法克生组同时加IL-1β(5ng/ml)和依法克生(100μmol/L),作用48h后行高糖刺激试验,结果低葡萄糖浓度下各组胰岛素分泌差异无统计学意义(P=0.298)。高葡萄糖浓度时IL-1β组胰岛素分泌较对照组明显减少(P<0.001),而依法克生的胰岛素分泌接近对照组(P=0.898),且明显高于IL-1β组(P<0.001)(表3),因此依法克生能良好阻断IL-1β对胰岛分泌的损伤作用。
表3 依法克生对IL-1β作用下胰岛素释放的影响(μg/L,±s)
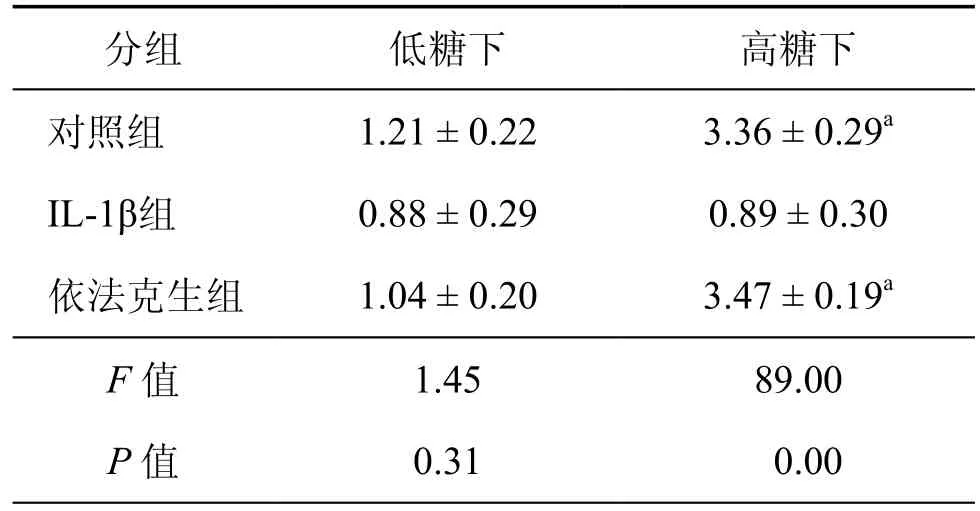
表3 依法克生对IL-1β作用下胰岛素释放的影响(μg/L,±s)
注:与IL-1β组比较,aP<0.001
分组 低糖下 高糖下对照组 1.21 ± 0.22 3.36 ± 0.29aIL-1β组 0.88 ± 0.29 0.89 ± 0.30依法克生组 1.04 ± 0.20 3.47 ± 0.19aF 值 1.45 89.00 P 值 0.31 0.00
四、依法克生对IL-1β诱导胰岛细胞凋亡的干预作用
对照组、IL-1β组和依法克生组的胰岛细胞凋亡数有明显差异(F=15.1,P=0.005)。两两比较显示IL-1β组凋亡数(49.7±15.5)较对照组(9.7±2.5)明显增加,差异有统计学意义(P<0.01),依法克生组凋亡数(15.7±5.5)少于IL-1β组,差异有统计学意义(P<0.05),而依法克生组与对照组差异无统计学意义(P>0.05),提示依法克生能抑制IL-1β诱导胰岛细胞凋亡,起到良好的干预作用(图3)。

图3 光学显微镜下观察依法克生对IL-1β诱导胰岛细胞凋亡的干预作用(TUNEL染色×400)
讨 论
糖尿病的病因及发病机理涉及众多环节,近年发现无论1型或是2型糖尿病的发病均与体内慢性炎症反应有关[9-10],IL-1β等炎症因子可引起胰岛细胞损伤,Silva等[11]比较NOD鼠发生胰岛炎时胰岛细胞主要基因表达谱,发现其与胰岛细胞在体外受IL-1β和IFN-γ刺激时的基因表达高度相似,离体胰岛细胞受IL-1β损伤时的变化类似1型糖尿病的胰岛炎。因此研究IL-1β对体外培养的胰岛细胞的损伤作用有一定的临床意义。
本研究观察到在低葡萄糖环境下,各种浓度IL-1β对胰岛素分泌无明显抑制,可能低糖状态下胰岛细胞功能处于抑制状态,使IL-1β不能发挥毒性作用。但在高糖环境下,较低浓度(0.1ng/ml)的IL-1β已经明显抑制葡萄糖诱导的胰岛素释放,提示高糖环境下的“糖毒性”能加强IL-1β对胰岛功能的损伤,随IL-1β浓度增加刺激指数进一步减小,浓度达5.0ng/ml后进入平台。高葡萄糖刺激下的胰岛素分泌功能亦与IL-1β作用时间有关,24h以上能最大程度抑制胰岛细胞的分泌功能,故IL-1β对胰岛分泌功能的抑制存在剂量依赖关系和时间依赖关系。IL-1β对胰岛细胞的损伤可能主要通过促使胰岛细胞凋亡,凋亡是糖尿病时胰岛细胞损伤的主要方式[12]。本组资料中IL-1β刺激后胰岛细胞凋亡率由(9.7±2.5)%上升至(49.7±15.5)%。IL-1β能介导葡萄糖诱导的Fas表达和胰岛细胞凋亡,是高浓度葡萄糖诱导的胰岛β细胞凋亡的重要中介因子,故抑制IL-1β作用,可改善1型糖尿病患者胰岛功能[13]。
在体外培养的胰岛细胞中阻断IL-1β的毒性作用能减少胰岛损伤,提高胰岛移植的成功率[14]。目前国外对依法克生的相关报道甚少,国内尚无类似研究。本研究用依法克生干预后发现胰岛细胞凋亡明显减少,IL-1β组凋亡百分率为(49.7±15.5)%,依法克生组降为(15.7±5.5)%,提示依法克生能抑制IL-1β诱导胰岛细胞凋亡,起到良好的干预作用。依法克生作用于胰岛细胞的咪唑啉受体3,与受体结合后,作用于ATP敏感钾通道的Kir6.2亚基,使钾通道关闭,胰岛细胞膜去极化,引起钙离子内流,胰岛素释放[15],但依法克生促胰岛素分泌作用有葡萄糖浓度依赖性,本组资料比较低糖和高糖环境下,不同浓度依法克生对胰岛素释放的影响发现:低葡萄糖浓度条件下,胰岛素分泌无明显改变,而在高葡萄糖浓度条件下,胰岛素分泌明显增加,并且胰岛素分泌量随着依法克生浓度的升高而增加,存在剂量依赖关系。同时依法克生能逆转IL-1β对胰岛分泌的抑制作用,在加入依法克生的干预组中,胰岛素分泌明显多于IL-1β组,且从数值上依法克生组稍高于对照组(但两者差异无统计学意义),提示依法克生具有良好的干预效果。但这种干预作用在低葡萄糖浓度时并不明显,低糖浓度下各组间胰岛素分泌无明显差异,推测依法克生主要通过增加高糖环境下胰岛素的分泌,改善“糖毒性”,减少胰岛细胞凋亡,起到保护胰岛功能的作用。
本组资料结果表明,依法克生加入体外培养的胰岛细胞中,可有效防止IL-1β诱导胰岛细胞损伤,逆转被抑制的胰岛分泌功能,并减少胰岛细胞凋亡。
.1 Giulietti A, Stoffels K, Decallonne B, et al. Monocytic expression behavior of cytokines in diabetic patients upon inflammatory stimulation[J]. Ann N Y Acad Sci, 2004,1037:74-78.
2 Genco RJ, Grossi SG, Ho A, et al. A proposed model linking infammation to obesity, diabetes, and periodontal infections[J]. J Periodontol, 2005, 76(11 Suppl):2075-2084.
3 Pickersgill LM, Mandrup-Poulsen TR. The antiinterleukin-1 in type 1 diabetes action trial - background and rationale[J]. Diabetes Metab Res Rev, 2009,25(4):321-324.
4 Herold KC, Vignali DA, Cooke A, et al. Type 1 diabetes: translating mechanistic observations into effective clinical outcomes[J]. Nat Rev Immunol, 2013, 13(4):243-256.
5 Westwell-Roper CY, Ehses JA, Verchere CB. Resident macrophages mediate islet amyloid polypeptide-induced islet IL-1β production and β-cell dysfunction[J]. Diabetes,2014, 63(5):1698-1711.
6 Westwell-Roper C, Dai DL, Soukhatcheva G, et al. IL-1 blockade attenuates islet amyloid polypeptideduced proinfammatory cytokine release and pancreatic isletgraft dysfunction[J]. J Immunol, 2011, 187(5):2755-2765.
7 Lehner Z, Stadlbauer K, Adorjan I, et al. Mechanisms of antihyperglycaemic action of efaroxan in mice: time for reappraisal of α2A-adrenergic antagonismin the treatment of type 2 diabetes?[J]. Diabetologia, 2012,55(11):3071-3082.
8 董维平,张洪德,王煜非,等.胰岛移植物质量鉴定方法的研究[J]. 中华器官移植杂志, 1998, 19(4):205-207.
9 Donath MY, Schumann DM, Faulenbach M, et al. Islet infammation in type 2 diabetes: from metabolic stress to therapy[J]. Diabetes Care, 2008, 31(Suppl 2):S161-S164.
10 徐晓东,谢汝莹,林硕,等.肝移植术后糖尿病的可逆性预测因子分析[J].器官移植, 2014, 5(1):28-31.
11 Silva D, Petrovsky N. Identifcation of key beta cell gene signaling pathways involved in type 1 diabetes[J]. Ann N Y Acad Sci, 2004, 1037(1):203-207.
12 Mandrup-Poulsen T. Apoptotic signal transductionpathways in diabetes[J]. Biochem Pharmacol, 2003,66(8):1433-1440.
13 Gottlieb PA, Alkanani AK, Michels AW, et al. α1-Antitrypsin therapy downregulates toll-like receptor-induced IL-1β responses in monocytes and myeloiddendritic cells and may improve islet function in recently diagnosed patients with type 1 diabetes[J]. J Clin Endocrinol Metab, 2014, 99(8):E1418-E1426.
14 Matsumoto S, Takita M, Chaussabel D, et al. Improving efficacy of clinical islet transplantation with iodixanolbased islet purification, thymoglobulin induction, and blockage of IL-1β and TNF-α[J]. Cell Transplant, 2011,20(10):1641-1647.
15 Abdel-Zaher AO, Ahmed IT, El-Koussi AD. The potential antidiabetic activity of some alpha-2 adrenoceptor antagonists[J]. Pharmacol Res, 2001, 44(5):397-409.
(本文编辑:蔡晓珍)
Protective effect of efaroxan on rat islet impairment by proinflammatory cytokine
Huang Yunhong1,Dong Weiping2, Wu Yijie1, Peng Yongde1.1Department of Endocrinology,2Diabetes Research Laboratory, Shanghai Jiaotong University Shanghai First People's Hospital, Shanghai 200080, China
Corresponding author:Dong Weiping, Email:dongwp@qq.com;Peng Yongde, Email: pengyongde0908@126.com
Objective To investigate the impairment of rat islet cells cultured in vitro induced by proinflammatory cytokines and the potential protective effects of efaroxan. Methods Islets separated and purified from a SD rat were cultured in vitro, their secretory function was assessed under different concentration(0.1~10ng/ml)of IL-1β at different time(0 ~ 48h). Islets cells were divided into control group, IL-1β group and efaroxan group, insulin secretions under low and high glucose situations were compared among three groups by one-way ANOVA. The stimulatory effect of efaroxan on insulin secretion and its protective effect on IL-1β impairment were also observed, and apoptosis rate of islet cells were measured and compared among three groups. Results Insulin secretion under high glucose situation was decreased by elevated concentration of IL-1β(P < 0.001)and also inhibited by extended duration of IL-1β(P < 0.001). The inhibitory effect became more obvious as IL-1β concentration exceeds 5.0 ng/ml over 24 h. Compared with IL-1β group, insulin secretion increased in efaroxan group (P < 0.001), but was similar to control group. The apoptotic rates of islet cells were higher in the IL-1β group (49.7%±15.5%) than in the control group(9.7%± 2.5%)(P <0.01), and were lower in the efaroxan group(15.7%± 5.5%)than in the IL-1β group(P <0.01). And efaroxan intervention significantly mitigated apoptosis of islet cells. Conclusion Islet insulinsecretion was inhibited by IL-1β under high glucose situation, which was dose-dependent and time-dependent. Efaroxan can prevent IL-1β-induced islet dysfunction and apoptosis.
Rats; Islet cell; Proinflammatory cytokine;Apoptosis
10.3877/cma.j.issn.2095-1221.2016.02.009
200080 上海交通大学附属第一人民医院内分泌科1,糖尿病研究室2
董维平,Email:dongwp@qq.com;彭永德,Email:pengyongde0908@126.com
2016-02-16)
