人脐带间充质干细胞对肿瘤细胞生长及软琼脂克隆形成的影响
2016-09-15曾桂芳谢长峰徐绍坤杜杰李婵李陶左丛林刘沐芸胡祥
曾桂芳谢长峰徐绍坤杜杰李婵李陶左丛林刘沐芸胡祥
人脐带间充质干细胞对肿瘤细胞生长及软琼脂克隆形成的影响
曾桂芳1谢长峰1徐绍坤1杜杰2李婵1李陶1左丛林2刘沐芸1胡祥1
目的 研究人脐带间充质干细胞(hUCMSC)体外共培养对肿瘤细胞增殖的影响以及在软琼脂中形成克隆的可能性,从而评价其体外促瘤性和致瘤性,为其体内致瘤性研究及临床应用提供安全性数据。方法 剥取脐带华通氏胶,剪碎,组织块贴壁法获得贴壁细胞,培养传代,倒置显微镜观察细胞形态,流式细胞仪测定细胞表型,检测诱导成脂肪和成骨及成软骨分化的能力,鉴定是否为hUCMSC。然后,通过体外软琼脂克隆形成实验观察hUCMSC形成集落的能力;hUCMSC分别与人白血病细胞株K562和人结肠癌细胞株Colo-205体外共培养,MTT法测定细胞增殖,并以肿瘤细胞的增殖指数(PI)值来判定hUCMSC是否对肿瘤细胞体外增殖有影响 。结果 人脐带华通氏胶分离培养的细胞具有成纤维细胞样的细胞形态,具有向成脂肪和成骨及成软骨方向分化的能力,表达间充质干细胞指标CD73、CD90、CD105,低表达CD34、CD45、CD19,符合间充质干细胞特点。软琼脂克隆形成实验显示hUCMSC未表现出在阻力介质中的克隆生长能力。hUCMSC分别与人白血病细胞K562和人结肠癌Colo-205细胞共培养,PI值显示hUCMSC对肿瘤细胞增殖没有影响。结论 hUCMSC体外培养不具有致瘤性,同时对肿瘤细胞增殖无影响。
脐带; 间质干细胞; 细胞分化; 致瘤性
间充质干细胞(mesenchymal stem cell,MSC)是一种能够自我更新,具有多向分化潜能的祖细胞[1]。人们已经在人多种组织内分离出MSC并在体内体外分化得到多种终末分化细胞,如骨[2-4]、软骨[5-6]、肌腱[7-9]、肌肉[10-12]、脂肪[13,4]、造血支持细胞[14]等。骨髓来源的MSC由于其免疫调节的特性,是用于治疗免疫性疾病的主要候选细胞[15]。但由于骨髓源性MSC取材时对供者有侵入性损伤,给供者带来痛苦,并且存在病毒污染的可能,所以研究者希望能找到替代骨髓MSC,弥补其缺陷的MSC来源。人们试着从其他组织中获得MSC,比如从脐血和外周血中获得细胞,但是具有一定难度,且在足月分娩的脐血或动员的外周血中MSC的数量尚存在争议[16-18]。近年较多学者从娩后的废弃组织脐带中分离和培养MSC,脐带中的华通氏胶不但含有丰富的MSC,且其来源的细胞在形态学、扩增能力、分化功能,以及表面标志物等生物学鉴定结果都符合间充质干细胞的标准[19],为MSC的基础和临床研究提供了新材料来源和基础资料[17]。脐带取材对供者不具有侵入性损伤和伦理道德的问题,被认为是代替骨髓来源MSC最佳材料[15]。
人脐带间充质干细胞(human umbilical cordderived mesenchymal stem cell,hUCMSC)缺乏HLA-Ⅱ类分子和共同刺激分子的表达,具有特殊的免疫学表型,不引起同种异体淋巴细胞增殖反应[20]。由于其免疫学特性,移植入宿主体内的MSC不引起宿主的免疫排斥反应,通过细胞间的相互作用以及旁分泌等方式抑制T细胞的增殖及其过度免疫反应,从而发挥免疫重建作用[21]。
目前hUCMSC临床应用的最大忧虑依然是其安全性,其中致瘤性又是其安全性中的关注重点。本文旨在通过体外实验研究hUCMSC是否具有致瘤性,为体内致瘤性实验及其临床使用提供安全性数据。
材料和方法
一、材料
在产妇及家属知情并同意捐赠的情况下,获取足月妊娠剖腹产分娩的胎儿脐带;CO2恒温培养箱(日本三洋公司);酶标仪(MODEL 1550,日本BIO RAD公司);倒置显微镜(日本奥林巴斯公司);DMEM/F12培养基(美国Hyclone公司);人胚肺成纤维细胞(MRC-5)、人宫颈癌细胞(Hela)、人白血病细胞株K562和人结肠癌细胞株Colo-205均购于中国医学科学院基础研究所细胞中心;低熔点琼脂糖(美国Amresco公司)。
二、方法
(一)hUCMSC分离培养
取合适的剖腹产婴儿脐带,用手术线将准备采集的脐带两端结扎,剪取已经结扎的脐带放入无菌的脐带采集瓶中,尽快运输至实验室处理。实验室接受脐带后,无菌操作分离培养Wharton'sjelly源性间充质干细胞。先用无菌PBS洗去脐带残存血液及杂质后,将脐带剪成2~3cm的小段,用有齿镊子轻轻撕开每小段脐带,暴露出脐带里面的华通氏胶以及血管。剥除脐带里面的两条静脉及一条动脉后,轻轻撕下华通氏胶,羊膜废弃。将获得华通氏胶剪碎至1mm3大小,加入含10%FBS(Gibco)DMEM/F12(Hyclone)于恒温37℃、5%CO2培养箱中培养。5~6天后进行首次换液,以后每隔3d进行换液1次。细胞长到70%~80%融合时使用0.25%胰酶进行消化传代。
(二)hUCMSC细胞表面抗原分析
取至少1×106个细胞样品移入相应流式管内,加入PBS充分混匀,离心洗涤2次;加入适量PBS混悬细胞,过滤,计数,将细胞浓度调整为(2.0~6.0)×106个/ml待用;每个抗原检测需同时设1支同型对照管,并用记号笔在试管外壁上标记清楚抗体及同型对照信息,按照管上标记抗体及同型信息加入相应抗体及同型对照试剂;然后将准备好的细胞样品混匀后,取100µl细胞悬液至已加入抗体试剂的流式管内,将细胞悬液与抗体试剂充分混匀,孵育30min;孵育完成后每管加入PBS,充分混匀,洗涤1次,调整细胞悬液体积至200µl左右,准备上机检测。检测细胞的阳性抗原表达CD73、CD90、CD105不低于95%,阴性抗原表达CD14、CD19、CD34、CD45、HLADR不得过2%。
(三)hUCMSC多向诱导分化
取需要检测分化的细胞铺板于6孔板中,用含10%FBS的DMEM/F12的培养基进行培养。待细胞生长达70%~80%融合度时,将培养基更换为成脂、成骨、成软骨的定向分化诱导液进行培养,并定期进行换液。各组诱导分化细胞均另设含10%FBS的DMEM/F12培养的细胞为对照。
1.向成脂肪细胞诱导分化:在细胞生长达70%~80%融合时加入脂肪细胞分化诱导液(GIBCO),对照为10%FBS的DMEM/F12培养基,每隔3~4d进行换液1次。每天使用倒置显微镜观察细胞生长的状况以及形态的变化,当脂滴出现后(约3周后)用4%多聚甲醛固定细胞10min,PBS洗涤,1%油红O染色15min,PBS洗涤后在光学显微镜下观察脂肪滴的现象,并拍照。
2.向成骨细胞诱导分化:在细胞生长达70%~80%融合时加入成骨细胞分化诱导液对照为10%FBS的DMEM/F12培养基,每3~4d全量换液1次。每天使用倒置显微镜观察细胞生长的状况以及形态的变化,观察出现钙化结晶及结节后(约4周)用4%多聚甲醛固定细胞10min,PBS洗涤,用1%茜素红染30min后光镜下观察有无钙化基质沉淀的现象并拍照。
3.向成软骨细胞诱导分化:取一定细胞加入到15ml离心管中离心,加入成软骨细胞诱导液,对照为10%FBS的DMEM/F12培养基,每3~4d全量换液1次。诱导2~3周后,进行常规石蜡包埋切片,1%阿尔新蓝染色,光镜下观察软骨细胞。
(四)软琼脂克隆实验
在6孔细胞培养板内无菌操作铺备0.6%底层琼脂,待室温凝固后,将培养板置于2℃~8℃保存备用。在使用前,先将培养板置于37℃培养箱中进行复温。收获对数生长期的细胞制备成单细胞悬液,按不同密度配成0.35%上层琼脂。根据文献[22]将受试细胞hUCMSC终浓度分别设定为500、1000、2000个/孔。同时设立阳性对照孔(Hela细胞,1000个/孔)和阴性对照(MRC-5,1000个/孔)以及空白对照孔,每组设3个平行孔。待培养基在室温凝固后,置37℃,5%CO2培养箱中培养21d。培养结束后,显微镜下观察,16个以上细胞组成的细胞团计为1个集落,计算细胞集落总数。
(五)MTT法检测hUCMSC体外对肿瘤细胞增殖的影响
采用人白血病细胞株K562和人结肠癌细胞株Colo-205,实验设空白对照组(无细胞培养基组)、阳性对照组(肿瘤细胞+顺铂组)、hUCMSC对照组(单纯hUCMSC组)、hUCMSC实验组(hUCMSC+肿瘤细胞组)。K562细胞浓度分别为1.25×104,2.5×104,5.0×104个/ml;Colo-205细胞浓度分别为1.25×104,2.5×104,5.0×104,1.0×105,2.0×105个/ml,每个浓度设3个平行孔。顺铂浓度为4μg/ml,于肿瘤细胞接种1h后加入。hUCMSC细胞1.0×105个/ml接种于96孔培养板,24h后经60Co12.5Gy照射后作为共培养铺层细胞,照射后4h接种肿瘤细胞,继续培养72h后MTT法检测细胞增殖情况,并计算肿瘤细胞的增殖指数(proliferation index,PI)。PI=(实验组或阳性对照组吸光度(A)值-空白对照(A)值)/(阴性对照组(A)值-空白对照(A)值)。将各组PI进行统计分析,比较不同浓度下的肿瘤细胞增殖情况,以PI值在(1.0±0.3)之内为对细胞增殖无影响。
结 果
一、hUCMSC的分离、扩增及鉴定
用组织块贴壁法分离hUCMSC,1周后于组织块间隙已可见散在分布的长条索状纺锤形细胞(图1)。贴壁细胞多为长梭形或扁平形的成纤维样细胞,折光度好,核仁明显。

图1 倒置显微镜下观察贴壁生长的hUCMSC(×40)
二、细胞免疫表型检测
流式细胞仪检测表明:贴壁细胞均强表达CD73、CD90、CD105,不表达造血细胞表型CD34、CD45、CD19、CD14和HLA-DR(图2)。
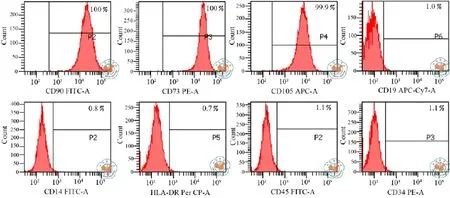
图2 hUCMSC细胞表面抗原分析细胞流式图
三、体外诱导分化检测
脂肪诱导第14天倒置显微镜下即可见细胞质内脂滴形成,第21天油红O染色呈强阳性(图3a),未加脂肪诱导培养基的对照组细胞无脂滴形成,油红O染色阴性(图3b)。成骨诱导第28天,实验组茜素红染色可见细胞间红色钙化基质沉积(图3c),未加成骨诱导培养基的对照组细胞茜素红染色未见红色矿化物沉积(图3d)成软骨诱导第21天,实验组阿尔新蓝染色可见明显蓝色斑块沉积(图3e),对照组则不明显(图3f)。
四、软琼脂克隆实验
阳性对照组1周时有110.7个集落出现,2周时为379.7个,3周时为501.7个(图4)。空白对照组、阴性对照组及供试品低、中、高剂量组在培养后3周内均未见细胞集落产生。
五、hUCMSC体外对肿瘤细胞增殖的影响
体外细胞试验结果表明,将1.0×105个/ml的hUCMSC与1.25×104、2.5×104、5.0×104个/ml浓度的悬浮生长人白血病细胞K562共培养,即其相应细胞比例为1:8、1:4、1:2时,与顺铂阳性对照组相比,对K562细胞增殖无明显作用(表1)。1.0×105个/ml的hUCMSC与1.25×104、2.5 ×104、5.0×104个/ml、1.0×105个/ml和2.0×105个/ml浓度的贴壁生长人结肠癌细胞Colo-205共培养,即其相应细胞比例为1:8、1:4、1:2、1:1和2:1时,与顺铂阳性对照组相比,hUCMSC共培养对Colo-205细胞增殖无明显作用(表2)。
讨 论

图3 倒置显微镜下观察hUCMSC诱导分化结果

图4 光学显微镜下观察软琼脂克隆实验细胞接种第3周时细胞形态(×20)
MSC来源于中胚层间充质,主要存在于全身结缔组织和器官间质中,目前研究较多的MSC主要来源于骨髓、脐血、脐带、外周血和脂肪组织。脐带是胎儿分娩后废弃组织,获取过程对供者无不利影响,经产妇自愿捐赠,不存在伦理道德风险,且所获细胞增殖、分化能力强,适合体外大规模培养,产品化前景较强,因此脐带MSC逐渐成为MSC移植的主要来源,也成为国内外商业开发的热点。hUCMSC具有特殊的免疫学表型,不表达HLA-Ⅱ类分子和共同刺激分子,不会引起同种异体淋巴细胞增殖反应。移植入宿主体内的MSC可避免宿主的免疫排斥反应,通过细胞间的相互作用及旁分泌作用等机制抑制过度活跃的T细胞的增殖及自身免疫反应,从而发挥免疫重建的功能,进而有可能在自身免疫疾病方面取得较好的疗效。南京鼓楼医院孙凌云教授将hUCMSC应用于难治性系统性红斑狼疮的治疗,发现hUCMSC治疗安全、耐受,通过纠正患者失衡的免疫系统、减少自身抗体产生,改善病人病情活动度和器官功能,取得了较好的治疗效果并能维持较长时间疗效[23-29]。但hUCMSC的安全性,尤其干细胞被广泛关注的致瘤性仍然没有得到充分研究。本研究通过hUCMSC软琼脂克隆以及肿瘤细胞增殖来评价其体外致瘤性,为进一步的体内致瘤性研究及临床应用提供依据。

表1 hUCMSC共培养对K562细胞增殖的影响
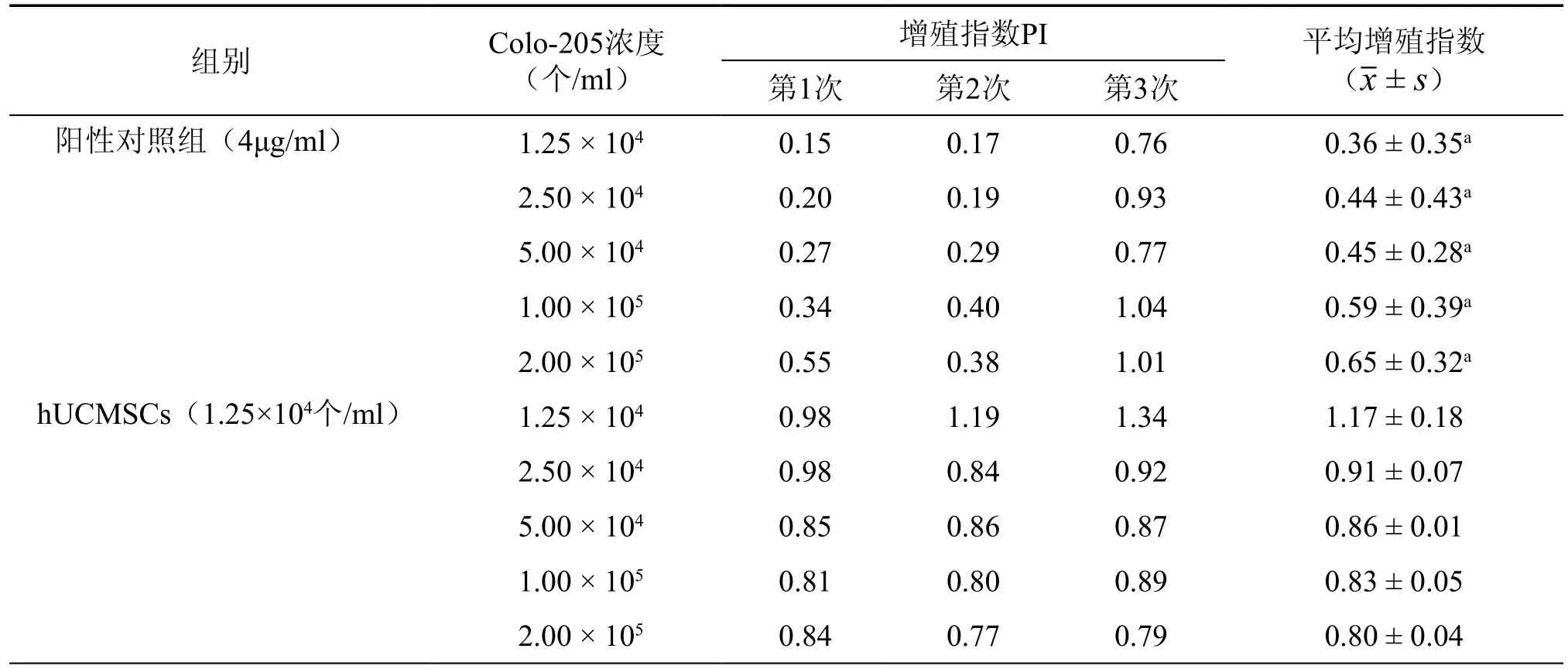
表2 hUCMSC共培养对Colo-205细胞增殖的影响
自脐带剥离得到的华通氏胶组织块贴壁培养,长出贴壁细胞镜下观察为梭形,与成纤维细胞形态相似。流式分析表明该方法分离培养的细胞高表达间充质干细胞阳性指标CD73、CD90、CD105,低表达血液系统来源细胞表面标志物CD34、CD45、CD19;具有向成脂肪和成骨及成软骨方向分化的能力,符合ISCT关于间充质干细胞的标准[19]。
软琼脂克隆实验的结果可以看出,空白对照组和阴性对照组均无克隆形成,说明试验无外源性污染,阴性对照细胞MRC-5为正常组织细胞,没有在阻力培养下生成克隆的能力。阳性对照宫颈癌细胞Hela为肿瘤细胞,增殖能力强,具有阻力培养条件下生成克隆的特性,并随着时间延长肿瘤细胞克隆增加,说明试验系统可信。hUCMSC属于人体正常组织细胞,实验过程中软琼脂培养无细胞克隆形成,证实体外培养时hUCMSC无致瘤性。
hUCMSC分别与人白血病细胞K562和人结肠癌Colo-205细胞体外共培养的促瘤性研究实验中,和对照组相比,hUCMSC对肿瘤细胞的增殖均无明显影响,证实体外培养时hUCMSC无促瘤性。
hUCMSC体外培养不具有软琼脂克隆形成能力,同时对人白血病细胞K562和人结肠癌Colo-205细胞的增殖无影响,为其进一步体内致瘤性研究提供了数据,并为其临床安全使用提供了部分证据。
关于hUCMSC在动物体内的致瘤性及临床应用的安全性,尚需开展更多的进一步研究。
1 Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV. Osteogenesis intransplants of bone marrow cells[J]. J Embryol Exp Morphol, 1966, 16(3):381-390.
2 Bruder SP, Jaiswal N, Haynesworth SE. Growthkinetics,self-renewal, and the osteogenic potential of purifed human mesenchymal stem cells during extensive subcultivation and following cryopreservation[J]. J CellBiochem, 1997,64(2):278-294.
3 Bruder SP, Kurth AA, Shea M, et al. Bone regeneration by implantation of purified, culture-expanded human mesenchymal stemcells[J]. J Orthop Res, 1998,16(2):155-162.
4 Chen Q, Shou P, Zheng C, et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts?[J]. Cell Death Differ. 2016 Feb 12. doi:10.1038/cdd.2015.168.
5 Kadiyala S, Young RG, Thiede MA, et al. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potential in vivo and in vitro[J]. CellTransplant, 1997,6(2):125-134.
6 Nakagawa Y, Muneta T, Otabe K, et al. Cartilage Derived from Bone Marrow Mesenchymal Stem Cells Expresses Lubricin In Vitro and In Vivo[J]. PLoS One, 2016, 11(2): e0148777.
7 Young RG, Butler DL, Weber W, et al. Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair[J]. J Orthop Res. 1998, 16(4):406-413.
8 Awad HA, Butler DL, Boivin GP, et al. Autologous mesenchymal stem cell-mediated repair of tendon[J]. Tissue Eng, 1999, 5(3):267-277.
9 Gao Y, Zhang Y, Lu Y, et al. TOB1 Deficiency Enhances the Effect of Bone Marrow-Derived Mesenchymal Stem Cells on Tendon-Bone Healing in a Rat Rotator Cuff Repair Model[J]. Cell Physiol Biochem, 2016, 38(1):319-329.
10 Ferrari G, Cusella-De Angelis G, Coletta M, et al. Muscle regeneration by bone marrow-derived myogenic progenitors[J]. Science. 1998, 279(5356):1528-1530.
11 Galmiche MC, Koteliansky VE, Brière J, et al. Stromal cells from human long-term marrow cultures are mesenchymal cells that differentiate following a vascular smooth muscle differentiation pathway[J]. Blood, 1993,82(1):66-76.
12 Klimczak A, Kozlowska U. Mesenchymal stromal cells and tissue-specific progenitor cells: their role in tissue homeostasis[J]. Stem Cells Int, 2016:4285215.
13 Dennis JE, Merriam A, Awadallah A, et al. A quadripotential mesenchymal progenitor cell isolated from the marrow of an adult mouse[J]. J Bone Miner Res, 1999,14(5):700-709.
14 Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues[J]. Science, 1997, 276(5309):71-74.
15 Yang H, Sun J, Li Y, et al. Human umbilical cordderived mesenchymal stem cells suppress proliferation of PHA-activated lymphocytes in vitro by inducing CD4+CD25highCD45RA+ regulatory T cell production and modulating cytokine secretion[J]. Cell Immunol, 2016,S0008-8749(16)30002-30008.
16 Romanov YA. Svintsitskaya VA, Smirnov VN. Searching for Alternative Sources of Postnatal Human Mesenchymal Stem Cells:Candidate Msc-like Cells from Umbilical Cord[J]. Stem Cells, 2003, 21(1):105-110.
17 Wang HS, Hung SC, Peng ST, et al. Mesenchymal Stem Cells in the Wharton' s Jelly of the Human Umbilical Cord[J]. Stem Cells, 2004, 22(7):1330-1337.
18 Bianco P, Riminucci M, Gronthos S, el al. Bone Marrow Stromal Stem Cells: Nature, Biology, and Potential Applications[J]. Stem cells, 2001, 19(3):180-192.
19 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stem cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4):315-317.
20 Minguelle JJ, Erices A, Conget P. Mesenchymal stem cells[J]. Exp Biomed, 2001, 226(4):507-520.
21 Van Pham P, Truong NC, Le PT, et al. Isolation and proliferation of umbilical cord tissue derived mesenchymal stem cells for clinical applications[J]. Cell Tissue Bank,2015, 17.
22 孟淑芳,林林,李修兰等. 软琼脂克隆法与裸鼠体内接种法检测细胞致瘤性的比较. 中国生物制品学杂志[J]. 2006, 19(5):516-519.
23 Liang J, Zhang H, Hua B, et al. Allogenic mesenchymalstem cells transplantation in refractory systemic lupus erythematosus: a pilot clinical study[J]. Ann Rheum Dis,2010, 69(8):1423-1429.
24 Liang J, Gu F, Wang H, et al. Mesenchymal stem cell transplantation for diffuse alveolar hemorrhage in SLE[J]. Nat Rev Rheumatol, 2010, 6(8):486-489.
25 Sun L, Wang D, Liang J, et al. Umbilical cord mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus[J]. Arthritis Rheum, 2010, 62(8): 2467-2475.
26 Shi D, Wang D, Li X, et al. Allogeneic transplantation of umbilical cord-derived mesenchymal stem cells for diffuse alveolar hemorrhage in systemic lupus erythematosus[J]. Clin Rheumatol, 2012, 31(5):841-846.
27 Wang D, Akiyama K, Zhang H, et al. Double allogenic mesenchymal stem cells transplantations could not enchance therapeutic effect compared with single transplantation in systemic lupus erhthematosus[J]. Clin Dev Immunol, 2012, 2012:273291.
28 Wang D, Zhang H, Liang J, et al. Allogeneic mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus: 4 years experience[J]. Cell Transplant, 2013, 22(12):2267-2277.
29 Wang D, Li J, Zhang Y, et al. Umbilical cord mesenchymal stem cell transplantation in active and refractory systemic lupus erythematosus: a multicenter clinical study[J]. Arthritis Res Ther, 2014, 16(2): R79.
(本文编辑:李少婷)
Clony formation capability of human umbilical cord-derived mesenchymal stem cell in soft agar and its effects on tumor cell proliferation in vitro
Zeng Guifang, Xie Changfeng,Xu Shaokun, Du Jie, Li Chan, Li Tao, Zuo Conglin, Liu Muyun, Hu Xiang.1Shenzhen Beike Bio-Technology Company Limited, Shenzhen 518062, China;2JOINN Laboratories, Incorporated,Beijing 100176, China
Corresponding author: Liu Muyun, Emai:muyun@beike.cc
Zeng Guifang and Xie Changfeng are the first authors who contributed equally to the article
Objective To study whether human umbilical cord-derived mesenchymal stem cells(hUCMSC)promoted tumor cell growth and formed clones in vitro and to provide safety data for future clinical use. Methods Wharton's jelly was stripped from human umbilical cord and cut into pieces;the adherent cells were collected using tissue explant method and subcultured. The morphology of hUCMSC was observed under microscope. The phenotype of hUCMSC was determined by flow cytometry. The osteogenesis, adipogenesis and chondrogenesis capability were tested by differentiation induction. The clone formation capability was evaluated on soft agar. Cells proliferation was evaluated by proliferation index(PI)through MTT methods after hUCMSC were co-cultured with K562 and colo-205. Results Fibroblasts-like morphology was observed in cells derived from Wharton's jellyof human umbilical cord. The capabilities of osteogenesis, adipogenesis and chondrogenesis differentiation were confirmed. Cells were positive for surface markers of mesenchymal stem cells such as CD73, CD90, CD105 and negative for CD34, CD45 and CD19. These results indicated they were mesenchymal stem cells. Soft agar colony formation assay showed hUCMSC did not exhibit clonal growth. hUCMSC had no effect on tumor cell proliferation when co-cultured with K562 and colo-205 tumor cells in vitro. Conclusion hUCMSCs has neither tumorigenicity nor effects on tumor cell proliferation in vitro.
Umbilical cord; Mesenchymal stem cell; Cells differentiation,;Tumorigenicity; Tumor enhancement
10.3877/cma.j.issn.2095-1221.2016.02.005
广东省科技计划(2013B070704118);深圳市科技计划项目(JSGG20130917151830203、CXZZ20150430152511042)
518062 深圳市北科生物科技有限公司1;100176 北京昭衍新药研究中心有限公司2
刘沐芸,Email: muyun@beike.cc
前两位作者对本文有同等贡献,均为第一作者
2016-01-11)
