海鲈鱼鱼糜冻藏过程中流变特性及凝胶结构的变化规律
2016-09-14岳开华黄永春张业辉张友胜刘学铭汪婧瑜广西科技大学生物与化学工程学院广西柳州545006广东省农业科学院蚕业与农产品加工研究所农业部功能食品重点实验室广东省农产品加工重点实验室广东广州5060
岳开华,黄永春,张业辉,张友胜,刘学铭,汪婧瑜(.广西科技大学生物与化学工程学院,广西柳州545006;.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州5060)
海鲈鱼鱼糜冻藏过程中流变特性及凝胶结构的变化规律
岳开华1,2,黄永春1,张业辉2,*,张友胜2,刘学铭2,汪婧瑜2
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州510610)
为研究不同冻藏温度和冻藏时间对海鲈鱼鱼糜的流变特性和凝胶结构的影响,实验采用流变仪和显微镜对冻藏过程中的鱼糜进行分析观察。结果显示,海鲈鱼鱼糜的黏度随剪切速率增加而减小,存在剪切变稀现象;鱼糜的弹性模量(G′)和损耗模量(G″)随频率的增加而升高;鱼糜凝胶过程经历了三个阶段(不同冻藏温度和冻藏时间的鱼糜有所偏差):第一阶段在40℃之前,第二阶段出现在40~50℃,第三阶段在50℃之后,蛋白开始形成最终的凝胶;鱼糜随冻藏温度的升高和冻藏时间的延长,鱼糜的G′和G″减小,黏弹性下降,损耗角正切(tanδ)增大,流动性增加。鱼糜凝胶的微观结构显示,随冻藏温度升高和冻藏时间延长,纤维基质的损伤越大,形成的凝胶性能越差。本研究对海鲈鱼鱼糜的应用具有一定的借鉴意义。
海鲈鱼鱼糜,冻藏,流变特性,凝胶结构
海鲈鱼(sea bass)蛋白质丰富,肉质鲜美,是我国常见的经济鱼类之一,也是海水养殖业的重要品种之一。据《中国渔业年鉴》统计,2010~2013年,海水养殖海鲈鱼产量一直处于首位,2013年产量达到128086吨。随着海鲈鱼养殖业的迅猛发展,消费者需求量的增加,冷冻鱼糜的加工生产已成为发展趋势。
鱼糜制品因其高蛋白、低热量、低脂肪、低胆固醇、品种多样、味美可口等优点,受到广大消费者的
喜爱。冷冻鱼糜作为制作鱼糜制品的主要原料,不仅能够延长鱼肉的保质期,还可以为鱼糜制品加工业提供质量稳定的原料供应,使其生产不受季节和地域的限制[1]。鱼糜制品的生产加工过程包括混合搅拌、管道运输、物料挤压、热凝胶化等,其中鱼糜加工设备的设计和鱼糜的热凝胶化与鱼糜流变参数有很大关系[2-3]。鱼糜的流变特性分析主要集中在研究鱼糜在加工过程中的变形和流动问题,以及最终产品在咀嚼过程中的变形和恢复问题[4]。目前国内对鱼糜流变特性的研究较少,尤其是对鱼糜在冻藏过程中流变特性的研究仍属于空白阶段。
本实验以海鲈鱼鱼糜为原料,针对不同冻藏温度(-70、-24、-14、-4℃)和冻藏时间对鱼糜动态黏弹性等流变特性进行研究。通过对鱼糜流变特性的研究,不仅可以反映出鱼糜的内部结构,分子形态及分子间的相互作用,还可以得到冻藏温度和时间对鱼糜流变特性的影响规律,对我国鱼糜的贮藏运输、加工生产以及市场消费有着重要的意义。
1 材料与方法
1.1 材料与仪器
海鲈鱼 购自广州天河区世纪联华超市,挑选大小均一(700~800 g)、鱼鳞完好、健康活力的鱼为实验原料;苏木精、伊红、无水乙醇、氯化钠 均为分析纯,购自国药集团化学试剂有限公司;OCT液 购自德国LEICA公司。
AR-1500EX流变仪 美国TA公司;SZ-5斩拌机 广州旭众食品机械有限公司;MICROM HM560冷冻切片机 美国THERMO公司;Axio Scope A1荧光正置显微镜 德国ZEISS公司;SZ-12A绞肉机 广州旭众食品机械有限公司。
1.2 实验方法
1.2.1 鲈鱼鱼糜的制备 将活鱼击毙,去鳞、去内脏、去头、去尾,清水洗净后采肉(只取白肉),用绞肉机绞碎。加入4倍体积蒸馏水漂洗三次,再用0.3% NaCl溶液漂洗一次,每次漂洗2~3 min,静置除去杂质,用尼龙纱布袋挤压脱水至水分80%左右。将脱水后的鱼糜混匀,以每100 g装袋,包装若干袋,分成四组,在-40℃下快速冻结5 h后,分别放到-4、-14、-24、-70℃的冰箱中冻藏。
1.2.2 实验样品处理 将冷冻的鱼糜自然解冻,先用斩拌机空擂5 min(500 r/min),然后加入3%鱼糜质量的NaCl擂溃10 min(1000 r/min),取出后调节含水量至80%,放在4℃冰箱中待测。
1.2.3 流变特性测定
1.2.3.1 黏度扫描 参照Yang[5]的方法并稍作修改。采用流变仪的锥形板(直径60 mm,角度1.89°)测定,将制备好的鱼糜置于两板之间,剪切速率范围为0~100 s-1,测试温度25℃。实验重复8次,从数据相似度最接近的3组中取均值作图。
1.2.3.2 频率扫描 参照Delgado[6]的方法并稍作修改。采用流变仪的平行板(直径为40 mm)测定,将制备好的鱼糜置于两平板之间,调节两平板之间的距离为1.5 mm。应变为1%,扫描频率范围为1~21 Hz,测试温度为25℃。实验重复8次,从数据相似度最接近的3组中取均值作图。
1.2.3.3 温度扫描 采用流变仪的平行板(直径为40 mm)测定,将制备好的鱼糜置于两平板之间,调节两平板之间的距离为1.5 mm。在扫描过程中,要除去过量的样品,并在样品表面添加一层薄硅化油,以防止水分的蒸发。应变为1%,扫描频率为1 Hz,扫描温度范围为10~70℃,起始温度10℃,程序升温2℃/min,结束后程序降温到25℃。实验重复8次,从数据相似度最接近的3组中取均值作图。
1.2.4 冻藏过程中鱼糜凝胶组织构造的变化 参照仪淑敏[7]的方法并稍作修改。将冷冻鱼糜解冻,用低温真空斩拌机空擂5 min(500 r/min),然后加入3%质量的NaCl擂溃10 min(1000 r/min),取出后调节含水量至80%。将鱼糜装到25 mL小烧杯中,填充结实,不留孔隙,填满烧杯后,将烧杯口用两层保鲜膜密封。将样品在40℃水浴加热1 h,然后转入90℃水浴加热30 min,流水冷却,放到4℃冰箱中放置24 h。取出凝胶并切成5 mm×5 mm×3 mm的小块,包埋于OCT液后,-22℃下冻藏20 min,采用冷冻切片机将其切成8 μm薄片,贴于载玻片上,通过HE染色法染色,光学显微镜50倍下进行观察。
1.3 数据分析
采用Origin 9.0数据分析软件进行数据分析。
2 结果与分析
2.1 冻藏温度和时间对海鲈鱼鱼糜黏度的影响
对新鲜鱼糜进行剪切应力扫描(图1),发现鱼糜呈现假塑性流体行为,曲线采用幂律公式τ=Kγn进行线性拟合,式中:τ为剪切应力(Pa),K为稠度系数(Pa·sn),γ为剪切速率(s-1),n为流变特性指数。结果发现,K=5.2460,n=0.3075,R2=0.9985,由于n<1,所以鱼糜属于假塑性流体[8]。
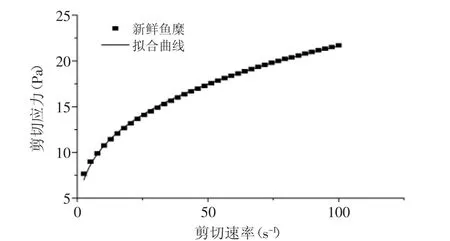
图1 新鲜鱼糜剪切应力随剪切速率的变化曲线Fig.1 Relationship between shear rate and shear stress of fresh surmi
图2~图3可以看出,海鲈鱼鱼糜的黏度随剪切速率的增加而下降,存在“剪切稀化”的现象。图2显示,鱼糜随冻藏温度的升高,其黏度呈下降趋势,且剪切速率越小,黏度差异越明显,随剪切速率增大,黏度差异越小。这是因为鱼糜内的肌原纤维蛋白分子之间相互缠绕,有交联作用,形成相对稳定的三维结构,随着剪切速率的增加,会破坏鱼糜的三维结构,
所以鱼糜的表观黏度会下降,且鱼糜会出现剪切依赖现象[5]。图3看出,-24℃冻藏温度下的鱼糜黏度随冻藏时间的延长而减小,冻藏前期变化幅度大,4周后变化相对较小,这与鱼糜冻藏过程中肌原纤维蛋白的变性程度有关,鱼糜冻藏时间越长,肌原纤维的变性程度越严重,蛋白之间的交联性变差,鱼糜的网状结构破坏,鱼糜的黏度越小[9]。
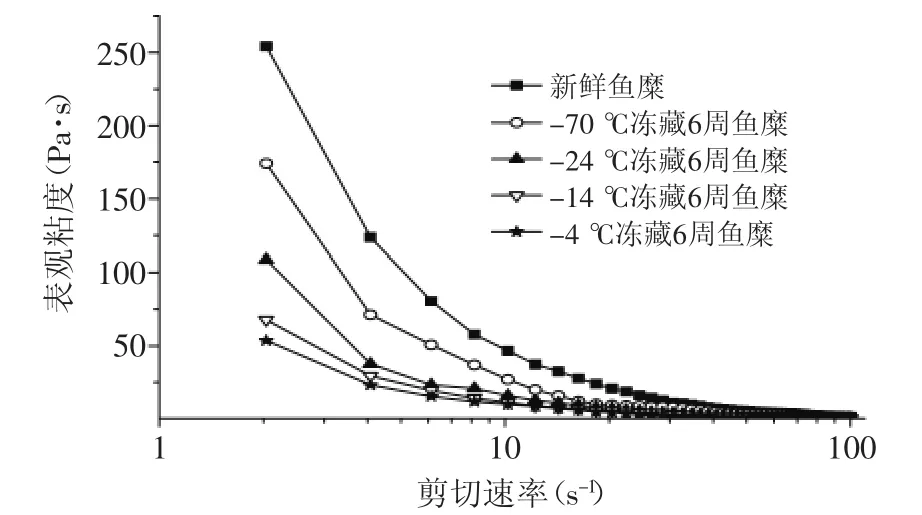
图2 不同冻藏温度对鱼糜黏度的影响Fig.2 Effect of different frozen storage temperatures on viscosity of surmi

图3 不同冻藏时间对鱼糜黏度的影响Fig.3 Effect of different frozen storage times on viscosity of surmi
2.2 频率对鱼糜体系黏弹性的影响
机械模量G′和G″分别是反应体系中弹性和黏性大小的指标。为进一步研究体系的黏弹性变化,通常用损耗角正切tanδ=G″/G′来表征。tanδ值以1为界限,其值小于1表明体系趋于固体特性,弹性成分占优势;其值大于1表明体系趋于流体特性,黏性成分占优势[10]。
图4可以看出,鱼糜的G′和G″随施加频率的增大而升高,且在0~2 Hz之间的G′和G″升高幅度较大,其弹性模量和黏性损耗模量都升高较快。图4(a、b)显示,-24℃和-14℃冻藏6周的鱼糜黏弹性相差不大,较-70℃冻藏鱼糜的黏弹性有所下降。图4(c)显示,-24℃冻藏温度下的鱼糜,前3周弹性模量下降幅度大,3周后下降幅度减缓,这与鱼蛋白在前3周变性速度快有关。由图4~图5可知,随鱼糜冻藏温度升高,冻藏时间延长,G′和G″的下降幅度变大,tanδ也在增大。这是因为鱼糜在冻藏过程中,肌原纤维蛋白会发生变性,蛋白分子会发生解链,一些化学键断裂,导致肌球蛋白分子之间相互作用形成共价键,使鱼糜内部结构稳定性下降,弹性模量下降,黏度降低,流动性变大[11]。其中-4℃冻藏温度的鱼糜G′和G″严重下降,tanδ也明显增大,这是因为鱼糜在-4℃冻藏过程中,微生物繁殖快,鱼蛋白变性速度快,导致鱼糜黏弹性下降严重,流动性增大。图5可知,在所有频率下鱼糜的tanδ<1,说明鱼糜体系趋于固体特性,弹性成分占优势。在0~2 Hz之间,tanδ减小,说明G″增大幅度比G′小,当频率继续增大时,G′和G″都在缓慢增加,
而tanδ也呈缓慢升高的趋势,说明鱼糜有着“剪切变稀”的现象。这是因为鱼糜内部分子之间相互交联,有着稳定的结构,施加过小的频率,不会对鱼糜内分子链之间化学键以及三维结构造成破坏,继续施加频率会对鱼糜内部的结构造成一定破坏,蛋白发生解链,延伸变长,导致流动性增加[12]。
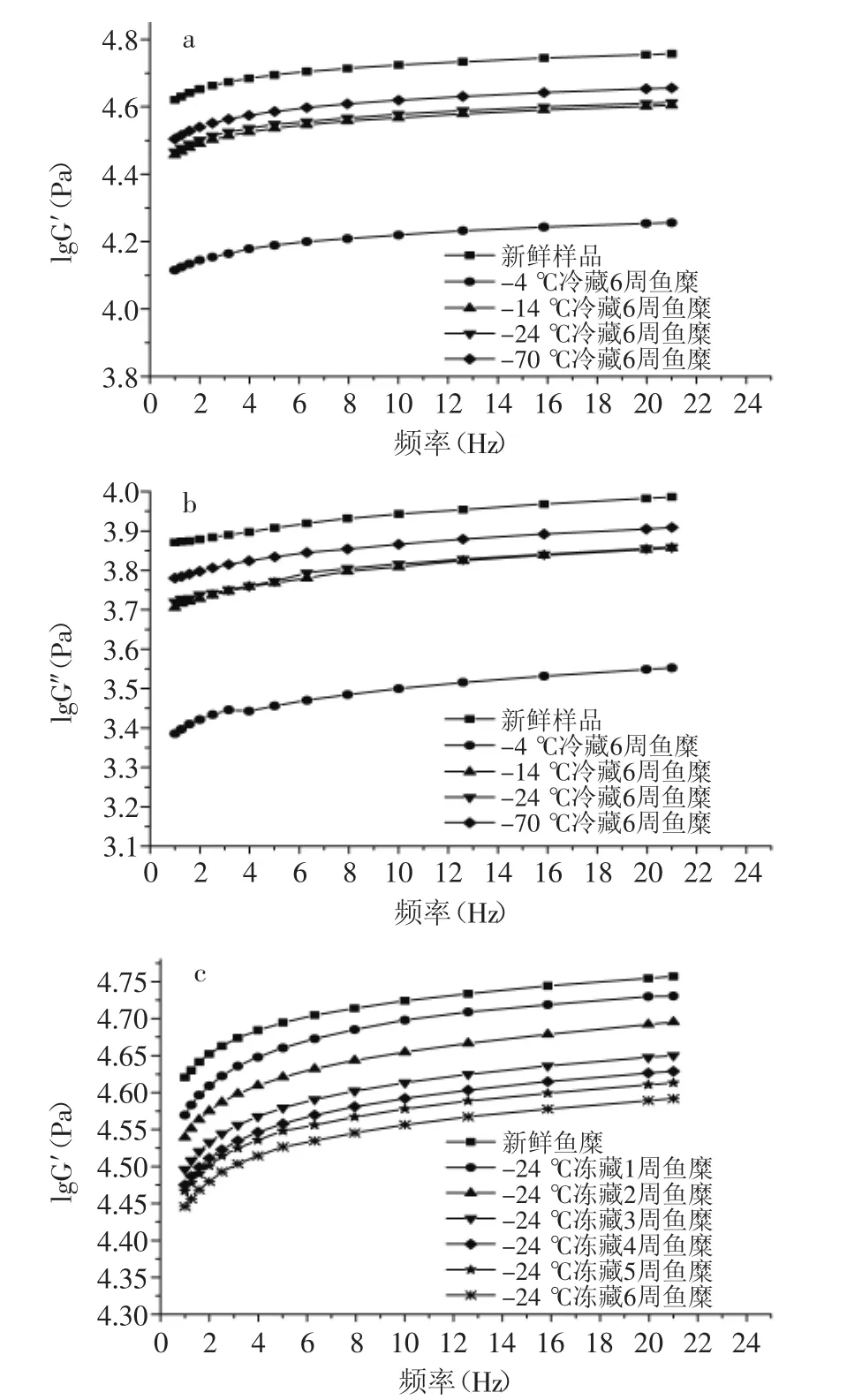
图4 不同冻藏温度及时间对鱼糜G′和G″的影响Fig.4 Effect of different times or temperatures of frozen storage on G′and G″of surmi
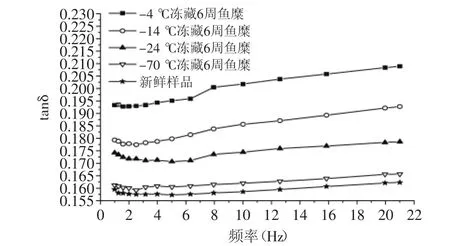
图5 震荡频率与不同冻藏温度鱼糜tanδ的关系图Fig.5 Relationship between oscillation frequency and tantδ of surmi at different frozen storage temperatures
2.3 温度对鱼糜黏弹性的影响
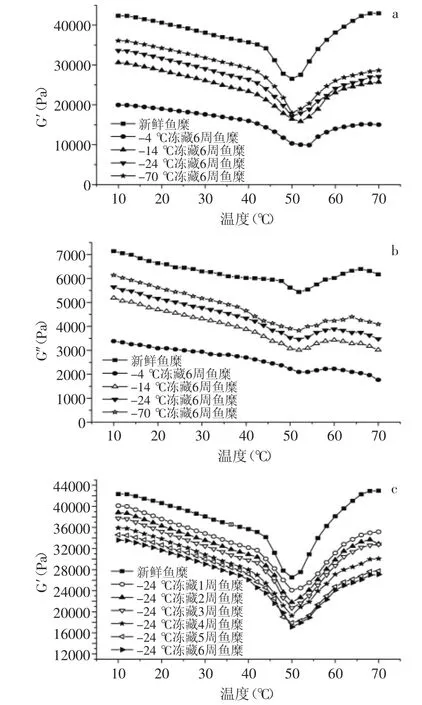
图6 温度对不同冻藏温度及时间鱼糜G′和G″的影响Fig.6 Effect of temperature on G′and G″of frozen storage surmi with diffrent temperatures or time
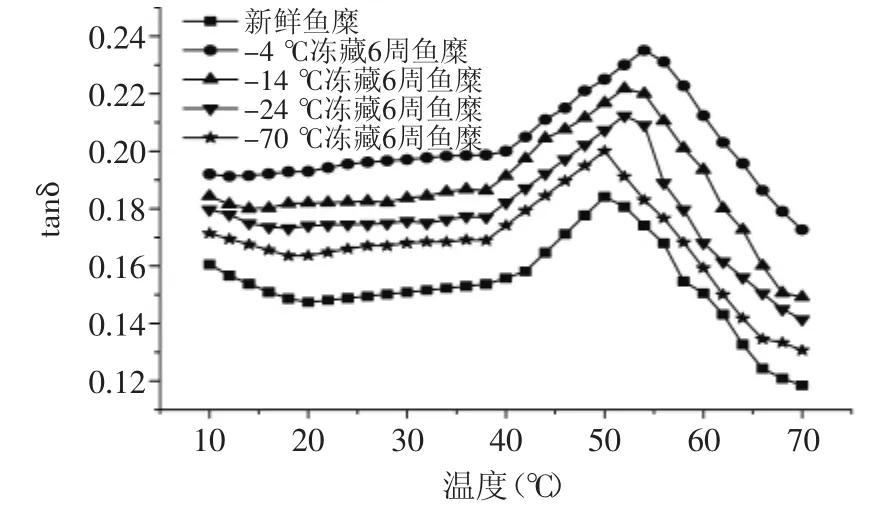
图7 温度对不同冻藏温度鱼糜tanδ的影响Fig.7 Effect of temperature on diffrent frozen storage temperatures on tanδ of surmi
鱼糜蛋白在加热过程中会形成凝胶,凝胶的形成主要经过三个阶段:凝胶化、凝胶劣化和鱼糕化[10]。鱼蛋白的凝胶性能影响着鱼肉制品的弹性、保水性和黏结性,直接影响消费者的口感。
图6显示,在40℃前,随温度的升高,鱼糜的G′和G″缓慢降低,此时肌球蛋白分子的α双螺旋会慢慢解开,分子之间通过化学键形成松散的网状结构[13];随着温度继续升高,鱼糜的G′和G″急剧下降,到50℃左右达到最低,此时达到内源性水解酶的最佳活性温度,导致肌动蛋白和肌球蛋白的网络结构断裂,蛋白分子大量迁移,蛋白分子之间部分化学键也被破坏,从而使得蛋白质分子发生延伸,流动性大大增加,鱼糜进入凝胶劣化阶段[14];当温度继续升高,G′和G″迅速增大,这可能是因为大量增加的肌球蛋白和肌动蛋白重链分子形成了不可逆的凝胶网络[15]。因而随着疏水键、二硫键等化学键的形成,鱼糜内部形成有序稳定的三维凝胶结构,导致鱼糜内部结构发生改变,弹性模量大幅度增大,最终进入鱼糕化阶段[16]。
由图6(a)可以看出,不同温度下冻藏6周的鱼糜,随冻藏温度的升高,凝胶劣化区G′的最低点在逐渐向高温度方向移动。新鲜鱼糜G′的最低点出现在50℃左右,而-14℃和-4℃冻藏6周的鱼糜G′分别出现在52℃和54℃左右,这可能是因为冻藏温度越高,肌原纤维蛋白的变性程度越严重,鱼糜在进入凝胶劣化阶段后,分子之间重链聚集及化学键形成受到破坏,不能迅速形成稳定的凝胶结构,导致G′最低点向高温度方向移动。图6显示,鱼糜随冻藏温度的升高和冻藏时间的延长,鱼糜形成稳定的凝胶结构后,G′和G″都有不同程度下降。Kaewudom[17]认为是肌原纤维蛋白的变性,会使MTG酶(转谷酰胺酶)减少,导致鱼糜内部蛋白分子的交联作用受到影响,最后形成的凝胶性能差,弹性模量减小。
图7可以看出,tanδ的变化趋势与G′和G″的变化趋势相反,在升温初期呈下降趋势,此时鱼糜内部肌原纤维蛋白处于相对稳定的网状结构。随温度升高,tanδ开始缓慢增大,不同冻藏温度的鱼糜tanδ开始变大的起始温度不同,新鲜鱼糜在20℃左右,-70℃冻藏的鱼糜在17℃左右,-24℃和-14℃冻藏的鱼糜在15℃左右,而-4℃冻藏的鱼糜没有明显的变化趋势。这是因为蛋白的变性程度越严重,鱼糜在低温时的内部结构越不稳定,随温度升高,肌球蛋白的α双螺旋解链越快[10]。温度在20~40℃之间,tanδ小幅度增加,此阶段,鱼糜内部结构处于缓慢解链状态。温度超过40℃后,tanδ急剧增大,并且在50℃左右达到最大值,此时鱼糜处于凝胶劣化阶段,肌原纤维蛋白大量解链延伸,导致鱼糜流动性增加,弹性模量大幅度下降。温度超过50℃后tanδ急剧减小,且冻藏温度越低,冻藏时间越短,tanδ下降幅度越大。随冻藏温度的升高,鱼糜的tanδ最大值点向高温度方向移动,与G′和G″最小值的变化一致。
2.4 冻藏过程中鱼糜热凝胶组织构造的变化
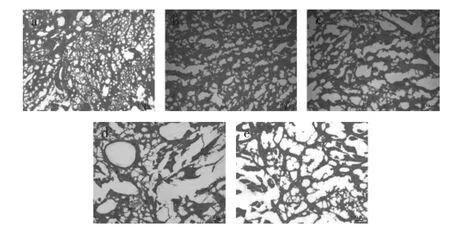
图8 不同冻藏温度下的鱼糜凝胶显微观察图Fig.8 Gel microscopic observation under different frozen storage temperatures
图8(a)可知,新鲜鱼糜凝胶样品有致密的网络结构,空隙小,结构紧密,具有良好的纤维基质。图8(b)中,-70℃冻藏6周鱼糜凝胶样品的网络结构相对紧密,但相比新鲜样品空隙较大,整体有断裂的网孔,纤维局部断裂。图8(c)中,-24℃冻藏6周鱼糜凝胶样品的网状结构舒松,空隙较b图大,纤维基质大量断裂,有少量不规则的聚集体,凝胶性能大大下降。图8(d)中,-14℃冻藏6周鱼糜凝胶样品局部有少量网状结构,存在少量的大孔隙,肌原纤维基质大量断裂,存在粗大的凝聚体。而图8(e)中,-4℃冻藏6周鱼糜凝胶样品网状结构不明显,肌原纤维基质大量断裂,存在大量大孔隙及聚集体,形成的凝胶疏松多孔。上述变化是因为肌原纤维蛋白的冷冻变性程度不同,导致蛋白解链,聚集成大的凝集体,不同程度地阻碍了凝胶形成过程中分子间的凝聚交联,使最后形成的凝胶有明显差异[18],上述凝胶差异恰好与图6~图7中鱼糜黏弹性的变化相符。另外,鱼糜随着冻藏温度的升高,冻藏时间的延长,导致分子内部化学键被破坏,巯基变性,一些酶的(如MTG酶、ATP酶等)失活等原因,从而影响凝胶的性能[19-20]。
3 结论
海鲈鱼鱼糜随冻藏时间的延长和冻藏温度的升高,蛋白质会发生不同程度的变性,鱼糜的表观黏度下降,G′和G″减小,tanδ增大,黏弹性下降,流动性增加。对于上述变化,-4℃冻藏温度下的鱼糜变化明显,-70℃冻藏温度下的鱼糜变化幅度最小,-24℃和-14℃冻藏温度下的鱼糜变化相差不大。
海鲈鱼鱼糜有着“剪切变稀”的行为,并且与剪切速率有依赖现象;鱼糜随施加频率的增加,G′、G″和tanδ都有增大现象;海鲈鱼鱼糜随冻藏时间的延长和冻藏温度的升高,凝胶劣化区的G′和G″最低点都有向高温度移动趋势,最后形成鱼糜凝胶的G′和G″都减小,而tanδ增大。
随冻藏时间的延长和冻藏温度的升高,海鲈鱼鱼糜凝胶的网状结构逐渐酥松,空隙逐渐变大,基质纤维逐渐聚集、变粗、断裂,严重影响其凝胶性能。
[1]Park J W.Surimi and surimi seafood[M].CRC Press,2013.
[2]王清章,邱承光,彭光华,等.莲藕粉糊的流变特性实验研究[J].农业工程学报,2002(4):116-119.
[3]李里特.食品物性学[M].中国农业出版社,1998.
[4]余振宇,姜绍通,潘丽军,等.芋头浆的流变特性[J].食品科学,2015,36(7):36-40.
[5]Yang H,Li J G,Wu N F,et al.Effect of hsian-tsao gum(HG)content upon rheological properties of film-forming solutions (FFS)and physical properties of soy protein/hsian-tsao gum films [J].Food Hydrocolloids,2015,50:211-218.
[6]Delgado-Pando G,Cofrades S,Ruiz-Capillas C,et al.Lowfat pork liver pâtés enriched with n-3 PUFA/konjac gel:Dynamic rheological properties and technological behaviour during chill frozen storage[J].Meat Science,2012,92(1):44-52.
[7]仪淑敏,马兴胜,励建荣,等.超高压对金线鱼鱼肉肠凝胶特性的影响[J].食品工业科技,2014,35(10):129-133.
[8]胡珊珊,王颉,孙剑锋,等.不同添加物对羟丙基木薯淀粉流变特性的影响[J].中国粮油学报,2012,27(5):35-38.
[9]Benjakul S,Visessanguanb W,Tueksubana J.Changes in physico-chemical properties and gel-forming ability of lizardfish (Saurida tumbil)during post-mortem storage in ice[J].Food Chemistry,2003,80(4):535-544.
[10]李勇,程裕东.白鲢鱼糜流变特性的研究[J].食品科学,2007,28(10):100-104.
[11]Zhou F,Zhao M,Zhao H,et al.Effects of oxidative modification on gel properties of isolated porcine myofibrillar protein by peroxyl radicals[J].Meat Science,2014,96(4):1432-1439.
[12]Zhang M,Li J,Ding C,et al.The rheological and structural properties of fish collagen cross-linked by N-hydroxysuccinimide activated adipic acid[J].Food Hydrocolloids,2013,30(2):504-511.
[13]黄海,辛荣,王秀敏.鱼肉蛋白在低温贮藏时生化特性变化研究进展[J].食品研究与开发,2009,30(2):149-155.
[14]Zhang T,Xue Y,Li Z,et al.Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to hightemperature(120℃)treatment[J].Food Hydrocolloids,2015,43:125-131.
[15]Buamard N,Benjakul S.Improvement of gel properties of sardine(Sardinella albella)surimi using coconut husk extracts [J].Food Hydrocolloids,2015,51:146-155.
[16]Pérez-Mateos M,Solas T,Montero P.Carrageenans and alginate effects on properties ofcombined pressure and temperature in fish mince gels[J].Food Hydrocolloids,2002,16:225-233.
[17]Kaewudom P,Benjakul S,Kijroongrojana K.Properties of surimigelas influenced by fish gelatin and microbial transglutaminase[J].Food Bioscience,2013,1:39-47.
[18]Benjakul S,Visessanguan W,Thongkaew C,et al.Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J].Food hydrocolloids,2005,19(2):197-207.
[19]Liu Q,Kong B,Han J,et al.Effects of superchilling and cryoprotectants on the quality of common carp(Cyprinus carpio)surimi:Microbial growth,oxidation,and physiochemical properties [J].LWT-Food Science and Technology,2014,57(1):165-171.
[20]Benjakul S,Visessanguan W,Thongkaew C,et al.Effect of frozen frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J].Food Hydrocolloids,2005,19(2):197-207.
The changes of rheological properties and gel structures of sea bass surimi during frozen storage
YUE Kai-hua1,2,HUANG Yong-chun1,ZHANG Ye-hui2,*,ZHANG You-sheng2,LIU Xue-ming2,WANG Jing-yu2
(1.College of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;2.Sericultural&Agri-Food Research Institute Guangdong Academy of Agricultural Sciences,Key Laboratory of Functional Foods,Ministry of Agriculture/Guangdong Key Laboratory of Agricultural Products Processing,Guangzhou 510610,China)
The effect of different frozen temperatures and time on rheological properties and surimi gel structure were investigated by using rotational rheometer and microscopy.The results showed that the viscosity of sea bass surimi were significantly decreased with increasing shear rate.It was a shear-thinning phenomenon.The surimi elastic modulus(G′)and loss modulus(G″)were increased with increasing frequency.The gel process of surimi had three stages:the first stage appeared below 40℃,the second stage appeared between 40℃and 50℃,the third stage appeared over 50℃,and then the protein formed gel.The G′,G″and viscoelastic of surimi were decreased with increasing frozen temperature and time,meanwhile the loss tangent(tanδ)and fluidity were increased.The gel microstructure revealed that the more matrix of fibers damaged,and the gel properties more weak with frozen temperature and frozen time extension.The results provided a certain reference for further widening the scope of the application of the sea bass surimi.
sea bass surimi;frozen;rheological properties;gel structure
TS201.1
A
1002-0306(2016)08-0330-06
10.13386/j.issn1002-0306.2016.08.061
2015-09-14
岳开华(1990-),男,硕士研究生,研究方向:食品化学,E-mail:309022875@qq.com。
*通讯作者:张业辉(1979-),男,博士,副研究员,研究方向:食品化学,E-mail:Zhangyhgx@163.com。
国家“863”子课题项目(2013AA102201-3);广西高等学校高水平创新团队及卓越学者计划资助(桂教人〔2014〕7号);广东省农科院院长基金(201415);广东省科技项目(2015B020206001);广州市对外合作项目(201603)。
