基于团簇结构模型的Na2O-A l2O3-SiO2三元体系熔体吉布斯混合摩尔自由能计算
2016-09-13李永康尤静林王建王敏马楠魏广超
李永康 尤静林王建王 敏马楠 魏广超
(省部共建高品质特殊钢冶金与制备国家重点实验室,上海市钢铁冶金新技术开发应用重点实验室,上海大学材料科学与工程学院,上海200072)
基于团簇结构模型的Na2O-A l2O3-SiO2三元体系熔体吉布斯混合摩尔自由能计算
李永康尤静林*王建王敏马楠魏广超
(省部共建高品质特殊钢冶金与制备国家重点实验室,上海市钢铁冶金新技术开发应用重点实验室,上海大学材料科学与工程学院,上海200072)
以三元硅酸盐熔体团簇结构模型为基础,选取了Na2O-Al2O3-SiO2体系不同成分的团簇结构,采用半经验量子化学方法MNDO/d分别计算该三元体系熔体中不同结构的团簇基元在1473、1873、2000K温度下的熵、焓、热容和自由能等热力学数据,计算得出不同团簇结构基元的混合自由能,并根据统计热力学波尔兹曼分布定律,推导计算得出Na2O-Al2O3-SiO2三元体系各成分下的混合摩尔自由能。三元硅酸盐熔体的热力学性质与该熔体的微观结构密切相关。
Na2O-Al2O3-SiO2;团簇结构模型;熔体;混合摩尔自由能
从Neuville10,Yang11和刘钦12等的研究中都可以得知铝硅酸玻璃中铝的配位数是四、五和六,四配位铝占多数。长期以来人们一度认为玻璃继承了熔体的结构,因而很多学者凭借对玻璃的研究来说明熔体结构。可是,玻璃的结构不能等同于熔体的结构。刘钦等12通过高温拉曼光谱对铝硅酸盐的研究认为铝在硅酸盐熔体中可以发现四配位和六配位的结构而且主要的配位数是四,但并没有证据证明有五配位铝的结构存在于熔体结构中。说明虽然很多研究指出铝硅酸盐玻璃中铝的配位数是四、五和六,但是铝硅酸盐熔体中只有含四配位铝和六配位铝的结构。类似的例子可以从锗酸盐和硼酸盐的研究中发现。锗酸盐玻璃和晶体中锗的配位数为四和六,但是熔体中只有四配位锗13;硼酸盐玻璃和晶体中硼的配位数为三和四,但是熔体中只有三配位硼14,15。
You等16,17利用高温拉曼光谱和量子化学从头计算对硅酸盐晶体、玻璃和熔体结构进行了研究,并预测了硅酸盐熔体中可能存在的团簇结构基元。除此之外,王威和尤静林18基于团簇结构模型采用半经验方法对碱金属二元硅酸盐的热力学性质进行了计算,得出100-2000K时的熵、焓、吉布斯自由能及比定压热容,并由此计算出该二元体系的混合自由能,并与实验数据相吻合。从硅酸盐微观精细结构出发计算得到某成分下硅酸盐宏观热力学性质是新的研究方法,具有指导意义。因此本文基于Na2O-A l2O3-SiO2三元体系熔体团簇结构,采用量子化学中的半经验方法,进行三元体系的高温热力学性质计算,给出了该体系的热力学性质随温度的变化规律。
2 实验部分
2.1铝硅酸盐熔体团簇结构模型
团簇的选取既要考虑相关晶体的结构,同时也包含了熔体和玻璃体系特有的结构19,20。尤静林等12,17,21采用高温拉曼光谱技术探测了硅酸盐和铝硅酸盐类熔体,并将熔体里的局域结构与拉曼光谱位移建立了对应的关系,并用量子化学从头计算进行相关有效的验证,从而作为熔体团簇结构假设的必要基础条件。在此基础上得到如图1所示的Na2O-A l2O3-SiO2三元体系熔体团簇结构。
2.2计算方法
本文使用Materials Studio 5.5软件22搭建不同成分的Na2O-Al2O3-SiO2三元系团簇模型,运用半经验的VAMP(Vienna Ab initio Molecular-dynam ics Package)模块对其进行结构优化和热力学计算。计算参数设置为:哈密顿函数选择MNDO/d23,24,收敛判据设为16.747 kJ∙mol-1∙nm-1,算法为Hartree-Fock(RHF)自洽分子轨道理论方法,自洽场(SCF)误差选择1.0×10-5,温度设置为100-2000K,步长为25K,计算结果为熵、焓、热容在不同温度下的值。计算结果将用于计算不同温度下该三元体系的混合自由能。
3 计算结果与讨论
3.1Na2O-Al2O3-SiO2三元系团簇基元混合自由能
Na2O-A l2O3-SiO2三元系团簇基元的熵、热容和焓值可由计算结果文件中直接给出。团簇基元的自由能G(T)由下式来计算:
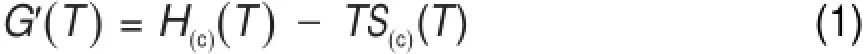
根据VAMP模块数据处理的需要,若要求得各团簇基元的自由能G(T),需要对其进行以下修正:
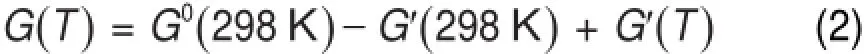
其中:G0(298 K)为计算时输出文件中的生成热(heatof formation)的值。
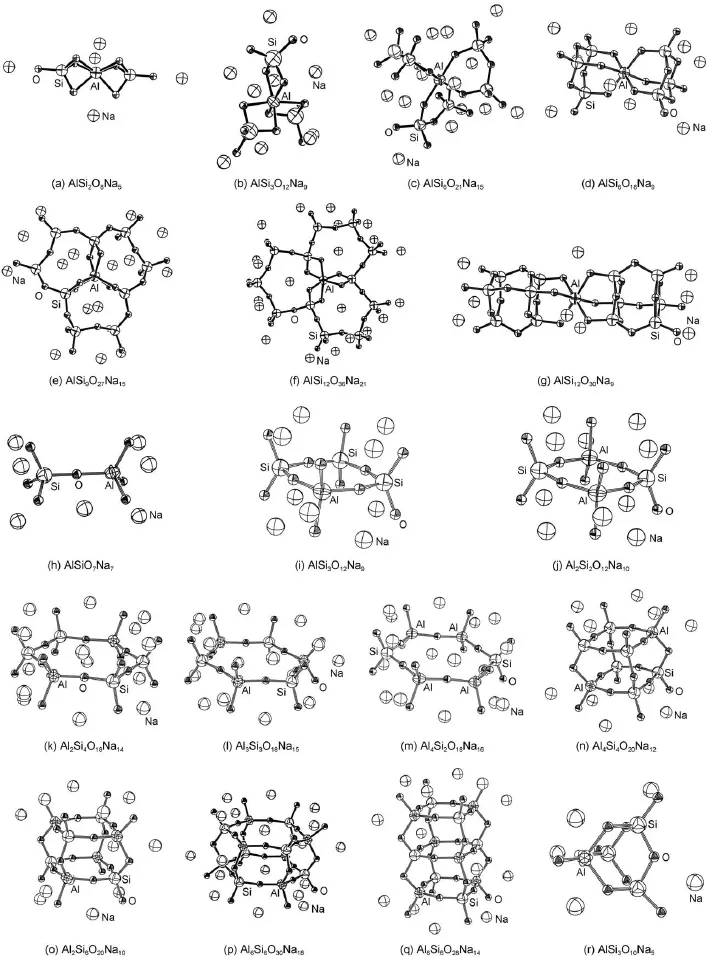
图1 Na2O-A l2O3-SiO2三元系团簇基元的构型图Fig.1 Diagram sofm odel clustersof the Na2O-A l2O3-SiO2ternary system Element labelsare all the sameasin the diagram of AlSi2O8Na5(a).
由半经验方法的计算结果得到不同温度下同一团簇基元的熵、焓和热容,再通过公式(1)和(2)得出自由能。A lSi2O8Na5团簇基元的熵、焓、热容、自由能与温度的关系图见图2。结构不同的硅酸盐团簇,它们的熵、焓、热容和自由能随温度的变化规律是相同的,其中熵、焓和热容随着温度升高而有不同程度的增加,自由能随着温度的升高而减小。
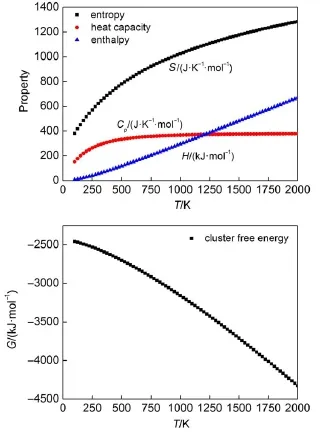
图2 AlSi2O8Na5团簇基元(图1(a))的熵、焓、热容、自由能与温度的关系图Fig.2 Tem peratue dependententropy,enthalpy,heat capacity,free energy of A lSi2O8Na5cluster in Fig.1(a)
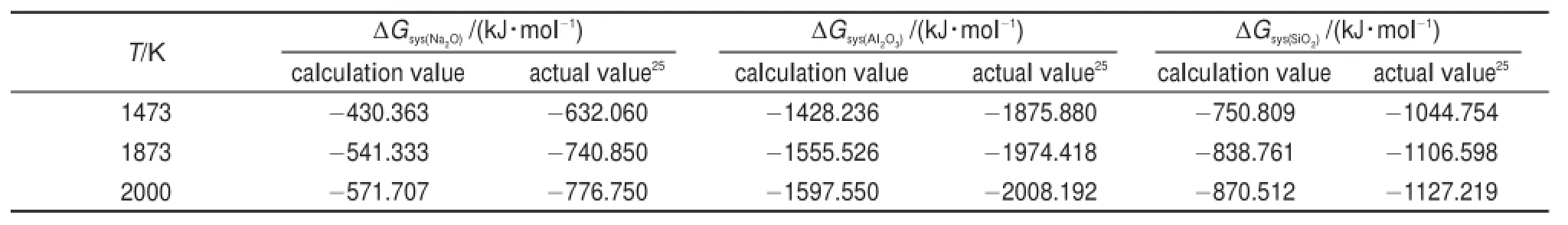
表1 归一化后的Li2O、Na2O和SiO2团簇的体系自由能Tab le1 Normalized freeenergy of Li2O,Na2O,and SiO2clusters
为计算Na2O-A l2O3-SiO2三元系团簇基元在高温下某一温度的混合自由能,从100到2000K中选取了硅酸盐熔体中常用的可用于比较的三个温度点,分别是1475、1875和2000K。为了确定纯物质Na2O、Al2O3和SiO2在1473、1873和2000K的自由能,从Na2O、SiO2和A l2O3的超晶胞中提取不同原子数的Na2O、SiO2和A l2O3团簇基元,结构优化后用半经验方法MNDO/d计算并将团簇基元的自由能归一化为单位摩尔分数的Na2O、SiO2和A l2O3,归一化的自由能分别用、和表示。选择Na2O、A l2O3和SiO2团簇基元自由能的相对低点分别记为Na2O、A l2O3和SiO2的稳定能级。并假设团簇基元的能级分布满足准连续近似,根据统计热力学波尔兹曼分布定律,通过式(3)将团簇基元的自由能转化为体系的平均自由能。
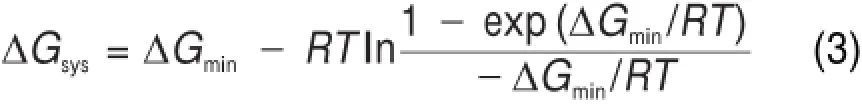
上式中ΔGmin和ΔGsys分别为团簇基元和体系的摩尔自由能,计算结果见表1。从表1中可以发现,纯物质Na2O、A l2O3和SiO2体系混合自由能的计算值要比实验值25普遍偏高,而且同一纯物质不同温度的计算值与实验值之间的差值几乎一样。说明目前采用VAMP模块计算物质的绝对能量存在系统误差。熔体的混合自由能是一个相对能量值,公式(4)中的各个项都是用同样的计算方法计算得出,系统误差在计算过程中会被抵消,对最后结果影响有限。
若以m Na2O∙n A l2O3∙p SiO2统一表示Na2OA l2O3-SiO2三元系团簇基元的组成(其中m、n和p分别为Na2O、A l2O3和SiO2的摩尔分数),则Na2OA l2O3-SiO2团簇基元的混合摩尔自由能可通过公式(4)归一化求得。Na2O-Al2O3-SiO2团簇基元的混合摩尔自由能计算如图3所示。
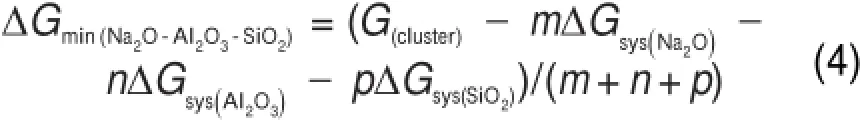
本工作是基于团簇模型作为熔体结构的基本假设。从Na2O-A l2O3-SiO2三元体系相图26(见图3)可知,编号为(g)、(h)、(j)、(l)和(m)的团簇模型所在成分点的材料在1473 K下并未熔解,因此会表现较大差异。但这五个团簇结构的成分点材料在1873和2000K高温下皆处于熔体状态,因此它们适用于1873和2000K下的模拟计算。
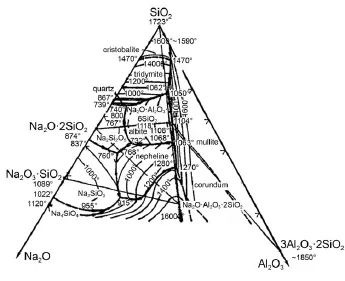
图3 Na2O-A l2O3-SiO2三元相图26Fig.3 Phasc diagram of Na2O-A l2O3-SiO226
团簇基元混合自由能的计算值如图4、图5和图6所示呈散点分布。通过将各成分的最低点筛选拟合出一个相对光滑且无奇点的光滑曲面(如图4中实线网格曲面),并称该曲面为团簇基元最低能量前沿(CULEF),这意味着该体系中不会存在一个团簇基元的混合自由能低于该曲面。处在CULEF曲面附近的团簇基元混合自由能较低,这些团簇基元在熔体中将会较稳定存在并且其分布权重也大。又由计算过程可知,由于团簇基元的混合自由能是通过差减得到的相对能量,有效地降低了因计算方法而带来的系统误差,因而更具有实际参考价值。
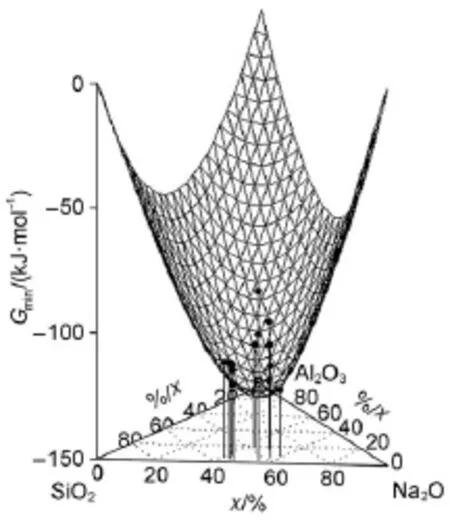
图4 Na2O-A l2O3-SiO2团簇基元在1473 K的混合自由能和其最低能量前沿Fig.4Mixing freeenergy of Na2O-A l2O3-SiO2cluster and cluster unit low est energy frontier CULEF at1473 K
从以上内容可知,团簇基元(f)、(g)、(h)、 (j)、(k)、(l)、(m)、(r)是最接近最低能量前沿CULEF曲面的团簇模型,因此它们是在高温下各自的成分点上的分布权重较大的团簇结构。而且我们得到了稳定团簇结构的同时,也得到了该三元体系的团簇结构在不同温度和成分下的最低混合自由能值。
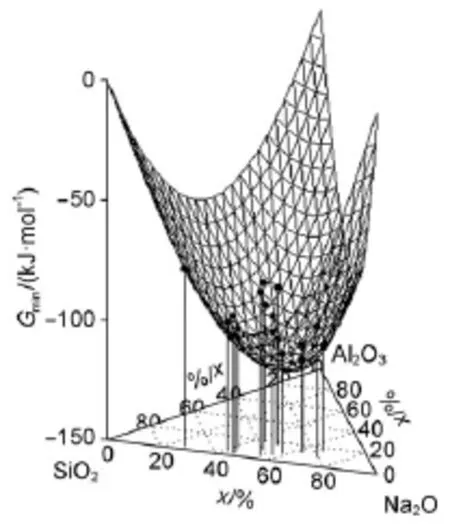
图5 Na2O-A l2O3-SiO2团簇基元在1873K的混合自由能和其最低能量前沿Fig.5Mixing freeenergy of Na2O-A l2O3-SiO2cluster and cluster unit lowestenergy frontier CULEF at1873K
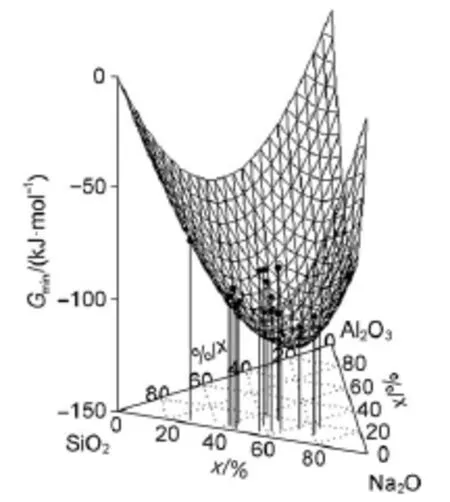
图6 Na2O-A l2O3-SiO2团簇基元在2000K的混合自由能和其最低能量前沿Fig.6Mixing freeenergy of Na2O-Al2O3-SiO2cluster and cluster unit lowest energy fron tier CULEF at 2000K
3.2Na2O-Al2O3-SiO2三元体系平均混合自由能
在较高的温度下,团簇基元的键长和键角会在一定范围内变化,这导致团簇基元的混合自由能发生连续变化。由此可知,团簇基元混合自由能的能级分布依然满足准连续近似,同样通过(3)式,可由最低能量前沿的混合自由能求得Na2OA l2O3-SiO2三元体系的平均混合自由能(如图7中的曲面)。Na2O-A l2O3-SiO2三元体系的平均混合自由能与HSC chem istry热学数据27进行对比,结果见图7。
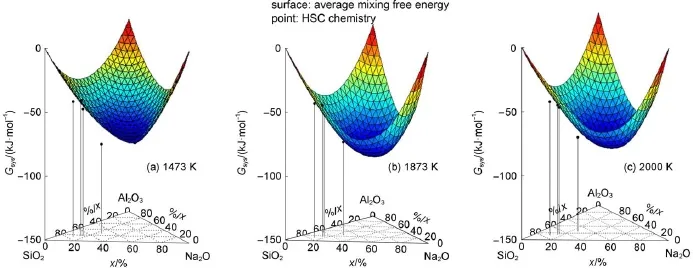
图7 Na2O-Al2O3-SiO2三元系在1473、1873和2000K的平均混合自由能和HSC chem istry热学数据的比较Fig.7 Com parison of averagem ixing freeenergy of Na2O-A l2O3-SiO2system with HSC chem istry data calculated at 1473,1873,and 2000K
从图7可以看出平均混合自由能和HSC chem istry热学数据有一定的误差,误差小于10%。1473 K下NaA lSiO4通过本工作计算得出的平均混合摩尔自由能与HSC计算值有较大的误差。原因是NaA l-SiO4在1473 K下仍未熔解(见图3),晶体状态下的NaAlSiO4的平均混合自由能显然比以计算熔体的方法模拟计算得到的平均混合自由能低。相反,在1473 K处于熔体状态的其他三个成分点计算得出的结果与HSC计算值吻合较好,并且在1873和2000K下处于熔体状态的NaA lSiO4的HSC计算值依然与本工作模拟计算得出的平均混合摩尔自由能吻合较好。这种差异恰恰验证了本工作模拟计算方法的合理性。
4 结论
通过分子模拟半经验量化计算,利用Materials Studio 5.5计算软件中半经验的MNDO/d计算方法计算得出Na2O-A l2O3-SiO2三元系的不同团簇基的熵、焓、热容和自由能随温度变化的能量曲线。进而计算得出Na2O-A l2O3-SiO2三元系不同的团簇基元的混合自由能,从而推导出该成分点在体系中的1473、1873和2000K的平均混合自由能。VAMP模块的计算方法仍存在系统误差,但是熔体的混合自由能是一个相对值,公式中的各个项都是用同样的计算方法计算得出,系统误差在这样的计算过程中会被消除掉,对混合自由能值没有太大的影响。Na2O-A l2O3-SiO2三元体系的平均混合自由能计算结果与HSC chem istry数据库的热学数据吻合较好,表明了Na2O-A l2O3-SiO2三元体系的热力学性能不仅与硅氧四面体的种类有关,而且与硅氧四面体的近邻连接情况和铝的配位数有关,即与硅酸盐的精细结构密切相关。搭建硅酸盐团簇模型需要预先了解硅酸盐熔融后的结构形态,掌握其高温特性。本研究工作表明团簇模型可以描述熔体中的微观结构及获取相关的热力学性能。
Refe ren ces
(1)Ma,X.C.;Yu,C.M.;Cheng,G.G.Journalof Iron and Steel Research 2011,5,3.[马小春,于春梅,成国光.钢铁研究学报,2011,5,3.]doi:10.3969/j.issn.1001-7208.2011.02.010
(2)Zhang,J.JournalofBeijing University of Iron and Steel Techno logy 1988,10,412.[张鉴.北京钢铁学院学报, 1988,10,412.]doi:10.13374/j.issn1001-053x.1988.04.023
(3)Lü,N.N.;Yu,J.K.;Su,C.;Wang,H.Z.Journalof Northeastern University Natural Science 2013,34(12),1743. [吕宁宁,于景坤,苏畅,王洪章.东北大学学报(自然科学版),2013,34(12),1743.]
(4)Mysen,B.O.;Lucier,A.;Cody,G.D.AmericanMineralogist 2003,88(11-12),1668.doi:10.2138/am-2003-11-1206
(5)Lin,P.;Pelton,A.Metallurgical TransactionsB 1979,10(4), 667.doi:10.1007/BF02662569
(6)Masson,C.Journalofthe American Ceramic Society1968,51 (3),134.doi:10.1111/jace.1968.51.issue-3
(7)Ottonello,G.JournalofNon-Crystalline So lids 2001,282(1), 72.doi:10.1016/S0022-3093(01)00330-1
(8)Zaitsev,A.I.;A rutyunyan,N.A.;Shaposhnikov,N.G.; Zaitseva,N.E.;Burtsev,V.T.Russ.J.Phys.Chem.2006,80(3),335.doi:10.1134/S0036024406030058
(9)Glibin,V.P.;King,P.L.Calphad-Comput.Coupling Ph. Diagrams Thermochem.2015,49,19.doi:10.1016/j. calphad.2015.02.001
(10)Neuville,D.R.;Corm ier,L.;Massiot,D.ChemicalGeology 2006,229(1),173.doi:10.1016/j.chemgeo.2006.01.019
(11)Yang,X.Y.;Vantomme,A.;Xiao,F.S.;Su,B.L.Catalysis Today 2007,128(3),123.doi:10.1016/j.cattod.2007.07.017
(12)Liu,Q.;You,J.L.;Wang,Y.Y.;Wang,C.Y.;Wang,J.;Liu,X. W.Spectroscopy and SpectralAnalysis 2013,10,31.[刘钦,尤静林,王媛媛,王晨阳,王静,刘晓伟.光谱学与光谱分析,2013,10,31.]doi:10.3964/j.issn.1000-0593(2013)10-2705-06
(13)Wang,Y.Y.;You,J.L.;Jiang,G.C.Chinese Journalof Inorganic Chemistry 2008,24(5),765.[王媛媛,尤静林,蒋国昌.无机化学学报,2008,24(5),765.]
(14)Wang,J.;You,J.L.;Wang,Y.Y.Journal ofSynthetic Crystals 2013,3,4.[王静,尤静林,王媛媛.人工晶体学报,2013,3, 4.]
(15)Wu,J.;Stebbins,J.F.JournalofNon-Crystalline Solids2010, 356(41),2097.doi:10.1016/j.jnoncrysol.2010.08.015
(16)You,J.;Jiang,G.;Hou,H.Isomorphic Representations of Hyperfine Structureof Binary Silicatesby Interior Stress, VibrationalWavenumber and Special Fractional Dimension.In JournalofPhysics:Conference Series;IOPPublishing Ltd.: Singapore2006;p 25.
(17)You,J.L.;Jiang,G.C.;Hou,H.Y.Journal ofRaman Spectroscopy 2005,36(3),237.doi:10.1002/jrs.1287
(18)Wang,W.;You,J.L.Thermodynam ic Calculation for LiO2-SiO2and Na2O-SiO2Binary MeltBased on Cluster Structure ModelofMolten Silicates.ShanghaiUniversity,Shanghai, 2009.[王威,尤静林.基于团簇结构模型的Li2O-SiO2、Na2O-SiO2二元系熔体的热力学性质计算[D].上海:上海大学,2009.]
(19)Park,S.Y.;Lee,S.K.Geochimica EtCosmochimica Acta 2014,147,26.doi:10.1016/j.gca.2014.10.019
(20)Neuville,D.;Cormier,L.;Ligny,D.American Mineralogist 2008,93(1),228.doi:10.2138/am.2008.2646
(21)You,J.L.;Wang,Y.Y.;Jiang,G.C.;Xie,J.;Yu,X.H.;Mo,X. X.Quantum Chemistry ab initio Calculation Study of Structure and Raman Spectraof A lum inosilicates.In Xxii InternationalConference on Raman Spectroscopy, Proceedingsof the AIPConference,Boston,America,Aug 8-13,2010;Champion,P.M.,Ziegler,L.D.Eds.;Elsevier: USA,2010.
(22)Segall,M.;Linda,P.;Probert,M.Materials Studio,Version 5.5;Accelrys:American,2010.
(23)Thiel,W.;Voityuk,A.A.Theoretica Chimica Acta 1992,81 (6),391.doi:10.1007/BF01134863
(24)Thiel,W.;Voityuk,A.A.The JournalofPhysicalChemistry 1996,100(2),616.doi:10.1021/jp952148o
(25)Farnan,I.;Stebbins,J.Journalofthe American Chemical Society 1990,112(1),32.doi:10.1021/ja00157a008
(26)Rui,L.PhysicalChemistry of Inorganic Materials;Chinese Construction Industry Press:Beijing,1986;p 194.[瑞伦.无机材料物理化学.北京:中国建筑工业出版社,1986:194.]
(27)Roine,A.HSCChemistry,Ver6.1;OutokumpuOy:Finland, 2002.
Molar Gibbs Mixing Free Energy Calcu lation for a Na2O-A l2O3-SiO2Ternary Melt Based on the Cluster Model
LIYong-Kang YOU Jing-Lin*WANG Jian WANG Min MA Nan WEIGuang-Chao
(State Key Laboratory ofAdvanced Special Steel,ShanghaiKey Laboratory ofAdvanced Ferrometallurgy, SchoolofMaterials Science and Engineering,ShanghaiUniversity,Shanghai200072,P.R.China)
Based on the clustermode lofmolten ternary silicates,the thermodynam ic properties,including entropy,enthalpy,and hea t capacity o f Na2O-A l2O3-SiO2a t 1473,1873,and 2000K w ere ca lculated by the modified neglecto fdifferentia loverlap(MNDO/d)sem i-em piricalmethod based on the prim itive assum ption of clusters in themelt.Themixing free energies of the Na2O-Al2O3-SiO2ternary system were derived.Them ixing free energy of the Na2O-Al2O3-SiO2ternary system is the sum ofa ll the clusterunits thatexistaccording to the Boltzmann distribution law.The thermodynam ic properties of this ternary silicate melt depend on its m icrostruc ture.
Na2O-A l2O3-SiO2;Cluste rmode l;Me lt;Mola rm ixing free ene rgy
1 引言
硅酸盐及含铝硅酸盐熔体的热力学性质一直是冶金、地学、玻璃和陶瓷等领域重要的研究课题之一。而对于硅酸盐的熔体热力学性质的研究,已经有文献分别从分子模型、分子离子共存模型、聚合模型等方面计算和讨论硅酸盐活度和组分之间的关系,进而利用活度求出热力学数据1-5。分子离子共存模型和聚合模型是应用比较广泛的两个热力学模型。分子离子共存理论模型最初是由前苏联丘意柯教授基于实验事实提出,张鉴2用此模型对二元硅酸盐熔体、三元硅酸盐熔体和熔盐做了验证。很多考虑到硅酸盐中的聚合反应的模型都应用到硅酸盐的热力学性质预测中并得到后续的发展,包括Lin和Pelton5,Masson6,Ottonello7,Zaitsev等8的研究。聚合模型是假设在给定的温度压强下各成分下的硅酸盐熔体由金属阳离子、离子氧化物和单元均衡分布聚合而成。关于硅酸盐聚合理论的研究已经扩展到三元体系当中。Glibin和King9基于当前对硅酸盐熔体结构的认识,以Guggenheim的准化学模型预测了二元体系的硅酸盐和铝硅酸盐的混合热力学函数,他们利用氧化物晶体、含氧分子和离子中已有的结构和热力学数据计算模型中所需的参数,计算结果与实验数据吻合较好。
September28,2015;Revised:December28,2015;Published onWeb:December28,2015.
O642
10.3866/PKU.WHXB201512281
*Corresponding author.Email:jlyou@163.com;Tel:+86-13331992297.
Theprojectwas supported by the Key Projectof NationalNatural Science Foundation of China(50932005),NationalNaturalScience Foundation of China(20973107,40973046),ShanghaiCommitteeof Scienceand Technology,China(12520709200),and CSIROMinerals Down Under Flagship of Australia.
国家自然科学基金重点项目(50932005),国家自然科学基金(20973107,40973046),上海科学技术委员会(12520709200)和澳大利亚Flagship的科学与工业研究组织CSIRO资助项目©Editorialofficeof Acta Physico-Chimica Sinica
