高产β-果糖基转移酶的米曲霉菌株的筛选及其产酶条件优化
2016-09-10刘成梅付桂明
高 斌,梁 露,李 娅,李 斌,刘成梅,付桂明,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2.南昌大学中德食品工程中心,江西南昌 330047; 3.南昌大学食品学院,江西南昌 330031)
高产β-果糖基转移酶的米曲霉菌株的筛选及其产酶条件优化
高斌1,2,3,梁露3,李娅3,李斌1,2,3,刘成梅1,2,3,付桂明1,2,3,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2.南昌大学中德食品工程中心,江西南昌 330047; 3.南昌大学食品学院,江西南昌 330031)
从本实验室保藏的6株米曲霉A-F01、A-F02、A-F03、A-F04、A-F05和 A-F06中,利用高效液相色谱HPLC-示差折光检测器RID测定6株米曲霉生物合成β-果糖基转移酶(β-FTase)酶活,筛选出高产β-果糖基转移酶的米曲霉菌株A-F04,并通过单因素实验和正交实验对其产酶发酵条件和培养基进行了优化。结果显示,影响发酵产酶因素的主次顺序为接种量、培养温度和转速;影响A-F04菌株发酵培养基组成因素的主次顺序为庶糖、酵母粉、pH、硫酸铵;确定了A-F04菌株最佳产酶条件,即培养基组成为0.4%(m/v)的蔗糖、0.15%(m/v)的酵母粉、0.15%(m/v)的硫酸铵和0.2%(m/v)的氯化钠,起始pH7.0,接种量为1.0%(v/v),培养时间为96 h,培养温度为35 ℃,转速为200 r/min,其β-FTase酶活力可达519.65 U/g,相比在发酵基础培养基和初始条件下的酶活466.25 U/g,提高了11.45%。
β-果糖基转移酶,米曲霉,高产菌株,条件优化
β-果糖基转移酶(β-fructosyltransferase,β-FTase,EC 2.4.1.9),能以蔗糖为反应底物,生成β-D-果糖残基和葡萄糖,β-D-果糖残基通过β-1,2-糖苷键再连接蔗糖,最终生成低聚果糖(fructooligosaccharides,FOS)[1-3]。FOS包括蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)[4]。FOS对改善肠道功能、防治便秘和腹泻、提高免疫力、促进矿物质吸收等具有特殊的生理功效[5-8],因此,FOS在医药、食品等开发应用市场潜力巨大[9]。自然条件下,从植物中获取FOS较为困难,且产量少,工业上主要用固定化酶β-FTase催化合成FOS[10-11]。研究表明,获取大量β-FTase酶和选育β-FTase分泌高的安全菌株成为促进FOS生产的关键之一。
杨正茂等[12]利用黑曲霉分泌表达β-FTase,然而黑曲霉一些次级代谢产物的食品安全性还存在争议[13]。研究发现,米曲霉(Aspergillusoryzae,A.oryzae)分泌和表达β-FTase能力较强,且具有极高的食品安全性,被美国FDA 认证为GRAS菌种之一[14-15]。对于利用米曲霉分泌表达β-FTase的研究近年来成为热点。目前有关米曲霉生物合成β-FTase的相关报道中,蒋波[16]和何小妮等[17]选用酶活为105.09 U/g原始米曲霉菌株,分别通过紫外-氯化锂复合诱变和利用非对称灭活双亲原生质体融合法选育产β-FTase的米曲霉新菌株,最终达到的酶活力分别为291.10 U/g和172.95 U/g。本实验以实验室保藏的6株米曲霉A-F01、A-F02、A-F03、A-F04、A-F05和 A-F06为研究对象,6株初始菌株的酶活均较高,在6株米曲霉菌种进一步对高产β-FTase米曲霉菌株进行了筛选,并对其产酶条件进行了研究,以期获得高产β-FTase的米曲霉菌株及其适宜的产酶条件,为工业化利用米曲霉发酵生产FOS提供一定的指导意义。
1 材料与方法
1.1材料与仪器
6株米曲霉:AspergillusoryzaeA-F01、A-F02、A-F03、A-F04南昌大学食品科学与技术国家重点实验室保藏;AspergillusoryzaeA-F05、A-F06江西中德联合研究院;酵母粉阿拉丁试剂,BR纯度;牛肉膏、蛋白胨北京奥博星,BR纯度;玉米浆新沂恒惠淀粉糖有限公司;琼脂粉上海山浦,BR纯度;乙腈西陇化工,HPLC级;低聚果糖日本WOKO,纯度≥99.9%;葡萄糖、蔗糖和果糖Sigma试剂,纯度≥99.0%;(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、NaOH、HCl、K2HPO4· 3H2O、磷酸氢二钠、柠檬酸等国产分析纯。
ZDX-35BI型座式蒸汽灭菌器上海申安医疗器械厂;LGJ-1冷冻干燥机北京亚泰科隆仪器技术有限公司;HWS-250型恒温恒湿培养箱上海森信实验仪器有限公司;ZHWY-2102C型恒温培养振荡器上海智诚分析仪器制造有限公司;SHZ-D(Ⅲ)型循环水式真空泵巩义市英峪予华仪器厂;LC-1260型高效液相色谱仪、示差折光检测器美国安捷伦公司;TGL-16B型高速离心机美国热电。
1.2实验方法
1.2.1生长曲线的建立采用菌丝体湿重法建立米曲霉的生长曲线。配制固态发酵基础培养基于121 ℃高压蒸汽灭菌30 min,分装试管冷却后制成斜面备用。用接种环接种6株米曲霉孢子,斜面划线,30 ℃恒温恒湿静置培养3 d后,用灭菌生理盐水洗脱斜面,制备米曲霉孢子悬浮液,孢子悬浮液倒入100 mL含有灭菌玻璃珠的三角瓶中,充分摇匀后用血球计数板计数。分别以1%(v/v)的接种量接种6株米曲霉孢子悬浮液,30 ℃、150 r/min培养0~5 d。将培养时间为0、24、48、60、72、84、96、120 h的米曲霉菌丝体抽滤至恒重,收集菌丝体并称重,确定生物量,菌丝体液氮研磨后冻干。
1.2.2粗酶液的制备称取冻干后的6株各个不同培养时间段的米曲霉菌粉0.2 g,用5 mL磷酸氢二钠-柠檬酸缓冲液(pH6.0)重悬,10000 r/min 4 ℃离心10 min,吸取上层清液,过0.22 μm的水系灭菌微孔滤膜,收集滤液,即为粗酶液。
1.2.3酶活测定用磷酸氢二钠-柠檬酸缓冲液(pH6.0)配制25%的蔗糖溶液,分装至100 mL锥形瓶中,于48 ℃预热30 min,分别加入6株米曲霉粗酶液5 mL于锥形瓶中。将反应体系置于恒温水浴振荡培养箱中,48 ℃、150 r/min条件下反应1 h,沸水浴15 min终止反应,离心取上清液制备样品。酶活定义如下[18]:48 ℃条件下,每分钟催化蔗糖产生1 μmol蔗果三糖GF2所需的酶量定义为一个酶活单位(U)。每克菌粉酶活力H=(GF2×106)/(504.44×t×m),其中,GF2为蔗果三糖生成量,g;t为反应时间,min;m为反应菌粉质量,g。
1.2.4HPLC检测条件检测器:安捷伦1260示差折光检测器;色谱柱:Waters Spherisorb 5.0 μm NH2,4.6 mm×250 mm;流动相:乙腈-水(80∶20,V/V),流速1.0 mL/min;柱温:40 ℃;进样量:10 μL。分别配制果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖和蔗果五糖标准液,分别单个标准品进样,确定6种糖类出峰时间。由于β-FTase在高浓度蔗糖下催化反应主要生成蔗果三糖,因此仅对蔗果三糖标准曲线进行绘制:精确配制100 mg/mL蔗果三糖标准液,超纯水稀释至0~100 mg/mL之间的不同浓度梯度的蔗果三糖标准液,HPLC示差折光检测其峰面积,根据峰面积进行定量。
1.2.5高产β-FTase菌株产酶条件优化
1.2.5.1菌株的发酵条件优化以高效液相HPLC酶活测定结果,确定高产β-FTase米曲霉菌株。
本研究以前期探究出的发酵基础培养基(酵母粉1 g,(NH4)2SO42 g,蔗糖3 g,NaCl 2 g,蒸馏水定容至1 L,自然pH)为出发,按照初始菌液0.5%、1.0%、2.0%、5.0%和10.0%的接种量在30 ℃,150 r/min发酵培养96 h,测定产β-FTase酶活,探究接种量对产酶的影响;得到最佳接种量后,继续探究菌体在25、30、35、37、40 ℃温度下,按照最佳接种量、150 r/min摇床培养96 h,测定其产β-FTase酶活大小,探究温度对产酶的影响;得到产酶最佳培养温度后,继续探究菌体在100、125、150、175、200、250 r/min转速下,在最佳接种量、最佳培养温度条件下摇床培养96 h,探究转速对产酶的影响。
以接种量、温度、转速为因子,采用L9(34)正交实验对发酵条件进行优化,因素水平表见表1。在所得的最佳发酵条件下进行3次验证实验,检查结果的重现性。
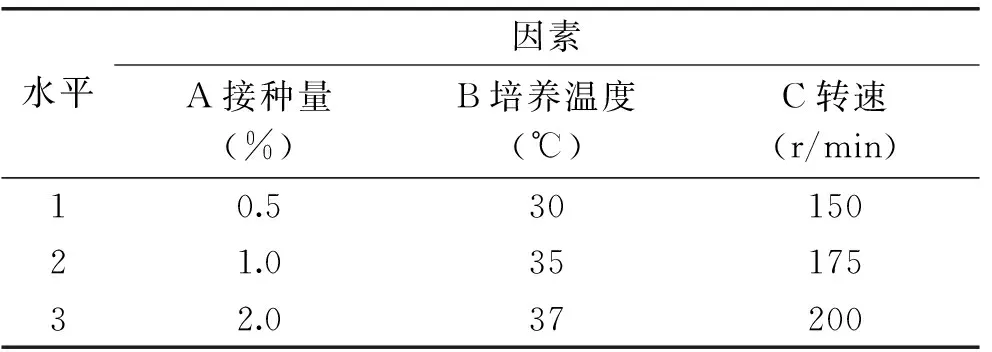
表1 发酵条件正交实验因素水平表
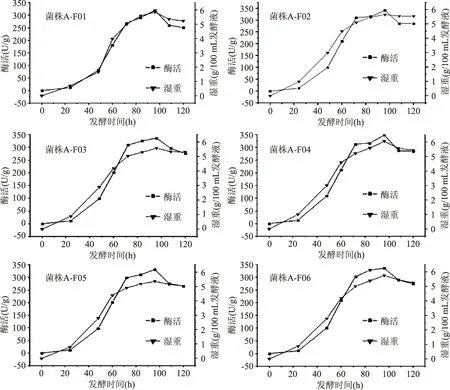
图1 6株菌不同发酵时间的β-FTase酶活和生物量Fig.1 β-FTase enzyme activity and biomass of 6 strains during different fermentation period
1.2.5.2菌株培养基的优化以最佳发酵条件(最佳接种量、温度和转速)为基础,探究四种不同的0.3%(m/v)碳源(淀粉、蔗糖、果糖和葡萄糖)对产酶的影响,并以此出发探究产酶最高的碳源浓度为0.1%、0.2%、0.4%、0.5%、0.8%、1.0%时对产酶的影响;以最佳发酵条件和最佳浓度的碳源为不变因素,探究四种不同的0.1%(m/v)的有机氮源(蛋白胨、酵母粉、玉米浆和牛肉膏)对产酶的影响,并以此出发探究最佳有机氮源浓度为0.05%、0.08%、0.10%、0.15%、0.20%时对产酶的影响;以最佳发酵条件、最佳浓度的碳源和最佳浓度的有机氮源为不变因素,探究四种不同的0.2%(m/v)的无机氮源(氯化铵、硫酸铵、硝酸铵和硝酸钠)对产酶的影响,并以此出发探究最佳无机氮源浓度为0.1%、0.15%、0.20%、0.25%时对产酶的影响;以最佳发酵条件、最佳浓度的碳源、最佳浓度的有机氮源和无机氮源为不变因素,探究不同起始pH(5.0、5.5、6.0、6.5、7.0、7.5和8.0)的培养基对产酶的影响。
以碳源、有机氮源、无机氮源和pH为因子,采用L9(34)正交实验对最佳培养基成分进行优化,因素水平见表2。在所得的最佳发酵条件和培养基下进行3次验证实验,检查结果的重现性。

表2 培养基正交实验因素水平表
1.3数据分析
本文中菌株产酶条件优化、高效液相测定菌株酶活等所有实验均重复3次,采用Origin 9.1和SPSS 16.0对实验数据进行统计分析,样品平均值之间的差异性通过Duncan法比较(p<0.05)。
2 结果与分析
2.16株米曲霉菌株产β-FTase能力分析
2.1.1蔗果三糖标曲的绘制在高浓度的蔗糖反应液中,β-FTase催化蔗糖主要生成蔗果三糖,因此测定蔗果三糖浓度即可反映β-FTase催化能力。以蔗果三糖标准品含量(x)为横坐标,该检测条件下信号的峰面积(y)作为纵坐标,得到的回归线性方程为y=103143x-24416,R2=0.9994,在其浓度为0~60 mg/mL内,蔗果三糖浓度与信号峰面积呈良好的线性关系。
2.1.2米曲霉生长曲线和产酶曲线抽滤米曲霉发酵菌球,获取菌丝体湿重。测定6株米曲霉在不同时间段(0、24、48、60、72、84、96和120 h)的酶活大小(三组平行样),结果(图1)可知,6株米曲霉在发酵时间为96 h时,生物量和酶活均最大,其中菌株A-F04生物达到(6.04±0.03)g,且6株菌均在对数生长期时酶活增加最快,在稳定期时酶活最高,趋于稳定。因此,选择发酵96 h的6株米曲霉作为酶活对比的时间点。
2.1.3高产β-FTase的米曲霉菌株的筛选利用HPLC-RID测定6株米曲霉发酵96 h的菌丝体酶活,计算GF2的量和酶活大小,结果见图2。可知米曲霉A-F04生成的GF2量为28.22 mg/mL,具有最高的酶活466.25 U/g。根据6株米曲霉在同等条件下的生物量和酶活测定结果,可知菌株A-F04是高产β-FTase菌株,因此选择米曲霉菌株A-F04为基础,进一步对其产酶条件研究。
2.2高产β-FTase米曲霉菌株A-F04产酶条件的优化
2.2.1米曲霉A-F04发酵条件的优化
2.2.1.1不同接种量对产酶的影响不同接种量对产酶的影响结果见图3。分析结果可知,1.0%的接种量对应的酶活最高,为284.77 U/g;接种量从0.5%增加到1.0%时,酶活呈现出增加的趋势,说明一定程度上,增加接种量可以提高酶的表达;而当接种量从1.0%增加到10.0%时,酶活呈现下降的趋势,说明接种量增加到一定程度反而不利于酶的表达。结果表明接种量过大或者过小都会影响酶活大小,其可能原因是接种量过大,营养供应不足;接种量过小,总菌体增长较慢从而使分泌的酶的酶活降低。
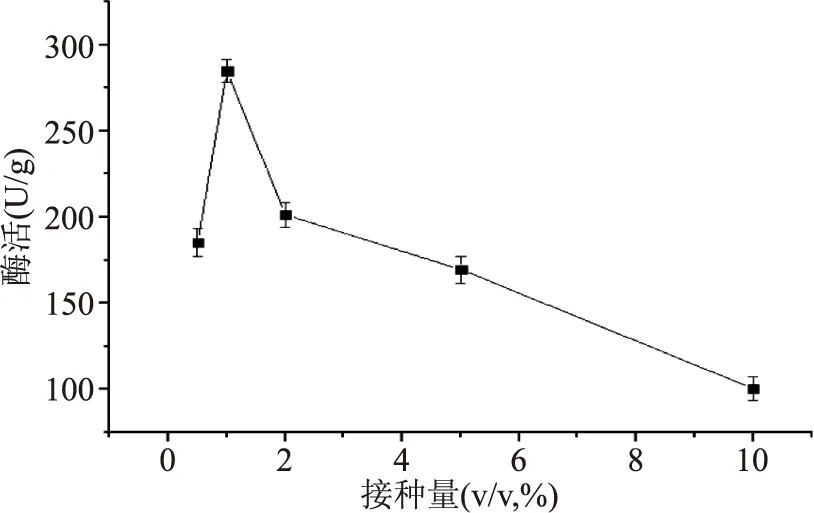
图3 接种量对产酶的影响Fig.3 β-FTase enzyme activity in different inoculum concentration
2.2.1.2不同培养温度对产酶的影响不同培养温度对产酶的影响结果见图4。分析结果可知,35 ℃条件下对应的酶活最高,为312.54 U/g;当温度从25 ℃增加到35 ℃时,酶活呈现增加的趋势,说明一定程度上,提高培养温度可以提高酶的表达;而当温度大于35 ℃时,酶活呈现出下降的趋势,说明温度过高不利于酶的表达。结果表明温度过高或者过低都会影响酶活,其原因是菌体需要在最适温度下,产酶能力相对较高。
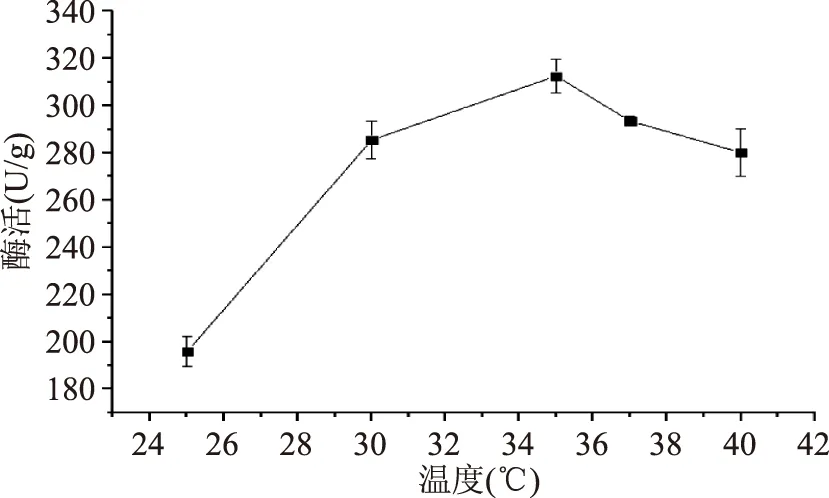
图4 温度对产酶的影响Fig.4 β-FTase enzyme activity in different temperature
2.2.1.3不同转速对产酶的影响不同转速对产酶的影响结果如图5。分析结果可知,转速为200 r/min对应的酶活最高,为390.65 U/g;当转速从100 r/min增加到200 r/min时,酶活呈现出增加的趋势,说明一定程度上,提高转速可以提高酶的表达;而当转速大于200 r/min时,酶活呈现出下降的趋势,说明转速过快不利于酶的表达。结果表明转速过大或者过小对产酶都有影响,其原因是菌体属于好氧菌,生长需要适宜的O2浓度,转速会影响O2浓度大小。

图5 转速对产酶的影响Fig.5 β-FTase enzyme activity in different rotation rate
2.2.1.4正交实验结果正交实验结果见表3,方差分析结果见表4。

表3 发酵条件正交实验结果

表4 发酵条件的方差分析
由表3和表4可知RA>RB>RC,即影响米曲霉A-F04菌株产β-FTase的主次顺序为:接种量>培养温度>转速。根据各因素不同水平的K值大小,可知米曲霉A-F04产β-FTase的发酵条件优组合为A2B2C3,即培养时间为96 h,接种量为1%,培养温度为35 ℃,转速为200 r/min。表4方差分析表明3个因子的影响均不显著。对正交实验所得的最佳产酶发酵条件组合进行3批次产酶培养验证,菌体的酶活分别为(495.47±3.87)、(496.11±1.68)、(494.28±3.66) U/g,平均值为495.29 U/g,实验结果具有较好的重现性。
2.2.2米曲霉A-F04发酵培养基优化
2.2.2.1碳源对发酵产酶的影响在最佳发酵条件下,培养基中的不同碳源对发酵产酶的影响结果见图6-A。图6-A结果表明,蔗糖为碳源时,酶活最高,达到469.87 U/g,可能原因是蔗糖对β-FTase酶的产生有一定的诱导效果,故确立蔗糖最佳碳源。探究了不同浓度的蔗糖对产酶的影响,其酶活测定结果见图6-B,可知蔗糖浓度为0.4%时,酶活最高,达到496.87 U/g。
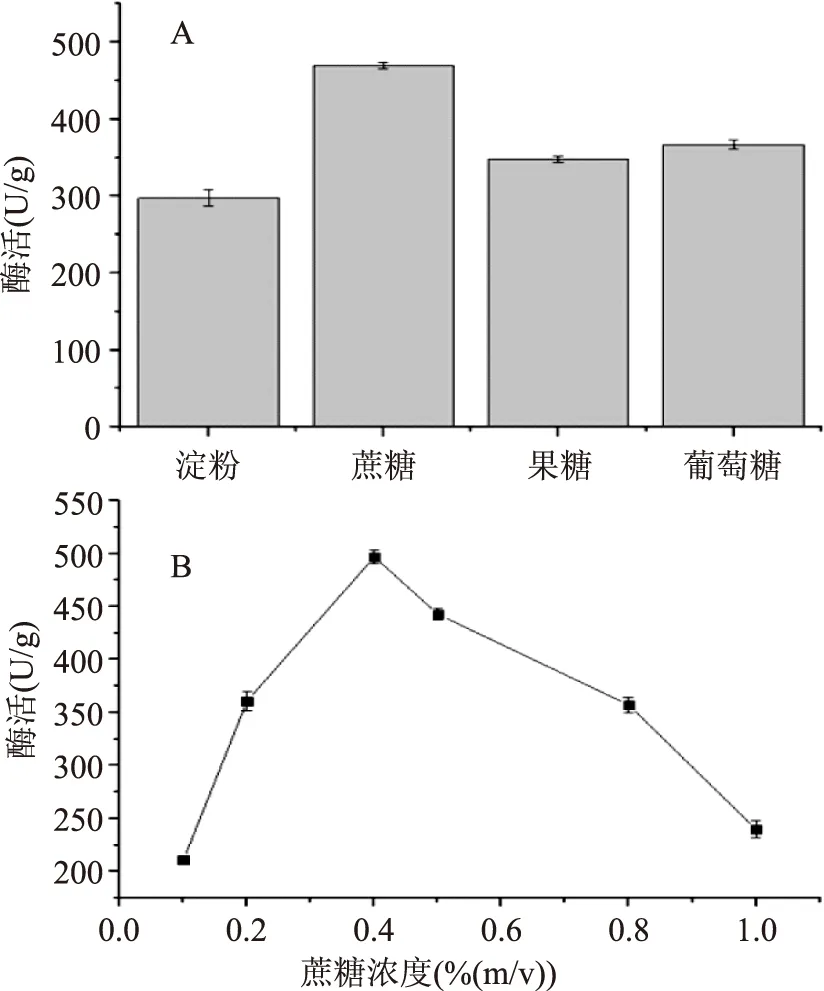
图6 最佳碳源和蔗糖浓度对产酶的探究Fig.6 β-FTase enzyme activity in different carbon source and sucrose concentration
2.2.2.2氮源对发酵产酶的影响在最佳发酵条件下,培养基中不同的有机氮源对发酵产酶的影响结果见图7-A。图7-A表明,酵母粉为有机氮源时,酶活最高。故确立酵母粉为最佳有机氮源。以此出发,探究酵母粉不同浓度。由图7-B可知酵母粉浓度为0.15%时,酶活最高,达到512.7 U/g。

图7 最佳有机氮源和酵母粉浓度对产酶的探究Fig.7 β-FTase enzyme activity in different organic nitrogen source and yeast extract concentration
在最佳发酵条件下,培养基中不同的无机氮源对发酵产酶的影响结果见图8。图8-A表明,硫酸铵为无机氮源时,酶活最高。故确定硫酸铵为最佳无机氮源。以此出发,探究不同浓度的硫酸铵对产酶的影响,酶活测定结果见图8-B,可知硫酸铵浓度为0.15%时,酶活最高。

图8 最佳无机氮源和硫酸铵浓度对产酶的探究Fig.8 β-FTase enzyme activity in different inorganic nitrogen source and ammonia sulfate concentration
2.2.2.3起始pH对发酵产酶的影响在最佳发酵条件下,培养基中的不同起始pH对发酵产酶的影响结果见图9,分析结果可知,培养基起始pH过高或过低都会对酶活会产生影响,pH为7.0时,产酶效果最好,酶活达到519.65 U/g。

图9 不同起始pH对产酶的影响Fig.9 β-FTase enzyme activity in different initial pH
2.2.2.4优化培养基的正交实验结果正交实验结果见表5,方差分析见表6。
由表5可知,各因素影响米曲霉A-F04菌株发酵产酶的主次顺序为:A>B>D>C。由表6可知ABDC四因素对菌株A-F04产酶影响不显著。因此,米曲霉A-F04菌株产β-FTase的最佳培养基组成为A2B2D2C1,即0.4%的蔗糖为碳源,0.15%的酵母粉为有机氮源,培养起始pH为7.0,0.15%的硫酸铵为无机氮源。对正交实验所得的最佳产酶培养基组合进行3批次产酶培养验证,酶活分别为(514.17±3.17)、(516.78±3.66)、(517.02±1.29)U/g,平均值为515.99 U/g,实验结果具有较好的重现性。
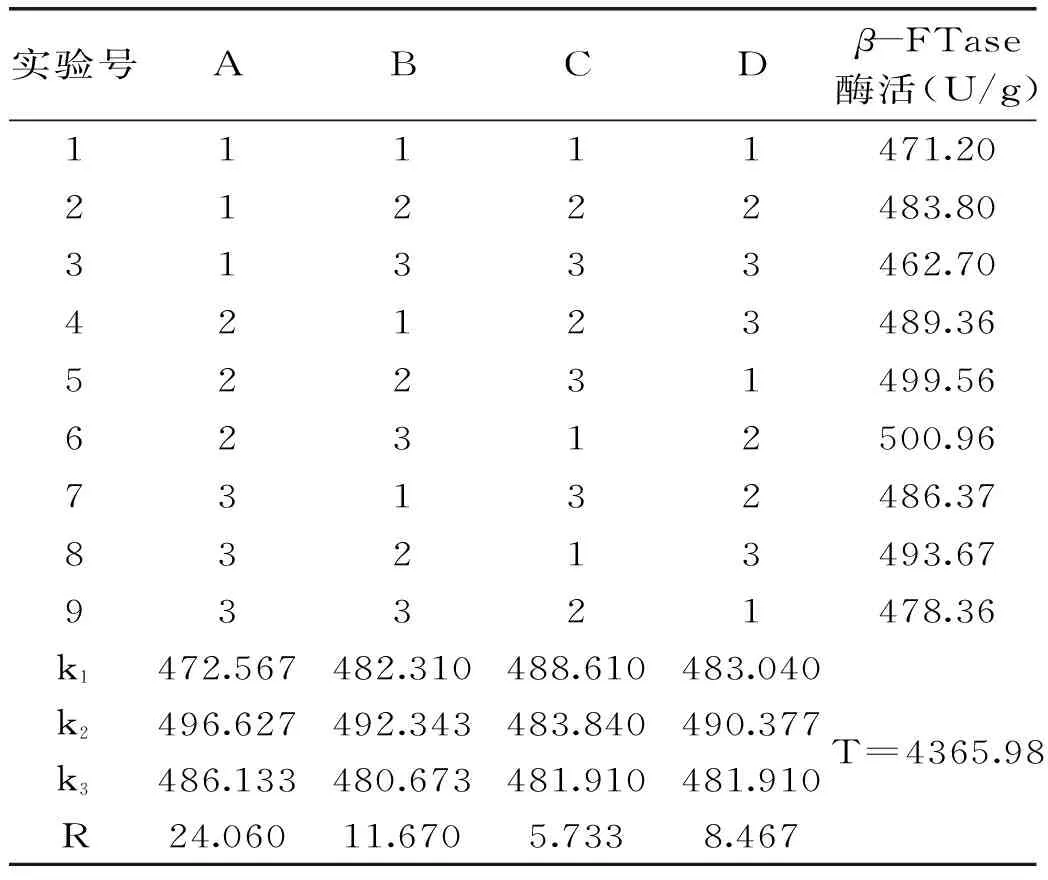
表5 培养基正交实验结果
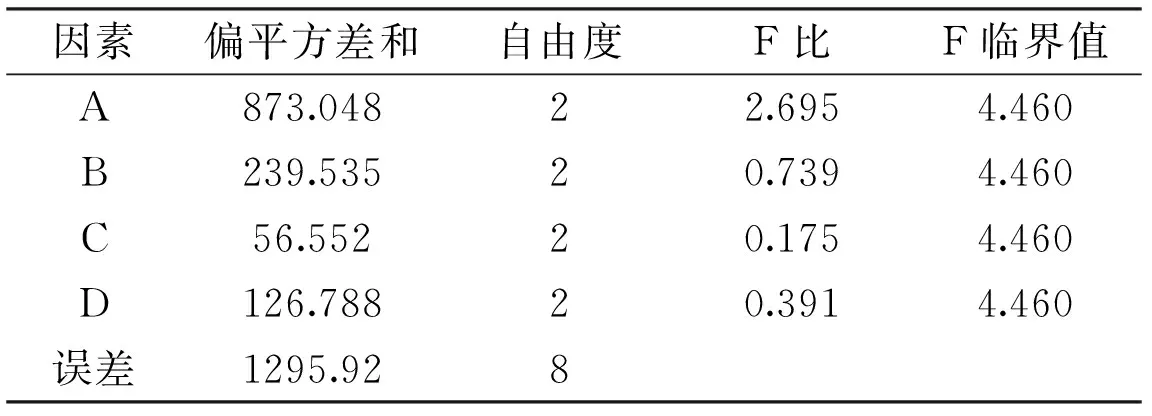
表6 培养基的方差分析
3 结论
通过实验,鉴定出了6株米曲霉都具有产β-FTase能力,且筛选出了米曲霉A-F04为高产β-FTase菌株,确定了米曲霉A-F04产β-FTase的最佳产酶条件,即在0.4%的蔗糖为碳源,0.15%的酵母粉为有机氮源,培养起始pH为7.0,0.15%的硫酸铵为无机氮源的基础发酵培养基中,接种量为1.0%,培养时间为96 h,培养温度为35 ℃,转速为200 r/min,具有较高的酶活力519.65 U/g,相比在发酵基础培养基和初始条件下的酶活466.25 U/g,提高了11.45%。同时测定了该条件的菌丝体湿重达到(6.04±0.03)g,说明米曲霉A-F04菌株在此条件下不仅生物量较高,而且具有较高的产酶能力。本研究结果表明,米曲霉A-F04是一株具有进一步改造利用价值的产β-FTase的米曲霉菌株,但所产β-FTase的酶学性质以及能否理想扩大至工业上生产应用有待进一步研究。
[1]毛多斌,王雪. 果糖基转移酶及低聚果糖生产研究进展[J]. 广东化工,2009,36(4):100-102.
[2]Chiang C J,Lee W C,Sheu D C,et al. Immobilization ofβ-Fructofuranosidases from Aspergillus on Methacrylamide-Based Polymeric Beads for Production of Fructooligosaccharides[J]. Biotechnology Progress,1997,13(5):577-582.
[3]覃益民,唐江涛,苏加坤,等. 米曲霉 GX0011β-果糖基转移酶的性质研究[J]. 食品工业科技,2007,28(5):123-126.
[4]Ruekjumnong R,Ngampanya B,Khuwijitjaru P,et al. Functional prebiotic activity of inulin and fructooligosaccharides[J]. Journal of Food Science and Agricultural Technology(JFAT),2015,1(1):149-151.
[5]OHTA A,OHTUKI M,TAKIZAWA T,et al. Effects of fructooligosaccharides on the absorption of magnesium and calcium by cecectomized rats[J]. International Journal for Vitamin and Nutrition Research,1994,64(4):316-323.
[6]Molis C H,Flourie B,Ouarne F,et al. Digestion,excretion,and energy value of fructooligosaccharides in healthy humans[J]. The American Journal of Clinical Nutrition,1996,64(3):324-328.
[7]Costa G T,Abreu G C,Guimarães A B B,et al. Fructo-oligosaccharide effects on serum cholesterol levels. An overview[J]. Acta Cirurgica Brasileira,2015,30(5):366-370.
[8]Vega R,Zuniga-Hansen M E. The effect of processing conditions on the stability of fructooligosaccharides in acidic food products[J]. Food Chemistry,2015,173:784-789.
[9]Spiegel J E,Rose R,Karabell P,et al. Safety and benefits of fructooligosaccharides as food ingredients[J]. Food Technology,1994,48(1):85-89.
[10]Lorenzoni A S G,Aydos L F,Klein M P,et al. Continuous production of fructooligosaccharides and invert sugar by chitosan immobilized enzymes:comparison between in fluidized and packed bed reactors[J]. Journal of Molecular Catalysis B:Enzymatic,2015,111:51-55.
[11]Mouelhi R,Abidi F,Marzouki M N. An improved method for production of fructooligosaccharides by immobilizedβ-fructofuranosidase from Sclerotinia sclerotiorum[J]. Biotechnology and Applied Biochemistry,2015,28(6),38-42.
[12]杨正茂,秦克亮.β-果糖基转移酶和β-呋喃果糖苷酶的分离纯化[J]. 中国医药工业杂志,2002,33(5):219-223.
[13]梁志宏,黄昆仑,何云龙,等. 黑曲霉及其食品安全领域的赭曲霉毒素问题[J]. 食品科技,2008,33(10):191-194.
[14]Kobayashi T,Abe K,Asai K,et al. Genomics of Aspergillus oryzae[J]. Bioscience Biotechnology and Biochemistry,2007,71(3):646.
[15]刘丽萍,刘丽华. 米曲霉研究进展与应用[J]. 中国调味品,2008(4):28-32.
[16]蒋波.高活力果糖基转移酶的菌种选育及生产工艺优化研究[D].广州:华南理工大学,2014.
[17]何小妮,蒋波,王玉海,等. 非对称灭活双亲原生质体融合法选育产果糖基转移酶的米曲霉新菌株的研究[J]. 现代食品科技,2013,29(5):993-997.
[18]李秀英,黄金凤,冼燕萍,等. 食品中低聚果糖的检测方法研究进展[J]. 乳业科学与技术,2014,37(3):32.
Screening and identification of efficientβ-fructosyltransferase-producingAspergillusoryzaeand optimization of the fermentation condition
GAO Bin1,2,3,LIANG Lu3,LI Ya3,LI Bin1,2,3,LIU Cheng-mei1,2,3,FU Gui-ming1,2,3,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China; 2.Sino-German Food Engineering Center,Nanchang University,Nanchang 330047,China;3.Food Science and Technology College,Nanchang University,Nanchang 330031,China)
6β-fructosyltransferase-producingAspergillusoryzaestrains were activated and cultured at shake flask fermentation. In this study,high efficiency liquid chromatography technology was applied to gauging the enzyme activity ofβ-fructosyltransferase,and the enzyme activity ofβ-fructosyltransferase produced by 6 differentAspergillusoryzaestrains were contrasted,in order to screening the efficientβ-fructosyltransferase-producingAspergillusoryzaestrains. Thus,experiments of single factor and orthogonal tests were done to optimize the fermentation condition. Experimental results showed that the influencing factors of fermentation were temperature,inoculum concentration,rotation rate,sucrose concentration,yeast extract concentration,initial pH and ammonia sulfate concentration. The optimum condition for higherβ-fructosyltransferase were determined:cultured in the medium of 0.4%(m/v)sucrose,0.15%(m/v)yeast extract,0.2%(m/v)NaCl,0.15%(m/v)ammonia sulfate,initial pH7.0,inoculum concentration 1.0% under 35 ℃,200 r/min in shake cultures for 96 h. Maximalβ-fructosyltransferase activity of A-F04 was 519.65 U/g,increasing 11.45% enzyme activity compared with the original fermentation condition(466.25 U/g).
β-fructosyltransferase;Aspergillusoryzae;efficient expressing strain;optimizing
2015-10-26
高斌(1991-),男,硕士研究生,研究方向:发酵工程,E-mail:820839790@qq.com。
付桂明(1972-),男,博士,教授,研究方向:天然产物、发酵食品研究,E-mail:fuguiming@ncu.edu.cn。
食品与技术国家重点实验室自由探索课题(SKLF-22B-201313)。
TS203.1
A
1002-0306(2016)10-0224-07
10.13386/j.issn1002-0306.2016.10.037
