姜黄精油的抗氧化活性研究
2016-09-10苏海兰张溪桐
魏 娟,苏海兰,张溪桐,毕 阳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
姜黄精油的抗氧化活性研究
魏娟,苏海兰,张溪桐,毕阳*
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
姜黄为姜科姜黄属的多年生草本植物,是一种药食两用材料。采用水蒸汽蒸馏法提取了姜黄精油,研究了其对ABTS+自由基、羟自由基的清除率及其抑制亚油酸脂质过氧化的能力,通过MTS法研究了其对HepG2细胞的细胞毒作用,采用流式细胞技术评估了其在细胞水平的抗氧化能力。结果表明:姜黄精油对ABTS+自由基具有良好的清除效果,但其清除能力低于VE;对羟自由基的清除效果非常明显,与VE的清除能力相当;并且能有效抑制亚油酸脂质过氧化。姜黄精油在0.02%(v/v)浓度范围内没有明显的细胞毒作用,在此浓度范围内能有效清除HepG2细胞内的活性氧。由此表明,姜黄精油具有开发为安全天然的食品抗氧化剂的潜力。
姜黄,精油,抗氧化
精油是植物的次生代谢产物,分子量小,可随水蒸汽蒸出,一般由几十种甚至几百种化合物组成。由于其成分复杂,具有多种生物学活性,被广泛应用于食品、化妆品及制药行业[1]。多种精油具有明显的抗氧化活性,Goze等发现,1 g/L刺山柑和海茴香精油可以抑制脂质过氧化,其效果与2,6-二叔丁基甲酚(BHT)类似[2]。Mechergui等发现,牛至精油可有效清除DPPH自由基,具有良好的抗氧化活性[3]。另外,异株百里香和拟百里香精油对羟基自由基也具有较好的清除效果[4]。
姜黄(CurcumalongaL.)为姜黄属的多年生草本植物,在亚洲地区分布广泛,我国和印度为主产国。姜黄可药食两用,作为中药,具有活血降压、驱寒消炎、抗癌等功效,另外由于其色泽鲜艳、着色力强、热稳定性好而在食品工业中被广泛用作天然着色剂[5]。姜黄的主要活性成分是姜黄素和精油。姜黄精油主要由芳姜黄酮、姜黄酮、姜黄烯、没药烯、梓檬烯、倍半水斧烯、莪术醇、莪术二酮及桉油精等成分构成[6]。有报道指出,姜黄精油具有抗肿瘤、抗突变、抑菌的功效。姜黄精油可以有效抑制人急性早幼粒白细胞(HL-60)和肝癌细胞(HepG2)的增殖[7],保护细胞免受损伤又能促使已突变细胞的DNA修复[8],还可抑制黄曲霉的生长及其毒素的产生[9]。但关于姜黄精油的抗氧化活性还未见报道。
本研究以姜黄为原料,采用水蒸汽蒸馏法提取姜黄精油,在生化水平研究姜黄精油对ABTS+自由基、羟自由基的清除效果及其抑制亚油酸脂质过氧化的能力,在细胞水平研究姜黄精油对HepG2细胞的细胞毒作用及其对细胞内活性氧的清除效果,以期为姜黄精油作为一种天然抗氧化剂的开发应用提供理论依据。
1 材料与方法
1.1材料与仪器
姜黄2014年7月购自甘肃省兰州市安宁区黄河药材市场;人肝癌HepG2细胞株上海拜力生物有限公司;DMEM、FBS、0.25%胰酶(含EDTA,比活力(250 U/mg)Hyclone公司;MTSPromega公司;DPPH、ABTS、TPTZ、DCFH-DA、VESigma-Aldrich公司;其余试剂均为国产分析纯。
CN69M/FW80型高效样品粉碎机北京中西远大科技有限公司;水蒸汽蒸馏装置常州普天仪器制造有限公司;15284型iMARK多功能酶标仪美国BIO-RAD公司;UV-2450型可见-紫外分光光度计日本岛津公司;移液器德国Eppendorf公司;GC6890N/MS5973N型气相色谱/质谱联用仪、HP-5 ms气相色谱毛细管柱(30 m×0.25 mm,0.25 μm)安捷伦科技有限公司;BD FACSCanto II型流式细胞仪美国 BD Biosciences。
1.2实验方法
1.2.1姜黄精油的提取参照Singh等的方法[10],采用水蒸汽蒸馏法以料液比为1/10对姜黄粉末进行蒸馏,冷凝水冷凝收集精油粗提液后经无水乙醚萃取、无水硫酸钠干燥,最后用旋转蒸发仪除去溶剂获得姜黄精油,避光保存于4 ℃冰箱中备用。
1.2.2HepG2细胞培养配制含10%小牛血清的DMEM细胞培养液,将人肝癌HepG2细胞株加入细胞培养液中置于含5% CO2的37 ℃细胞培养箱中培养2~3 d。
1.2.3姜黄精油对ABTS+自由基的清除能力测定参照Chun等的方法[11]。将ABTS+水溶液与过硫酸钾溶液配制成ABTS+储备液。使用前将ABTS+储备液用无水乙醇稀释得到ABTS+工作液并于室温避光保存。用无水乙醇分别配制浓度为2.0、4.0、6.0、8.0、10.0 mg/mL的姜黄精油样品溶液,以抗氧化剂VE溶液(2.0、4.0、6.0、8.0、10.0 mg/mL)作为阳性对照溶液。将1.9 mL ABTS+工作液与0.1 mL样品溶液混合均匀,暗处反应4 min,于734 nm处测定吸光度值A。用无水乙醇替代样品溶液,于734 nm处测定吸光度值A0。ABTS自由基清除率计算公式为:
清除率(%)=(A0-A)/A0×100
1.2.4姜黄精油对羟自由基的清除能力测定参照刘骏的方法[12]。用无水乙醇分别配制浓度为1.0×10-3mg/mL的姜黄精油溶液和VE溶液作为样品液。在10 mL比色管中分别加入0.3 mL 0.4 mmol/L 结晶紫溶液、0.6 mL 2.0 mmol/L过氧化氢溶液以及1.2 mL 1.0 mmol/L硫酸亚铁溶液。用pH=4.0磷酸柠檬酸缓冲液将上述溶液定容至10 mL,静置0.5 h后,在580 nm处测其吸光度Ab。在上述体系加过氧化氢之前分别加入0.1、0.2、0.3、0.4、0.5 mL的样品液,测定其吸光度As,按下式公式计算清除率:
清除率(%)=(As-Ab)/(A0-Ab)×100
其中:A0为上述体系中加入0.3 mL 0.4 mmol/L结晶紫溶液、1.2 mL 1.0 mmol/L硫酸亚铁溶液,不加过氧化氢,再用pH=4.0磷酸柠檬酸缓冲液定容至10 mL,测出580 nm处的吸光度值。平行测定三次,取平均值。
1.2.5姜黄精油抑制亚油酸过氧化能力测定参照Zainola等的方法[13]。用无水乙醇分别配制4 mg/mL的姜黄精油溶液、VE溶液作为样品液。取4 mL样品液,加入4.1 mL 2.5%亚油酸(v/v),8 mL 磷酸缓冲液(pH=7.0),3.9 mL蒸馏水,放于40 ℃恒温下培养。取上述培养液1 mL,加入l mL 20%三氯乙酸,静置20 min。然后加入2 mL 0.3%硫代巴比妥酸(TBA)溶液,在沸水中恒温10 min,取出室温下冷却。3000 r/min离心20 min,取上清液在532 nm下测定吸光度值。平行测定三次,取平均值。以无水乙醇为取代样品测吸光值作为空白对照组。
1.2.6MTS法检测姜黄精油对HepG2细胞的毒性取对数生长期的HepG2细胞,制备细胞悬液并以1×105/mL密度接种于96孔培养板中,培养24 h后加入不同浓度的姜黄精油溶液,每组浓度设定6个平行孔,于37 ℃、5% CO2培养箱条件下继续培养24 h,加入20 μL/100 μL MTS试剂,37 ℃、5% CO2条件下孵化1~4 h后,使用酶标仪在490 nm处测定吸光度值OD1,以单纯培养液作为空白孔,测定吸光度值为OD0,以未做任何处理作为对照,测定吸光度值OD。细胞存活率按公式计算:
细胞存活率(%)=(OD1-OD0)/(OD-OD0)×100
1.2.7姜黄精油细胞内抗氧化活性测定DCFH-DA作为一种氧化指示剂,当其被细胞吸收并被细胞酯酶去脂化生成DCFH后,细胞中的ROS能将其氧化成带有荧光的DCF,通过流式细胞仪进行荧光定量,以荧光强度或阳性细胞率来指示细胞内ROS的水平[14]。参照张红城等的方法[15],取对数生长期的HepG2细胞制备细胞悬液1×105/mL接种于6孔板中于37 ℃、5% CO2培养箱培养24 h后,加入0.001%、0.005%、0.01%的姜黄精油乙醇溶液处理30 min,再加入25 μmol/L DCFH-DA溶液,37 ℃、5% CO2培养30 min,使探针被完全吸收,弃去培养液后用预冷的D-Hanks清洗三次,以充分洗去未进入的荧光探针,加入10 mmol/L H2O2刺激30 min,用流式细胞仪检测荧光强度,激发波长为488 nm,发射波长为525 nm。以细胞培养液为空白组(BLANK),以未用DCFH-DA刺激的HepG2细胞为阴性对照组(NTC),以用DCFH-DA刺激、但未用精油处理的HepG2细胞为阳性对照组(PTC),A、B、C分别为0.001%、0.005%、0.01%(v/v)姜黄精油处理组。
1.3数据处理
采用Origin 8.0 处理数据计算标准偏差并作图,图中竖线表示标准误(SD±SE)。
2 结果与分析
2.1姜黄精油对ABTS+自由基的清除能力
图1显示姜黄精油对ABTS+自由基具有良好的清除能力,其清除能力随着精油浓度的升高逐渐增大,当浓度为10.0 mg/mL时可以清除52%的ABTS+自由基。但与阳性对照抗氧化剂VE相比,姜黄精油对ABTS+自由基的清除能力要低于VE,而2 mg/mL的VE对ABTS+自由基的清除率就达到了98%。

图1 不同浓度VE和姜黄精油对ABTS+自由基的清除能力Fig.1 Scavenging capacity against ·OH radicals of different concentrations of VE and turmeric essential oi
2.2姜黄精油对羟自由基的清除能力
由图2可知,姜黄精油和VE对由Fenton体系产生的羟自由基均有较好的清除效果,清除能力随浓度增加逐渐加强。当浓度为3×10-4mg/mL时,姜黄精油和VE对羟自由基的清除效果均显著增加,清除率接近100%,且姜黄精油与VE的清除能力相当。
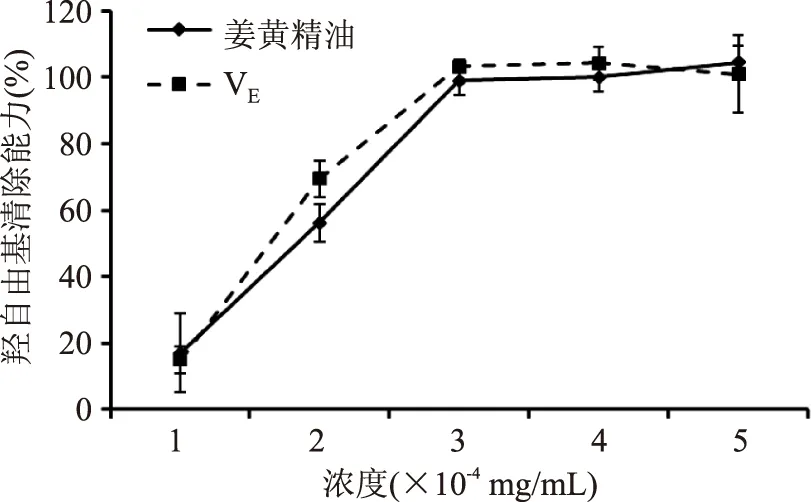
图2 不同浓度VE和姜黄精油对羟自由基的清除能力Fig.2 Scavenging capacity against ·OH radicals of different concentrations of VE and turmeric essential oil
2.3姜黄精油抑制亚油酸脂质过氧化的能力
由图3可知,姜黄精油和VE均表现出一定的抑制亚油酸脂质过氧化的能力,而且姜黄精油抑制亚油酸脂质过氧化的能力与相同浓度的VE的抑制效果相当。4 mg/mL的姜黄精油和VE对亚油酸过氧化的抑制率均超过了50%。
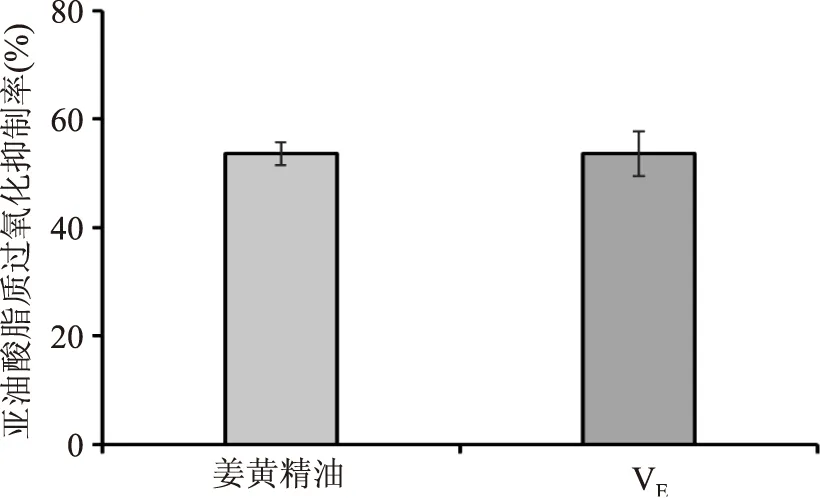
图3 VE和姜黄精油对亚油酸脂质过氧化的抑制能力Fig.3 The inhibitory capacity of VE and turmeric essential oil against linoleic acid oxidation
2.4姜黄精油的细胞内抗氧化活性
2.4.1姜黄精油的细胞毒性图4显示,姜黄精油在0.02%(v/v)浓度范围以内时,HepG2细胞的细胞存活率与对照组基本一致,说明当姜黄精油浓度低于0.02%(v/v)时,对细胞没有细胞毒作用。因此后续实验选定在0.02%(v/v)浓度以内进行。
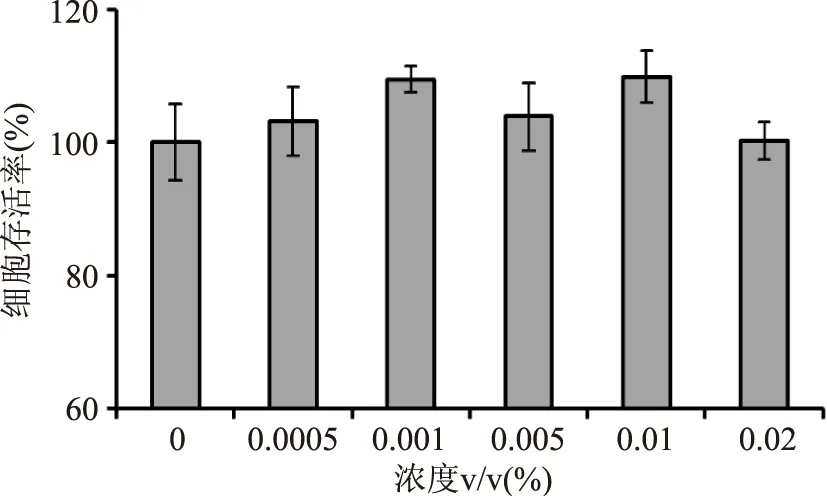
图4 不同浓度姜黄精油对HepG2细胞的细胞毒作用Fig.4 Cytotoxicity of different concentrations of turmeric essential oil on HepG2 cells assayed by MTS test
2.4.2姜黄精油的细胞内抗氧化活性采用流式细胞仪对HepG2细胞内活性氧含量进行分析,分析图谱见图5,对分析图谱进行统计,统计结果见图6。由图5、图6可知,细胞培养液(空白组,BLANK)自身的荧光强度非常弱,未用DCFH-DA刺激的HepG2细胞(阴性对照组,NTC)自发荧光也较弱,其阳性细胞率仅为5.74%,当用DCFH-DA刺激、但未用精油处理后HepG2细胞(阳性对照组,PTC)的阳性细胞率达到了85.34%,而用0.001%,0.005%,0.01%(v/v)浓度的姜黄精油处理后,相比阳性对照组(PTC)其阳性细胞率分别降低到了22.36%、10.64%和14.29%。结果证明了姜黄精油能有效降低HepG2细胞内的DCFH-DA的荧光强度,降低阳性细胞率,清除细胞内的活性氧,具有一定的细胞内抗氧化活性。
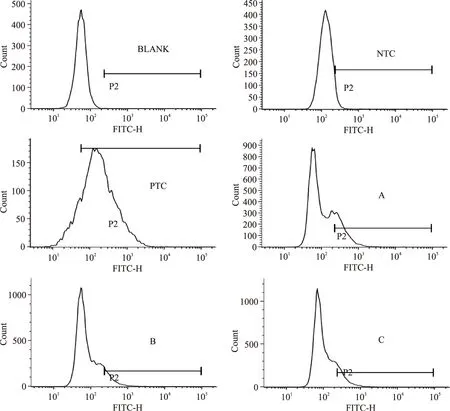
图5 不同浓度姜黄精油处理后HepG2细胞阳性细胞率的流式细胞仪分析图谱Fig.5 Flow cytometry analysis of different concentrations of turmeric essential oil on positive cell ratio of HepG2 cells注:BLANK为空白,NTC为阴性对照,PTC为阳性对照,A、B、C分别为0.001%、0.005%、0.01%(v/v)姜黄精油处理组。
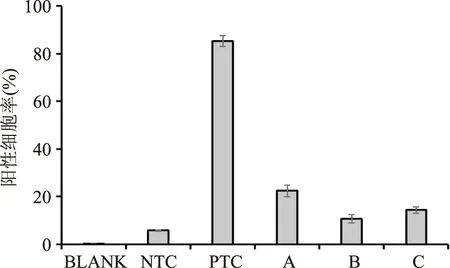
图6 不同浓度姜黄精油对HepG2细胞阳性细胞率的影响.Fig.6 Effect of different concentrations of turmeric
3 讨论
羟基自由基是活性氧类物质中化学活性最强的物质[11],本研究结果显示姜黄精油对羟自由基具有很高的清除率,与VE的清除效果相当,在浓度为3×10-4mg/mL时,对羟自由基的清除率就达到了100%。脂质过氧化是导致很多食品酸败变质的原因[16],本研究结果显示,姜黄精油可以很好地抑制亚油酸的脂质过氧化,与VE的作用效果相当。姜黄精油具有较好的抗氧化活性,在某些方面与VE的效果相当。
目前ABTS法、羟自由基法、抑制亚油酸脂质过氧化等方法来都是通过化学反应来检测物质的抗氧化活性,其优点是快速简便。但是这些方法并不能真实的反应有机体对物质的吸收、运输、代谢,及其在有机体内有效的作用浓度。因此细胞水平的抗氧化实验提供了一种更接近生物有机体体内水平的一种抗氧化研究方法[17]。
细胞毒性实验结果显示姜黄精油在浓度低于0.02%(v/v)时,其对HepG2细胞没有明显的细胞毒作用,证明姜黄精油作为一种食品抗氧化剂是安全的。我们的研究结果显示不同浓度的姜黄精油均可以有效降低H2O2刺激HepG2产生的细胞内活性氧水平,证明了姜黄精油在细胞内也具有较好的抗氧化能力。
4 结论
4.1姜黄精油对ABTS+自由基具有良好的清除效果,但其清除能力低于VE;对羟自由基的清除效果非常明显,与VE的清除能力相当;并且能有效抑制亚油酸脂质过氧化。
4.2姜黄精油能有效清除HepG2细胞内的活性氧,并且没有明显的细胞毒作用,具有开发为天然安全的食品抗氧化剂的潜力。
[1]Maria G M. Antioxidant and anti-inflammatory activities of essentialoils:a short review[J]. Molecules,2010,15(12):9252-9287.
[2]Goze I,Alim A,Cetinus SA,et al. Antimicrobial,antioxidant,and antispasmodic activities and the composition of theOriganumacutidens(Hand.-Mazz.)letswaart[J]. Journal of Medicinal Food,2010,13(3):705-709.
[3]Mechergui K,Coelho J A,Serra M C,et al. Essential oils ofOriganumvulgareL. subsp. glandulosum(Desf.)letswaart from Tunisia:chemical composition and antioxidant activity[J]. Journal of the Science of Food and Agriculture,2010,90(10):1745-1749.
[4]Jia H L,Ji Q L,Xing S L,et al. Chemical composition and antioxidant,antimicrobial activities of the essential oils ofThymusmarschallianusWill. andThymusproximusSerg[J]. Journal of Food Science,2010,75(1):59-65.
[5]孙乃有,张卫. 姜黄有效成分的提取及其油基色素制备[J]. 食品工业科技,2003,24(7):49-50.
[6]汤敏燕,汪洪武,孙凌峰. 中药姜黄挥发油化学成分研究[J]. 江西师范大学学报:自然科学版,2000,24(3):274-276.
[7]石雪蓉,顾健,谭睿. 姜黄挥发油抗肿瘤作用机制研究[J].中药药理与临床,2003,19(6):15-16.
[8]赵泽贞,温登瑰,魏丽珍,等. 姜黄油抗突变作用机理进一步实验研究[J]. 癌变、畸变、突变,1999,11(2):75-77.
[9]Sindhu S,Chempakam B,Lee N K,et al. Chemoprevention by essential oil of turmeric leaves(CurcumalongaL.)on the growth ofAspergillusflavusand aflatoxin production[J]. Food and Chemical Toxicology,2011,49(5):1188-1192.
[10]Singh S,Dass S S,Singh G,et al. Composition,invitroantioxidant and antimicrobial activities of essential oil and oleoresins obtained from black cumin seeds(NigellasativaL.)[J]. Biomed Research International,2014,209(2):1-10.
[11]Chun S S,Vattem D A,Lin Y T,et al. Phenolic antioxidants from clonal oregano(Origanumvulgare)with antimicrobial activity againstHelicobacterpylori[J]. Process Biochemistry,2005,40(9):809-816.
[12]刘骏. 结晶紫分光光度法测定Fenton反应产生的羟自由基[J]. 武汉工业学院学报,2005,24(2):53-55.
[13]Zainola M K,Abd-Hamida A,Yusof S. Antioxidative activity and total phenolic compounds of leaf,root and Petiole of four aeeessions ofCentellaasiatiea(L.)Urban[J]. Food Chemistry,2003,81(4):575-581.
[14]Royall J A,Ischiropoulos H. Evaluation of 2′,7′-dichlorofluorescin and dihydrorhodamine 123 as fluorescent probes for intracellular H2O2in cultured endothelial cells[J]. Archives of Biochemistry and Biophysics,1993,302(2):348-355.
[15]张红城,赵亮亮,胡浩,等. 蜂胶中多酚类成分分析及其抗氧化活性[J]. 食品科学,2014,35(13):59-65.
[16] 施琳,尉芹,赵忠,等. 苦杏壳木醋液多酚对核桃油过氧化的抑制作用[J]. 食品科学,2013,34(5):76-80.
[17]Wolfe K L,Liu R H. Cellular antioxidant activity(CAA)assay for assessing antioxidants,foods,and dietary supplements[J]. Journal of Agricultural and Food Chemistry,2007,55(22):8896-8907.
Study on antioxidant activity of turmeric essential oil
WEI Juan,SU Hai-lan,ZHANG Xi-tong,BI Yang*
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Turmeric(CurcumalongaL.)is a plant belonging to the family of Zingiberaceae,it has been commonly used in Chinese traditional medicine and food coloring. In this study,the turmeric essential oil was extracted by steam distillation,and its antioxidant capacity was evaluated based on ABTS radical and hydroxyl free radical(·OH)scavenging activities,inhibition of lipid peroxidation in linoleie acid. Its cytotoxic effect on HepG2 cells was evaluated by mitochondrial-respiration-dependent 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium(MTS)assay,the antioxidant effect in cell levels was investigated by flow cytometry. The results indicated that turmeric essential oil exhibited good scavenging activities against ABTS free radicals,but the scavenging rate was lower than that of VE. The essential oil could significantly scavenge ·OH radicals,the scavenging rate was similar with that of VE. And it could inhibit lipid peroxidation in linoleie acid. Within the concentration of 0.02%(v/v),the essential oil had no obvious cytotoxicity on HepG2 cells,and could scavenge the reactive oxygen in them. It is suggested that turmeric essential oil could be developed as a food addictive of natural antioxidants.
turmeric;essential oil;antioxidant
2015-11-09
魏娟(1982-),女,硕士,讲师,研究方向:果蔬采后生物学与技术,天然产物生物学活性,E-mail:weijuan@gsau.edu.cn。
毕阳(1962-),男,博士,教授,研究方向:果蔬采后生物学与技术,E-mail:biyang@gsau.edu.cn。
甘肃省青年科技基金计划(1208RJYA095);国家自然科学基金(31360382)。
TS201.3
A
1002-0306(2016)10-0141-05
10.13386/j.issn1002-0306.2016.10.019
