不同鸡种和浸烫温度对宰后鸡肉品质的影响
2016-09-10刘关瑞魏超昆刘敦华
刘关瑞,魏超昆,刘敦华,房 想,王 旭,龚 媛
(宁夏大学农学院,宁夏银川 750021)
不同鸡种和浸烫温度对宰后鸡肉品质的影响
刘关瑞,魏超昆,刘敦华*,房想,王旭,龚媛
(宁夏大学农学院,宁夏银川 750021)
采用两因素可重复裂区实验设计,以淘汰蛋鸡和AA肉鸡2个鸡种为主区,5个浸烫温度(50、55、60、65、70 ℃)为裂区,研究不同鸡种和浸烫温度对宰后鸡肉品质的影响。结果表明,随着浸烫温度升高,淘汰蛋鸡、AA肉鸡的肌肉pH1均呈下降趋势(p<0.05),而肌肉pH2均无显著变化(p>0.05);亮度L*值升高,而红度a*值和黄度b*值呈下降趋势;滴水损失、蒸煮损失均呈增大趋势(p<0.05);T2b峰面积变化不大,T21峰面积有显著差异(p<0.05);肉鸡肌苷酸(IMP)含量变化总体呈平稳趋势(p>0.05),而蛋鸡IMP含量变化总体呈下降趋势(p<0.05)。GLM-Multivariate分析结果表明,鸡种对亮度L*值、红度a*值、滴水损失、蒸煮损失、T2b峰面积、T21峰面积、IMP含量影响均显著(p<0.05),浸烫温度对除pH2、T2b峰面积外的所有指标影响均显著(p<0.05),鸡种与浸烫温度的交互作用对红度a*值、黄度b*值、滴水损失、T21峰面积影响显著(p<0.05)。因此,在其他屠宰工艺一定的条件下,肉鸡在50~55 ℃范围内浸烫,蛋鸡在60~65 ℃范围内浸烫,将有利于提高宰后鸡肉品质。
鸡种,浸烫温度,鸡肉,品质
鸡肉因其肉质柔软,味道鲜美,具有高蛋白、低脂肪、低胆固醇和低热量等特点,逐渐成为我国继猪肉之后的第二大消费肉类[1]。前处理(挂鸡、屠宰、浸烫脱羽、预冷)是鸡成为鸡肉产品的必须工序,处理过程的不同,会直接影响鸡肉的品质。其中浸烫脱羽是前处理过程中的关键环节,烫羽好坏不仅直接影响脱羽机的脱羽效果,同时也关系到肉品卫生与质量。浸烫温度过低会导致脱羽不干净并且会增加微生物繁殖,而温度过高会因皮下脂肪与水分流失导致出品率降低、产生白肌肉(PSE,Pale Soft Exudative Meat)[2]。因此,选择合适的浸烫温度并根据季节、鸡种、日龄和产品市场要求等情况适时调控对后续加工至关重要。
肉的品质主要受到基因、环境以及它们之间的交互作用的影响。基因因素主要包括品种、性别、基因型等,环境因素主要有营养的水平、饲养方式、宰前和宰后的处理方式。基因和环境共同影响了肉的组织和结构、宰前和宰后肉的化学组成,从而影响到肉的食用品质[3]。但在目前的研究中,关于环境因素(如宰前和宰后因素等)或基因因素(如品种等)对肌肉品质研究较多[4-6],而对基因因素与环境因素相互间的作用研究较少。同时鉴于淘汰蛋鸡数量逐年增加的现状,完善屠宰工艺十分必要。本研究在夏季高温条件下,讨论不同鸡种和烫毛温度对宰后鸡肉品质的影响,以期为国内禽类清真屠宰企业提供数据指导和帮助。
1 材料和方法
1.1材料与仪器
普通肉鸡AA白羽肉鸡,日龄42 d,体重2.5~3 kg;淘汰蛋鸡罗曼褐壳蛋鸡,日龄1~2年,体重1.5~1.8 kg,由固原清真食品有限公司提供,宰后冷藏运输保存;肌苷酸标准品Dr. Ehrenstorfer公司,纯度99.4%;甲醇色谱纯,天津市凯通化学试剂有限公司;磷酸二氢钠分析纯,烟台市双双化工有限公司;高氯酸分析纯,天津政成化学制品有限公司,纯度70%~72%。
PHSJ-3F便携式pH计上海精科仪器有限公司;WSC-S色差仪北京精密仪器有限公司;TGL-16G台式冷冻离心机上海安亭科学仪器厂;AGILENT1100高效液相色谱仪美国安捷伦科技公司;NMI20-15低场核磁共振成像分析仪上海纽迈电子科技有限公司。
1.2实验方法
1.2.1实验设计本实验采用两因素可重复裂区实验设计[7],处理因素分别为鸡种(AA白羽肉鸡、罗曼褐壳蛋鸡)、浸烫温度(50、55、60、65、70 ℃),共10个处理,每个处理2个重复,每个重复5只鸡,共100只。
活鸡运输前8 h限饲处理,肉鸡、蛋鸡随机抽取各50只鸡,每个鸡笼装5只鸡(1个重复);运输时车外气温30~32 ℃。运输货车到达屠宰场后,将活鸡安置在休息室内休息1 h,休息结束后,按照工厂生产线屠宰流程,由阿訇操刀按照伊斯兰教法进行放血宰杀;胴体经过50、55、60、65、70 ℃烫毛(浸烫时间90 s)、脱毛、冲洗、净膛、预冷、分割鸡胸肉,制备肌肉样品,4 ℃冷藏待测。
1.2.2指标测定
1.2.2.1pH测定根据国标GB/T9695.5-2008《肉与肉制品:pH测定》,分别对宰后45 min和24 h鸡胸肉进行测定,每个样品测定三次,记宰后45 min pH为pH1,宰后24 h pH为pH2。
1.2.2.2肉色测定取宰后24 h鸡胸肉,利用色差仪测定宰后肉样的颜色。测定时尽量保持肌肉表面平整光滑,肉样厚度不得少于1.5 cm,利用色差仪测定肉样的L*值、a*值和b*值。每个样品分别在鸡胸肉的三个不同区域测定色差值,然后取平均值。每次使用前要对仪器进行校准。
1.2.2.3滴水损失参照Honikel[8]的方法。取宰后24 h鸡胸肉2 g左右肉样,剔除表层脂肪和肌膜,整理成长方体形,称量m1,用铁丝吊挂在吹气的塑料袋里(不与袋壁接触),封闭后置于4 ℃冰箱内吊挂24 h,取出肉块称量m2。计算滴水损失W滴。
W滴(%)=[(m1-m2)/m1]×100
1.2.2.4蒸煮损失参考魏心如等[9]的方法并做改进。取宰后24 h鸡胸肉,剔除表面脂肪和肌膜,按肌纤维方向修成4 cm×5 cm×2 cm形状(近似即可),称量m1,后置于蒸煮袋,75 ℃水浴至肉样中心温度达到70 ℃停止,流水冷却至室温。取出肉样用吸水纸吸干表面水分,称量m2。计算蒸煮损失W蒸。
W蒸(%)=[(m1-m2)/m1]×100
1.2.2.5结合水、不易流动水含量测定将宰后24 h肉样,置于室温下平衡0.5 h,剔除筋腱和脂肪,准确称取2.0 g,放入直径15 mm核磁专用检测管中,进行核磁测定。每个样品重复测定3次,取其平均值,分析其弛豫特征值。核磁测定参数:质子共振频率SF(MHz)=18,偏移频率O1(Hz)=377177.24,90°硬脉冲脉宽P1(us)=16.00,采样点数TD=79996,180°硬脉冲脉宽P2(us)=32.00,采样频率SW(KHz)=200,采样等待时间TW(ms)=2500.000,回波个数NECH=2000,模拟增益RG1(db)=20.0,数字增益DRG1=3,重复采样次数NS=16,数据半径DR=1,开始采样时间RFD(ms)=0.020,样品测试室温度32 ℃,自旋-自旋弛豫时间T2用CPMG序列进行测量,弛豫时间用T2b、T21和T22表示,其中T2b表示结合水,T21表示不易流动水,T22表示自由水。
1.2.2.6IMP含量测定参考吴莹莹等[10]的方法并稍作改进。称取1 g左右(准确至0.0001 g)的宰后24 h的鸡胸肉至研钵中,研磨至浆状,分次加入4 mL 6%的预冷高氯酸,充分研磨搅拌,转移至10 mL离心管中。以8000 r/min离心15 min,离心温度4 ℃左右,取上清液转入另一支10 mL离心管中,沉淀物加入2 mL 6%的预冷高氯酸,摇匀,离心,合并2次上清液,用5.0 mol/L及0.5 mol/L NaOH溶液调pH=6.5,转移至50 mL容量瓶定容。提取液用0.45 μm水系滤膜过滤后用于HPLC分析测定。色谱条件:SP-120-5-C18色谱柱(5 μm,4.6 mm×250.0 mm);柱温30 ℃;进样量20 μL;流动相,A液为甲醇,B液为0.05 mol/L磷酸二氢钠,A液∶B液=8∶92(B液现配现用并进行0.45 μm滤膜过滤及超声脱气处理),流速1 mL/min。
1.2.3数据处理实验数据采用SPASS19.0软件统计分析,使用One-Way ANOVA方法对10组处理数据进行方差分析和Duncan氏多重比较,采用GLM-Multivariate方法对鸡种和烫毛温度进行主效应分析和交互作用分析,显著水平为p=0.05,结果均以平均数±标准差表示。
2 结果与分析
2.1不同鸡种和浸烫温度对鸡肉pH的影响
宰后肌肉pH下降速率和极限pH都会对肌肉品质产生重要的影响,其中包括肉色、嫩度、保水性等。一般认为,宰后45 min肌肉pH是肌肉pH下降速率的良好指标,反映肌肉糖原酵解速度和强度,而宰后24 h肌肉pH反映的则是肌肉糖原酵解总量。由图1可知,肉鸡、蛋鸡pH1下降速度随浸烫温度升高而减小,这与赵慧等[11]认为较高的宰后肌肉温度会加速肌肉中pH的下降的研究结果一致,分析其原因可能与无氧酵解酶的活性有关。肉鸡浸烫50 ℃与55 ℃组的pH1显著高于浸烫60、65、70 ℃组(p<0.05),而两组pH1并无显著性差异(p>0.05)。蛋鸡浸烫50 ℃组的pH1显著高于浸烫60、65、70 ℃组(p<0.05),而浸烫55、60、65、70 ℃组之间差异不显著(p>0.05)。

表1 不同鸡种和浸烫温度对鸡肉色度的影响
注:同一指标平均值肩标字母不同者差异显著(p<0.05),表2同。
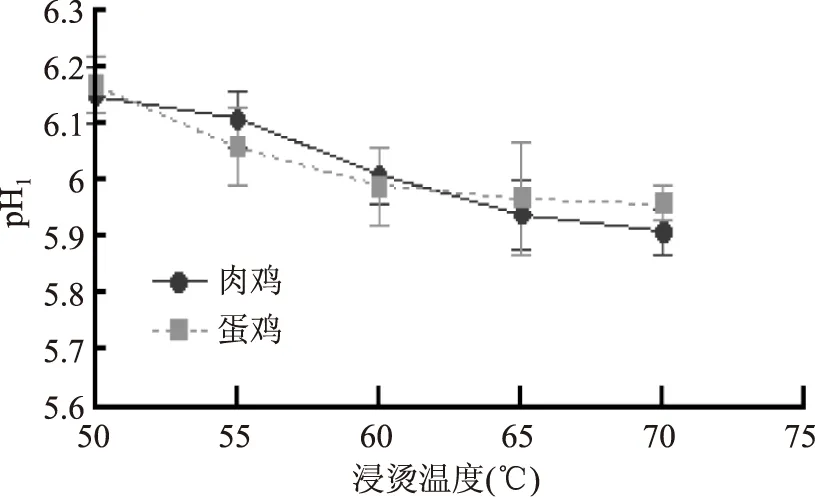
图1 不同鸡种和烫毛温度对鸡肉pH1的影响Fig.1 Effects of different species and scalding temperature on pH1 in chicken
由图2可知,浸烫温度对鸡肉pH2的影响没有明显的趋势。在同一浸烫温度下(除浸烫50 ℃),蛋鸡组pH2显著大于肉鸡(p<0.05)。肉鸡、蛋鸡不同温度浸烫组之间pH2差异均不显著(p>0.05),这可能是因为浸烫温度对宰后鸡体内肌肉糖原总量影响不大造成的。
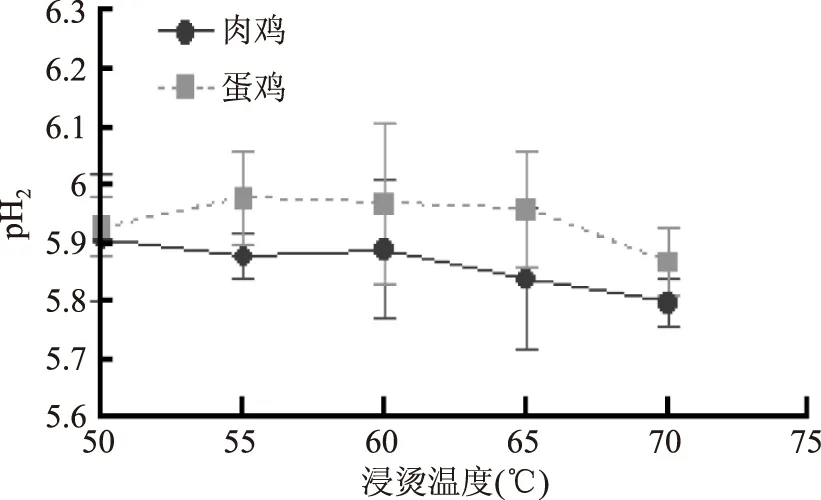
图2 不同鸡种和烫毛温度对鸡肉pH2的影响 Fig.2 Effects of different species and scalding temperature on pH2in chicken
2.2不同鸡种和浸烫温度对鸡肉色度的影响
肉色是评判肉质表观最直接的指标,它对消费者的购买欲望有强烈的影响。由表1可知,在浸烫时间为90 s时,无论是肉鸡还是蛋鸡,随着浸烫温度升高,亮度L*值升高,而红度a*值和黄度b*值呈下降趋势,这与潘金龙[12]的研究结果一致。亮度L*值增加可能是由于浸烫使肌肉中胶原纤维产生热收缩,水分溶出至肌肉表面产生折光所致;红度a*值的下降可能与肌红蛋白含量及其溶解度有关[13-14]。各种浸烫温度下(除浸烫55 ℃),蛋鸡组L*值高于肉鸡,但不显著(p>0.05)。肉鸡50、55 ℃浸烫组的L*值均显著低于60、65、70 ℃浸烫组(p<0.05),而两组之间差异不显著(p>0.05);蛋鸡55、60、65 ℃浸烫组L*值差异不显著(p>0.05)。
2.3不同鸡种和浸烫温度对鸡肉保水性的影响
保水性是评价肌肉品质的另一重要指标,滴水损失和蒸煮损失的大小可以用来衡量肌肉保水性。本研究中,随着浸烫温度升高,肉鸡和蛋鸡的滴水损失、蒸煮损失均呈增大趋势,说明浸烫温度升高会降低肉的保水性,这主要与肌肉中胶原纤维热收缩迫使肌原纤维与肌内膜之间以及肌束与肌束膜之间的通道中的水分排到肉表面有关[15]。无论是蛋鸡还是肉鸡,浸烫70 ℃组的滴水损失、蒸煮损失最大,因此,家禽屠宰企业应尽量避免采取70 ℃以上的高温浸烫。肉鸡浸烫60 ℃组的滴水损失显著大于浸烫50、55 ℃(p<0.05),浸烫50、55 ℃组之间差异不显著(p>0.05);蛋鸡浸烫65 ℃组的滴水损失显著大于浸烫50、55、60 ℃组(p<0.05)。肉鸡浸烫65、70 ℃组的蒸煮损失显著大于浸烫50、55、60 ℃组(p<0.05);蛋鸡浸烫50、55、60、65 ℃组差异不显著(p>0.05),但均显著小于浸烫70 ℃组(p<0.05)。鸡种对鸡肉保水性影响显著,在同一浸烫温度下,蛋鸡的滴水损失、蒸煮损失均大于肉鸡,说明淘汰蛋鸡的保水性劣于AA肉鸡,这与徐幸莲等[16]研究淘汰蛋鸡与普通肉鸡肌肉品质的比较结果一致。
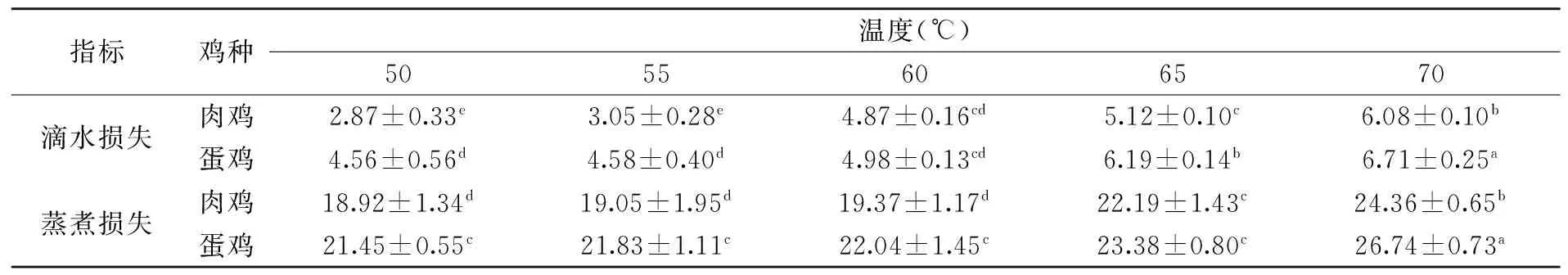
表2 不同鸡种和浸烫温度对鸡肉保水性的影响
2.4不同鸡种和浸烫温度对鸡肉结合水及不易流动水含量的影响
由图3可知,无论是蛋鸡还是肉鸡,弛豫图谱上显示3个峰,其中0~10 ms(T2b)之间有1个小峰,代表与大分子紧密结合的水即结合水;10~100 ms(T21)的峰为主峰,代表肌原纤维蛋白结构高度保持的不易流动水,包括被蛋白3、4级结构及肌原纤维蛋白中高密度的肌动蛋白丝和肌球蛋白丝结构所持留的水;100~1000 ms(T22)间组分代表肌原纤维晶格内的自由水[17]。
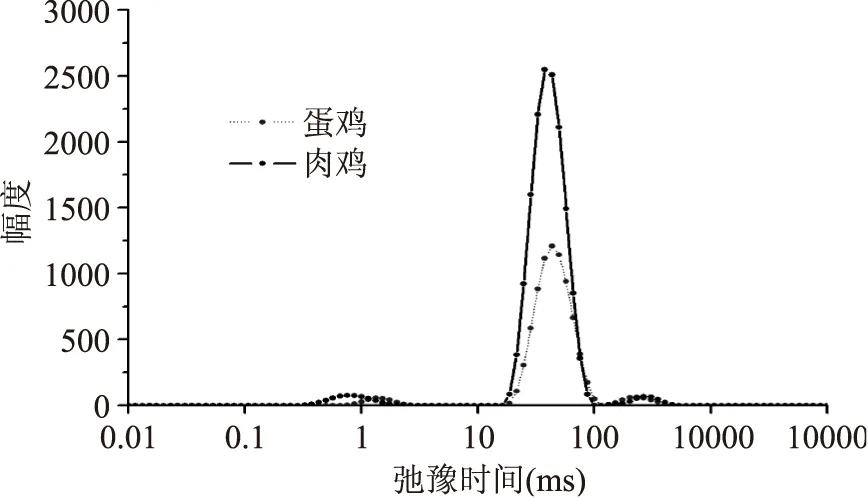
图3 鸡肉横向弛豫时间T2分布Fig.3 Distribution of transverse relaxation time in chicken
利用低场核磁共振技术,通过氢质子(1H)的横向驰豫时间T2可表征肉中水分子的迁移变化及存在状态,驰豫时间越长,水与底物结合的越疏松,水的流动性越大[18]。肉的保水性能主要取决于肌肉对不易流动水的保持能力。有研究[19]表明,肉保水性与T21峰面积呈正相关。由图4可以看出,不同温度热水浸烫后,肉样的T2b峰面积变化不大,T21峰面积有明显差异。肉鸡各浸烫组T2b、T21峰面积分别显著大于蛋鸡各浸烫组(p<0.05),前者可能与鸡的品种和日龄有关,后者主要是因为淘汰蛋鸡系水力较AA白羽肉鸡系水力低,而系水力的大小主要由这部分不易流动水决定的,徐幸莲等[16]的研究有类似的报道。随浸烫温度升高,肉鸡、蛋鸡T21峰面积均呈减小趋势,可能是由于浸烫使肌纤维产生热收缩,存在于肌丝、肌原纤维及膜之间的水分流出,造成不易流动水含量的降低。肉鸡T21峰面积从65 ℃开始显著降低(p<0.05),浸烫50、55、60 ℃组差异不显著(p>0.05);蛋鸡浸烫65 ℃组T21峰面积显著大于浸烫70 ℃组(p<0.05),与浸烫55、60 ℃组差异不显著(p>0.05)。
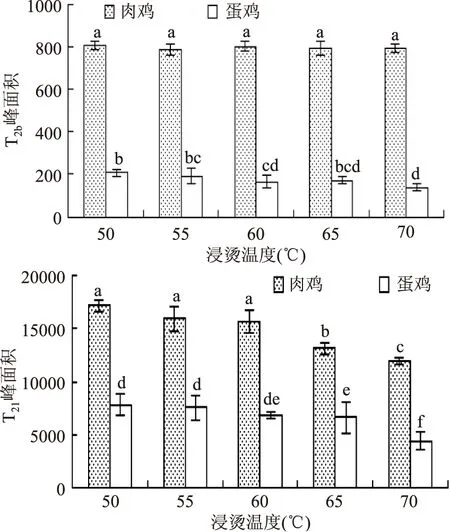
图4 不同鸡种和浸烫温度对鸡肉T2b、T21峰面积的影响Fig.4 Effects of different species and scalding temperature on T2band T21peak area in chicken注:不同字母表示差异显著(p<0.05),图5同。
2.5不同鸡种和浸烫温度对鸡肉IMP含量的影响
畜禽肌肉中的肌苷酸含量作为衡量肉质优劣的一项重要指标,已广泛应用于各种动物肉类产品的品质评定。品种作为影响鸡肉肌苷酸含量的重要因素之一,大量研究表明[20-22],不同鸡品种肌肉中肌苷酸含量存在品种差异。本实验中,蛋鸡各浸烫组IMP含量显著大于肉鸡各浸烫组(p<0.05),结果见图5。Fujimura等[23]认为生长速度慢的蛋用型母鸡肌肉IMP含量高于肉仔鸡,风味较好,与本研究结论一致。造成差异的原因可能是肌苷酸含量受遗传因素控制,与肌苷酸代谢酶基因的多样性相关。随浸烫温度升高,肉鸡IMP含量总体基本呈平稳趋势,各浸烫组IMP含量均无显著性差异(p>0.05);而蛋鸡IMP含量总体呈下降趋势,浸烫50、55、60 ℃组IMP含量显著高于浸烫65、70 ℃组。随浸烫温度的升高,肉鸡、蛋鸡IMP含量呈现不同的趋势,这可能与鸡种和鸡只大小有关,因为蛋鸡体积往往比肉鸡体积小的多,而其鸡胸肉厚度也比肉鸡小很多,从而导致浸烫温度能够传递的更快,对肌苷酸的影响也更大。
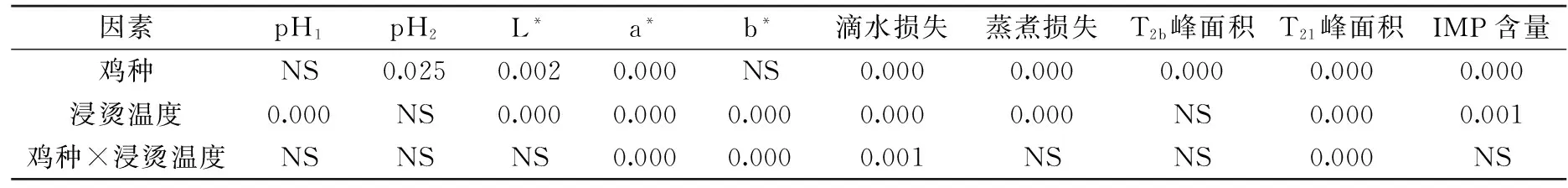
表3 鸡种、浸烫温度主效应及交互效应对鸡肉品质指标影响方差分析
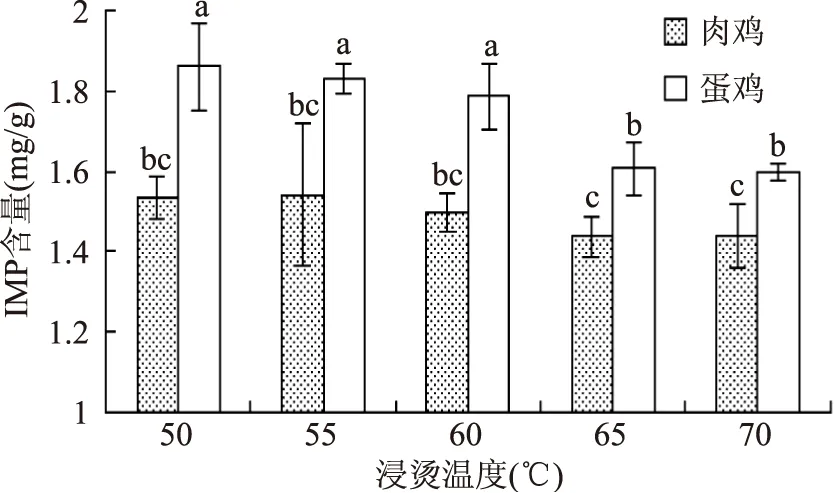
图5 不同鸡种和浸烫温度对鸡肉IMP含量的影响Fig.5 Effects of different species and scalding temperature on IMP content in chicken
注:表内数值表示各指标p值,p<0.05表示差异显著,NS(Not Significant)表示差异不显著(p>0.05)。
2.6鸡种、浸烫温度主效应及交互效应对鸡肉品质的影响
由表3可知,鸡种对pH2、L*值、a*值、滴水损失、蒸煮损失、T2b峰面积、T21峰面积、IMP含量影响显著(p<0.05),浸烫温度对除pH2、T2b峰面积外鸡肉品质的所有指标影响均显著(p<0.05),鸡种与浸烫温度的交互作用对a*值、b*值、滴水损失、T21峰面积影响显著(p<0.05)。
3 结论
本文研究了鸡种和浸烫温度主效应作用以及两者交互作用对宰后鸡肉品质的影响,结果表明,鸡种对pH2、亮度L*值、红度a*值、滴水损失、蒸煮损失、T2b峰面积、T21峰面积、IMP含量影响均显著(p<0.05),浸烫温度对除pH2、T2b峰面积外的所有指标影响均显著(p<0.05),鸡种与浸烫温度的交互作用对红度a*值、黄度b*值、滴水损失、T21峰面积影响显著(p<0.05)。肉鸡在60 ℃浸烫时,pH1显著减小,L*值、滴水损失均显著增大,在65 ℃浸烫时蒸煮损失显著增大、T21峰面积显著减小;蛋鸡在60 ℃浸烫时pH1显著减小、L*值显著增大,在65 ℃浸烫时滴水损失显著增大、IMP含量显著减小,在70 ℃浸烫时蒸煮损失显著增大;无论是蛋鸡还是肉鸡,T21峰面积随浸烫温度升高而减小,且应尽量避免采取70 ℃以上的高温浸烫,因此,综合考虑,在其他屠宰工艺一定的条件下,肉鸡在50~55 ℃范围内浸烫,蛋鸡在60~65 ℃范围内浸烫,将有利于提高宰后鸡肉品质。
[1]高晓平,黄现青,付进华,等.姜味鸡肉糜脯加工技术研究[J]. 食品与机械,2011,27(4):152-155.
[2]姜喃喃,王鹏,邢通,等. 宰前与宰杀因素对禽肉品质的影响研究进展[J]. 食品科学,2015,35(3):240-244.
[3]Gardener G E,Kennedy L,Milton J T B,et al. Glycogen metabolism and ultimate pH of muscle in Merino,first-cross,and second-cross whether lambs as affected by stress before slaughter[J]. Australian Journal of Agricultural Research,1999,50:175-181.
[4]王晓明,王鹏,李伟明,等. 不同季节和运输时间对肉鸡应激及肌肉品质的影响[J]. 食品工业科技,2013,23(34):315-318.
[5]王晓明,王鹏,李伟明,等. 夏季运输和休息时间对肉鸡应激及肌肉品质的影响[J]. 食品科学,2014,35(3):55-60.
[6]王志祥. 固始鸡与肉鸡、蛋鸡肉质、生长、代谢及相互关系的比较研究[D]. 北京:中国农业大学,2005.
[7]杨继学,黄珊珊,杨明亮,等. 密度和施肥量对不同分枝类型大豆产量的影响[J]. 大豆科学,2012,31(3):382-384.
[8]Honjkel K O. Reference methods for the assessment of physical characteristics of meat[J]. Meat Science,1998,49(4):447-457.
[9]魏心如,赵颖,韩敏义,等. 冷却鸡肉保水性评定指标标准化及其嫩度和pH24h相关性研究[J]. 食品科学,2014,35(21):50-56.
[10]吴莹莹,李文英,谢明. 高效液相色谱法测定肌肉中肌苷酸的含量[J]. 食品科学,2005,26(12):191-193.
[11]赵慧,甄少波,任发政,等. 待宰时间和致晕方式对生猪应激及猪肉品质的影响[J]. 农业工程学报,2013,29(4):272-277.
[12]潘金龙. 浸烫对鸡肉品质和脱羽效果的影响及工艺参数优化研究[D]. 北京:中国农业机械化科学研究院,2009.
[13]Fletcher D L,Qiao M,Smith D P. The relationship of raw broiler breast meat color and pH to cooked meat color and pH[J].Poultry Science,2000,79:784-788.
[14]J Claude Cheftel,Joseph Culioli. Effects of high pressure on meat:a review[J]. Meat Science,1997,46(3):211-236.
[15]刘静明. 新鲜猪肉和经盐腌后在加热过程中超微细结构变化的研究[J]. 食品科学,2003,24(10):67-72.
[16]徐幸莲,周光宏,刘海斌. 淘汰蛋鸡与普通肉鸡肌肉品质的比较研究[J]. 食品工业科技,2001,22(6):28-30.
[17]戚军,高菲菲,李春保,等. 低场NMR研究冻融过程中羊肉持水力的变化[J]. 江苏农业学报,2010,26(3):617-622.
[18]Bertram H C,Kohler A,Bocker U,et al. Heat-induced changes in myofibrillar protein structures and myowater of two pork qualities. A combined FT-IR spectroscopy and low-field NMR relaxometry study[J]. Journal of Agricultural and Food Chemistry,2006,54(5):1740-1746.
[19]Ida K S,Marianne R,Henrik J A,et al. Aging-induced changes in microstructure and water distribution in fresh and cooked pork in relation to water-holding capacity and cooking loss-A combined confocal laser scanning microscopy(CLSM)and low-field nuclear magnetic resonance relaxation study[J].Meat Science,2007,75:687-695.
[20]陈国宏,侯水生,吴信生. 中国部分地方鸡肌肉肌营酸含量研究[J]. 畜牧兽医报,2000,31(3):211-215.
[21]宋焕禄,张建,赵环环. 几种鸡肌肉中肌苷酸(IMP)的测定[J]. 食品科学,2002,23(2):103-105.
[22]苏一军,李慧芳,沈晓鹏,等. 不同类型鸡肌肉肌苷酸含量分析和比较[J]. 中国家禽,2002,24(23):12-13.
[23]Fujimura S,Muramoto T,Katsukawa M,et al.Chemical analysis and sensory evalution of free amino acids and 5′-inosinic acid in meat of Hinai-dori,Japanese native chicken comparison with borilers and layer pullets[J]. Animal Science and Technology,1994,65:610-618.
Effects of different species and scalding temperature on chicken quality after slaughter
LIU Guan-rui,WEI Chao-kun,LIU Dun-hua*,FANG Xiang,WANG Xu,GONG Yuan
(College of Agriculture,Ningxia University,Yinchuan 750021,China)
The effects of different species and scalding temperature on chicken quality after slaughter were studied by the means of a split plot experiment. Two chicken species(rejected layer,AA broiler)and five scalding temperatures(50,55,60,65 and 70 ℃)were included in this study. The results showed that with scalding temperature increasing,pH1in rejected layer and AA broiler decreased(p<0.05),but their pH2had no significant variance(p>0.05). L*value increased,while a*and b*value decreased. Drip loss and cooking loss all increased(p<0.05). Scalding temperature had a markedly effect on T21peak area(p<0.05),instead of T2bpeak area. Inosinic acid(IMP)content of AA broiler nearly kept steady(p>0.05),while IMP content of rejected layer decreased(p<0.05). GLM-Multivariate analysis results showed that species had a significant influence on L*value,a*value,drip loss,cooking loss,T2bpeak area,T21peak area and IMP content. Scalding temperature had a significant effect on all of the indicators,except pH2value and T2bpeak area. Interactions between species and scalding temperature significantly affected a*value,b*value,drip loss and T21peak area. In conclusion,it would contribute to improving chicken quality after slaughter,when AA broiler was scalded at 50~55 ℃,and rejected layer was scalded at 60~65 ℃.
species;scalding temperature;chicken;quality
2015-10-26
刘关瑞(1991-),男,硕士研究生,研究方向:食品质量与安全,E-mail:15204552540@163.com。
刘敦华(1964-),男,博士,教授,研究方向:食品质量与安全,E-mail:dunhualiu@126.com。
国家农业科技成果转化资金项目“清真鸡肉产品质量安全及品牌研究与示范”。
TS251.4
B
1002-0306(2016)10-0111-06
10.13386/j.issn1002-0306.2016.10.013
