藏医白脉疗法对局灶性脑缺血再灌注大鼠脑损伤的保护作用及对海马齿状回Jagged1表达的影响
2016-09-08祝日荣任小巧王明强郭慧娟仁青加葛东宇李根茂郑丽娟
祝日荣 任小巧 毛 萌 王明强 郭慧娟 仁青加 葛东宇 李根茂 郑丽娟
论 著
藏医白脉疗法对局灶性脑缺血再灌注大鼠脑损伤的保护作用及对海马齿状回Jagged1表达的影响
祝日荣任小巧毛萌王明强郭慧娟仁青加葛东宇李根茂郑丽娟
目的 探讨白脉疗法对局灶性脑缺血再灌注大鼠脑损伤的保护作用及对海马齿状回Jagged1表达的影响。方法 线栓法制作局灶性脑缺血再灌注大鼠模型。随机分为假手术组、模型组、白脉疗法组,脑缺血1.5小时,分别再灌注7天、14天,通过氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染色观察脑梗死面积,苏木精-伊红染色法 (hematoxylin-eosin staining,HE)染色观察皮层细胞形态变化,并应用免疫组化法检测各组大鼠海马齿状回Jagged1阳性细胞数量。结果 (1)TTC染色观察到正常脑组织呈鲜红色,梗死区脑组织呈苍白色,并且随着再灌注时间的延长可见梗死区扩大,白脉疗法组的脑梗死体积小于模型组,且14天时与模型组比较有显著性差异(P<0.05)。(2)HE染色表明白脉疗法组脑缺血大鼠皮层神经元的损伤程度低于模型组。(3)白脉疗法可以上调脑缺血大鼠海马齿状回SGZ的Jagged1表达,术后7天、14天Jagged1阳性细胞数高于模型组、假手术组,且有显著性差异(P<0.05)。结论 白脉疗法对局灶性脑缺血再灌注大鼠脑损伤有一定的保护作用,且可促进大鼠局灶性脑缺血再灌注损伤后海马齿状回区Jagged1的表达,Jagged1的表达增加可能是白脉疗法通过Notch通路促进脑缺血损伤后内源性神经干细胞增殖分化的分子机制之一。
白脉疗法; Jagged1; 海马齿状回; 局灶性脑缺血再灌注模型
藏医白脉疗法是指通过口服藏药和外治的方法相结合,达到改善脑血管病所导致的不良后遗症的综合性治疗方法[1-2]。本实验选择口服药如意珍宝丸和外用药白脉软膏,二者皆为白脉病常用藏成药[3],且有临床研究表明其疗效显著[4-5]。脑缺血后治疗的主要关注点在脑内神经的再生,Notch信号通路具有调节神经再生的作用,Jagged1为Notch信号通路的配体[6]。白脉疗法是否通过调控Jagged1的表达,并在内源性神经干细胞(neural stem cells,NSCs)增殖分化中发挥重要作用从而产生神经保护作用,但作用机制目前尚未明确。本实验采用大脑中动脉阻塞线栓法建立局灶性脑缺血再灌注大鼠模型,动态观察白脉疗法对局灶性脑缺血再灌注模型大鼠缺血侧海马齿状回Notch信号转导通路Jagged1表达的影响,探讨其促进脑缺血损伤后NSCs增殖分化的机制。
1 材料与方法
1.1实验动物
健康雄性SPF级SD大鼠60只,体质量(250±10)g,购买于北京斯贝福实验动物技术有限公司,许可证号为:SCXK(京)2011-0004。
1.2药物、试剂及仪器
如意珍宝丸(生产批号:20150116),购自金科藏药股份有限公司;白脉软膏(生产批号:130826),购自西藏奇正藏药股份有限公司;大鼠A级MCAO栓线,购自北京西浓生物技术有限公司;TTC(Genebio)、Rabbit Anti-Jagged1多克隆抗体(Santa Cruz Biotechnology)、浓缩型DAB试剂盒、抗兔超敏二步法免疫组化检测试剂,均购自北京中杉金桥生物公司。
1516型切片机,购自德国Leitz公司;BX40型光学显微镜、E320型显微照相机,购自日本Olympus公司;电热恒温培养箱(DH4000 AB型),购自天津市泰斯特仪器有限公司。
1.3局灶性脑缺血再灌注模型制备
参照Belayev[7]报道的线栓法加以改良后建立左侧大脑中动脉栓塞缺血模型(middle cerebral artery occlusion,MCAO)。手术前1天禁食,自由饮水。将SD大鼠腹腔注射10%水合氯醛溶液(3.5 mL/kg)麻醉后,于颈正中线处纵向切开皮肤,分离右侧颈总动脉(common carotid artery,CCA),向近心端分离出颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。结扎CCA近心端及ECA,同时在CCA远心端下置线备用。用动脉夹暂时夹闭ICA,在CCA结扎线远心端插入准备好的栓线,待栓线进入至ECA和ICA分叉口处,将CCA远心端的结扎线打一活结固定栓线,打开ICA处动脉夹,将栓线经ICA插入,使其到达大脑前动脉(anterior cerebral artery,ACA),进入深度约18~20 mm,阻断MCA血流。将CCA上远心端处固定栓线的结扎线打一死结,并将栓线尾端用黑色记号笔涂黑后留于皮肤外1 cm,消毒并逐层缝合。缺血1.5小时后将漏在皮肤外的线栓拔出1 cm 并剪断,使大脑动脉Willis环和MCA恢复血供,造成缺血再灌注模型,保持体温至清醒。造模后将动物置于放有清洁垫料的鼠笼内,自由饮水、进食。假手术组只进行术前麻醉和血管分离术,不结扎及导入线栓。手术过程中室温保持在24~25℃。
1.4实验分组与给药
动物于麻醉清醒后6小时进行神经行为学评分。参照Zea Longa[8]评分法进行神经行为学评分,Zea Longa评分法把神经学检查分5个等级:0分:不能自发行走,意识丧失;1分:行走时,大鼠向左侧(瘫痪侧)转圈;2分:将大鼠放在地上活动拉住鼠尾时大鼠向左侧(瘫痪侧)转圈;3分:轻提鼠尾将其悬空,足距地面1 m,观察前肢弯曲情况,左前肢持续弯曲;4分:正常,大鼠两侧前肢伸向地面且无其他神经行为学特征。评分为1~3分的纳入本研究。采用随机表将每个分值的大鼠平均分配到各组,以此保证每组大鼠神经行为学评分没有显著性差异。
大鼠分为3组:假手术组、模型组、白脉疗法组。每组根据缺血再灌注时间分为缺血再灌注7天、再灌注14天两个亚组。
白脉疗法组大鼠给予如意珍宝丸灌胃,每天1次,从造模后开始给药至处死,给药量依据成人给药量的6.3倍计算[9],如意珍宝丸成人每天用量4~5片,每天2次,每片重0.5 g,折合计算后给药量约为0.052 g/100 g,用生理盐水配成0.052 g/mL的药液,即每100 g体重灌胃1 mL药液。假手术组和模型组按照同样方法予以等量的生理盐水,每天1次至处死;白脉疗法组在如意珍宝丸灌胃基础上再给予白脉软膏外用,每天2次,每次1g并按摩5分钟;假手术组和模型组均于大鼠患肢涂凡士林,其余同白脉疗法组。
1.5取材
造模成功后于第7天、第14天取材,经水合氯醛麻醉后断头取脑,每组5只全脑取出后放在冻存管置于-20℃冰箱中速冻20分钟后TTC染色;每组另取5只大鼠心脏灌注,沿胸骨左侧剪开胸腔,从左心室进针,插入到主动脉,固定针头,剪开右心耳,快速滴入预冷生理盐水(10 mL/min),无血污后改滴入4%多聚甲醛(5~10 mL/min),先快后慢,约250 mL,开颅取脑,去额极、小脑,4%多聚甲醛固定2天,石蜡包埋。在海马齿状互包平面连续冠状切片,片厚7 μm,备用。
1.6观察指标
1.6.1脑梗率观测 -20℃冰箱中速冻20分钟后切片,一般切成5片(厚1.8 mm)。第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。将切片置于浓度为1%TTC染液中,将脑组织放入避光的容器内,放入37℃温箱20~30分钟,不时翻动脑片,使均匀接触到染色液,配置过程和使用过程均需避光。染色完成后用4%的多聚甲醛固定,24小时后照相,用Image-Pro Plus 6计算机图像分析系统计算脑梗率。
1.6.2病理形态观察 将各组组织切片于46℃烤箱烘烤24小时后,二甲苯Ⅰ、Ⅱ脱蜡,递减的浓度梯度酒精脱水,苏木精染色,1%盐酸酒精分化,流水冲洗返蓝,0.5%伊红复染,80%、95%、100%酒精脱水,二甲苯透明,中性树胶封片。200倍光镜随机观察右侧脑组织皮层区不重叠的5个视野,并摄片。
1.6.3大鼠海马齿状回SGZ Jagged1的表达 采用免疫组化SP法,切片脱蜡,0.01 mol/L PBS清洗2 min×3,置于枸橼酸盐微波修复,冷却后0.01 mol/L PBS洗2 min×3,滴加3%过氧化氢溶液10分钟,灭活内源性过氧化物酶;0.01 mol/L PBS洗2 min×3次;滴加一抗Jagged1抗体(1∶50),4℃过夜,PBS冲洗2 min×3;滴加超敏二步法免疫组化检测试剂盒中的试剂1(聚合物辅助剂),37℃孵育10分钟,PBS冲洗2 min×3;滴加试剂2(辣根酶标记抗兔IgG聚合物),37℃孵育10分钟,PBS冲洗2 min×3;DAB显色剂10分钟,水洗终止,透明、封片。从标本中随机取部分切片,用0.01 mol/L PBS代替一抗,其余步骤相同,作为阴性对照。每只动物随机取免疫组化切片5张,在高倍镜下(200倍)计数海马齿状回颗粒细胞区内1/3、颗粒下区Jagged1阳性细胞,取其均值作为海马SGZ Jagged1阳性细胞数。
拍照定位参考《大鼠脑立体定位图谱》[10],具体取像位置在海马齿状回。
1.7统计学处理
数据资料使用SPSS 21.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,若数据符合正态分布且方差齐,则采用单因素方差分析(one-way ANOVA),两组间的比较采用 LSD检验;若不符合正态分布或方差不齐,则采用秩和检验,以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1脑梗率观测
再灌注7天、14天后各组随机取5只动物进行TTC染色。染色结果表明:假手术组脑片均红染,未见白色梗死灶形成;模型组7天出现白色梗死灶,位于颞顶叶皮质和尾壳核;模型组于14天后梗死灶范围逐渐扩大;白脉疗法组7天可见白色梗死灶位于尾壳核和额颞顶叶皮质,白脉疗法组14天脑梗死面积小于7天,14天时白脉疗法组脑梗死率小于模型组,且有显著性差异(P<0.05)。见图1、表1。
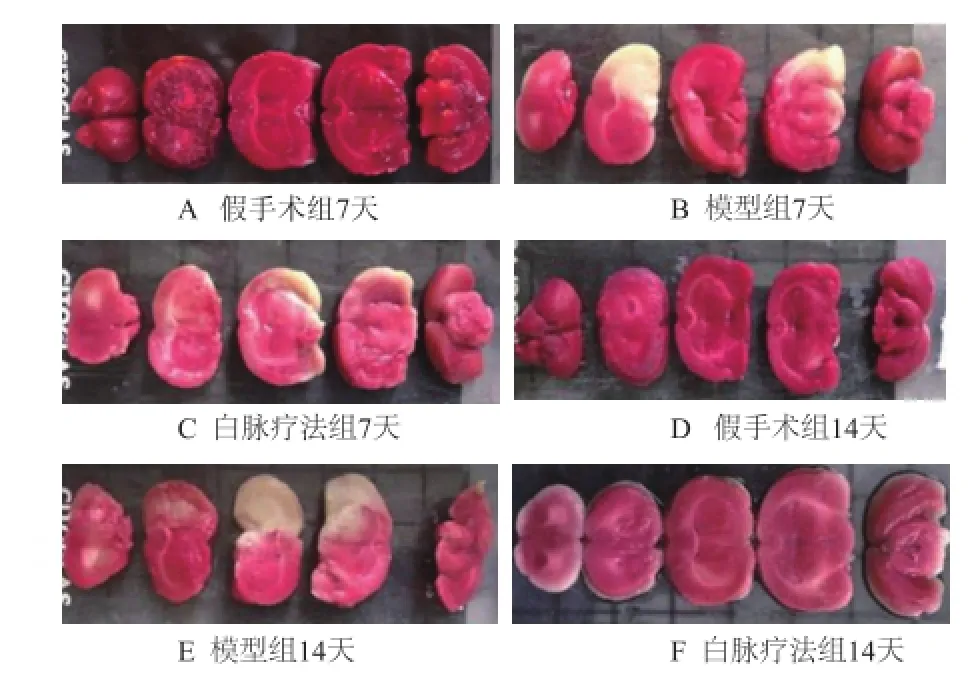
图1 各组大鼠给药7天、14天后脑组织TTC染色图

表1 各组大鼠TTC染色脑梗率改变(x±s)
2.2病理学观察
假手术组7天皮层神经元结构完整,数量多,核圆、大,偶见核固缩,14天同7天无显著性差异;模型组7天神经元排列紊乱,部分细胞排列疏松,细胞核固缩,深染,周围出现空泡,正常神经元数量减少,14天可见大量细胞溶解后残留的痕迹,细胞稀疏,排列紊乱;白脉疗法组7天神经元排列疏松,部分细胞核皱缩,深染,周围出现空泡,14天正常神经元数量有所增加,核固缩细胞减少,细胞间的空泡区域减少。7天白脉疗法组有少量核固缩细胞,与模型组相比明显少,与假手术组相比没有显著差别;14天白脉疗法组核固缩细胞比7天多,但与模型组相比明显少许多,与假手术组相比核固缩细胞明显多。见图2。
2.3大鼠海马齿状回SGZ Jagged1的表达
Jagged1在正常脑组织亦有一定量的表达,阳性细胞主要分布于大鼠海马齿状回颗粒细胞层、齿状回颗粒细胞下层(subgranular zone,SGZ)、门区等,本实验主要分析海马齿状回Jagged1阳性细胞,阳性神经细胞多呈颗粒状,Jagged1蛋白分布于细胞膜和细胞外基质,呈深棕色或浅棕色。脑缺血损伤后7天,白脉疗法组Jagged1阳性细胞数与正常组及模型组比较均有显著性差异(P<0.05);14天各组Jagged1阳性细胞数较7天均有所下降,且白脉疗法组与正常组及模型组比较均有显著性差异(P<0.05)。模型组Jagged1阳性细胞数和假手术组在7天、14天两个时间点均无显著性差异。见图3、表2。

图2 再灌注7天、14天后各组大鼠神经细胞病理学改变(×200)

表2 不同时间点大鼠海马齿状回SGZ Jagged1阳性细胞数(x±s)
3 讨论
缺血性卒中是临床常见疾病,且致死致残率高,幸存的病人预后多不同程度地患有偏瘫等后遗症,但目前还没有好的治疗方法。神经再生是脑损伤后运动功能恢复的基础,探寻有效增加神经再生是其重要的康复手段[11]。很长一段时间以来成年哺乳动物中枢神经系统被认为不具有再生能力,但在1992年NSCs的发现打破了这一观念,这一发现为脑损伤后神经再生提供了希望。

图3 不同时间点各组大鼠海马齿状回SGZ Jagged1的表达(×400)
本实验中TTC结果显示,白脉疗法可以减少脑缺血再灌注大鼠右侧大脑梗死面积。HE染色结果显示白脉疗法可以减轻脑缺血再灌注大鼠皮层神经元核固缩现象。由以上两项提示白脉疗法可以降低缺血再灌注造成的神经损伤。SGZ是目前已确认的 NSCs的主要聚集区之一[12],研究表明Jagged1-Notch信号通路能促进 NSCs增殖[13-15],白脉疗法组SGZ区的Jagged1阳性细胞数比模型组、假手术组均高,差异具有统计学意义(P<0.05),提示白脉疗法可能通过Notch信号通路来调节脑缺血后SGZ区的神经再生过程;也有研究表明活化的Jagged1能促进NSCs向星形胶质细胞分化[16],星形胶质细胞能够分泌多种神经营养因子,有利于轴突的再生和修复,有促进神经元存活的作用[16-17]。由此猜测脑缺血前期白脉疗法通过调节Jagged1促进NSCs向星形胶质细胞分化,并为后期分化出的神经元提供营养支持。
本实验从多角度观察了白脉疗法对于缺血再灌注大鼠脑损伤的保护作用,从TTC染色和HE结果均可看出白脉疗法能起到一定的神经保护作用,从Jagged1的表达情况来看白脉疗法在脑缺血后通过Notch信号通路发挥调节作用,对于缺血再灌注大鼠脑损伤的保护作用机制白脉疗法是否有其他通路参与调节,以及是否是Notch信号通路起到主导作用还有待大量实验验证。
[1] 仁旺次仁,扎桑.藏医白脉疗法在中风病治疗康复中的作用[J].中国藏学,2010,(4):159-162.
[2] 毛萌,任小巧,仁青加.浅议藏医白脉疗法对脑卒中后遗症的治疗特色[J].中医药学报,2014,42(3):7-9.
[3] 索朗顿珠.藏汉合璧常用藏成药使用手册[M].北京:民族出版社,2006:436,439-440.
[4] 刘宪勇,王丽娥,付加雷.如意珍宝丸治疗脑中风后遗症临床观察[J].山东医药,2010,50(1):88.
[5] 李宁,郭文华,董纪革.白脉软膏改善脑卒中患者肌张力增高的有效性和安全性临床研究[J].中国实用医药,2011,6(35):240-242.
[6] Lin Jen-tsun,Chen Mu-kuan,Yeh Kun-tu.Association of High Levels of Jagged-1 and Notch-1 Expression with Poor Prognosis in Head and Neck Cancer[J].Annals of Surgical Oncology,2010,17:2976
[7] Belayev L,Alonso OF,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model.[J].Stroke,1996,27(9):1616-1623.
[8] Zea Longa E,Weinstein PR,Carlson S,et al.Middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[9] 翁维良.中药临床药理学[M].北京:人民卫生出版社,2002:40.
[10] George Paxinos,Charles Watson,诸葛启钏.大鼠脑立体定位图谱[M].北京:人民卫生出版社,2005:99.
[11] 袁栋才,张凤春,魏巍.神经可塑性与脑卒中后运动功能恢复的研究进展[J].中国康复医学杂志,2014,29(4):391.
[12] Rebecca D Hodge,Robert JKahoud,Robert F Hevner.Transcriptional control of glutamatergic differentiation during adult neurogenesis[J].Cellular and Molecular Life Sciences,2012,69(13):2125-2134.
[13] AguirreAdan,Rubio Maria E,Gallo Vittorio.Notch and EGFR pathway interaction regulates neural stem cell number and selfrenewal[J].Nature,2010,467(7313):323-327.
[14] Nyfeler Yves,Kirch Robert D,Mantei Ned,et al.Jagged1 signals in the postnatal subventricular zone are required for neural stem cell self-renewal[J].EMBO Journal,2005,24(19):3504-3515.
[15] 韩羽楠,王振宇.Notch和Wnt信号通路对神经干细胞增殖分化的影响[J].解剖科学进展,2014,20(4):385-387.
[16] 闫荣,罗晓光,张尧,等.星形胶质细胞影响神经干细胞突触表达的神经营养家族基因表达机制探讨[J].中国医科大学学报,2013,42(11):989,992-995.
[17] FreddyJeanneteau,Katrin Deinhardt,Goichi Miyoshi,et al.The MAP kinase phosphatase MKP-1 regulates BDNF-induced axon branching[J].NatureNeuroscience,2010,13(11):1373-1379.
(本文编辑:韩虹娟)
Protective effects of the Tibetan Baimai(BM)therapy on focal cerebral ischemia-reperfusion injuryin rats and the influence of BM therapy on Jagged1 expression of hippocampal dentate gyrus
ZHU Ri-rong,REN Xiao-qiao,MAO Meng,et al.Basic Medical College,Beijing University of Chinese Medicine,Beijing 100029,China
REN Xiao-qiao,E-mail:rxq23111111@126.com
Objective To explore the protective effects of the Baimai(BM)therapy on focal cerebral ischemia-reperfusion injury in rats and the influence of BM therapy on Jagged1 expression of hippocampal dentate gyrus.Methods The focal cerebral ischemia-reperfusion injury models were induced by suture method,inserting thread 1.5 h and reperfusion 7 d and 14 d respectively.The rats were randomly divided into sham-operation group,model group,Baimai therapy group(BMT group).The area of cerebral infarction was observed by TTC staining,the morphological changes of cortex cell was observed by HE staining,and immunohistochemistry method was used to detect hippocampal dentate gyrus Jagged1 positivecell number of each group rats.Results (1)the TTC staining result showed that normal brain tissue was bright red,infarction area of the brain was pale,and with the prolongation of reperfusion time,the infarct area was enlarged.The areas of cerebral infarction of BMT group were less than model group,and there was a significant difference compared with model group on 14 days(P<0.05).(2)HE staining showed that degree of injury of cortical neurons in the cerebral ischemia group was lower than that in the model group.(3)BM therapy can increase hippocampal dentate gyrus Jagged1 expression of cerebral ischemia rats,Jagged1 positive cells was higher than model group and control group,the result had significant difference(P<0.05),after having operation 7 days and 14 days.Conclusions BM therapy has certain protective effect on focal cerebral ischemia-reperfusion injury,and can promote Jagged1 expression in hippocampal dentate gyrus after rats having focal cerebral ischemia-reperfusion injury,the increase of Jagged1 expression may be one of the molecular mechanisms of the proliferation and differentiation of endogenous neural stem cells after cerebral ischemia injury via the Notch pathway.
Baimai therapy; Jagged1; Hippocampal dentate gyrus; Focal cerebral ischemiareperfusion model
R285.5
A
10.3969/j.issn.1674-1749.2016.06.001
国家自然科学基金(81360575)
100029 北京中医药大学基础医学院[祝日荣(硕士研究生)、王明强(硕士研究生)、郭慧娟(硕士研究生)、葛东宇、李根茂、郑丽娟(硕士研究生)];北京中医药大学民族医药学研究所(任小巧、毛萌);西藏自治区西藏藏医学院(仁青加)
祝日荣(1989-),女,2013级在读硕士研究生。研究方向:中医诊断学。E-mail:zhurirong1@ 163.com
任小巧(1965-),女,博士,教授。研究方向:民族医药与现代疾病的证治规律研究。E-mail:rxq23111111@126.com
2016-01-19)
