壳寡糖对红鳍东方鲀血液指标和非特异性免疫指标的影响
2016-09-06苏鹏潘金露韩雨哲刘海映霍圃宇孙航姜志强大连海洋大学水产与生命学院农业部北方海水增养殖重点实验室辽宁大连116023
苏鹏,潘金露,韩雨哲,刘海映,霍圃宇,孙航,姜志强(大连海洋大学水产与生命学院,农业部北方海水增养殖重点实验室,辽宁大连116023)
壳寡糖对红鳍东方鲀血液指标和非特异性免疫指标的影响
苏鹏,潘金露,韩雨哲,刘海映,霍圃宇,孙航,姜志强
(大连海洋大学水产与生命学院,农业部北方海水增养殖重点实验室,辽宁大连116023)
为研究壳寡糖 (chitosan-oligosaccbarides,COS)对红鳍东方鲀Takifugu rubripes血清和血液生化指标及非特异性免疫指标的影响,选用体质量为 (129.2±3.1)g的红鳍东方鲀600尾,随机分为C0、C1、C2、C3 4组,每组设3个平行,在基础饲料中分别添加0、500、1000、2000 mg/kg的壳寡糖,经56 d饲养后,测定其血液指标、抗氧化酶活性及其攻毒耐受性。结果表明:饲料中添加壳寡糖能显著提高血清中碱性磷酸酶、溶菌酶、过氧化氢酶、超氧化物歧化酶活力和全血中血小板数量 (P<0.05),各项指标随壳寡糖添加量的增加整体呈升高趋势;饲料中添加壳寡糖能显著提高红鳍东方鲀肝脏组织中过氧化氢酶、超氧化物歧化酶活力 (P<0.05),显著降低丙二醛含量(P<0.05);壳寡糖能明显提高红鳍东方鲀对迟缓爱德华氏菌和哈维弧菌的抵抗力。研究表明,在本试验条件下,饲料中添加2000 mg/kg壳寡糖能够提高红鳍东方鲀的非特异性免疫功能。
红鳍东方鲀;壳寡糖;血清生化指标;非特异性免疫
壳寡糖 (chitosan-oligosaccbarides,COS)由壳聚糖降解获得,是由2~10个氨基葡萄糖通过β-1,4糖苷键连接而成的低聚糖,壳寡糖具有比壳聚糖水溶性高、黏度低等物理特性,还表现出比壳聚糖更高的抗菌、抗炎、免疫增强等生理活性[1-2]。目前,关于壳寡糖在水产饲料中的应用研究主要集中在鲤Cyprinus carpio[3]、牙鲆Paralichthys olivaceus[4]、大黄鱼Pseudosciaena crocea[5]、吉富罗非鱼 Oreochromis niloticus[6-7]、大菱鲆 Scophthalmus maximus[8-9]、锦鲤 Cyprinus carpio koi[10]、虹鳟 oncorhynchus mykiss[11]、斑节对虾 Penaeus mondon[12]等水产动物中,研究结果表明,在饲料中添加适量的壳寡糖能够发挥抗菌、抗炎等生物学功能,提高机体的免疫力,改善水产动物的生产性能[13]。
红鳍东方鲀 Takifugu rubripes隶属于鲀形目Telraodontiformes、鲀科 Teraodontoidae、东方鲀属Takifugu。红鳍东方鲀属于河鲀鱼中经济价值较高的一个种类,养殖过程中多采用高密度集约化方式,由于养殖密度过大,常导致环境压力过大,并由此导致鱼体大范围疾病的暴发;由于红鳍东方鲀彼此间相互撕咬,易导致体表损伤,并引发感染,因此,如何提高其免疫力显得尤为重要。鱼类主要依赖非特异性免疫系统抵御外界病原体或细菌的侵袭[14],有关壳寡糖等饲料添加剂在鲀属中的应用研究较少,Hua等[15]研究发现,在饲料中添加壳聚糖可以增强暗纹东方鲀Takifugu obscurus的免疫力,且壳聚糖和益生菌混合后还可以显著增强鱼体的免疫力。但未见壳聚糖和壳寡糖对红鳍东方鲀非特异性免疫影响的相关报道,红鳍东方鲀和暗纹东方鲀均属于鲀属,推测添加壳寡糖可能会增强红鳍东方鲀的免疫力。
本试验中,以红鳍东方鲀为研究对象,通过在饲料中添加不同水平的壳寡糖,研究壳寡糖对红鳍东方鲀血液指标和非特异性免疫酶指标的影响,并找到适宜的饲料添加量,以期为开发红鳍东方鲀免疫增强剂提供理论依据。
1 材料与方法
1.1材料
试验鱼选用体质量为 (129.2±3.1)g的红鳍东方鲀。
壳寡糖由中国科学院大连化学物理研究所提供,其聚合度为2~8,脱乙酰度大于95%。
1.2方法
1.2.1试验饲料的制备 将质量分数为28%的鱼粉、14%的玉米胚芽粕、22.4%的豆粕、3.5%的啤酒酵母、1.4%的预混料混合均匀,过80目网筛,加入30%的鲜杂鱼 (玉筋鱼 Ammodytes personatus),混匀,通过饲料机制成直径为4 mm的基础颗粒饲料。经测定,饲料的水分为29.3%,粗蛋白质为42.55%,粗脂肪为11.96%,灰分为11.5%。在基础饲料原料中分别添加含量为0(C0组,对照)、500 mg/kg(C1组)、1000 mg/kg (C2组)、2000 mg/kg(C3组)的壳寡糖 (COS),采用逐级混匀,制成的试验饲料于冰箱 (-20℃)中保存备用。其中预混料中每千克饲料提供的维生素和微量元素为:维生素D30.25 mg,维生素A 12 mg,维生素K380 mg,维生素E 400 mg,维生素B120.4 mg,维生素B6240 mg,维生素B2200 mg,维生素B1100 mg,高稳定 VC 40 mg,肌醇300 mg,泛酸钙120 mg,叶酸8 mg,烟酸120 mg,铁100 mg,锰50 mg,锌30 mg,硒0.6 mg,铜20 mg,生物素1 mg。
1.2.2试验设计与管理 将600尾试验鱼随机分为4组,每组设3个平行,每个平行放50尾鱼,放养于大连大黑石天正养殖场中试车间的蓝色塑料水槽内静水养殖,水体为2 m3。试验开始前用基础颗粒饲料驯化3周,使试验鱼适应养殖环境进入正常摄食饲料状态。3周后开始正式试验,投喂量为表观饱食投喂,每天08:00、14:00各投喂1次,16:00换水1次,换水量为总水体的1/2,在换水期间需进行吸底,同时收集粪便残饵.试验期间,24 h充气,水温为 (17.0±2.0)℃,自然光照,试验时间为56 d。在此期间及时捞出死亡个体并记录。
1.2.3样品的制备 试验结束后,进行血清生化指标、全血常规和肝脏组织非特异性免疫指标的测定。
全血的抽取:从每桶随机取5尾鱼,使用一次性注射器 (1 mL)进行静脉抽血,抽血时针头使用抗凝剂 (肝素钠浓度为1600 IU/mL)润洗,并将全血分装在2 mL的离心管中,于4℃下保存。
血清的制备:取一次性注射器,不使用抗凝剂,取出全血,4℃下静置5 min,再以4000 r/min离心10 min,取上层血清,一管血清放入液氮中速冻,然后转至超低温冰箱 (-80℃)中冷冻保存,以进行酶活力的测定;另一管血清于冰箱中 (4℃)保存并于24 h内完成血清生化指标的测定。
肝脏组织样品的制备:试验结束后停止投喂24 h,从各组随机取5尾鱼,于冰盘上进行解剖,将肝脏样品于液氮中速冻,然后转移至超低温冰箱(-80℃)中保存。从冰箱中取出肝脏样品,剪碎后使用玻璃匀浆器冰上进行研磨,在此过程中,加入4倍样品重的生理盐水,在4℃下以 10 000 r/min离心10 min,上清液置于冰箱 (4℃)中保存,并配制成20%的组织匀浆液用于酶活性的测定,24 h内测定完毕。
1.2.4指标的测定 血清中血糖 (GLU)、白球比(A/G)、总蛋白 (TP)、三酰甘油 (TG)、总胆固醇 (TCH)、低密度脂蛋白胆固醇 (LDL)、高密度脂蛋白胆固醇 (HDL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸转移酶 (AST)、碱性磷酸酶(AKP)指标均用日立7180分析仪 (日本)测定,全血中平均血红蛋白、平均血红蛋白浓度、平均红细胞体积、红细胞压积、血红蛋白、血小板、红细胞、白细胞指标均用西斯美康XE-2100D(日本)仪直接测得。
按照试剂盒 (购自南京建成)说明书进行血清超氧化物歧化酶 (SOD)、溶菌酶 (LZM)、过氧化氢酶 (CAT)活力和肝脏 CAT、SOD活力、丙二醛 (MDA)含量的测定。用考马斯亮兰蛋白试剂盒进行组织匀浆液蛋白质含量的测定。
1.2.5攻毒试验 养殖试验结束后,从每个水槽随机抽取5尾鱼移到200 L蓝色槽子中暂养5 d,待鱼体适应环境后,使用一次性注射器通过背部肌肉分别注射浓度为0.5×108cfu/mL的迟缓爱德华氏菌 (迟缓2CDM001,来自大连海洋大学细菌库)和哈维弧菌 (哈维2SYX 002 H06091,来自大连海洋大学细菌库)菌液0.5 mL/尾 (浓度为经预试验确定的半数致死量),另设一组未注射任何菌的组为对照,观察并记录鱼的状态、死亡数量和死亡时间,试验期间不投喂,水温为 (16±1)℃,24 h充气。
1.3数据处理
将试验数据经Excel 2007软件整理后,以平均值±标准差 (mean±S.D.)表示。用SPSS 19.0软件对数据进行单因子方差分析 (One-Way ANOVY),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1各组红鳍东方鲀血液指标
从表1可见:饲料中添加壳寡糖,对红鳍东方鲀血清中的血糖、总胆固醇、三酰甘油、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、丙氨酸氨基转移酶、天门冬氨基酸转移酶、总蛋白、白蛋白和白球比的影响均未达到显著性水平 (P>0.05);仅壳寡糖添加量为2000 mg/kg时,血清中碱性磷酸酶活力显著升高 (P<0.05)。
从表2可见:全血中白细胞、红细胞、血红蛋白、红细胞压积、平均红细胞体积和平均血红蛋白浓度各组间均无显著性差异 (P>0.05);饲料中添加壳寡糖能显著增加红鳍东方鲀血小板数量 (P<0.05)。
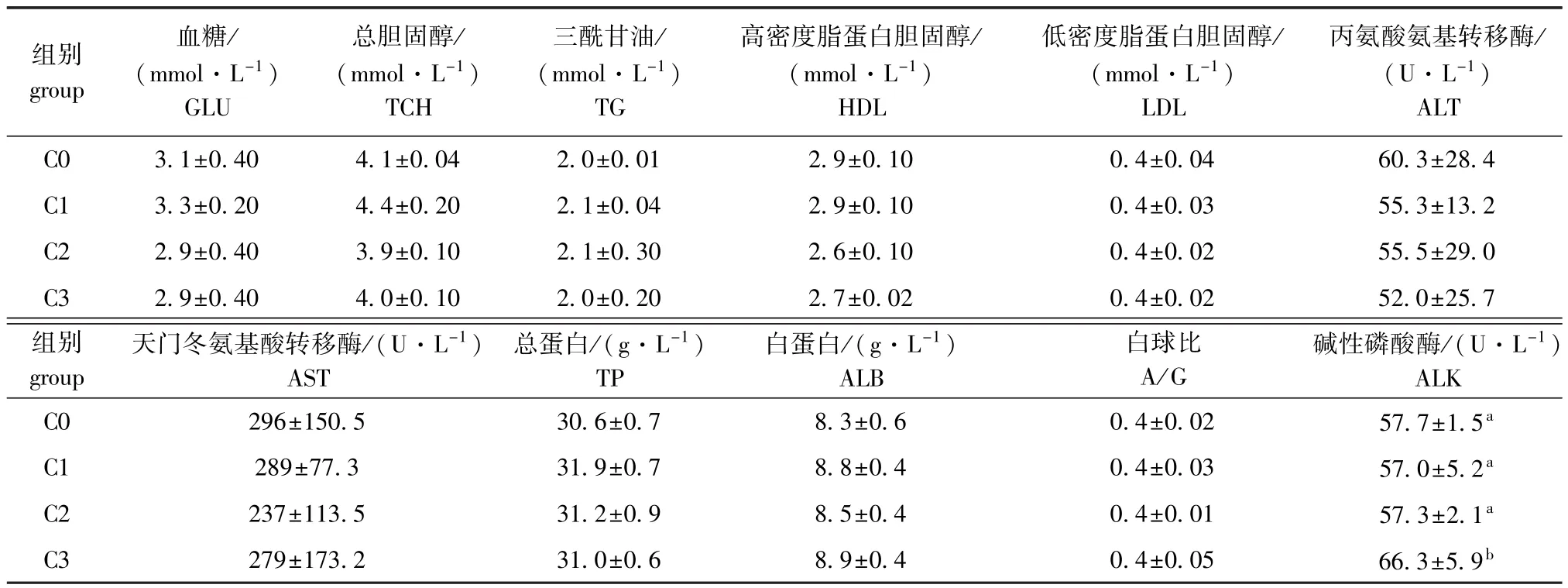
表1 饲料中不同壳寡糖水平对红鳍东方鲀血清生化指标的影响Tab.1 Effects of chitosan-oligosaccharides(COS)on the biochemical indices in serum of redfin puffer Takifugu rubripe
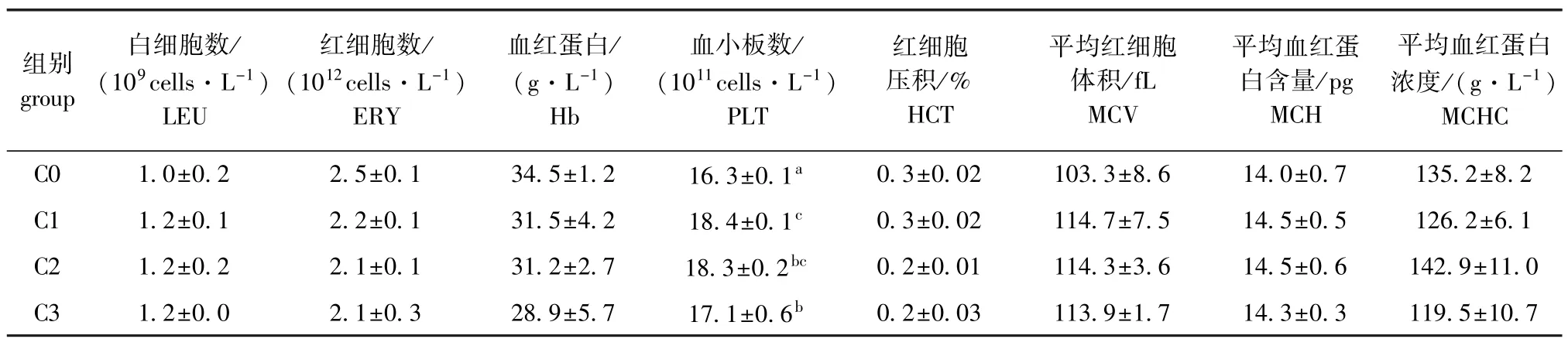
表2 饲料中不同壳寡糖水平对红鳍东方鲀血液生化指标的影响Tab.2 Effects of COS on the biochemical parameters in blood of redfin puffer Takifugu rubripes
2.2各组红鳍东方鲀血清非特异性免疫指标
从表3可见:饲料中添加壳寡糖能显著提高血清LZM、CAT、SOD活力,随着壳寡糖添加量的增加,各组血清LZM、CAT活力均呈逐渐上升的趋势,而SOD活力则呈先降低后升高的趋势;壳寡糖添加组血清LZM活力均显著高于对照组 (P<0.05),仅C3组血清 CAT活力显著高于对照组(P<0.05),C1、C2组血清SOD活力显著低于对照组 (P<0.05),而C3组血清SOD活力则显著高于对照组 (P<0.05);血清LZM、CAT、SOD活力均在C3组达到最大值。
2.3各组红鳍东方鲀肝脏SOD、CAT和MDA活力
从表4可见:饲料中添加壳寡糖能显著影响肝脏CAT、SOD活力和MDA含量,随着壳寡糖添加量的增加,各组肝脏CAT、SOD活力均呈逐渐上升的趋势,而MDA含量则呈逐渐降低的趋势;仅C3组肝脏CAT、SOD活力显著高于对照组 (P<0.05),各壳寡糖添加组肝脏MDA含量均显著低于对照组 (P<0.05);肝脏CAT、SOD活力均在C3组达到最大值,MDA含量在C3组达到最小值。
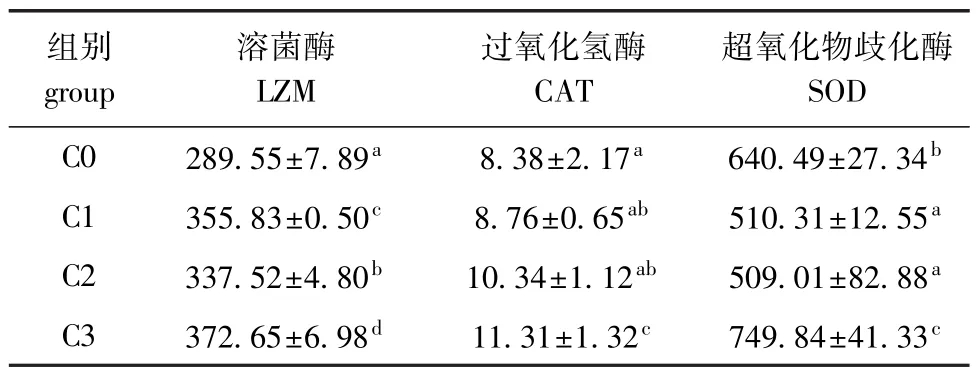
表3 饲料中不同壳寡糖水平对红鳍东方鲀血清非特异性免疫酶活力的影响Tab.3 Effects of COS on the activities of non-specific immune enzymes in serum of redfin puffer Takifugu rubripes U/mL

表4 饲料中不同壳寡糖水平对红鳍东方鲀肝脏非特异性酶活力的影响Tab.4 Effects of COS on the activities of non-specific immune enzymes in liver of redfin puffer Takifugu rubripes
2.4两种病原菌对红鳍东方鲀的攻毒试验
图1为注射哈维弧菌后各试验组红鳍东方鲀累计死亡率统计图,注射哈维弧菌后的前10 d,红鳍东方鲀均无死亡,从第11天开始逐渐死亡,对照组 (C0)组在第13天时全部死亡,其余组鱼在第14天时全部死亡,壳寡糖添加组鱼的死亡率明显低于对照组。
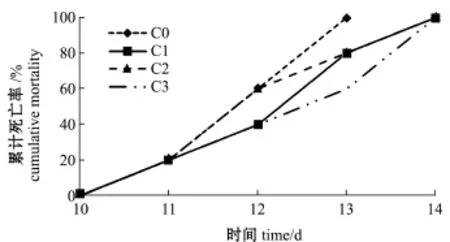
图1 注射哈维弧菌对红鳍东方鲀累计死亡率的影响Fig.1 Cumulative mortality of redfin puffer Takifugu rubripes fed diets containing different COS levels and challenged with Vibrio harveyi
图2为注射迟缓爱德华氏菌后各试验组红鳍东方鲀累计死亡率统计图,注射迟缓爱德华氏菌的红鳍东方鲀在前10 d均无死亡,对照组鱼在第12天时全部死亡,其余组鱼在第13天时全部死亡 (C1 和C2组重叠),壳寡糖添加组鱼的死亡率明显低于对照组。
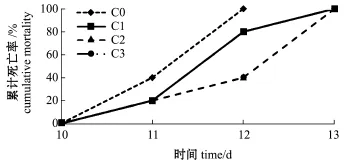
图2 注射迟缓爱德华氏菌对红鳍东方鲀累计死亡率的影响Fig.2 Cumulative mortality of redfin puffer Takifugu rubripes fed diets containing different COS levels and challenged with Edwardsiella tarda
3 讨论
3.1壳寡糖对红鳍东方鲀血清生化指标的影响
血脂主要包括甘油三酯和胆固醇,还有少量的类脂、类固醇等,血液中胆固醇过高会引发高胆固醇血症。壳寡糖能够降低血清中血脂的含量,进而改善脂类代谢。Luo等[16]研究表明,壳寡糖能够降低虹鳟血液中皮质醇水平,并显著增强虹鳟体细胞的吞噬能力,更好地发挥出抗菌和抗应激作用。孙立威等[6]研究表明,在饲料中添加壳寡糖能使吉富罗非鱼幼鱼血清TCH和LDL水平显著下降,有利于鱼体健康。血清中转氨酶在氨基酸代谢以及与蛋白质、脂肪和糖三者相互转化的过程中起着极其重要的作用,当体内肝功能发生障碍时,常表现出谷丙转氨酶活性升高[11]。血清中血糖含量可直接反映机体的营养状况,当血清中血糖含量较高时,鱼类积极摄食,故血清生化指标的变化可作为评价鱼体健康状况的依据。刘含亮等[11]研究表明,饲料中添加壳寡糖可显著增强虹鳟血清中白蛋白、总蛋白和球蛋白水平,增强白细胞吞噬率、吞噬指数,以及虹鳟的增重率和蛋白质效率,提高鱼体的免疫能力。
本研究中探讨了不同壳寡糖添加水平对红鳍东方鲀血清生化指标影响,结果显示,壳寡糖添加组红鳍东方鲀血清中总蛋白、白蛋白含量略有提高,丙氨酸氨基转移酶、天门冬氨基酸转移酶活性略有降低,说明壳寡糖可能提高了饲料蛋白质在体内的沉积,在一定程度上也反映了红鳍东方鲀的健康水平。C2和C3组血清中胆固醇较对照组有降低趋势,说明壳寡糖的添加可能加速血脂在肝脏内转化为胆汁酸,减少了血脂胆固醇量,进而降低血脂。
3.2壳寡糖对红鳍东方鲀全血血液指标的影响
全血中白细胞、红细胞、血红蛋白、血小板等是血液中重要的免疫细胞,在细胞免疫中,血液的白细胞能够治愈伤病的损伤,提高抗御病原体入侵的能力,且具有吞噬异物并产生抗体的作用。Lin等[10]研究表明,饲料中添加2 g/kg壳寡糖可显著增加血清中的总白细胞数量。红细胞和血红蛋白负责体内的氧气运输,再从各部位运送出代谢产物二氧化碳。血小板的主要功能是凝血和止血,修补破损的血管。本研究结果表明,不同壳寡糖添加水平提高了红鳍东方鲀全血中白细胞数量,且显著提高了血小板数量,说明在饲料中添加壳寡糖可提高红鳍东方鲀的免疫力,发挥抗菌、抗炎等生物特性。
3.3壳寡糖对红鳍东方鲀血清 LZM、SOD、AKP酶活力的影响
鱼类作为低等的脊椎动物,非特异性免疫防御是抵抗病原最重要的屏障,除皮肤、黏膜外,还主要包括非特异性免疫酶如LZM、SOD等[15]。LZM是一种专门作用于微生物细胞壁的水解酶,它可以破坏细菌的细胞壁,使细菌细胞壁松弛而失去对细菌细胞的保护作用,最终使细菌破解死亡,LZM也是鱼类非特异性免疫的重要组成部分[16],其活性直接关系到鱼体的免疫状态。Cha等[4]用添加1%壳寡糖的饲料喂养牙鲆Palichthy olivaceus,10周后,牙鲆的LZM、髓过氧化物酶等免疫功能与对照组相比有显著增强。刘含亮等[11]、Lin等[10]对虹鳟和鲤的研究结果相似,在饲料中添加壳寡糖可显著增强血清的LZM活性。本试验结果与上述结果类似,饲料中添加壳寡糖后,红鳍东方鲀血清中LZM活力显著高于对照组,LZM活力最大组相对于对照组提高了83.1%,显著提高了鱼体的非特异性免疫能力。可能是因为壳寡糖的活性成分可以促进有益菌的增值,而有益菌可以激活巨噬细胞、粒细胞等免疫细胞的活性,进而促进分泌溶菌酶的能力,使其在血清中的浓度增加,提高了机体的抗体水平[17]。
SOD是一种能够通过歧化反应催化超氧化物,将超氧化物转化为氧气和过氧化氢的酶。SOD是一种重要的抗氧化剂,可保护暴露于氧气中的细胞,在抗衰老、抗炎症方面起着非常重要的作用,能显著提高机体免疫功能[18]。卢明淼等[19]、沈锦玉等[20]在分别对草鱼和中华绒螯蟹的研究中发现,添加壳寡糖可增强血清中SOD活性,进而增加鱼体免疫力。本试验结果表明,饲料中添加2000 mg/kg壳寡糖组,红鳍东方鲀血清中SOD活力显著高于对照组,较对照组提高了17%,说明一定量的壳寡糖能提高红鳍东方鲀血清中SOD活力,增强鱼体对炎症的抵抗力。
AKP是一种磷酸单酯酶,在生物体内可催化磷酸单酯及磷酸基团的转移反应,并直接参与磷的代谢,维持体内适宜的钙磷比例,与RNA、DNA、脂质和蛋白质等的代谢有关[21-22]。AKP对磷酸钙的沉积、钙质的吸取和骨骼的形成均发挥着非常重要的作用,它是集体防御过氧化损伤系统和有机磷代谢的关键酶,在免疫反应中发挥重要作用[23]。本试验结果表明,饲料中添加2000 mg/kg壳寡糖组的红鳍东方鲀血清中AKP活力显著高于其他组,可能是随着壳寡糖含量的增加,红鳍东方鲀免疫机能得到加强,从而影响了酶的分泌,最终实现了酶量的增加。
CAT是一种可有效从细胞中清除高浓度H2O2的酶[24],存在于细胞的过氧化物体内。本试验中,2000 mg/kg壳寡糖添加组红鳍东方鲀的CAT活性显著高于对照组,说明添加壳寡糖可增强红鳍东方鲀抗氧化能力。
3.4壳寡糖对红鳍东方鲀肝脏SOD、CAT酶活力和MDA含量的影响
肝脏是鱼类合成血清蛋白的主要场所,也是能量代谢的中枢器官,在蛋白质、脂肪和糖类的分解与合成代谢中起着重要作用。肝脏指标的变化是一种对短期和长期营养方式的直接反映,故肝脏功能可作为评价鱼类健康状况的重要指标。本试验中,饲料中添加壳寡糖的红鳍东方鲀,肝脏中SOD、CAT活力和MDA含量与对照组相比均达到显著性差异。SOD活力最大值较对照组提高了25%,说明饲料中添加壳寡糖能够加速红鳍东方鲀肝脏对代谢过程中产生的活性氧自由基的分解和代谢;CAT活力最大值较对照组提高了79%,说明饲料中添加壳寡糖能显著提高红鳍东方鲀肝脏CAT活力。MDA是膜脂过氧化的终产物之一,具有很强的生物毒性,MDA含量的高低可作为考察细胞受胁迫严重程度的指标之一,MDA主要损伤生物膜结构,改变膜的通透性,影响生理生化反应,进而反映出机体细胞受自由基损伤的程度[25]。本试验中,壳寡糖添加组的MDA含量显著低于对照组,说明添加壳寡糖能够减轻红鳍东方鲀肝脏中自由基对机体的损伤。MDA、SOD、CAT三者有一定的相关性,SOD、CAT活力的升高直接反映鱼体非特异性免疫的增强,MDA含量的降低反映出鱼体肝功能受损较小,可保持肝功能高效地运作,进而反映出鱼体非特异性免疫能力的增强。
3.5壳寡糖在红鳍东方鲀抗细菌感染中的作用
攻毒试验可以较为直接地观察鱼体对细菌感染的抵抗能力,并能间接地反映出鱼体的免疫能力。
迟缓爱德华氏菌是爱德华菌属中的一种,此病流行范围广,发病率及死亡率高,在多种养殖鱼类中均有报道,并引起水产养殖从业者的高度重视[26]。本试验中注射的哈维弧菌是从某养殖场体表溃烂的养殖红鳍东方鲀病灶处分理出的一株优势菌。哈维弧菌是条件致病菌,当水体环境发生变化,鱼体皮肤损伤、寄生虫感染等因素造成鱼体抵抗力降低时,极易感染哈氏弧菌。哈维弧菌可引起多种海水养殖鱼类的溃疡病[27-29]。王斌等[30]给红鳍东方鲀肌肉注射哈维弧菌,发现红鳍东方鲀内脏出现充血,表皮出现溃疡糜烂。张艺等[9]报道,在大菱鲆饲料中添加壳寡糖,能明显提高大菱鲆对迟钝爱德华菌感染的抵抗能力。
本研究在攻毒试验的两周中,注射的两种菌浓度高、剂量大,但红鳍东方鲀在两周后才全部死亡,说明红鳍东方鲀对这两种细菌具有一定的抵抗力,壳寡糖添加组红鳍东方鲀的死亡率均低于对照组,原因可能是:(1)饲料中添加壳寡糖增加了全血中白细胞的含量,吞噬进而消灭了外来细菌,血清中LZM活性的增加可以使大量细菌裂解死亡,血清和肝脏中SOD和CAT可以产生协同作用,大量清除细胞内过量的氧自由基[31],由此产生的一系列反应增强了鱼体的抵抗力;(2)迟缓爱德华氏菌与哈维弧菌均属于革兰氏阴性菌,Wang等[32]研究发现,壳寡糖可通过扩散作用进入细胞核并与DNA结合,干扰革兰氏阴性菌特定的基因转录,进而抑制细菌生长,增强红鳍东方鲀对革兰氏阴性菌的抵抗能力;(3)壳寡糖可以吸附聚集在细胞表面,形成高分子膜,阻止营养物质向细胞内运输,由此起到杀菌作用[33],增强鱼体对细菌的抵抗力。
本试验表明,饲料中添加壳寡糖可提高红鳍东方鲀机体非特异性免疫功能。建议红鳍东方鲀饲料中壳寡糖的适宜添加量为2000 mg/kg。
[1] Huang R L,Yin Y L,Wu G Y,et al.Effect of dietary oligochitosan supplementation on ideal digestibility of nutrients and performance in broilers[J].Poultry Science,2005,84(9):1383-1388.
[2] Kim S K,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):a review[J].Carbohydrate Polymers,2005,62(4):357-368.
[3] Gopalakannan A,Arul V.Immunomodulatory effects of dietary intake of chitin,chitosan and levamisole on the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds[J].Aquaculture,2006,255(1-4):179-187.
[4] Cha S H,Lee J S,Song C K,et al.Effects of chitosan-coated diet on improving water quality and innate immunity in the olive flounder,Paralichthys olivaceus[J].Aquaculture,2008,278(1-4):110-118.
[5] 徐后国.几种新型免疫增强剂对大黄鱼幼鱼生长、存活、免疫力及抗病力的影响[D].青岛:中国海洋大学,2010.
[6] 孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[7] Qin Chubin,Zhang Yuting,Liu Wenshu,et al.Effects of chito-oligosaccharides supplementation on growth performance,intestinal cytokine expression,autochthonous gut bacteria and disease resistance in hybrid tilapia Oreochromis niloticus×Oreochromis aureus[J].Fish&Shellfish Immunology,2014,40(1):267-274.
[8] 崔丽卿.稀土及稀土壳寡糖配合物对大菱鲆生长、非特异性免疫以及镉含量的影响[D].青岛:中国海洋大学,2012.
[9] 张艺,徐玮,崔丽卿,等.壳寡糖对大菱鲆生长和免疫功能的影响[J].中国海洋大学学报:自然科学版,2012,42(10):71-74.
[10] Lin Shimei,Mao Shuhong,Guan Yong,et al.Effects of dietary chitosan oligosaccharides and Bacillus coagulans on the growth,innate immunity and resistance of koi(Cyprinus carpio koi)[J]. Aquaculture,2012,342-343:36-41.
[11] 刘含亮,孙敏敏,王红卫,等.壳寡糖对虹鳟生长性能、血清生化指标及非特异性免疫功能的影响[J].动物营养学报,2012,24(3):479-486.
[12] Niu J,Lin H Z,Jiang S G,et al.Comparison of effect of chitin,chitosan,chitosan oligosaccharide and N-acetyl-D-glucosamine on growth performance,antioxidant defenses and oxidative stress status of Penaeus monodon[J].Aquaculture,2013,372-375:1-8.
[13] 梁新晓,綦文涛,王永伟,等.壳寡糖的生物学功能及其在动物营养中的应用研究进展[J].中国畜牧兽医,2014,41(2):78-82.
[14] Magnadóttir B.Innate immunity of fish(overview)[J].Fish& Shellfish Immunology,2006,20(2):137-151.
[15] Hua Xueming,Zhou Hongqi,Zhang Dongqing,et al.Effect of di-etary chitosan and probiotics on disease resistance immunity of obscure puffer(Fugu obscurus)[J].Journal of Fisheries of China,2007,31(4):478-486.
[16] Luo Lin,Cai Xuefeng,He Chu'an,et al.Immune response,stress resistance and bacterial challenge in juvenile rainbow trout Oncorhynchus mykiss fed diets containing chitosan-oligosaccharides [J].Current Zoology,2009,55(6):1-14.
[17] 张永安,孙宝剑,聂品.鱼类免疫组织和细胞的研究概况[J].水生生物学报,2000,24(6):648-654.
[18] Callewaert L,Michiels C W.Lysozymes in the animal kingdom [J].Journal of Biosciences,2010,35(1):127-160.
[19] 卢明淼,陈孝煊,吴志新,等.果寡糖对草鱼非特异性免疫功能的影响[J].华中农业大学学报,2010,29(2):213-216.
[20] 沈锦玉,刘问,曹铮,等.免疫增强剂对中华绒螯蟹免疫功能的影响[J].浙江农业学报,2004,16(1):25-29.
[21] Fernley H N.18 mammalian alkaline phosphatases[J].The Enzymes,1971,4:417-447.
[22] Chen Qingxi,Zhang Wei,Zheng Wenzhu,et al.Kinetics of inhibition of alkaline phosphatase from green crab(Scylla serrata)by N-bromosuccinimide[J].Journal of Protein Chemistry,1996,15 (4):345-350.
[23] 艾春香,陈立侨,高露姣,等.VC对河蟹血清和组织中超氧化物歧化酶及磷酸酶活性的影响[J].台湾海峡,2002,21(4):431-438.
[24] Del Maestro R F.An approach to free radicals in medicine and biology[J].Acta Physiologica Scandinavica Supplementum,1980, 492:153-168.
[25] Gu Jun,Gong Jingjan,Yin Yuebao,et al.Effects of intermittent hyperbaric oxygen exposure and oxygen convulsions on antioxidant enzyme activity and lipid peroxide contents in rats[J].Chinese Journal of Nautical Medicine,1995,2(4):31-34.
[26] 陈翠珍.爱德华氏菌及鱼类爱德华氏菌病(综述)[J].河北科技师范学院学报,2004,18(3):70-76.
[27] 范文辉,黄倢,王秀华,等.养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析[J].微生物学报,2005,45(5):665-670.
[28] 覃映雪,池信才,苏永全,等.网箱养殖青石斑鱼的溃疡病病原[J].水产学报,2004,28(3):297-302.
[29] 王保坤,余俊红,李筠,等.花鲈弧菌病病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2002,9(1):52-55.
[30] 王斌,于兰萍,胡亮,等.红鳍东方鲀皮肤溃烂病病原菌的分离与鉴定[J].中国水产科学,2008,15(2):352-358.
[31] Livingsytone D R.Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms[J]. Marine Pollution Bulletin,2001,42(8):656-666.
[32] Wang Yan,Zhou Peigen,Yu Jianxing,et al.Antimicrobial effect of chitooligosaccharides produced by chitosanase from Pseudomonas CUY8[J].Asia Pacific Journal of Clinical Nutrition,2007,16(S1):174-177.
[33] 叶磊,何立千,高天洲,等.壳聚糖的抑菌作用及其稳定性研究[J].北京联合大学学报:自然科学版,2004,18(1):79-82.
Effects of dietary chitosan on hematological parameters and non-specific immunity of redfin puffer Takifugu rubripes
SU Peng,PAN Jin-lu,HAN Yu-zhe,LIU Hai-ying,HUO Pu-yu,SUN Hang,JIANG Zhi-qiang
(College of Fisheries and Life Science,Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Juvenile redfin puffer Takifugu rubripes with body weight of(129.2±3.1)g were reared in a plastic 2 m3tank at a density of 50 fish per treatment and fed a basal diet supplemented with chitosan-oligosaccharides at dose of 0(C0),500(C1),1000(C2)and 2000(C3)mg/kg for 56 days at water temperature of(17.0±2.0)℃ with triplication to evaluate the effects of chito-oligosaccharides on serum,blood biochemical parameters and non-specific immunity function of redfin puffer.The results showed that there were significantly higher contents of blood platelet and higher activities of serum alkaline phosphatase,lysozyme,catalase,and superoxide dismutase in the fish fed the diets supplemented with chitosan-oligosaccharides than those in the fish fed the control diet(P<0.05),increase with elevated dose of chitosan-oligosaccharides.The redfin puffer juveniles fed the diets containing chitosanoligosaccharides had significantly higher activities of hepatic catalase,and superoxide dismutase and significantly lower malondialdehyde content in liver than the fish fed the control diet(P<0.05).The redfin puffer juveniles fed the diets containing chitosan-oligosaccharides showed high resistance to Edwardsiella tarda and Vibrio harvey.It can be concluded that dietary supplementation of chito-oligosaccharides can improve the non-specific immunity function of redfin puffer,and that the supplemental level of chitosan-oligosaccharides in diets is suggested to be 2000 mg/kg diet.
Takifugu rubripes;chitosan-oligosaccharide;serum biochemical parameter;non-specific immunity
S965.225
A
10.16535/j.cnki.dlhyxb.2016.01.007
2095-1388(2016)01-0037-07
2015-05-17
国家海洋公益性行业科研专项 (201405003);辽宁省科技厅重大项目 (2014203015)
苏鹏 (1989—),男,硕士研究生。E-mail:468152515@qq.com
姜志强 (1960—),男,教授。E-mail:zhqjiang@dlou.edu.cn
