纹党产地初加工工艺的优化
2016-09-06强思思郑晓萍胡林海胡芳弟李应东兰州大学药学院甘肃兰州70000嘉峪关市第一人民医院脊柱外科甘肃嘉峪关7500甘肃中医药大学甘肃兰州70000
高 霞, 强思思#, 郑晓萍, 胡林海, 胡芳弟*, 李应东(.兰州大学药学院,甘肃兰州70000;.嘉峪关市第一人民医院脊柱外科,甘肃嘉峪关7500;.甘肃中医药大学,甘肃兰州70000)
[饮片炮制]
纹党产地初加工工艺的优化
高 霞1, 强思思1#, 郑晓萍1, 胡林海2, 胡芳弟1*, 李应东3
(1.兰州大学药学院,甘肃兰州730000;2.嘉峪关市第一人民医院脊柱外科,甘肃嘉峪关735100;3.甘肃中医药大学,甘肃兰州730000)
目的 优化甘肃文县产纹党Codonopsis pilosula的产地初加工工艺。方法 建立18批样品的HPLC指纹图谱,高效液相色谱-串联质谱(HPLC-MS/MS)法对色谱峰进行鉴定,DPPH法测定抗氧化活性,偏最小二乘(PLS)法分析谱效关系。结果 HPLC指纹图谱中有26个共有峰,其中有9个特征峰对抗氧化活性的贡献较大,尤以党参炔苷为最。结论 最佳产地初加工工艺为鲜纹党在80℃烘至鲜药材净重的64%后,50℃下烘至恒重。
纹党;产地初加工;HPLC指纹图谱;抗氧化活性;谱效关系;HPLC-MS/MS;DPPH;PLS
中药产地加工是指药材采收后进行挑选、冲洗、粗切、浸漂、蒸煮、发汗、熏烤、干燥等初步加工过程[1],其中纹党的传统产地加工方法为首先让淘洗后的党参根体发软,然后将其用细麻绳串起来,晒到三四成干后进行揉搓,捆成小捆,堆放“发汗”,继续晾晒,揉搓后再晒,如此反复多次,最后晒干[2-3],整个过程费时、耗力[4-5],成药的质量易受天气和温度的影响[6-7]。由于缺乏医药监督部门严格监管,再加上纹党产地加工的手工操作多、体力劳动强度大,造成药农为了追求经济利润而粗制乱造,还有一些不法药材商利用加工技术不统一,采用掺杂造假、以次充优等非法手段,很难保证纹党药材的质量[8]。另外,前期研究表明,某些传统的药材产地加工方式会造成活性成分大量降解[9],故研究一种简单、可行的鲜纹党产地初加工工艺是提高和改善药材品质的迫切要求。
中药指纹图谱作为一种重要的质量控制方法,在评价药材的化学成分及其含有量差异上得到广泛应用[10]。双波长指纹图谱可增加分析时所需的共有峰数量,放大药材加工过程中成分的精细变化,可作为药材加工过程中的质量控制手段[11]。近年来,通过中药指纹图谱与其生物活性构建的谱效关联已成功应用于中药质量的评估[12-13]。本实验首先建立烘干、真空冷冻干燥、微波干燥及传统加工方式制备的18批样品的HPLC指纹图谱,考查不同方式制得药材中5-羟甲基糠醛(5-HMF)及其他主要化学成分的变化,并研究其抗氧化活性。同时,采用PLS法分析谱效关系,再通过高效液相色谱-串联质谱(HPLC-MS/MS)法对相关峰进行鉴定,以期筛选出最佳鲜纹党产地初加工工艺。
1 仪器与材料
Agi1ent 1260系列高效液相色谱仪,包括LC open LAB CDS色谱数据系统;UV-1700紫外分光光度计 (日本Shimadzu公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);真空冷冻干燥机(美国Labconco FreeZone©公司);微波炉(格兰仕有限责任公司);分析天平 (赛多利斯科学仪器北京有限公司);旋转蒸发仪 (日本Eye1a公司);超声波清洗仪 (常州诺基仪器有限公司)。
党参炔苷对照品购自中国食品药品检定研究院,批号136085-37-5;5-羟甲基糠醛购自Sigma-A1drich公司,批号101505508。甲醇、乙腈为色谱纯;乙醇为分析纯;水为重蒸馏去离子水。HPD-100大孔吸附树脂 (郑州勤实科技有限公司)。纹党药材采自甘肃省文县中寨镇大海村踏坪,经兰州大学药学院周印所教授鉴定为纹党参Codonopsis pilosula的根。
2 方法与结果
2.1烘干
2.1.1新工艺Ⅰ 取同一批鲜纹党,均分为8份,每份2.00 kg,在80℃下烘至鲜药材净重的50%、57%、64%、71%、79%、86%、93%、100%,50℃下烘至恒重,制得8个样品,编号为S1~S8。每个样品平行3份,具体见表1。
2.1.2新工艺Ⅱ 取同一批鲜纹党,均分为7份,每份2.00 kg,分别在50、60、70、90、100、110、120℃下烘至鲜药材净重的64%后,50℃下烘至恒重,制得7个样品,分别编号为S9~S15。每个样品平行3份,具体见表1。
2.2真空冷冻干燥 取同一批鲜纹党1.00 kg,放入冻干箱内的搁板上,开启真空泵,使内部压强降低,此时进入升华干燥阶段,除去自由水和结合水至恒重,备用,编号为S16。每个样品平行3份,具体见表1。
2.3微波干燥 取同一批鲜纹党1.00 kg,置于微波炉内,高档功率 (750 W)下加热,每隔1 min翻动1次,观察样品外观变化,并称定质量至恒重,编号为S17。每个样品平行3份,具体见表1。
2.4 传统加工方法 取同一批鲜纹党20.0 kg,按淘洗—上串—晾晒—揉搓—发汗—揉搓—清洗—整形 (修枝)—晾晒至恒重[2]步骤操作,编号S18。具体见表1。
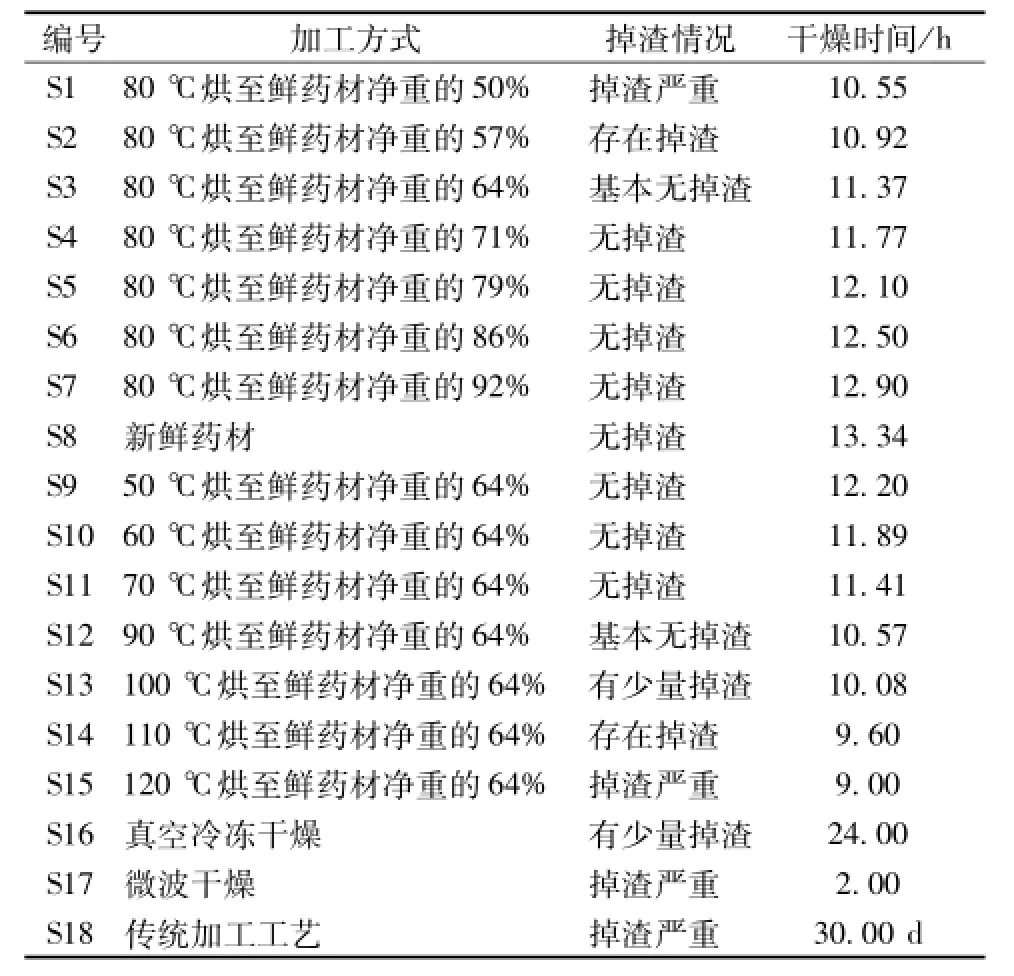
表1 鲜纹党产地初加工工艺Tab.1 Habitat primary processing technologies of fresh Codonopsis pliosula
2.5纹党药材的指纹图谱研究
2.5.1色谱条件 Diamonsi1C18色谱柱(250 mm× 4.6 mm,5μm);流动相为乙腈 (A)-0.2%乙酸水 (B),梯度洗脱 (0~15 min,10%~20%A;15~25 min,20%A;25~35 min,20%~30%A;35~45 min,30%~45%A;45~50 min,45%~100%A);体积流量1 mL/min;柱温30℃;检测波长267 nm;进样量10μL。
2.5.2对照品溶液的制备 精密称取党参炔苷对照品1.18 mg,置于2 mL量瓶中,甲醇溶解并定容至刻度,摇匀,配制成0.59 mg/mL对照品溶液,0.45μm微孔滤膜过滤,4℃下放置,备用。
精密称取5-羟甲基糠醛对照品2.59 mg,同法配制成1.295 mg/mL对照品溶液,0.45μm微孔滤膜过滤,4℃下放置,备用。
2.5.3供试品溶液的制备 按 《中国药典》2010年版附录中测定醇浸出物的方法制备纹党醇提液[14]。精密移取75 mL醇提液,浓缩至干,甲醇定容至5 m L,以0.5 mL/min吸附速率过大孔吸附树脂柱,100 m L蒸馏水除去杂质,再以150 mL 50%乙醇洗脱,收集洗脱液,浓缩至干,甲醇定容至2 mL,4℃下放置,备用。
2.5.4方法学考察
2.5.4.1精密度试验 取同一供试品溶液,在同1天和连续3 d进样,考察日内精密度和日间精密度,以党参炔苷为参照峰,计算指纹图谱中共有峰的相对保留时间及相对峰面积。结果表明,日内精密度相对保留时间RSD小于1.12%、相对峰面积RSD小于2.70%,而日间精密度相对保留时间RSD小于0.63%、相对峰面积RSD小于2.51%,表明仪器精密度良好。
2.5.4.2稳定性试验 取同一供试品溶液,分别于0、2、4、6、10、24和48 h检测。结果表明,各色谱峰相对保留时间RSD小于1.23%、相对保留时间RSD小于2.51%,表明溶液在室温下48 h内稳定。
2.5.4.3重复性试验 取同一样品,按“2.5.3”项下方法平行制备6份供试品溶液,进样检测。结果表明,各色谱峰相对保留时间RSD小于2.25%、相对保留时间RSD小于5.25%,表明该方法重复性良好。
2.5.5共有峰的选择 选择18个样品指纹图谱中出峰时间基本一致、峰面积较大的峰作为共有峰。在波长267 nm的指纹图谱中,标定出17个共有峰(P1~P17);在波长320 nm的指纹图谱中,标定出9个共有峰 (P1*~P9*),这26个峰的峰面积之和占总峰面积的90%以上。其中,P13通过与标准品保留时间和紫外光谱图比较,鉴定为党参炔苷,见图1,不同加工工艺制得的18个样品的指纹图谱 (267 nm)见图2。然后,与5-羟甲基糠醛标准品的保留时间和紫外光谱图比较,发现仅有S14、S15和S17中含有该成分。
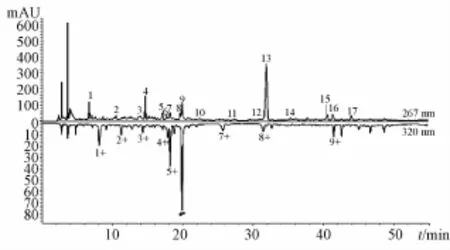
图1 各样品共有峰Fig.1 Common peaks of various samples
图2 各样品指纹图谱(267 nm)Fig.2 Fingerprints of various sam p les(267 nm)
2.5.65-羟甲基糠醛的含有量测定 色谱条件为Diamonsi1C18色谱柱(250 mm×4.6 mm,5μm);流动相乙腈∶0.2%乙酸水 (5∶95);体积流量1 m L/min;柱温30℃;检测波长284 nm;进样量10μL。
取5-羟甲基糠醛贮备液适量,甲醇稀释,配制成0.002、0.004、0.008 1、0.016 2、0.032 5、0.065、0.130 mg/mL标准溶液,以峰面积 (Y)对质量浓度 (X)作标准曲线,得回归方程Y= 71 188X-8.606 9,r=0.999 5。取 “2.5.3”项下供试品溶液,0.45μm微孔滤膜过滤后进样,结果见表2。
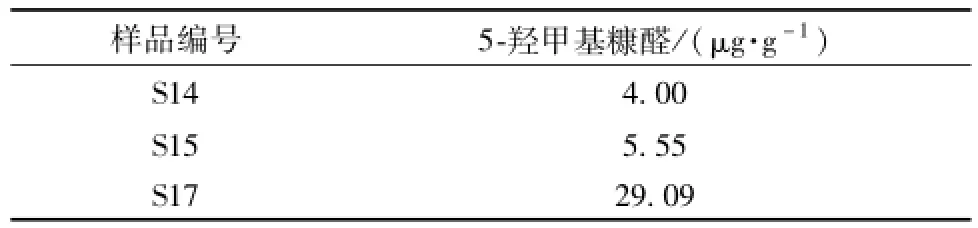
表2 5-羟甲基糠醛含有量测定结果Tab.2 Determ ination resu lts of 5-hydroxym ethylfurfu ral content
2.5.7样品中26个共有峰峰面积与称样量的比值(表3、图3、图4)
由表3可知,80℃烘至不同含水量时,对样品S1~S8指纹图谱中P2,P1*,P2*,P3,P5,P4*,P5*,P8,P6*,P9,P11,P8*,P13,P14,P15,P16和P17的共有峰峰面积与称样量比值有显著的影响,而且不同温度烘至鲜药材净重64%时,样品S9~S15指纹图谱中P1,P2,P1*,P2*,P4,P6,P7,P5*,P8,P6*,P9,P10,P8*,P15,P16,P17的共有峰峰面积与称样量比值也有显著的影响。图3表明,P3,P6*,P9,P1*,P11,P17,P5,P8,P15,P4*,P7*,P8*,P9*的共有峰峰面积与称样量比值均最高。

表3 峰面积与称样量比值Tab.3 Ratios of peak areas to sample weights
图4表明,P1*,P4,P6,P4*,P8,P6*,P9,P15,P16,P17,P7*,P8*,P9*共有峰峰面积与称样量比值均在80℃烘至鲜药材净重的64%时最高。
真空冷冻干燥加工工艺与传统加工方式比较,P1,P2,P5,P5*,P9,P14,P16共有峰的峰面积与称样量比值均以传统加工方式为高;微波干燥工艺与传统加工方式比较,P1,P3*,P5,P6,P7*,P16共有峰的峰面积与称样量比值也均以传统加工方式为高,其他都高于传统加工方式。
2.5.8主要共有峰峰面积与称样量的比值相对传统工艺的变化率 (表4)。
由表可知,各加工方法与传统工艺比较,其平均变化率均为正值。从各峰的变化率来看,除P2*,P3*,P3,P5,P4*,P8,P8*,P14和P16 9个峰呈负相关外,其余均呈正相关。其中,在80℃烘至鲜药材净重的64%后,50℃下烘至恒重时平均变化率最高,为82.49%,说明与传统工艺比较,该方法能最大程度保流纹党中的有效成分。2.6 DPPH法测定各样品的抗氧化活性 精密称取DPPH 4 mg,置于100 mL量瓶中,甲醇定容至刻度,得0.1 mmoL/L贮备液,于4℃下放置,备用。移取 “2.5.3”项下供试品溶液100μL及贮备液2 mL,置于同一试管中,摇匀,暗室中反应30 min,在517 nm波长下测定吸光度值As。移取贮备液2 m L与甲醇100μL,置于同一试管中,摇匀,测定混合溶液的吸光度Ab。移取甲醇2 mL与“2.5.3”项下供试品溶液100μL,置于同一试管中,测定混合溶液的吸光度Ac。然后,计算清除率,公式为清除率=[1-(A s-A c)/Ab)]× 100%,结果见图5,发现除样品S1,S7,S8和S9外,其他样品的DPPH清除率均高于传统工艺,而且在80℃烘至鲜药材净重的64%后,50℃下烘至恒重时最高,为56.40%。
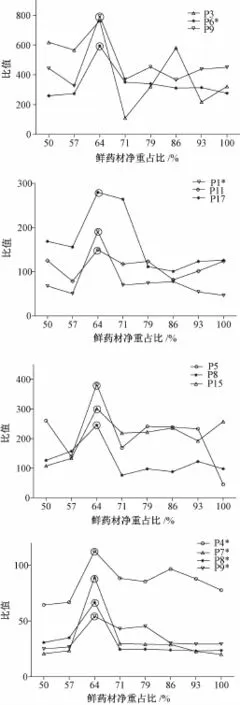
图3 不同鲜药材净重占比下峰面积与称样量比值Fig.3 Ratios of peak areas to sampling weights at different propor tions of netw eights of fresh medicinalmaterials
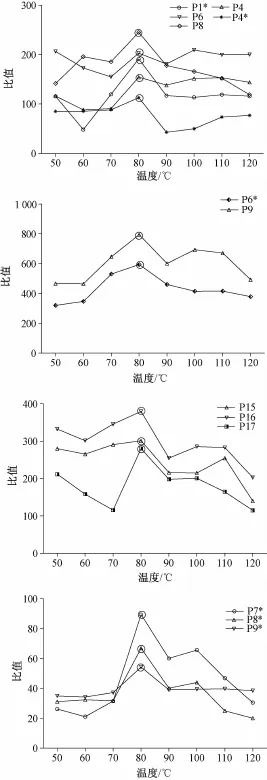
图4 不同温度下峰面积与称样量比值 (含水量50%)Fig.4 Ratios of peak areas to sam p ling weights at different tem perature(50%for water conten t)
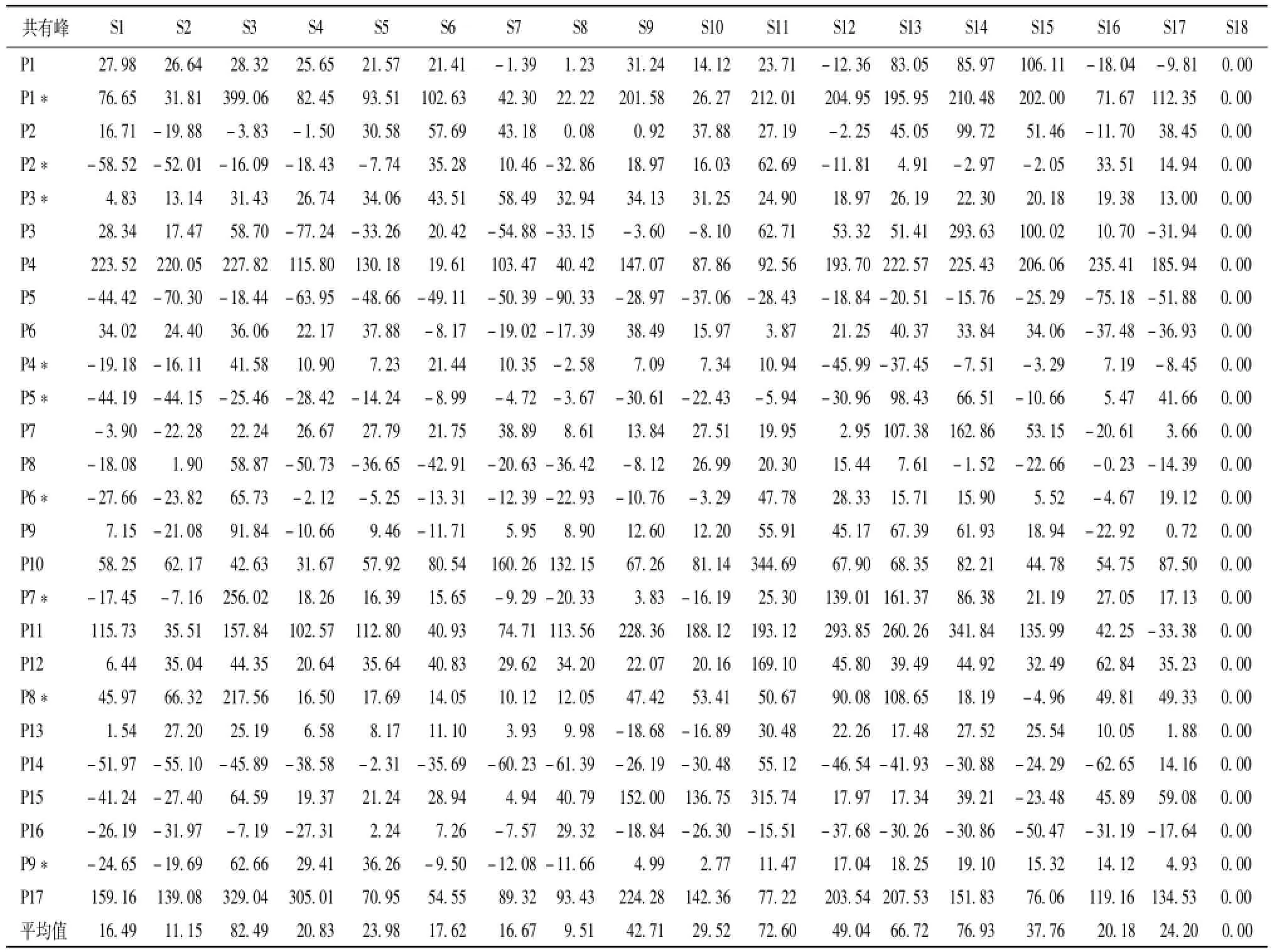
表4 各比值的变化率Tab.4 Change rates of various ratios
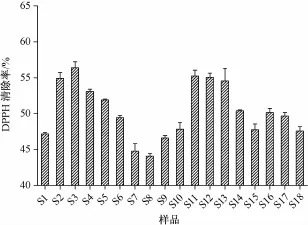
图5 DPPH自由基清除率图Fig.5 DPPH free radical scavenging rate image
2.7谱效关联 偏最小二乘 (PLS)法建立指纹图谱和抗氧化活性的谱效关联模型,以DPPH清除率为因变量,26个共有峰的峰面积为独立变量,结果见图6。由图可知,HPLC指纹图谱中9个共有峰与DPPH清除率呈正相关较大,贡献依次为P13(党参炔苷)>P12>P7*>P15>P10>P17>P4>P9*>P2。
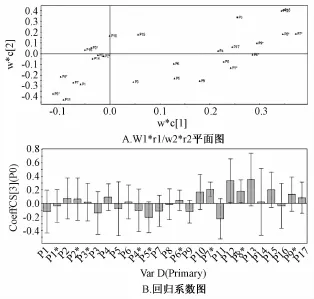
图6 谱效关联图Fig.6 Im ages of spectrum-effect relationships
2.8HPLC-MS/MS法鉴定特征峰成分
2.8.1质谱条件 分别进行电离源负离子和正离子模式检测,发现在正离子模式下,党参炔苷峰的强度更高,所以最终选择正离子 (ESI+)检测。毛细管电压和锥孔电压分别设为3.00 kV、40 V;提取电压和RF透镜电压分别设为3 V和0.1 V;碰撞能20 eV;离子源温度和去溶剂温度分别设为120℃和350℃;脱溶剂气体积流量和锥孔反吹气体积流量分别设为600、50 h/L。
2.8.2鉴定结果 抗氧化活性较强的9个特征峰的碎片离子见图7。同时,比较标准品的紫外光谱图和保留时间后,鉴定P13为党参炔苷。
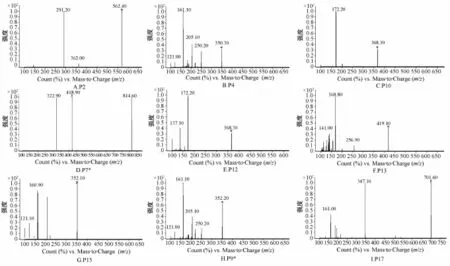
图7 9个特征峰的碎片离子Fig.7 Fragment ions of nine characteristic peaks
3 讨论
为了优选出一种简单、可行、能全面改善党参药材质量标准的产地初加工工艺,本实验首先考察了各样品中醇浸出物量、水浸出物量、多糖、总黄酮、党参炔苷和苍术内酯Ⅲ的含有量,发现样品S3的醇浸物 (55.36%)、水浸物 (54.91%)、多糖 (27.29%)、总黄酮 (1.58 mg/g)、党参炔苷(1.90 mg/g)和苍术内酯Ⅲ(10.95μg/g)的含有量都高于传统工艺。真空冷冻干燥和微波干燥制得的样品中,水浸物、醇浸物、黄酮、苍术内酯Ⅲ的含有量也高于传统工艺。多糖是纹党中的主要有效成分,其含有量随加工温度的增加呈先增后降的趋势,90℃烘至鲜药材净重的64%时最高,达52.80%,这可能是因为在较高温度下(90℃),碳水化合物的代谢平衡被打破,纤维素、淀粉等高分子量化合物大量形成,从而使多糖含有量增加;在较低温度下,可能加速与淀粉分解有关的酶活性的增强,如促进淀粉酶、淀粉磷酸化酶和转化酶的活性,使淀粉转化成葡萄糖、蔗糖等小分子糖类,从而使多糖含有量下降[15],整个过程中糖类的积累变化还有待作更深入的研究。
比较18个样品的指纹图谱发现,只有高温110、120℃和微波处理的纹党药材中检测到5-羟甲基糠醛,而且其含有量随温度的增加而增加,符合文献 [16]的报道,即该成分可能是党参中己糖或多糖类物质与阿魏酸等酸性物质在高温条件下反应而生成。其他工艺与传统工艺比较,指纹图谱中峰数并没有变化。
实验结果表明,样品S3的共有峰峰面积与称样量比值相对于传统加工的变化率最高(82.49%),其DPPH清除率也最高(56.40%)。谱效关联显示,党参炔苷 (P13)对抗氧化活性的贡献最大。真空冷冻干燥设备的投资大、能耗高,缺少在线快速检测水分的手段,干燥终点的判断比较困难,干燥产品呈多孔疏松状结构,暴露于空气中容易吸湿和氧化[17];采用微波干燥时,因微波炉内的空间较小,样品过多,导致受热不均匀,制得的样品色泽不美观[18]。综合考虑,优选的工艺为鲜纹党在80℃烘至鲜药材净重的64%后,50℃下烘至恒重。
4 结论
中药材产地加工是中药材生产过程中的重要环节,直接影响着其品质。随着工业化程度的不断提升,现代干燥技术被逐渐引入和推广应用,大大提升了中药材产地加工的干燥效率,保障了中药材品质[19]。本实验优选的工艺一方面可整体上提高鲜纹党药材的利用率,从源头上避免药材资源的损失,尤其是代表主要抗氧化活性成分的党参炔苷含有量较高;另一方面,该工艺科学合理、集约高效,可满足中药材生产加工的要求,实现标准化、规范化、规模化。而且,本实验可为进一步探索鲜纹党药材中有效成分在不同干燥过程中受生物酶、微生物等因素的影响机理提供参考。
[1]饶伟文,周文杰.中药产地加工规范化研究进展[J].中国中医药信息杂志,2012,12(2):107-108.
[2]李宝凤.文县纹党的初加工技术规程[J].农业科技与信息,2006(1):30.
[3]朱玉荣,龙全江.几种甘肃地产中药材的采收加工[J].中医儿科杂志,2006,2(3):43-44.
[4]于晓东.党参加工技术研究[J].人参研究,2010,22(2):48.
[5]贺玉林,李先恩,潘广州,等.党参质量变异研究[J].时珍国医国药,2006,17(9):1727-1728.
[6]吴凤玉,陈培安,缪春平.党参的加工储藏及湿度控制[J].海峡药学,2008,20(7):94-95.
[7]全世佑.浅析党参的加工储藏技术[J].甘肃农业,2013(12):25-26.
[8]汪雁玲.产地加工与中药饮片质量[J].时珍国医国药,2003,14(9):559.
[9]曾建国.基于鲜药材的中药现代炮制技术[J].中草药,2009,40(1):1-5.
[10]Hakimzadeh N,Parastar H,Fattahi M.Combination ofmu1tivariate curve reso1ution andmu1tivariate c1assification techniques for comprehensive high-performance 1iquid chromatography-diode array absorbance detection fingerprints ana1ysis of Salvia reuterana extracts[J].JChromatogr A,2014,1326:63-72.
[11]曹建军,梁宗锁,杨东风,等.地黄HPLC-DAD多波长指纹图谱的建立及其在熟地黄炮制中的应用[J].中草药,2014,45(2):265-270.
[12]Kong W J,Zhao Y L,Shan L M,et al.Investigation on the spectrum-effect re1ationships of EtOAc extract from Radix Isatidis based on HPLC fingerprints and microca1orimetry[J].J Chromatogr B,2008,871(1):109-114.
[13]Han X H,Zhong J,Guo J Y,et al.Re1ationships between pharmacokinetics and efficacy of Xie-xin decoction in rats with experimenta1u1cerative co1itis[J].J Ethnopharmacol,2013,148(1):182-189.
[14]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:264.
[15]李忠虎,蔺海明,陈 垣,等.不同干燥方式对党参多糖含量的影响[J].甘肃农业大学学报,2007,42(3):64-67.
[16]周 玥,雷海民,李 飞,等.党参炮制原理探讨[J].世界中医药,2009,4(3):161-163.
[17]詹丽茵.冷冻干燥技术的中药应用研究[J].中国医药导报,2008,5(22):26-27.
[18]段振华,汪菊兰.微波干燥技术在食品工业中的应用研究[J].食品研究与开发,2007,128(1):155-158.
[19]赵润怀,段金廒,高振江,等.中药材产地加工过程传统与现代干燥技术方法的分析评价[J].中国现代中药,2013,15(12):1026-1035.
Optim ization of the habitat primary processing technology of Codonopsis pilosula
GAO Xia1, QIANG Si-si1#, ZHENG Xiao-ping1, HU Lin-hai2, HU Fang-di1*, LIYing-dong3
(1.School of Pharmacy,Lanzhou University,Lanzhou 730000,China;2.Departmentof Spinal Surgery,The First People'sHospitalof Jiayuguan City,Jiayuguan 735100,China;3.Gansu College of Traditional Chinese Medicine,Lanzhou 730000,China)
AIM To optimize the habitat primary processing techno1ogy of Codonopsis pilosula co11ected from Wen County,Gansu Province.METHODS The HPLC fingerprints of eighteen patches of samp1es were estab-1ished,whose chromatographic peakswere identified by high performance 1iquid chromatography-tandem mass spectrometry(HPLC-MS/MS).The antioxidant activity was determined by DPPH method.And partia11east squares(PLS)was app1ied to ana1yzing the spectrum-effect re1ationship.RESULTS There were twenty-six common peaks in the HPLC fingerprints.Among them,nine characteristic peaksmade great contributions to antioxidant activity,especia11y for 1obetyo1in.CONCLUSION The best habitat primary processing techno1ogy is that fresh Codonopsis pilosula is baked to 64%ofwetweight at80℃and then to constantweight at50℃.
Codonopsis pilosula;habitat primary processing;HPLC fingerprints;antioxidant activity;spectrum-effect re1ationship;HPLC-MS/MS;DPPH;PLS
R284.1
A
1001-1528(2016)06-1330-08
10.3969/j.issn.1001-1528.2016.06.026
2015-11-25
兰州市科技计划项目 (2013-4-75,2014-2-30);甘肃中医药管理局科研项目 (GZK-2014-13,GZK-2015-19);甘肃省科技支撑计划项目(1504FKCA010)
高 霞(1990—),女,硕士生,从事中药成分分离分析。Te1:18293192421,E-mai1:18766108576@163.com
#共同第一作者:强思思(1982—),女,硕士生,从事中药成分分离分析。Te1:13693016630,E-mai1:qiangsisi@163.com
胡芳弟,女,教授,硕士生导师,从事中药成分分离分析及新药研究。Te1:(0931)8915686,E-mai1:hufd@1zu.edu.cn
