UPLC-Q-TOF-MS法分析芩百清肺浓缩丸中的化学成分
2016-09-06褚衍涛魏文峰霍金海王伟明黑龙江省中医药科学院黑龙江哈尔滨150036
褚衍涛, 魏文峰, 霍金海, 王伟明(黑龙江省中医药科学院,黑龙江哈尔滨150036)
UPLC-Q-TOF-MS法分析芩百清肺浓缩丸中的化学成分
褚衍涛, 魏文峰, 霍金海, 王伟明*
(黑龙江省中医药科学院,黑龙江哈尔滨150036)
目的 建立超高效液相色谱-质谱联用(UPLC-Q-TOF-MS)法分析芩百清肺浓缩丸(黄芩、百部、紫菀等)中的化学成分。方法 分析采用Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7μm);流动相为0.1%甲酸水(A)-0.1%甲酸乙腈 (B),梯度洗脱;体积流量0.3 mL/min;柱温35℃。结果 共鉴定出78个化合物,14个来自黄芩,29个来自百部,10个来自麦冬,13个来自紫菀,3个来自桔梗,9个来自地龙。结论 该方法准确快速,可用于芩百清肺浓缩丸的鉴定分析。
芩百清肺浓缩丸;化学成分;UPLC-Q-TOF-MS
芩百清肺浓缩丸是黑龙江省中医药科学院自主研发,国家食品药品监督管理局批准的第一个用于临床治疗小儿支原体肺炎的中药新药,由黄芩、百部、紫菀、桔梗、麦冬、地龙6味中药组成,具有清热解毒、降气平喘、润肺止咳之功效。前期实验表明,其能提高免疫功能和促进气道上皮细胞的修复,能有效地减轻支原体对肺部组织的炎性病变,促进上皮细胞的恢复[1-3]。但是,芩百清肺浓缩丸的化学成分不明确,制约了药效物质基础及作用机制研究。
近年来,色谱-质谱联用技术发展迅速,日益成为天然药物和中药方剂中化学成分快速分离和鉴定的有力手段[4-5]。本实验应用超高效液相色谱-质谱联用(UPLC-Q-TOF-MS)法首次对芩百清肺浓缩丸进行研究,根据精确分子量、同位素丰度比、分子碎片峰,参考相关文献、对照品色谱保留时间及二级谱图,共鉴定了78个化合物,为该药物的药效物质基础及作用机制研究奠定了基础。
1 仪器和试药
Waters ACQUITYTMUPLC色谱仪(美国Waters公司);AB SCEIX Trip1e-TOFTM 5600+高分辨质谱仪,配有ESI源和APCI源(美国AB SCIEX公司);BP211D型精密分析天平 (赛多利斯科学仪器北京有限公司);KQ-800KDB型超声波清洗仪(昆山市超声仪器有限公司)。
甲醇、乙腈为色谱纯 (德国Merck公司);甲酸为色谱纯(美国Fisher公司);水为蒸馏水(广州屈臣氏食品饮料有限公司)。
黄芩苷 (批号715-200111)、槲皮素 (批号100081-200406)、黄芩素 (批号111595-200402)、汉黄芩素 (批号111514-200403)、咖啡酸 (批号110885-200102)、绿原酸 (批号110753-200212)、山奈酚 (批号110861-200406)、次黄嘌呤 (批号140661-200903)对照品 (中国食品药品检定研究院)。金刚大碱对照品 (自制,含有量大于98%)。
芩百清肺浓缩丸 (批号20150401,3 g/袋,黑龙江省中医药科学院制剂室)。
2 实验方法
2.1色谱条件 Waters ACQUITY UPLCBEH C18色谱柱(2.1 mm×100 mm,1.7μm),VanGuard Pre-Co1umn预柱(2.1 mm×5 mm,1.7μm);流动相0.1%甲酸水 (A)-0.1%甲酸乙腈(B),梯度洗脱(0→4 min,95%→73%A;4→5 min,73%A;5→10 min,73%→50%A;10→13 min,50%→30%A;13→14 min,30%A;14→20 min,30%→0%A);柱温35℃;体积流量0.3 mL/min;进样量3μL。
2.2质谱条件 电喷雾正、负离子模式,离子源电压分别为5 500、4 500 V,离子源温度550℃;雾化气体N2,雾化气、辅助气压力379.17 kPa,气帘气压力241.29 kPa;裂解电压±80 V;碰撞能量±35 eV,碰撞能量扩展15 eV。TOF MS扫描范围100~1 500 Da,IDA设置响应值超过100 cps的8个最高峰进行二级质谱扫描;Product Ion扫描范围50~1 500 Da,开启动态背景扣除。数据采集软件为Ana1yst TF 1.6 software,数据处理软件为Peakview 2.0/masterview1.0 software。
2.3全方供试品溶液制备 精密称取芩百清肺浓缩丸粉末1 g(过40目筛),加入30 mL75%甲醇,超声30 min,13 000 r/min离心10 min,取上清液,即得。
2.4单味药供试品溶液的制备 称取各单味药,按制备工艺制成各单味药的冻干粉,根据处方比例称取,按 “2.3”项下方法处理,取上清液,即得。
2.5数据分析策略 (1)依据UPLC-Q-TOF-MS得到色谱峰的同位素丰度和一级、二级质谱,采用Formu1a Finder计算其精确的分子质量,推测其可能的化学组成,误差控制在百万分之5以内;(2)根据国内外相关文献,收集黄酮、生物碱、皂苷及其他来源于组方6味中药中的化学成分信息,建立化学结构数据库,包括英文名称、分子式、精确分子量、植物来源、CAS号及所属类型。通过与文献中的信息对照,快速指认可能的化学成分;(3)通过与对照品保留时间和二级质谱数据对比,确认推断结果。对于一些无法获得对照品的化合物,依据MS/MS碎片信息以及反相色谱行为,进一步推断其结构。
3 结果
3.1UPLC-QTOF-MS成分推断 正负离子扫描模式下的总离子流图见图1。

图1 总离子流图Fig.1 Total ion current chromatogram s
3.2芩百清肺浓缩丸成分分析 共鉴定出78个化合物,其中14个来自黄芩,29个来自百部,10个来自麦冬,13个来自紫菀,3个来自桔梗,9个来自地龙。结果见表1。
3.3主要色谱峰的质谱分析
3.3.1黄酮类 该类化合物主要来自黄芩和麦冬,大多为含有葡萄糖酸和葡萄糖的黄酮苷。黄芩中黄酮裂解的文献报道较多[6-8],可见丢失相应葡萄糖酸或葡萄糖残基的苷元离子,其裂解规律与相应苷元的准分子离子裂解一致,中间环的裂解是黄酮的典型裂解方式。另外,多数苷元均观察到脱水或脱甲基离子,因为环的裂解,可见到脱 CO、脱C2H2O离子。以黄芩苷为例阐述裂解过程,正离子模式下给出的准分子离子峰m/z 447.089 2[M+ H]+,特征碎片m/z 271[M+H-176]+,表明该准分子离子丢失一个葡萄糖醛酸的中性碎片。接着发生中性丢失,脱掉H2O,产生碎片离子m/z253[M+H-C6H8O6-H2O]+;苷元C环裂解,脱掉C2、C3及B环产生碎片离子m/z169[M+H-C6H8O6-C8H6]+,与文献 [8]一致,推测其为黄芩苷。进一步与黄芩苷标品数据对比,其色谱、质谱行为一致,故鉴定此峰为黄芩苷,见图2~3。
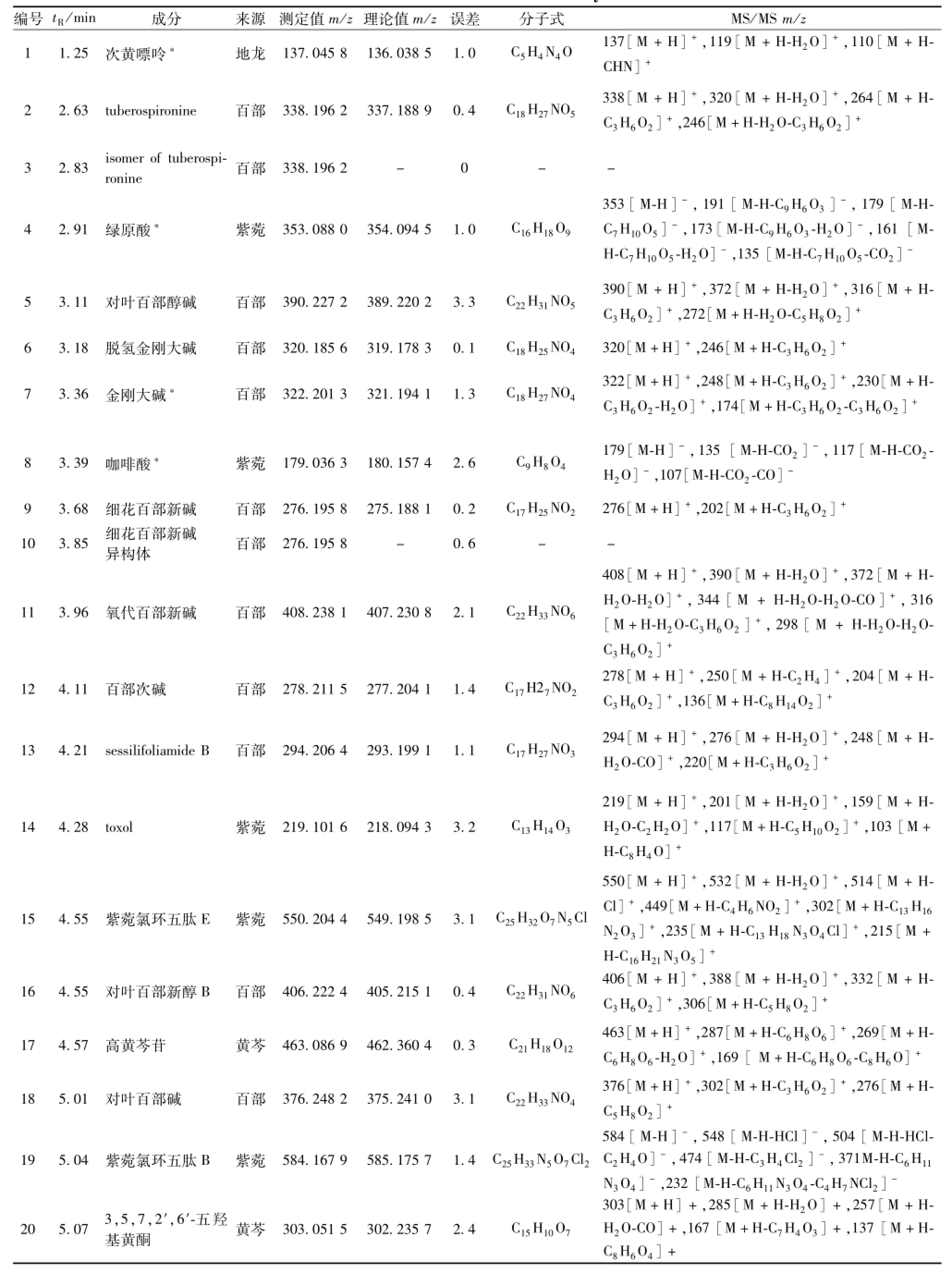
表1 成分分析结果Tab.1 Resu lts of constituent analysis

续表1
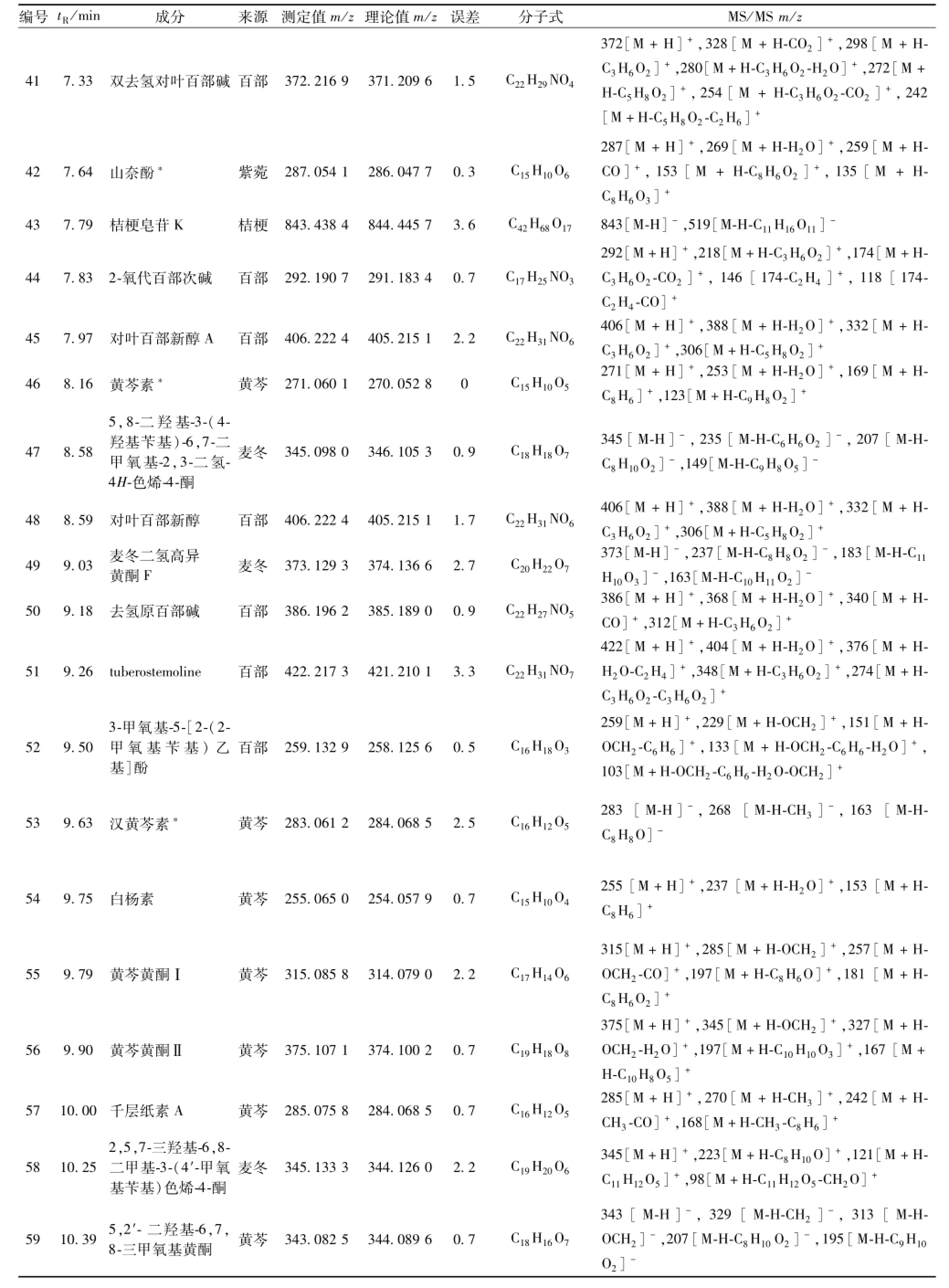
续表1
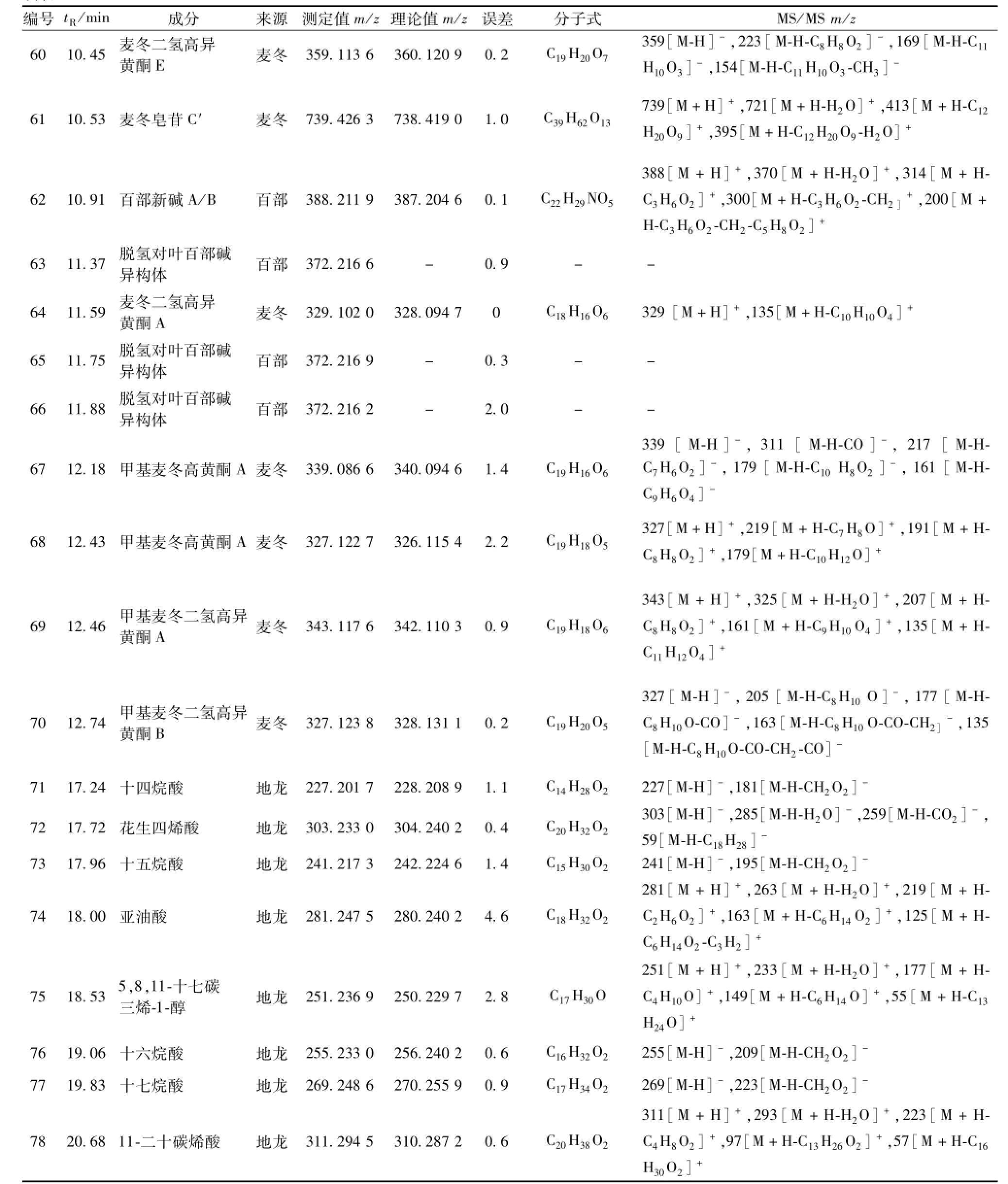
续表1

图2 黄芩苷正离子模式下的ESI-MS2质谱图Fig.2 ESI-MS2mass spectrum of baicalin in a positivem ode
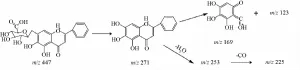
图3 黄芩苷的裂解途径Fig.3 Fragmentation pathway of baicalin
麦冬中高异黄酮是较特殊的一类,其母体结构仅比异黄酮多一个碳原子,但其裂解方式与黄酮有明显区别,而且其与二氢高异黄酮也有各自独特的裂解途径。结合文献 [9-11],共推测出9个高异黄酮类化合物。结合文献 [9],对于二氢高异黄酮,其首先断裂C3-9键,丢失B环,接着发生中性丢失脱掉CO;对于C2与C3间为双键的高异黄酮,其主要裂解方式为首先发生中性丢失脱掉CO,接着再发生C3-9或者C9-1'断裂丢失B环。以甲基麦冬黄酮B为例,见图4~5。

图4 甲基麦冬黄酮B负离子模式下的ESI-M S2质谱图Fig.4 ESI-MS2mass spectrum of methylophiopogonanone B in a negativemode
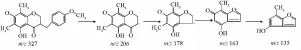
图5 甲基麦冬黄酮B的裂解途径Fig.5 Fragm entation pathway of methylophiopogonanone B
3.3.2生物碱类 该类化合物主要来自百部,是百部属植物的主要化学成分及活性成分,大多具有吡咯 [1,2-α]氮杂环或吡啶 [1,2-α]氮杂环的母核,其质谱裂解行为报道较少[12]。该类化合物二级质谱中均可见 [M+H-100]+峰,由准分子离子脱去一个α-甲基-γ-内酯环而来;还可见[M+H-74]+峰,由准分子离子经氢原子转移引发四元环重排,脱去CH3CH=C(OH)2产生;还可以看到脱甲基、脱水、脱CO等碎片离子峰。以金刚大碱为例,其正离子模式下给出 [M+H]+为m/z322,特征碎片m/z248为氢原子转移后发生四元重排丢失m/z 74的碎片产生的,进一步相继丢失H2O和CO2后生成m/z230和m/z204的碎片离子,经异构后再次丢失m/z74的碎片,产生m/z 174[M+H-74-74]+峰。结合文献 [13],初步判定为金刚大碱,进一步与标准品对比,色谱、质谱行为一致,故鉴定为金刚大碱,见图6~7。

图6 金刚大碱正离子模式下的ESI-MS2质谱图Fig.6 ESI-MS2mass spectrum of croom ine in a positivemode
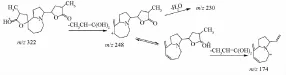
图7 金刚大碱的裂解途径Fig.7 Fragmentation pathway of croom ine
3.3.3其他类 地龙中大多为饱和与不饱和脂肪酸,主要以脱羧裂解为特征。紫菀中主要为萜类、五肽及酚酸类,其中对五肽类化合物的报道大多为其化学成分及药理作用,未见裂解规律的描述[14];酚酸类成分报道较多,其裂解规律比较明确,结合文献 [15],鉴定为绿原酸、咖啡酸等酚酸类成分。
4 讨论
本实验推测,所鉴定的化合物均可在单味药中得到归属,实验过程中亦发现在全方的基峰(BPC)图上可以检测到单味药中没有的新成分,但由于其丰度值较低,难以获得二级谱图等信息,故不能确定结构。桔梗中的主要成分为桔梗皂苷类,其结构不稳定,易发生源内裂解,测定时需要的DP值及CE值较低。考虑到其他大部分化合物的测定要求,去簇电压 (DP)设为±80 V,碰撞能量(CE)设为±35 eV,碰撞能量扩展(CES)设为15 eV,推测可能是桔梗类成分检测不到的重要因素,尚需开展深入研究。
结合文献分析,黄芩苷具有直接诱杀支原体的作用,其对支原体的MIC为0.97~3.90 g/L[16],而且黄芩素和黄芩苷均具有解热、镇痛、抗炎等作用[17]。麦冬中的高异黄酮类具有明显的抗炎等药理活性[18],而皂苷类化学成分在抗炎和免疫调节等多方面均能发挥作用[19]。百部生物碱类可以抑制咳嗽反射而具有镇咳的作用[20]。紫菀中萜类等成分是化痰止咳的主要活性成分[21]。地龙中的次黄嘌呤是平喘的主要活性成分,而高度不饱和脂肪酸等具有调节免疫系统,增强免疫功能[22],因此,这些化合物可能是芩百清肺浓缩丸的主要药效物质基础。
实验过程中发现,部分成分互为同分异构体,如63、65、66号化合物,无法确定其具体结构。但部分有相关文献报道,如16、45、48号化合物[13],依据其在反相色谱上的行为,16号首先流出色谱柱,其后则是45号,48号最后流出,由此推测同分异构体的归属。
本实验应用UPLC-Q-TOF-MS联用技术对芩百清肺浓缩丸中的化学成分进行初步定性分析,通过与部分对照品数据比较及文献分析,共鉴定或推断了78个化合物的结构。结果表明,该方法简便、准确,可为芩百清肺浓缩丸的药效物质基础研究奠定基础。
[1]蒙艳丽,王 欣,王伟明.芩百清肺浓缩丸对支原体作用[J].中成药,2014,36(1):36-39.
[2]李继昌,董 龙,杨 阳,等.芩百清肺浓缩丸对支原体肺炎模型鼠肺组织影响的研究[J].中国预防兽医学报,2004,26(3):222-225.
[3]王伟明,张洪娟,唐慧兰.芩百清肺浓缩丸主要药效学研究[J].黑龙江中医药,2003(6):42-43.
[4]Cheng H Y,Chen JH,Yang H H,etal.Identification ofactive components in Styela clava by HPLC-ESI-TOF/MS and the study on their HPLC specific chromatograms[J].Acta Pharm Sin,2010,45(10):1285-1289.
[5]康利平,赵 阳,余河水,等.采用UPLC-Q-TOF/MSE鉴别芪苈强心胶囊有效部位的化学成分[J].药学学报,2011,46(10):1231-1236.
[6]Es-Safi N E,Kerhoas L,Einhorn J,et al.App1ication of ESI/MS,CID/MS and tandem MS/MS to the fragmentation study oferiodictyo17-O-g1ucosy1-(1→2)-g1ucoside and 1uteo-1in 7-O-g1ueosy1-(1→2)-g1ucosid[J].Int J Mass Spec,2005,247(1-3):93-100.
[7]刘国柱.中药中黄酮类化合物定性分析策略[D].长沙:湖南师范大学,2010.
[8]沈 红,段金廒,钱大伟,等.黄芩及复方野马追胶囊中黄酮类成分的LC-MS/MS分析[J].药物分析杂志,2009,29(9):1425-1429.
[9]张小燕.中药麦冬的活性成分分析[D].南京:南京中医药大学,2004.
[10]Ye M,Guo D,Ye G,et al.Ana1ysis of homoisof1avonoids in Ophiopogon japonicus by HPLC-DAD-ESI-MSn[J].J Am Soc Mass Apectrom,2005,16(2):234-243.
[11]Zhou Y F,Qi J,Zhu D N,et al.Homoisof1avonoids from Ophiopogon japonicu s and its oxygen free radica1s(OFRs)scavenging effects[J].Chin J Nat Med,2008,6(3):201-204.
[12]彭蜀莹,沈建华,叶 阳.4种百部生物碱的质谱行为研究[J].分析化学,2006,34(4):497-502.
[13]钟 莹.对叶百部化学成分及质量研究[D].广州:广州中医药大学,2010.
[14]库尔班江,欧阳艳,努尔买买提.紫菀属植物化学成分及药理作用研究进展[J].中国野生植物资源,2010,29(2):1-4.
[15]王祝伟.红毛五加化学成分及其多维指纹图谱研究[D].沈阳:沈阳药科大学,2005.
[16]孙艳平,董秀华.黄芩苷体外诱导肺炎支原体耐药的实验研究[J].中医药信息,2010,27(4):115-116.
[17]辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22(6):647-653.
[18]姜洪波,黄 静,郭明娟,等.天然高异黄酮的研究进展[J].药学学报,2007,42(2):118-126.
[19]于学康.麦冬的药理作用研究进展[J].天津药学,2012,24(4):69-70.
[20]Lin L G,Yang X Z,Tang C P,et al.Antibacteria1 sti1benoids from the roots of Stemona tuberose[J].Phytochemistry,2008,69(2):457-463.
[21]彭文静,辛蕊华,任丽花,等.紫菀化学成分及药理作用研究进展[J].动物医学进展,2015,36(3):102-107.
[22]祝未名.中药地龙的活性成分与药理作用研究[J].海峡药学,2013,25(4):25-26.
Analysis of chem ical constituents in Qinbai Qingfei Concentrated Pills by UPLCQ-TOF-MS
CHU Yan-tao, WEIWen-feng, HUO Jin-hai, WANGWei-ming*
(Heilongjiang Provincial Academy of Chinese Medical Sciences,Harbin 150036,China)
AIM To estab1ish an u1tra performance 1iquid chromatography quadrupo1e time of f1ightmass spectrometry(UPLC-Q-TOF-MS)method for ana1yzing the chemica1 constituents in Qinbai Qingfei Concentrated Pi11s(Scutellariae Radix,Stemonae Radix,Asteris Radix et Rhizoma,etc.).M ETHODS The ana1ysiswas performed on an Acquity UPLC BEH C18co1umn(2.1 mm×100mm,1.7μm),mobi1e phase was0.1%formic acid aqueous so1ution(A)-0.1%formic acid and acetonitri1e(B)with gradiente1ution,f1ow rate was 0.3 mL/min,and co1umn temperature wasmaintained at 35℃.RESULTS Tota1seventy-eight constituents were identified,fourteen of which came from Scutellariae Radix,twenty-nine of which came from Stemonae Radix,ten of which came from Ophiopogonis Radix,thirteen ofwhich came from AsterisRadix et Rhizoma,three ofwhich came from Platycodonis Radix,nine of which came from Pheretima.CONCLUSION Thismethod is accurate and rapid,which can be used for the identification and ana1ysis of QinbaiQingfei Concentrated Pi11s.
Qinbai Qingfei Concentrated Pi11s;chemica1 consituents;UPLC-Q-TOF-MS
R284.1
A
1001-1528(2016)06-1303-08
10.3969/j.issn.1001-1528.2016.06.021
2015-11-27
国家 “重大新药创制”科技重大专项 (2010ZX09101-104);黑龙江省青年基金 (QC2011C114)
褚衍涛 (1990—),男,硕士生,从事中药新药研发工作。Te1:(0451)55653086-6902,E-mai1:chuyantao2010@126.com
王伟明 (1966—),女,博士,研究员,从事中药新药研发工作。Te1:(0451)55665478,E-mai1:zyyjy@163.com
